El selenio es un elemento químico ; tiene el símbolo Se y el número atómico 34. Es un no metal (más raramente considerado un metaloide ) con propiedades intermedias entre los elementos de arriba y de abajo en la tabla periódica , azufre y telurio , y también tiene similitudes con el arsénico . [8] Rara vez se presenta en su estado elemental o como compuestos minerales puros en la corteza terrestre . El selenio (del griego antiguo σελήνη ( selḗnē ) 'luna') fue descubierto en 1817 por Jöns Jacob Berzelius , quien notó la similitud del nuevo elemento con el telurio previamente descubierto (llamado así por la Tierra).
El selenio se encuentra en minerales de sulfuro metálico , donde reemplaza parcialmente al azufre. Comercialmente, el selenio se produce como subproducto del refinado de estos minerales, con mayor frecuencia durante la producción. Los minerales que son seleniuro puro o compuestos de selenato son conocidos pero raros. Los principales usos comerciales del selenio en la actualidad son la fabricación de vidrio y los pigmentos . El selenio es un semiconductor y se utiliza en fotocélulas . Las aplicaciones en electrónica , que alguna vez fueron importantes, han sido reemplazadas en su mayoría por dispositivos semiconductores de silicio . El selenio todavía se utiliza en algunos tipos de protectores contra sobretensiones de CC y en un tipo de punto cuántico fluorescente .
Aunque se necesitan trazas de selenio para la función celular en muchos animales, incluidos los humanos, tanto el selenio elemental como (especialmente) las sales de selenio son tóxicos incluso en dosis pequeñas y causan selenosis. [9] El selenio figura como ingrediente en muchos multivitamínicos y otros suplementos dietéticos, así como en fórmulas infantiles , y es un componente de las enzimas antioxidantes glutatión peroxidasa y tiorredoxina reductasa (que reducen indirectamente ciertas moléculas oxidadas en animales y algunas plantas). así como en tres enzimas desyodasas . Los requerimientos de selenio en las plantas difieren según la especie: algunas plantas requieren cantidades relativamente grandes y otras aparentemente no requieren ninguna. [10]

El selenio forma varios alótropos que se interconvierten con los cambios de temperatura , dependiendo en cierta medida de la velocidad del cambio de temperatura. Cuando se prepara mediante reacciones químicas, el selenio suele ser un polvo amorfo de color rojo ladrillo. Cuando se derrite rápidamente, forma una forma vítrea negra, que generalmente se vende comercialmente como cuentas. [11] La estructura del selenio negro es irregular y compleja y consta de anillos poliméricos con hasta 1000 átomos por anillo. El selenio negro es un sólido brillante y quebradizo que es ligeramente soluble en CS 2 . Al calentarlo, se ablanda a 50 °C y se convierte en selenio gris a 180 °C; la temperatura de transformación se reduce por la presencia de halógenos y aminas . [8]
Las formas rojas α, β y γ se producen a partir de soluciones de selenio negro variando la velocidad de evaporación del disolvente (normalmente CS 2 ). Todos ellos tienen una simetría cristalina monoclínica relativamente baja ( grupo espacial 14) y contienen anillos fruncidos de ciclooctaselenio (Se 8 ) casi idénticos con diferentes disposiciones geométricas, como en el azufre . [12] Los ocho átomos de un anillo no son equivalentes (es decir, no se asignan entre sí mediante ninguna operación de simetría) y, de hecho, en la forma γ-monoclínica, la mitad de los anillos están en una configuración (y su imagen especular). y la mitad en otro. [13] [14] El empaquetamiento es más denso en la forma α. En los anillos de Se 8 , la distancia Se-Se varía dependiendo de dónde se encuentre el par de átomos en el anillo, pero el promedio es de 233,5 pm y el ángulo Se-Se-Se es en promedio de 105,7°. Otros alótropos de selenio pueden contener anillos de Se 6 o Se 7 . [8]
La forma más estable y densa de selenio es gris y tiene una red cristalina hexagonal quiral (grupo espacial 152 o 154 dependiendo de la quiralidad) [15] que consta de cadenas poliméricas helicoidales, donde la distancia Se-Se es 237,3 pm y Se-Se. –El ángulo es de 103,1°. La distancia mínima entre cadenas es de 343,6 pm. El selenio gris se forma mediante un calentamiento suave de otros alótropos, mediante un enfriamiento lento del selenio fundido o mediante la condensación de vapor de selenio justo por debajo del punto de fusión. Mientras que otras formas de selenio son aislantes , el selenio gris es un semiconductor que muestra una fotoconductividad apreciable . A diferencia de otros alótropos, es insoluble en CS 2 . [8] Resiste la oxidación por el aire y no es atacado por ácidos no oxidantes . Con agentes reductores fuertes, forma poliselenuros. El selenio no presenta los cambios de viscosidad que sufre el azufre cuando se calienta gradualmente. [11] [16]
El selenio tiene siete isótopos naturales . Cinco de ellos, 74 Se, 76 Se, 77 Se, 78 Se, 80 Se, son estables, siendo el 80 Se el más abundante (49,6% de abundancia natural). También se encuentra de forma natural el radionúclido primordial de larga vida 82 Se, con una vida media de 8,76 × 10 19 años. [7] El radioisótopo no primordial 79 Se también se encuentra en cantidades mínimas en minerales de uranio como producto de la fisión nuclear . El selenio también tiene numerosos isótopos sintéticos inestables que van desde el 64 Se al 95 Se; los más estables son el 75 Se con una vida media de 119,78 días y el 72 Se con una vida media de 8,4 días. [17] Los isótopos más ligeros que los isótopos estables experimentan principalmente una desintegración beta plus a isótopos de arsénico , y los isótopos más pesados que los isótopos estables experimentan una desintegración beta menos a isótopos de bromo , con algunas ramas menores de emisión de neutrones en los isótopos más pesados conocidos.
Los compuestos de selenio existen comúnmente en los estados de oxidación −2, +2, +4 y +6.

El selenio forma dos óxidos : dióxido de selenio (SeO 2 ) y trióxido de selenio (SeO 3 ). El dióxido de selenio se forma por la combustión de selenio elemental: [11]
Es un sólido polimérico que forma moléculas monoméricas de SeO 2 en fase gaseosa. Se disuelve en agua para formar ácido selenoso , H 2 SeO 3 . El ácido selenoso también se puede producir directamente oxidando selenio elemental con ácido nítrico : [20]
A diferencia del azufre, que forma un trióxido estable , el trióxido de selenio es termodinámicamente inestable y se descompone en dióxido por encima de 185 °C: [11] [20]
El trióxido de selenio se produce en el laboratorio mediante la reacción de selenato de potasio anhidro (K 2 SeO 4 ) y trióxido de azufre (SO 3 ). [21]
Las sales del ácido selenoso se llaman selenitos. Estos incluyen selenito de plata (Ag 2 SeO 3 ) y selenito de sodio (Na 2 SeO 3 ).
El sulfuro de hidrógeno reacciona con ácido selenoso acuoso para producir disulfuro de selenio :
El disulfuro de selenio consta de anillos de 8 miembros. Tiene una composición aproximada de SeS 2 , con anillos individuales que varían en composición, como Se 4 S 4 y Se 2 S 6 . El disulfuro de selenio se ha utilizado en champús como agente anticaspa , inhibidor en la química de polímeros, tinte para vidrio y agente reductor en fuegos artificiales . [20]
El trióxido de selenio se puede sintetizar deshidratando el ácido selénico , H 2 SeO 4 , que a su vez se produce mediante la oxidación del dióxido de selenio con peróxido de hidrógeno : [22]
El ácido selénico concentrado caliente reacciona con el oro para formar selenato de oro (III). [23]
El selenio reacciona con el flúor para formar hexafluoruro de selenio :
En comparación con su homólogo de azufre ( hexafluoruro de azufre ), el hexafluoruro de selenio (SeF 6 ) es más reactivo y es un irritante pulmonar tóxico. [24] Con diferente estequiometría, los elementos forman tetrafluoruro de selenio , un agente fluorante a escala de laboratorio .
Los únicos cloruros estables son el tetracloruro de selenio (SeCl 4 ) y el monocloruro de selenio (Se 2 Cl 2 ), que podría conocerse mejor como cloruro de selenio (I) y es estructuralmente análogo al dicloruro de disulfuro . Se pueden preparar soluciones metaestables de dicloruro de selenio a partir de cloruro de sulfurilo y selenio (la reacción de los elementos genera el tetracloruro ) y constituyen un reactivo importante en la preparación de compuestos de selenio (por ejemplo, Se 7 ). Todos los bromuros correspondientes son conocidos y recapitulan la misma estabilidad y estructura que los cloruros. [25]
Los yoduros de selenio no son muy conocidos y durante mucho tiempo se creyó que no existían. [26] Existe evidencia espectroscópica limitada de que los yoduros inferiores pueden formarse en soluciones bielementales con disolventes no polares, como el disulfuro de carbono [27] y el tetracloruro de carbono ; [26] pero incluso estos parecen descomponerse bajo la iluminación . [28]
Algunos oxihaluros de selenio (fluoruro de seleninilo (SeOF 2 ) y oxicloruro de selenio (SeOCl 2 )) se han utilizado como disolventes especiales. [11]
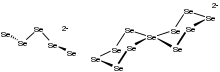
De manera análoga al comportamiento de otros calcógenos, el selenio forma seleniuro de hidrógeno , H 2 Se. Es un gas fuertemente oloroso, tóxico e incoloro. Es más ácido que el H 2 S. En solución se ioniza a HSe − . El seleniuro dianión Se 2− forma una variedad de compuestos, incluidos los minerales de los que se obtiene comercialmente el selenio. Los seleniuros ilustrativos incluyen seleniuro de mercurio (HgSe), seleniuro de plomo (PbSe), seleniuro de zinc (ZnSe) y diseleniuro de cobre, indio y galio (Cu(Ga,In)Se 2 ). Estos materiales son semiconductores . Con metales altamente electropositivos, como el aluminio , estos seleniuros son propensos a la hidrólisis, lo que puede describirse mediante esta ecuación idealizada: [11]
Los seleniuros de metales alcalinos reaccionan con el selenio para formar poliselenuros, Se2-
norte, que existen como cadenas y anillos.
El tetranitruro de tetraselenio, Se 4 N 4 , es un compuesto explosivo de color naranja análogo al tetranitruro de tetraazufre (S 4 N 4 ). [11] [30] [31] Puede sintetizarse mediante la reacción de tetracloruro de selenio (SeCl 4 ) con [((CH
3)
3Si)
2NORTE]
2Sí . [32]
El selenio reacciona con cianuros para producir selenocianatos : [11]
El selenio, especialmente en el estado de oxidación II, forma diversos derivados orgánicos. Son estructuralmente análogos a los correspondientes compuestos organosulfurados . Especialmente comunes son los seleniuros (R 2 Se, análogos de tioéteres ), diselenuros (R 2 Se 2 , análogos de disulfuros ) y selenoles (RSeH, análogos de tioles ). Los representantes de selenuros, diselenuros y selenoles incluyen respectivamente selenometionina , difenildiselenuro y benceneselenol . El sulfóxido en la química del azufre está representado en la química del selenio por los selenóxidos (fórmula RSe(O)R), que son intermedios en la síntesis orgánica, como lo ilustra la reacción de eliminación del selenóxido . De acuerdo con las tendencias indicadas por la regla del doble enlace , rara vez se observan selencetonas, R(C=Se)R, y selenaldehídos, R(C=Se)H. [33]
El selenio ( griego σελήνη selene que significa "Luna") fue descubierto en 1817 por Jöns Jacob Berzelius y Johan Gottlieb Gahn . [34] Ambos químicos eran dueños de una planta química cerca de Gripsholm , Suecia, que producía ácido sulfúrico mediante el proceso de cámara de plomo . Las muestras de pirita de la mina Falun produjeron un precipitado sólido rojo en las cámaras de plomo, que se suponía era un compuesto de arsénico, por lo que se suspendió el uso de pirita para producir ácido. Berzelius y Gahn, que querían utilizar la pirita, observaron que el precipitado rojo despedía un olor a rábano picante cuando se quemaba. Este olor no era típico del arsénico, pero se conocía un olor similar de los compuestos de telurio . De ahí que la primera carta de Berzelius a Alexander Marcet afirmara que se trataba de un compuesto de telurio. Sin embargo, la falta de compuestos de telurio en los minerales de la mina Falun finalmente llevó a Berzelius a volver a analizar el precipitado rojo, y en 1818 escribió una segunda carta a Marcet describiendo un elemento recién encontrado similar al azufre y al telurio. Debido a su similitud con el telurio, llamado así por la Tierra, Berzelius nombró al nuevo elemento en honor a la Luna . [35] [36]
En 1873, Willoughby Smith descubrió que la conductividad eléctrica del selenio gris se veía afectada por la luz. [37] [38] Esto llevó a su uso como célula para detectar la luz. Los primeros productos comerciales que utilizaban selenio fueron desarrollados por Werner Siemens a mediados de la década de 1870. La célula de selenio se utilizó en el fotófono desarrollado por Alexander Graham Bell en 1879. El selenio transmite una corriente eléctrica proporcional a la cantidad de luz que incide sobre su superficie. Este fenómeno se utilizó en el diseño de fotómetros y dispositivos similares. Las propiedades semiconductoras del selenio encontraron muchas otras aplicaciones en la electrónica. [39] [40] [41] El desarrollo de rectificadores de selenio comenzó a principios de la década de 1930, y estos reemplazaron a los rectificadores de óxido de cobre porque eran más eficientes. [42] [43] [44] Estos duraron en aplicaciones comerciales hasta la década de 1970, después de lo cual fueron reemplazados por rectificadores de silicio menos costosos e incluso más eficientes .
El selenio llegó a la atención médica más tarde debido a su toxicidad para los trabajadores industriales. El selenio también fue reconocido como una toxina veterinaria importante, que se observa en animales que han comido plantas con alto contenido de selenio. En 1954, la bioquímica Jane Pinsent descubrió los primeros indicios de funciones biológicas específicas del selenio en microorganismos . [45] [46] Se descubrió que era esencial para la vida de los mamíferos en 1957. [47] [48] En la década de 1970, se demostró que estaba presente en dos conjuntos independientes de enzimas . A esto le siguió el descubrimiento de la selenocisteína en las proteínas. Durante la década de 1980, se demostró que la selenocisteína estaba codificada por el codón UGA . El mecanismo de recodificación se descubrió primero en bacterias y luego en mamíferos (ver elemento SECIS ). [49]

El selenio nativo (es decir, elemental) es un mineral raro que normalmente no forma buenos cristales, pero, cuando lo hace, son romboedros empinados o pequeños cristales aciculares (parecidos a pelos). [50] El aislamiento de selenio a menudo se complica por la presencia de otros compuestos y elementos.
El selenio se presenta naturalmente en varias formas inorgánicas, incluidos seleniuro , selenato y selenita , pero estos minerales son raros. El mineral común selenito no es un mineral de selenio y no contiene iones selenita , sino que es más bien un tipo de yeso (sulfato de calcio hidrato) llamado como selenio de la luna mucho antes del descubrimiento del selenio. El selenio se encuentra más comúnmente como impureza, reemplazando una pequeña parte del azufre en minerales sulfurados de muchos metales. [51] [52]
En los sistemas vivos, el selenio se encuentra en los aminoácidos selenometionina , selenocisteína y metilselenocisteína . En estos compuestos, el selenio desempeña un papel análogo al del azufre. Otro compuesto de organoselenio natural es el seleniuro de dimetilo . [53] [54]
Ciertos suelos son ricos en selenio y algunas plantas pueden bioconcentrar el selenio. En los suelos, el selenio se presenta con mayor frecuencia en formas solubles, como el selenato (análogo al sulfato), que se lixivia muy fácilmente a los ríos mediante la escorrentía. [51] [52] El agua del océano contiene cantidades significativas de selenio. [55] [56]
Las concentraciones de fondo típicas de selenio no superan 1 ng/m 3 en la atmósfera; 1 mg/kg en suelo y vegetación y 0,5 μg/L en agua dulce y agua de mar. [57]
Las fuentes antropogénicas de selenio incluyen la quema de carbón y la extracción y fundición de minerales de sulfuro. [58]
El selenio se produce más comúnmente a partir del seleniuro de muchos minerales de sulfuro , como los de cobre , níquel o plomo . El refinado electrolítico de metales produce selenio como subproducto, obtenido del lodo anódico de las refinerías de cobre. Otra fuente fue el lodo de las cámaras de plomo de las plantas de ácido sulfúrico , proceso que ya no se utiliza. El selenio se puede refinar a partir de estos lodos mediante varios métodos. Sin embargo, la mayor parte del selenio elemental proviene como subproducto del refinado del cobre o de la producción de ácido sulfúrico . [59] [60] Desde su invención, la producción de extracción por solventes y electroobtención (SX/EW) de cobre produce una proporción cada vez mayor del suministro mundial de cobre. [61] Esto cambia la disponibilidad de selenio porque sólo una parte comparativamente pequeña del selenio en el mineral se lixivia con el cobre. [62]
La producción industrial de selenio suele implicar la extracción de dióxido de selenio a partir de residuos obtenidos durante la purificación del cobre. Luego, la producción común a partir del residuo comienza mediante oxidación con carbonato de sodio para producir dióxido de selenio, que se mezcla con agua y se acidifica para formar ácido selenoso ( paso de oxidación ). El ácido selenoso se burbujea con dióxido de azufre ( paso de reducción ) para dar selenio elemental. [63] [64]
En 2011 se produjeron alrededor de 2.000 toneladas de selenio en todo el mundo, principalmente en Alemania (650 t), Japón (630 t), Bélgica (200 t) y Rusia (140 t), y las reservas totales se estimaron en 93.000 toneladas. Estos datos excluyen a dos grandes productores: Estados Unidos y China. En 2004 se observó un fuerte aumento de 4 a 5 dólares por libra. El precio se mantuvo relativamente estable durante 2004-2010 en aproximadamente 30 dólares estadounidenses por libra (en lotes de 100 libras), pero aumentó a 65 dólares por libra en 2011. El consumo en 2010 se dividió de la siguiente manera: metalurgia – 30%, fabricación de vidrio – 30%, agricultura – 10%, productos químicos y pigmentos – 10% y electrónica – 10%. China es el consumidor dominante de selenio con entre 1.500 y 2.000 toneladas al año. [sesenta y cinco]
Durante la electroobtención de manganeso, la adición de dióxido de selenio disminuye la potencia necesaria para operar las celdas de electrólisis . China es el mayor consumidor de dióxido de selenio para este fin. Por cada tonelada de manganeso se utilizan una media de 2 kg de óxido de selenio. [65] [66]
El mayor uso comercial del selenio, que representa alrededor del 50% del consumo, es la producción de vidrio. Los compuestos de selenio confieren el color rojo al vidrio. Este color anula los tintes verdes o amarillos que surgen de las impurezas de hierro típicas de la mayoría del vidrio. Para ello se añaden diversas sales de selenito y selenato. Para otras aplicaciones se puede desear un color rojo, producido por mezclas de CdSe y CdS. [67]
El selenio se utiliza con bismuto en latón para reemplazar el plomo, que es más tóxico . La regulación del plomo en aplicaciones de agua potable, como en los EE. UU. con la Ley de Agua Potable Segura de 1974, hizo necesaria una reducción del plomo en el latón. El nuevo latón se comercializa con el nombre de EnviroBrass. [68] Al igual que el plomo y el azufre, el selenio mejora la maquinabilidad del acero en concentraciones de alrededor del 0,15%. [69] [70] El selenio produce la misma mejora de maquinabilidad en aleaciones de cobre. [71]
La batería de litio-selenio (Li-Se) es uno de los sistemas de almacenamiento de energía más prometedores de la familia de las baterías de litio. [72] La batería Li-Se es una alternativa a la batería de litio-azufre , con la ventaja de una alta conductividad eléctrica.
El selenio se utilizó como capa fotoabsorbente en la primera célula solar de estado sólido, como lo demostraron el físico inglés William Grylls Adams y su alumno Richard Evans Day en 1876. [73] Con sólo unos años de capa, Charles Fritts fabricó la primera capa delgada -Célula solar de película, que también utiliza selenio como fotoabsorbente. Sin embargo, con la aparición de las células solares de silicio en la década de 1950, la investigación sobre células solares de película fina de selenio declinó. Como resultado, la eficiencia récord del 5,0% demostrada por Tokio Nakada y Akio Kunioka en 1985 se mantuvo sin cambios durante más de 30 años. [74] En 2017, investigadores de IBM lograron un nuevo récord de eficiencia del 6,5% al rediseñar la estructura del dispositivo. [75] Después de este logro, el selenio ha ganado un interés renovado como un fotoabsorbente de banda prohibida amplia con el potencial de integrarse en conjunto con fotoabsorbentes de banda prohibida más baja. [76] Sin embargo, un gran déficit en el voltaje de circuito abierto es actualmente el principal factor limitante para mejorar aún más la eficiencia, lo que requiere ingeniería de defectos de películas delgadas de selenio para mejorar la vida útil del portador . [77] Hasta la fecha, la única estrategia de ingeniería de defectos que se ha investigado para las células solares de película delgada de selenio implica la cristalización de selenio utilizando un láser . [78]
Las películas delgadas de selenio amorfo (α-Se) han encontrado aplicación como fotoconductores en detectores de rayos X de panel plano . Estos detectores utilizan selenio amorfo para capturar y convertir los fotones de rayos X incidentes directamente en carga eléctrica. Se ha elegido el selenio para esta aplicación entre otros semiconductores debido a una combinación de sus propiedades físicas y tecnológicas favorables: [79] [80]
Los rectificadores de selenio se utilizaron por primera vez en 1933. En su mayoría han sido reemplazados por dispositivos basados en silicio. Una excepción notable es la protección contra sobretensiones de CC , donde las capacidades energéticas superiores de los supresores de selenio los hacen más deseables que los varistores de óxido metálico . [ cita necesaria ]
Se han utilizado pequeñas cantidades de compuestos de organoselenio para modificar los catalizadores utilizados en la vulcanización para la producción de caucho. [62]
La demanda de selenio por parte de la industria electrónica está disminuyendo. [65] Sus propiedades fotovoltaicas y fotoconductoras todavía son útiles en fotocopias , [81] [82] [83] [84] fotocélulas , fotómetros y células solares . Su uso como fotoconductor en fotocopiadoras de papel normal alguna vez fue una aplicación líder, pero en la década de 1980, la aplicación del fotoconductor declinó (aunque todavía era un uso final importante) a medida que más y más fotocopiadoras cambiaron a fotoconductores orgánicos.
El seleniuro de zinc fue el primer material para los LED azules , pero el nitruro de galio domina ese mercado. [85] El seleniuro de cadmio era un componente importante en los puntos cuánticos . Las láminas de selenio amorfo convierten imágenes de rayos X en patrones de carga en xerorradiografía y en cámaras de rayos X de panel plano de estado sólido. [86] El selenio ionizado (Se+24, donde 24 de los orbitales externos D, S y P son eliminados debido a las altas energías de entrada [ se necesita aclaración ] ) es uno de los medios activos utilizados en los láseres de rayos X. [87]
El selenio cataliza algunas reacciones químicas, pero no se usa mucho debido a problemas de toxicidad. [88] En cristalografía de rayos X , la incorporación de uno o más átomos de selenio en lugar de azufre ayuda con la dispersión anómala de múltiples longitudes de onda y la fase de dispersión anómala de una sola longitud de onda . [89]
El selenio se utiliza para tonificar impresiones fotográficas y numerosos fabricantes fotográficos lo venden como tóner. El selenio intensifica y amplía la gama tonal de las imágenes fotográficas en blanco y negro y mejora la permanencia de las impresiones. [90] [91] [92]
El Se 75 se utiliza como fuente gamma en radiografía industrial. [93]
El selenio se utiliza en algunos champús anticaspa en forma de disulfuro de selenio , como las marcas Selsun y Vichy Dereos [94] .
La contaminación por selenio podría afectar algunos sistemas acuáticos y puede ser causada por factores antropogénicos como la escorrentía agrícola y los procesos industriales. [95] Las personas que comen más pescado son generalmente más saludables que las que comen menos, [96] lo que sugiere que no hay ningún problema importante para la salud humana por la contaminación por selenio, aunque el selenio tiene un efecto potencial en los humanos. [97]
Pueden ocurrir cambios fisiológicos sustanciales en peces con altas concentraciones de selenio en los tejidos. Los peces afectados por el selenio pueden experimentar hinchazón de las laminillas branquiales , lo que impide la difusión de oxígeno a través de las branquias y el flujo sanguíneo dentro de las branquias. La capacidad respiratoria se reduce aún más debido a la unión del selenio a la hemoglobina . Otros problemas incluyen degeneración del tejido hepático, hinchazón alrededor del corazón, folículos de óvulos dañados en los ovarios, cataratas y acumulación de líquido en la cavidad del cuerpo y la cabeza. El selenio a menudo causa malformaciones en el feto de pez que puede tener problemas para alimentarse o respirar; La distorsión de las aletas o la columna también es común. Los peces adultos pueden parecer sanos a pesar de su incapacidad para producir crías viables.
El selenio se bioacumula en hábitats acuáticos, lo que resulta en concentraciones más altas en los organismos que en el agua circundante. Los compuestos de organoselenio pueden ser concentrados más de 200.000 veces por el zooplancton cuando las concentraciones de agua están en el rango de 0,5 a 0,8 μg Se/L. El selenio inorgánico se bioacumula más fácilmente en el fitoplancton que en el zooplancton. El fitoplancton puede concentrar selenio inorgánico en un factor de 3000. Se produce una mayor concentración mediante bioacumulación a lo largo de la cadena alimentaria, a medida que los depredadores consumen presas ricas en selenio. Se recomienda que una concentración de agua de 2 μg Se/L se considere altamente peligrosa para peces y aves acuáticas sensibles . El envenenamiento por selenio puede transmitirse de padres a hijos a través del óvulo, y el envenenamiento por selenio puede persistir durante muchas generaciones. La reproducción de los ánades reales se ve afectada en concentraciones dietéticas de 7 μg Se/L. Muchos invertebrados bentónicos pueden tolerar concentraciones de selenio de hasta 300 μg/L de selenio en su dieta. [98]
La bioacumulación de selenio en ambientes acuáticos provoca la muerte de peces dependiendo de las especies de la zona afectada. Sin embargo, se ha observado que algunas especies sobreviven a estos eventos y toleran el aumento de selenio. También se ha sugerido que la estación podría tener un impacto en los efectos nocivos del selenio en los peces. [99]
El envenenamiento por selenio de los sistemas de agua puede producirse siempre que nuevas escorrentías agrícolas discurran por tierras secas. Este proceso lixivia compuestos naturales de selenio solubles (como los selenatos) en el agua, que luego pueden concentrarse en los humedales a medida que el agua se evapora. La contaminación por selenio de las vías fluviales también ocurre cuando el selenio se lixivia de las cenizas de carbón, la minería y la fundición de metales , el procesamiento de petróleo crudo y los vertederos. [100] Se descubrió que los altos niveles de selenio en las vías fluviales causan trastornos congénitos en especies ovíparas, incluidas las aves de los humedales [101] y los peces. [102] Los niveles elevados de metilmercurio en la dieta pueden amplificar el daño de la toxicidad del selenio en especies ovíparas. [103] [104]
En Belews Lake , Carolina del Norte, se eliminaron 19 especies de peces del lago debido a la descarga de 150 a 200 μg Se/L de aguas residuales entre 1974 y 1986 de una planta de energía alimentada por carbón de Duke Energy . En el Refugio Nacional de Vida Silvestre Kesterson en California, miles de peces y aves acuáticas fueron envenenados por el selenio contenido en el drenaje de riego agrícola.
Aunque es tóxico en grandes dosis, el selenio es un micronutriente esencial para los animales. En las plantas, se encuentra como un mineral espectador, [105] a veces en proporciones tóxicas en el forraje (algunas plantas pueden acumular selenio como defensa contra el consumo de animales, [106] pero otras plantas, como la hierba loca , requieren selenio, y su el crecimiento indica la presencia de selenio en el suelo). [107]
El selenio es un componente de los inusuales aminoácidos selenocisteína y selenometionina . En los seres humanos, el selenio es un nutriente oligoelemento que funciona como cofactor para la reducción de enzimas antioxidantes , como la glutatión peroxidasa [108] y ciertas formas de tiorredoxina reductasa que se encuentran en animales y algunas plantas (esta enzima se encuentra en todos los organismos vivos, pero no en todos). sus formas en las plantas requieren selenio).
La familia de enzimas glutatión peroxidasa (GSH-Px) cataliza ciertas reacciones que eliminan especies reactivas de oxígeno como el peróxido de hidrógeno y los hidroperóxidos orgánicos :
La glándula tiroides y todas las células que utilizan la hormona tiroidea utilizan selenio, [109] que es un cofactor para tres de los cuatro tipos conocidos de hormona tiroidea desyodasas , que activan y luego desactivan varias hormonas tiroideas y sus metabolitos; Las yodotironina desyodasas son la subfamilia de enzimas desyodasas que utilizan selenio como el raro aminoácido selenocisteína. (Sólo la deyodasa yodotirosina desyodasa , que actúa sobre los últimos productos de degradación de la hormona tiroidea, no utiliza selenio.) [110]
El selenio puede inhibir la enfermedad de Hashimoto , en la que las propias células tiroideas del cuerpo son atacadas como extrañas. Se informa una reducción del 21% en los anticuerpos TPO con la ingesta dietética de 0,2 mg de selenio. [111]
El aumento de selenio en la dieta reduce los efectos de la toxicidad del mercurio, [112] [113] [114] aunque sólo es eficaz en dosis bajas o modestas de mercurio. [115] La evidencia sugiere que los mecanismos moleculares de la toxicidad del mercurio incluyen la inhibición irreversible de las selenoenzimas que se requieren para prevenir y revertir el daño oxidativo en el cerebro y los tejidos endocrinos. [116] [117] El compuesto selenoneína que contiene selenio está presente en la sangre del atún rojo. [118] [119]
Desde hace unos tres mil millones de años, las familias de selenoproteínas procarióticas impulsan la evolución de la selenocisteína, un aminoácido. El selenio se incorpora a varias familias de selenoproteínas procarióticas en bacterias, arqueas y eucariotas como selenocisteína, [120] donde las selenoproteínas peroxiredoxinas protegen las células bacterianas y eucariotas contra el daño oxidativo. Las familias de selenoproteínas de GSH-Px y las desyodasas de células eucariotas parecen tener un origen filogenético bacteriano . La forma que contiene selenocisteína se encuentra en especies tan diversas como algas verdes, diatomeas, erizos de mar, peces y pollos. Las enzimas de selenio están involucradas en las pequeñas moléculas reductoras glutatión y tioredoxina . Una familia de moléculas que contienen selenio (las glutatión peroxidasas ) destruye el peróxido y repara las membranas celulares peroxidadas dañadas, utilizando glutatión. Otra enzima portadora de selenio en algunas plantas y animales ( tiorredoxina reductasa ) genera tiorredoxina reducida, un ditiol que sirve como fuente de electrones para las peroxidasas y también la importante enzima reductora ribonucleótido reductasa que produce precursores de ADN a partir de precursores de ARN. [121]
Los oligoelementos involucrados en las actividades de las enzimas GSH-Px y superóxido dismutasa, es decir, selenio, vanadio , magnesio , cobre y zinc , pueden haber faltado en algunas áreas terrestres con deficiencia de minerales. [120] Los organismos marinos retuvieron y, a veces, expandieron sus selenoproteomas, mientras que los selenoproteomas de algunos organismos terrestres se redujeron o se perdieron por completo. Estos hallazgos sugieren que, con la excepción de los vertebrados , la vida acuática apoya el uso de selenio, mientras que los hábitats terrestres conducen a un uso reducido de este oligoelemento. [122] Los peces marinos y las glándulas tiroides de los vertebrados tienen la mayor concentración de selenio y yodo. Desde hace unos 500 millones de años, las plantas terrestres y de agua dulce optimizaron lentamente la producción de "nuevos" antioxidantes endógenos como el ácido ascórbico (vitamina C), los polifenoles (incluidos los flavonoides), los tocoferoles , etc. Algunos de ellos aparecieron en los últimos 50 años. 200 millones de años, en frutos y flores de plantas angiospermas . De hecho, las angiospermas (el tipo de planta dominante en la actualidad) y la mayoría de sus pigmentos antioxidantes evolucionaron durante el período Jurásico tardío . [ cita necesaria ]
Las isoenzimas desyodasas constituyen otra familia de selenoenzimas eucariotas. Las deyodasas participan en la regulación de las hormonas tiroideas, participando en la protección de los tirocitos del daño causado por el H 2 O 2 producido para la biosíntesis de las hormonas tiroideas. [123] Hace unos 200 millones de años, se desarrollaron nuevas selenoproteínas como enzimas GSH-Px de mamíferos. [124] [125] [126] [127]
El selenio dietético proviene de la carne, los frutos secos, los cereales y las setas. Las nueces de Brasil son la fuente dietética más rica (aunque esto depende del suelo, ya que la nuez de Brasil no requiere altos niveles del elemento para sus propias necesidades). [128] [129]
La cantidad diaria recomendada (CDR) de selenio en los Estados Unidos para adolescentes y adultos es de 55 µg /día. El selenio como suplemento dietético está disponible en muchas formas, incluidos suplementos multivitamínicos y minerales, que normalmente contienen 55 o 70 µg por porción. Los suplementos específicos de selenio suelen contener 100 o 200 µg por porción.
En junio de 2015, la Administración de Medicamentos y Alimentos de Estados Unidos (FDA) publicó su norma final estableciendo el requisito de niveles mínimos y máximos de selenio en las fórmulas infantiles . [130]
Se cree que el contenido de selenio en el cuerpo humano está entre 13 y 20 mg. [131]
Ciertas especies de plantas se consideran indicadores de un alto contenido de selenio en el suelo porque requieren altos niveles de selenio para prosperar. Las principales plantas indicadoras de selenio son las especies de astrágalo (incluidas algunas hierbas locas ), el penacho del príncipe ( Stanleya sp.), los ásteres leñosos ( Xylorhiza sp.) y la falsa hierba dorada ( Oonopsis sp.) [132].
El selenio se puede medir en sangre, plasma, suero u orina para controlar la exposición ambiental u ocupacional excesiva, para confirmar un diagnóstico de intoxicación en víctimas hospitalizadas o investigar un caso sospechoso de sobredosis fatal. Algunas técnicas analíticas son capaces de distinguir las formas orgánicas e inorgánicas del elemento. Tanto la forma orgánica como la inorgánica del selenio se convierten en gran medida en conjugados de monosacáridos (selenoazúcares) en el cuerpo antes de su eliminación en la orina. Los pacientes con cáncer que reciben dosis orales diarias de selenotionina pueden alcanzar concentraciones de selenio en plasma y orina muy altas. [133]

Aunque el selenio es un oligoelemento esencial , es tóxico si se toma en exceso. Exceder el nivel máximo de ingesta tolerable de 400 microgramos por día puede provocar selenosis. [135] Este nivel máximo de ingesta tolerable de 400 µg se basa principalmente en un estudio de 1986 de cinco pacientes chinos que exhibieron signos evidentes de selenosis y un estudio de seguimiento en las mismas cinco personas en 1992. [136] El estudio de 1992 encontró el nivel máximo de ingesta tolerable La ingesta segura de selenio en la dieta es de aproximadamente 800 microgramos por día (15 microgramos por kilogramo de peso corporal), pero sugirió 400 microgramos por día para evitar crear un desequilibrio de nutrientes en la dieta y para estar de acuerdo con datos de otros países. [137] En China, las personas que ingirieron maíz cultivado en carbón pedregoso extremadamente rico en selenio ( esquisto carbonoso ) han sufrido toxicidad por selenio. Se demostró que este carbón tenía un contenido de selenio de hasta el 9,1%, la concentración más alta jamás registrada en carbón. [138]
Los signos y síntomas de la selenosis incluyen olor a ajo en el aliento, trastornos gastrointestinales, caída del cabello, desprendimiento de las uñas, fatiga, irritabilidad y daño neurológico. Los casos extremos de selenosis pueden presentar cirrosis hepática, edema pulmonar o muerte. [139] El selenio elemental y la mayoría de los seleniuros metálicos tienen toxicidades relativamente bajas debido a su baja biodisponibilidad . Por el contrario, los selenatos y selenitos tienen un modo de acción oxidante similar al del trióxido de arsénico y son muy tóxicos. La dosis tóxica crónica de selenita para los seres humanos es de aproximadamente 2400 a 3000 microgramos de selenio por día. [140] El seleniuro de hidrógeno es un gas extremadamente tóxico y corrosivo. [141] El selenio también se encuentra en compuestos orgánicos, como el seleniuro de dimetilo, la selenometionina , la selenocisteína y la metilselenocisteína , todos los cuales tienen una alta biodisponibilidad y son tóxicos en grandes dosis.
El 19 de abril de 2009, 21 caballos de polo murieron poco antes de un partido del Abierto de Polo de Estados Unidos. Tres días después, una farmacia emitió un comunicado explicando que los caballos habían recibido una dosis incorrecta de uno de los ingredientes utilizados en un compuesto de suplemento de vitaminas y minerales que había sido preparado incorrectamente por una farmacia de compuestos . El análisis de los niveles sanguíneos de compuestos inorgánicos en el suplemento indicó que las concentraciones de selenio eran de 10 a 15 veces más altas de lo normal en las muestras de sangre y de 15 a 20 veces más altas de lo normal en las muestras de hígado. Posteriormente se confirmó que el selenio era el factor tóxico. [142]

En los peces y otros animales salvajes, el selenio es necesario para la vida, pero tóxico en dosis altas. Para el salmón , la concentración óptima de selenio es aproximadamente 1 microgramo de selenio por gramo de peso corporal total. Muy por debajo de ese nivel, los salmones jóvenes mueren por deficiencia; [144] mucho más arriba, mueren por exceso tóxico. [143]
La Administración de Salud y Seguridad Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para el selenio en el lugar de trabajo en 0,2 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,2 mg/m 3 durante una jornada laboral de 8 horas. En niveles de 1 mg/m 3 , el selenio es inmediatamente peligroso para la vida y la salud . [146]
La deficiencia de selenio puede ocurrir en pacientes con función intestinal gravemente comprometida , en aquellos sometidos a nutrición parenteral total y [147] en personas de edad avanzada (más de 90 años). Además, las personas que dependen de alimentos cultivados en suelos con deficiencia de selenio corren riesgo. Aunque el suelo de Nueva Zelanda tiene bajos niveles de selenio, no se han detectado efectos adversos para la salud de los residentes. [148]
La deficiencia de selenio, definida por niveles bajos (<60% de lo normal) de actividad de selenoenzima en el cerebro y los tejidos endocrinos, ocurre sólo cuando un nivel bajo de selenio está relacionado con un estrés adicional, como una alta exposición al mercurio [149] o un aumento del estrés oxidativo debido a deficiencia de vitamina E. [150]
El selenio interactúa con otros nutrientes, como el yodo y la vitamina E. El efecto de la deficiencia de selenio en la salud sigue siendo incierto, particularmente en relación con la enfermedad de Kashin-Beck . [151] Además, el selenio interactúa con otros minerales, como el zinc y el cobre . Altas dosis de suplementos de selenio en animales preñados podrían alterar la proporción zinc:cobre y provocar una reducción del zinc; en tales casos de tratamiento, se deben controlar los niveles de zinc. Se necesitan más estudios para confirmar estas interacciones. [152]
En las regiones (por ejemplo, varias regiones de América del Norte) donde los niveles bajos de selenio en el suelo conducen a concentraciones bajas en las plantas, algunas especies animales pueden tener deficiencias a menos que se complemente el selenio con la dieta o mediante inyecciones. [153] Los rumiantes son particularmente susceptibles. En general, la absorción de selenio en la dieta es menor en los rumiantes que en otros animales, y es menor en los forrajes que en los cereales. [154] Los rumiantes que pastan ciertos forrajes, por ejemplo, algunas variedades de trébol blanco que contienen glucósidos cianogénicos , pueden tener mayores necesidades de selenio, [154] presumiblemente porque la aglicona libera cianuro por la actividad de la glucosidasa en el rumen [155] y la glutatión peroxidasa se desactiva por el cianuro actúa sobre la fracción glutatión . [156] A los rumiantes recién nacidos con riesgo de enfermedad del músculo blanco se les puede administrar selenio y vitamina E mediante inyección; algunas de las miopatías por armas de destrucción masiva responden sólo al selenio, otras sólo a la vitamina E y otras a cualquiera de las dos. [157]
Los efectos de la ingesta de selenio sobre el cáncer se han estudiado en varios ensayos clínicos y estudios epidemiológicos en humanos. El selenio puede tener un papel quimiopreventivo en el riesgo de cáncer como antioxidante y podría desencadenar la respuesta inmune. En niveles bajos, se utiliza en el cuerpo para crear selenoproteínas antioxidantes , en dosis más altas de lo normal provoca la muerte celular. [134]
El selenio (en estrecha relación con el yodo ) desempeña un papel en la salud de la tiroides. El selenio es un cofactor de las tres hormonas tiroideas desyodasas , ayudando a activar y luego desactivar varias hormonas tiroideas y sus metabolitos. Actualmente se está investigando la deficiencia aislada de selenio por su papel en la inducción de reacciones autoinmunes en la glándula tiroides en la enfermedad de Hashimoto . [158] Sin embargo, en un caso de deficiencia combinada de yodo y selenio, se demostró que la deficiencia de selenio desempeña un papel protector de la tiroides. [159]
En dosis más altas, el selenio podría ser tóxico para una variedad de animales, incluidos los humanos.
{{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )