Los roedores (del latín rodere , 'roer') son mamíferos del orden Rodentia ( / r oʊ ˈ d ɛ n ʃ ə / roh- DEN -shə ), que se caracterizan por tener un solo par de incisivos de crecimiento continuo en cada una de las mandíbulas superior e inferior . Alrededor del 40% de todas las especies de mamíferos son roedores. Son nativos de todas las masas terrestres principales excepto la Antártida y varias islas oceánicas, aunque posteriormente han sido introducidos en la mayoría de estas masas terrestres por la actividad humana.
Los roedores son extremadamente diversos en su ecología y estilos de vida y se pueden encontrar en casi todos los hábitats terrestres, incluidos los entornos creados por el hombre. Las especies pueden ser arbóreas , fosoriales (que excavan), saltatorias /rebotadoras (que saltan sobre sus patas traseras) o semiacuáticas. Sin embargo, todos los roedores comparten varias características morfológicas, incluido el hecho de tener solo un par superior e inferior de incisivos en constante crecimiento. Los roedores más conocidos incluyen ratones , ratas , ardillas , perros de las praderas , puercoespines , castores , conejillos de indias y hámsteres . Los conejos , las liebres y las pikas , que también tienen incisivos que crecen continuamente (pero tienen dos pares de incisivos superiores en lugar de uno), [1] alguna vez se incluyeron con los roedores, pero ahora se consideran en un orden separado, los Lagomorpha . Sin embargo, Rodentia y Lagomorpha son grupos hermanos , que comparten un único ancestro común y forman el clado de Glires .
La mayoría de los roedores son animales pequeños con cuerpos robustos, extremidades cortas y colas largas. Utilizan sus afilados incisivos para roer comida, excavar madrigueras y defenderse. La mayoría come semillas u otro material vegetal, pero algunos tienen dietas más variadas. Suelen ser animales sociales y muchas especies viven en sociedades con formas complejas de comunicarse entre sí. El apareamiento entre roedores puede variar desde la monogamia , a la poligamia , a la promiscuidad . Muchos tienen camadas de crías altriciales subdesarrolladas , mientras que otras son precoces (relativamente bien desarrolladas) al nacer.
El registro fósil de roedores se remonta al Paleoceno en el supercontinente de Laurasia . Los roedores se diversificaron enormemente en el Eoceno , a medida que se extendieron por los continentes, a veces incluso cruzando océanos . Los roedores llegaron tanto a Sudamérica como a Madagascar desde África y, hasta la llegada del Homo sapiens , fueron los únicos mamíferos placentarios terrestres que llegaron y colonizaron Australia.
Los roedores se han utilizado como alimento, para la confección de ropa, como mascotas y como animales de laboratorio en la investigación. Algunas especies, en particular la rata parda , la rata negra y el ratón doméstico , son plagas graves que se comen y estropean los alimentos almacenados por los seres humanos y propagan enfermedades. Las especies de roedores introducidas accidentalmente suelen considerarse invasivas y han provocado la extinción de numerosas especies, como las aves isleñas, como por ejemplo el dodo , que anteriormente estaban aisladas de los depredadores terrestres.
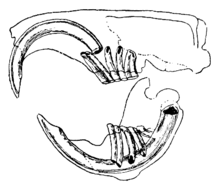

La característica distintiva de los roedores son sus pares de incisivos de raíz abierta, afilados como navajas y en continuo crecimiento . [2] Estos incisivos tienen gruesas capas de esmalte en la parte delantera y poco esmalte en la parte trasera. [3] Debido a que no dejan de crecer, el animal debe seguir desgastándolos para que no alcancen y perforen el cráneo. A medida que los incisivos se muelen entre sí, la dentina más blanda de la parte trasera de los dientes se desgasta, dejando el borde afilado del esmalte con forma de hoja de cincel . [ 4] La mayoría de las especies tienen hasta 22 dientes sin caninos ni premolares anteriores . En la mayoría de las especies se produce un espacio, o diastema , entre los incisivos y los molares. Esto permite a los roedores succionar sus mejillas o labios para proteger su boca y garganta de virutas de madera y otros materiales no comestibles, desechando estos desechos por los lados de la boca. [ cita requerida ] Las chinchillas y los conejillos de indias tienen una dieta rica en fibra; Sus muelas no tienen raíces y crecen continuamente al igual que sus incisivos. [5]
En muchas especies, los molares son relativamente grandes, de estructura intrincada y muy cuspidentes o estriados. Los molares de los roedores están bien equipados para moler alimentos en partículas pequeñas. [2] La musculatura de la mandíbula es fuerte. La mandíbula inferior se empuja hacia adelante mientras roe y se tira hacia atrás durante la masticación. [3] La roedura utiliza incisivos y la masticación utiliza molares, sin embargo, debido a la anatomía craneal de los roedores, estos métodos de alimentación no se pueden utilizar al mismo tiempo y se consideran mutuamente excluyentes. [6] Entre los roedores, el músculo masetero juega un papel clave en la masticación, representando el 60% - 80% de la masa muscular total entre los músculos masticatorios y refleja la dieta herbívora de los roedores. [7] Los grupos de roedores difieren en la disposición de los músculos de la mandíbula y las estructuras craneales asociadas, tanto de otros mamíferos como entre ellos mismos.
Los Sciuromorpha , como la ardilla gris oriental , tienen un masetero grande y profundo , lo que los hace eficientes al morder con los incisivos. Los Myomorpha , como la rata parda, tienen músculos temporales y maseteros agrandados, lo que les permite masticar poderosamente con sus molares. [8] En los roedores, los músculos maseteros se insertan detrás de los ojos y contribuyen al parpadeo de los ojos que ocurre durante la roedura, donde la rápida contracción y relajación del músculo hace que los globos oculares se muevan hacia arriba y hacia abajo. [8] Los Hystricomorpha , como el conejillo de indias, tienen músculos maseteros superficiales más grandes y músculos maseteros profundos más pequeños que las ratas o las ardillas, posiblemente haciéndolos menos eficientes al morder con los incisivos, pero sus músculos pterigoideos internos agrandados pueden permitirles mover la mandíbula más hacia los lados al masticar. [9] La bolsa de la mejilla es una característica morfológica específica utilizada para almacenar alimentos y es evidente en subgrupos particulares de roedores como ratas canguro , hámsteres, ardillas listadas y tuzas que tienen dos bolsas que pueden ir desde la boca hasta la parte delantera de los hombros. [10] Los ratones y ratas verdaderos no contienen esta estructura, pero sus mejillas son elásticas debido a un alto grado de musculatura e inervación en la región. [11]

Aunque la especie más grande, el capibara , puede pesar hasta 66 kg (146 lb), la mayoría de los roedores pesan menos de 100 g (3,5 oz). Los roedores tienen morfologías muy variadas, pero por lo general tienen cuerpos rechonchos y extremidades cortas. [2] Las extremidades anteriores suelen tener cinco dedos, incluido un pulgar oponible, mientras que las extremidades traseras tienen de tres a cinco dedos. El codo proporciona a los antebrazos una gran flexibilidad. [4] La mayoría de las especies son plantígradas , caminan tanto con las palmas como con las plantas de los pies y tienen uñas en forma de garra. Las uñas de las especies excavadoras tienden a ser largas y fuertes, mientras que los roedores arbóreos tienen uñas más cortas y afiladas. Las especies de roedores utilizan una amplia variedad de métodos de locomoción, que incluyen caminar en cuatro patas , correr, excavar, trepar, saltar en dos patas ( ratas canguro y ratones saltadores ), nadar e incluso planear. [4] Las ardillas de cola escamosa y las ardillas voladoras , aunque no están estrechamente relacionadas, pueden planear de un árbol a otro utilizando membranas similares a paracaídas que se extienden desde las extremidades anteriores hasta las posteriores. [12] El agutí es veloz y parecido a un antílope , siendo digitígrado y teniendo uñas similares a pezuñas. La mayoría de los roedores tienen cola, que puede ser de muchas formas y tamaños. Algunas colas son prensiles , como en el ratón cosechador euroasiático , y el pelaje de las colas puede variar de tupido a completamente calvo. La cola a veces se usa para comunicarse, como cuando los castores golpean sus colas en la superficie del agua o los ratones domésticos hacen sonar sus colas para indicar alarma. Algunas especies tienen colas vestigiales o no tienen cola en absoluto. [2] En algunas especies, la cola es capaz de regenerarse si se rompe una parte. [4]

Los roedores generalmente tienen sentidos del olfato , el oído y la vista bien desarrollados . Las especies nocturnas a menudo tienen ojos agrandados y algunas son sensibles a la luz ultravioleta . Muchas especies tienen bigotes o vibrisas largos y sensibles para tocar o "batir" . [14] La acción de los bigotes es impulsada principalmente por el tronco encefálico, que a su vez es provocado por la corteza. [14] Sin embargo, Legg et al. 1989 encuentra un circuito alternativo entre la corteza y los bigotes a través de los circuitos cerebelosos, y Hemelt & Keller 2008 el colículo superior. [14] Algunos roedores tienen bolsas en las mejillas , que pueden estar revestidas de pelo. Estas se pueden dar vuelta para limpiarlas. En muchas especies, la lengua no puede llegar más allá de los incisivos. Los roedores tienen sistemas digestivos eficientes, que absorben casi el 80% de la energía ingerida. Al comer celulosa , la comida se ablanda en el estómago y pasa al ciego , donde las bacterias la reducen a sus elementos de carbohidratos . El roedor practica entonces la coprofagia , comiendo sus propias heces, para que los nutrientes puedan ser absorbidos por el intestino. Por lo tanto, los roedores a menudo producen una heces duras y secas. [2] Horn et al. 2013 [15] descubre que los roedores carecen por completo de la capacidad de vomitar. [16] [17] [18] [19] En muchas especies, el pene contiene un hueso, el báculo ; los testículos pueden estar ubicados en el abdomen o en la ingle. [4]
El dimorfismo sexual se presenta en muchas especies de roedores. En algunos roedores, los machos son más grandes que las hembras, mientras que en otros ocurre lo contrario. El dimorfismo sexual con sesgo masculino es típico de las ardillas terrestres , ratas canguro, ratas topo solitarias y tuzas de bolsillo ; probablemente se desarrolló debido a la selección sexual y un mayor combate entre machos. El dimorfismo sexual con sesgo femenino existe entre las ardillas listadas y los ratones saltadores . No se entiende por qué ocurre este patrón, pero en el caso de las ardillas listadas de pino amarillo , los machos pueden haber seleccionado hembras más grandes debido a su mayor éxito reproductivo. En algunas especies, como los topillos , el dimorfismo sexual puede variar de una población a otra. En los topillos bancarios , las hembras suelen ser más grandes que los machos, pero el dimorfismo sexual con sesgo masculino ocurre en las poblaciones alpinas, posiblemente debido a la falta de depredadores y una mayor competencia entre machos. [20]

Los roedores son uno de los grupos de mamíferos más extendidos y se encuentran en todos los continentes, excepto en la Antártida. Son los únicos mamíferos placentarios terrestres que han colonizado Australia y Nueva Guinea sin intervención humana. Los humanos también han permitido que los animales se expandan a muchas islas oceánicas remotas (por ejemplo, la rata polinesia ). [4] Los roedores se han adaptado a casi todos los hábitats terrestres, desde la fría tundra (donde pueden vivir bajo la nieve) hasta los desiertos cálidos.
Algunas especies, como las ardillas arbóreas y los puercoespines del Nuevo Mundo, son arbóreas , mientras que otras, como las tuzas , los tuco-tucos y las ratas topo, viven casi completamente bajo tierra, donde construyen complejos sistemas de madrigueras. Otras viven en la superficie del suelo, pero pueden tener una madriguera a la que pueden retirarse. Los castores y las ratas almizcleras son conocidos por ser semiacuáticos, [2] pero el roedor mejor adaptado a la vida acuática es probablemente la rata de agua sin orejas de Nueva Guinea. [21] Los roedores también han prosperado en entornos creados por el hombre, como las áreas agrícolas y urbanas . [22]

Aunque algunas especies son plagas comunes para los humanos, los roedores también desempeñan importantes funciones ecológicas. [2] Algunos roedores se consideran especies clave e ingenieros de ecosistemas en sus respectivos hábitats. En las Grandes Llanuras de América del Norte, las actividades de excavación de los perros de las praderas desempeñan un papel importante en la aireación del suelo y la redistribución de nutrientes, aumentando el contenido orgánico del suelo y aumentando la absorción de agua. Mantienen estos hábitats de pastizales, [23] y algunos herbívoros grandes como el bisonte y el berrendo prefieren pastar cerca de las colonias de perros de las praderas debido a la mayor calidad nutricional del forraje. [24]
La extinción de los perros de las praderas también puede contribuir a la pérdida de biodiversidad regional y local , al aumento de la depredación de semillas y al establecimiento y propagación de arbustos invasores. [23] Los roedores excavadores pueden comer los cuerpos fructíferos de los hongos y esparcir esporas a través de sus heces, lo que permite que los hongos se dispersen y formen relaciones simbióticas con las raíces de las plantas (que generalmente no pueden prosperar sin ellos). Como tal, estos roedores pueden desempeñar un papel en el mantenimiento de bosques saludables. [25]
En muchas regiones templadas, los castores desempeñan un papel hidrológico esencial . Al construir sus presas y madrigueras, los castores alteran los cursos de agua de los arroyos y ríos [26] y permiten la creación de amplios hábitats de humedales. Un estudio descubrió que la ingeniería de los castores conduce a un aumento del 33 por ciento en el número de especies de plantas herbáceas en las zonas ribereñas . [27] Otro estudio descubrió que los castores aumentan las poblaciones de salmón salvaje. [28] Mientras tanto, algunos roedores son vistos como plagas , debido a su amplia distribución. [29]

La mayoría de los roedores son herbívoros y se alimentan exclusivamente de material vegetal como semillas, tallos, hojas, flores y raíces. Algunos son omnívoros y unos pocos son depredadores. [3] El topillo campestre es un roedor herbívoro típico y se alimenta de pastos, hierbas, tubérculos, musgo y otra vegetación, y roe la corteza durante el invierno. Ocasionalmente come invertebrados como larvas de insectos. [30] La tuza de las llanuras come material vegetal que encuentra bajo tierra durante la excavación de túneles, y también recolecta pastos, raíces y tubérculos en sus bolsas de las mejillas y los esconde en cámaras subterráneas de despensa. [31]
La tuza de Texas evita salir a la superficie para alimentarse agarrando las raíces de las plantas con sus mandíbulas y tirándolas hacia abajo, hacia su madriguera. También practica la coprofagia. [32] La rata africana busca alimento en la superficie, recolectando cualquier cosa que pueda ser comestible en sus grandes bolsas de las mejillas hasta que su cara sobresale hacia un lado. Luego regresa a su madriguera para clasificar el material que ha recolectado y come los elementos nutritivos. [33]
Las especies de agutíes son uno de los pocos grupos animales que pueden romper las grandes cápsulas de la nuez de Brasil . En su interior hay demasiadas semillas para consumirlas en una sola comida, por lo que el agutí se lleva algunas y las guarda en un escondite. Esto facilita la dispersión de las semillas, ya que las que el agutí no consigue recuperar están lejos del árbol padre cuando germinan. Otros árboles que producen nueces tienden a dar una sobreabundancia de frutos en otoño. Estos son demasiado numerosos para comerlos en una sola comida y las ardillas recogen y almacenan el excedente en grietas y árboles huecos. En las regiones desérticas, las semillas suelen estar disponibles solo durante períodos cortos. La rata canguro recoge todas las que puede encontrar y las almacena en cámaras de despensa en su madriguera. [33]

Una estrategia para lidiar con la abundancia estacional es comer tanto como sea posible y almacenar los nutrientes excedentes en forma de grasa. Las marmotas hacen esto y pueden ser un 50% más pesadas en otoño que en primavera. Dependen de sus reservas de grasa durante su larga hibernación invernal . [33] Los castores se alimentan de las hojas, brotes y corteza interna de los árboles en crecimiento, así como de plantas acuáticas. Almacenan alimentos para su uso invernal talando árboles pequeños y ramas frondosas en otoño y sumergiéndolos en su estanque, clavando los extremos en el barro para anclarlos. Aquí, pueden acceder a su suministro de alimentos bajo el agua incluso cuando su estanque está congelado. [34]
Aunque tradicionalmente se ha considerado a los roedores como herbívoros, la mayoría de los pequeños roedores incluyen de manera oportunista insectos, gusanos, hongos, pescado o carne en sus dietas y unos pocos se han especializado para depender de una dieta de materia animal. Un estudio morfológico-funcional del sistema dentario de los roedores apoya la idea de que los roedores primitivos eran omnívoros en lugar de herbívoros. Los estudios de la literatura muestran que numerosos miembros de los Sciuromorpha y Myomorpha, y algunos miembros de los Hystricomorpha, han incluido materia animal en sus dietas o han sido preparados para comer dicho alimento cuando se les ofrece en cautiverio. El examen del contenido estomacal del ratón de patas blancas norteamericano , normalmente considerado herbívoro, mostró un 34% de materia animal. [35]
Entre los carnívoros más especializados se encuentran las ratas de Filipinas, que se alimentan de insectos e invertebrados de cuerpo blando, y el rakali o rata de agua australiana, que devora insectos acuáticos, peces, crustáceos, mejillones, caracoles, ranas, huevos de aves y aves acuáticas. [35] [36] El ratón saltamontes de las regiones secas de América del Norte se alimenta de insectos, escorpiones y otros ratones pequeños, y solo una pequeña parte de su dieta es material vegetal. Tiene un cuerpo robusto con patas y cola cortas, pero es ágil y puede dominar fácilmente a presas tan grandes como él. [37]

Los roedores exhiben una amplia gama de tipos de comportamiento social que van desde el sistema de castas de los mamíferos de la rata topo desnuda , [38] la extensa "ciudad" del perro de las praderas colonial , [39] pasando por los grupos familiares hasta la vida independiente y solitaria del lirón comestible . Los lirones adultos pueden tener áreas de alimentación superpuestas, pero viven en nidos individuales y se alimentan por separado, reuniéndose brevemente en la temporada de reproducción para aparearse. La tuza de bolsillo también es un animal solitario fuera de la temporada de reproducción, cada individuo cava un complejo sistema de túneles y mantiene un territorio. [40]
Los roedores más grandes tienden a vivir en unidades familiares donde los padres y sus crías viven juntos hasta que las crías se dispersan. Los castores viven en unidades familiares extendidas, generalmente con una pareja de adultos, las crías de este año, las crías del año anterior y, a veces, crías mayores. [41] Las ratas pardas suelen vivir en pequeñas colonias con hasta seis hembras compartiendo una madriguera y un macho defendiendo un territorio alrededor de la madriguera. En altas densidades de población, este sistema se rompe y los machos muestran un sistema jerárquico de dominio con rangos superpuestos. Las crías hembras permanecen en la colonia mientras que los machos jóvenes se dispersan. [42] El topillo de pradera es monógamo y forma un vínculo de pareja de por vida. Fuera de la temporada de reproducción, los topillos de pradera viven con otros en pequeñas colonias. Un macho no es agresivo con otros machos hasta que se ha apareado, después de lo cual defiende un territorio, una hembra y un nido contra otros machos. La pareja se acurruca junta, se acicalan mutuamente y comparten las responsabilidades de anidación y crianza de las crías. [43]

Entre los roedores más sociales se encuentran las ardillas terrestres, que suelen formar colonias basadas en el parentesco entre hembras, y los machos se dispersan después del destete y se vuelven nómadas cuando son adultos. La cooperación en las ardillas terrestres varía entre especies y normalmente incluye hacer llamadas de alarma, defender territorios, compartir comida, proteger áreas de anidación y prevenir el infanticidio. [44] El perrito de las praderas de cola negra forma grandes poblados que pueden cubrir muchas hectáreas. Las madrigueras no se interconectan, sino que son excavadas y ocupadas por grupos familiares territoriales conocidos como camarillas. Una camarilla a menudo consta de un macho adulto, tres o cuatro hembras adultas, varios ejemplares de un año que no están en edad reproductiva y la descendencia del año en curso. Los individuos dentro de las camarillas son amistosos entre sí, pero hostiles hacia los extraños. [39]
Quizás los ejemplos más extremos de comportamiento colonial en roedores son la rata topo desnuda eusocial y la rata topo de Damaraland . La rata topo desnuda vive completamente bajo tierra y puede formar colonias de hasta 80 individuos. Solo una hembra y hasta tres machos de la colonia se reproducen, mientras que el resto de los miembros son más pequeños y estériles, y funcionan como trabajadores. Algunos individuos son de tamaño intermedio. Ayudan en la crianza de las crías y pueden ocupar el lugar de un reproductor si uno muere. [38] La rata topo de Damaraland se caracteriza por tener un solo macho y hembra reproductivamente activos en una colonia donde los animales restantes no son verdaderamente estériles, sino que se vuelven fértiles solo si establecen una colonia propia. [45]

Los roedores utilizan el marcado con olor en muchos contextos sociales, como la comunicación entre especies y dentro de ellas, el marcado de senderos y el establecimiento de territorios. Su orina proporciona información genética sobre los individuos, incluida la especie, el sexo y la identidad individual, e información metabólica sobre el dominio, el estado reproductivo y la salud. Los compuestos derivados del complejo mayor de histocompatibilidad (CMH) están unidos a varias proteínas urinarias. El olor de un depredador deprime el comportamiento de marcado con olor. [46]
Los roedores pueden reconocer a sus parientes cercanos por el olor, lo que les permite mostrar nepotismo (comportamiento preferencial hacia sus parientes) y también evitar la endogamia. Este reconocimiento de parentesco se realiza mediante señales olfativas de la orina, las heces y las secreciones glandulares. La evaluación principal puede involucrar el MHC, donde el grado de parentesco de dos individuos se correlaciona con los genes MHC que tienen en común. En la comunicación no familiar, donde se requieren marcadores de olor más permanentes, como en las fronteras territoriales, también se pueden utilizar proteínas urinarias mayores (MUP) no volátiles, que funcionan como transportadores de feromonas . Las MUP también pueden señalar la identidad individual, ya que cada ratón doméstico macho ( Mus musculus ) excreta orina que contiene alrededor de una docena de MUP codificadas genéticamente. [47]
Los ratones domésticos depositan orina, que contiene feromonas, para marcar territorio, reconocer individuos y grupos y organizarse socialmente. [48] Los castores y las ardillas rojas territoriales investigan y se familiarizan con los olores de sus vecinos y responden menos agresivamente a las intrusiones de estos que a las de los "flotadores" no territoriales o extraños. Esto se conoce como el " efecto del querido enemigo ". [49] [50]

Muchas especies de roedores, en particular las diurnas y sociales, emiten una amplia gama de llamadas de alarma cuando perciben amenazas. Esto tiene beneficios tanto directos como indirectos. Un depredador potencial puede detenerse cuando sabe que ha sido detectado, o una llamada de alarma puede permitir que sus congéneres o individuos relacionados tomen medidas evasivas. [51] Varias especies, por ejemplo los perros de las praderas, tienen complejos sistemas de llamadas de alarma antidepredadores. Estas especies pueden tener diferentes llamadas para diferentes depredadores (por ejemplo, depredadores aéreos o terrestres) y cada llamada contiene información sobre la naturaleza de la amenaza precisa. [52] La urgencia de la amenaza también se transmite por las propiedades acústicas de la llamada. [53]
Los roedores sociales tienen una gama más amplia de vocalizaciones que las especies solitarias. Se han reconocido quince tipos de llamadas diferentes en ratas topo Kataba adultas y cuatro en juveniles. [54] De manera similar, el degú común , otro roedor social que excava, exhibe una amplia gama de métodos de comunicación y tiene un repertorio vocal elaborado que comprende quince categorías diferentes de sonido. [55] Las llamadas ultrasónicas juegan un papel en la comunicación social entre lirones y se utilizan cuando los individuos están fuera de la vista unos de otros. [56]
Los ratones domésticos utilizan llamadas tanto audibles como ultrasónicas en diversos contextos. Las vocalizaciones audibles suelen oírse durante encuentros agonísticos o agresivos, mientras que el ultrasonido se utiliza en la comunicación sexual y también por parte de las crías cuando se han caído del nido. [48]
Las ratas de laboratorio (que son ratas marrones, Rattus norvegicus ) emiten vocalizaciones ultrasónicas cortas y de alta frecuencia durante experiencias supuestamente placenteras, como juegos bruscos, cuando anticipan dosis rutinarias de morfina , durante el apareamiento y cuando se les hacen cosquillas. La vocalización, descrita como un "chirrido" distintivo, se ha comparado con la risa y se interpreta como una expectativa de algo gratificante. En estudios clínicos, el chirrido se asocia con sentimientos emocionales positivos y se produce un vínculo social con el que hace cosquillas, lo que hace que las ratas se condicionen a buscar las cosquillas. Sin embargo, a medida que las ratas envejecen, la tendencia a chirriar disminuye. Como la mayoría de las vocalizaciones de las ratas, el chirrido se produce en frecuencias demasiado altas para que los humanos lo escuchen sin un equipo especial, por lo que se han utilizado detectores de murciélagos para este propósito. [57]
Los roedores, como todos los mamíferos placentarios excepto los primates, tienen sólo dos tipos de conos receptores de luz en su retina, [58] un tipo "azul-UV" de longitud de onda corta y un tipo "verde" de longitud de onda media. Por lo tanto, se clasifican como dicrómatas ; sin embargo, son visualmente sensibles al espectro ultravioleta (UV) y, por lo tanto, pueden ver la luz que los humanos no pueden. Las funciones de esta sensibilidad a los rayos UV no siempre están claras. En los degús , por ejemplo, el vientre refleja más luz UV que la espalda. Por lo tanto, cuando un degú se pone de pie sobre sus patas traseras, lo que hace cuando está alarmado, expone su vientre a otros degús y la visión ultravioleta puede servir para comunicar la alarma. Cuando se pone de pie sobre cuatro patas, su espalda de baja reflectancia UV podría ayudar a que el degú sea menos visible para los depredadores. [59] La luz ultravioleta es abundante durante el día, pero no durante la noche. Hay un gran aumento en la relación entre luz ultravioleta y luz visible en las horas del crepúsculo de la mañana y la tarde. Muchos roedores son activos durante las horas del crepúsculo (actividad crepuscular), y la sensibilidad a los rayos ultravioleta sería ventajosa en esos momentos. La reflectividad ultravioleta es de dudoso valor para los roedores nocturnos. [60]
La orina de muchos roedores (por ejemplo, topillos, degús, ratones, ratas) refleja fuertemente la luz ultravioleta y esto puede usarse en la comunicación al dejar marcas visibles y olfativas. [61] Sin embargo, la cantidad de luz ultravioleta que se refleja disminuye con el tiempo, lo que en algunas circunstancias puede ser desventajoso; el cernícalo vulgar puede distinguir entre rastros de roedores antiguos y recientes y tiene mayor éxito cazando en rutas marcadas más recientemente. [62]

Las vibraciones pueden proporcionar señales a los congéneres sobre conductas específicas que se están realizando, advertencias y evitación de depredadores, mantenimiento de manadas o grupos y cortejo. La rata topo ciega de Oriente Medio fue el primer mamífero para el que se documentó la comunicación sísmica . Estos roedores fosoriales golpean su cabeza contra las paredes de sus túneles. Este comportamiento se interpretó inicialmente como parte de su comportamiento de construcción de túneles, pero finalmente se descubrió que generan señales sísmicas con patrones temporales para la comunicación a larga distancia con ratas topo vecinas. [63]
El golpeteo de pies se utiliza ampliamente como una advertencia de depredadores o una acción defensiva. Lo utilizan principalmente los roedores fosoriales o semifosoriales. [64] La rata canguro de cola de pancarta produce varios patrones complejos de golpeteo de pies en varios contextos diferentes, uno de los cuales es cuando se encuentra con una serpiente. El golpeteo de pies puede alertar a la descendencia cercana, pero lo más probable es que transmita que la rata está demasiado alerta para un ataque exitoso, evitando así la persecución depredadora de la serpiente. [63] [65] Varios estudios han indicado el uso intencional de vibraciones del suelo como un medio de comunicación intraespecífica durante el cortejo entre la rata topo del Cabo . [66] Se ha informado que el golpeteo de pies está involucrado en la competencia entre machos; el macho dominante indica su potencial de retención de recursos al tamborilear, minimizando así el contacto físico con rivales potenciales. [63]

Algunas especies de roedores son monógamas, y un macho y una hembra adultos forman una pareja duradera . La monogamia puede presentarse de dos formas: obligada y facultativa. En la monogamia obligada, ambos padres cuidan de la descendencia y desempeñan un papel importante en su supervivencia. Esto ocurre en especies como los ratones de California , los ratones de campo , las ratas gigantes malgaches y los castores. En estas especies, los machos suelen aparearse solo con sus parejas. Además de un mayor cuidado de las crías, la monogamia obligada también puede ser beneficiosa para el macho adulto, ya que disminuye las posibilidades de no encontrar nunca una pareja o de aparearse con una hembra infértil. En la monogamia facultativa, los machos no proporcionan cuidado parental directo y se quedan con una hembra porque no pueden acceder a otras debido a que están dispersos espacialmente. Los topillos de pradera parecen ser un ejemplo de esta forma de monogamia, en la que los machos vigilan y defienden a las hembras que se encuentran en su vecindad. [67]
En las especies poligínicas , los machos intentarán monopolizar y aparearse con varias hembras. Al igual que con la monogamia, la poligamia en los roedores puede presentarse en dos formas: defensiva y no defensiva. La poligamia defensiva implica que los machos controlan territorios que contienen recursos que atraen a las hembras. Esto ocurre en ardillas terrestres como las marmotas de vientre amarillo , las ardillas terrestres de California , las ardillas terrestres colombianas y las ardillas terrestres de Richardson . Los machos con territorios se conocen como machos "residentes" y las hembras que viven dentro de los territorios se conocen como hembras "residentes". En el caso de las marmotas, los machos residentes no parecen perder nunca sus territorios y siempre ganan los encuentros con los machos invasores. También se sabe que algunas especies defienden directamente a sus hembras residentes y las peleas resultantes pueden provocar heridas graves. En las especies con poligamia no defensiva, los machos no son territoriales y deambulan ampliamente en busca de hembras para monopolizar. Estos machos establecen jerarquías de dominio, en las que los machos de alto rango tienen acceso a la mayoría de las hembras. Esto ocurre en especies como las ardillas terrestres de Belding y algunas especies de ardillas arbóreas. [67]

La promiscuidad , en la que tanto los machos como las hembras se aparean con múltiples parejas, también se da en roedores. En especies como el ratón de patas blancas, las hembras dan a luz camadas con paternidades múltiples. La promiscuidad conduce a una mayor competencia espermática y los machos tienden a tener testículos más grandes. En la ardilla terrestre del Cabo , los testículos del macho pueden tener el 20 por ciento de la longitud de su cabeza y cuerpo. [67] Varias especies de roedores tienen sistemas de apareamiento flexibles que pueden variar entre la monogamia, la poligamia y la promiscuidad. [67]
Las hembras de roedores desempeñan un papel activo en la elección de sus parejas. Entre los factores que contribuyen a la preferencia de las hembras se encuentran el tamaño, el dominio y la capacidad espacial del macho. [68] En las ratas topo desnudas eusociales, una sola hembra monopoliza el apareamiento de al menos tres machos. [38]
En la mayoría de las especies de roedores, como las ratas pardas y los ratones domésticos, la ovulación se produce en un ciclo regular, mientras que en otras, como los topillos, se induce mediante el apareamiento . Durante la cópula, los machos de algunas especies de roedores depositan un tapón de apareamiento en la abertura genital de la hembra, tanto para evitar la fuga de esperma como para protegerse de que otros machos inseminen a la hembra. Las hembras pueden retirar el tapón y pueden hacerlo inmediatamente o después de varias horas. [68]
El metabolismo de las hormonas tiroideas y del yodo en el hipotálamo mediobasal cambia en respuesta al fotoperiodo . Las hormonas tiroideas a su vez inducen cambios reproductivos. Esto lo encontraron Watanabe et al. 2004 y 2007, Barrett et al. 2007, Freeman et al. 2007 y Herwig et al. 2009 en hámsteres siberianos , Revel et al. 2006 y Yasuo et al. 2007 en hámsteres sirios , Yasuo et al. 2007 y Ross et al. 2011 en ratas, y Ono et al. 2008 en ratones. [69]

Los roedores pueden nacer altriciales (ciegos, sin pelo y relativamente poco desarrollados) o precoces (mayormente peludos, con los ojos abiertos y bastante desarrollados) según la especie. El estado altricial es típico de las ardillas y los ratones, mientras que el estado precoz suele darse en especies como los conejillos de indias y los puercoespines. Las hembras con crías altriciales suelen construir nidos elaborados antes de dar a luz y los mantienen hasta que sus crías son destetadas . La hembra da a luz sentada o acostada y las crías emergen en la dirección en la que ella mira. Los recién nacidos salen del nido por primera vez unos días después de haber abierto los ojos y al principio siguen volviendo con regularidad. A medida que crecen y se desarrollan más, visitan el nido con menos frecuencia y se van de forma permanente cuando son destetados. [70]
En las especies precoces, las madres invierten poco en la construcción del nido y algunas ni siquiera lo construyen. La hembra da a luz de pie y las crías emergen detrás de ella. Las madres de estas especies mantienen contacto con sus crías, que son muy móviles, mediante llamadas de contacto maternal. Aunque son relativamente independientes y se destetan en cuestión de días, las crías precoces pueden seguir amamantándose y siendo acicaladas por sus madres. El tamaño de las camadas de roedores también varía y las hembras con camadas más pequeñas pasan más tiempo en el nido que las que tienen camadas más numerosas. [70]

Las madres roedoras brindan tanto cuidado parental directo, como amamantamiento, acicalamiento, recuperación y amontonamiento, como crianza indirecta, como almacenamiento de alimentos, construcción de nidos y protección a sus crías. [70] En muchas especies sociales, las crías pueden ser cuidadas por individuos distintos a sus padres, una práctica conocida como crianza aloparental o cooperativa . Se sabe que esto ocurre en los perros de las praderas de cola negra y las ardillas terrestres de Belding, donde las madres tienen nidos comunales y amamantan a crías no relacionadas junto con las suyas. Existe cierta duda sobre si estas madres pueden distinguir qué crías son suyas. En la mara patagónica , las crías también se colocan en madrigueras comunales, pero las madres no permiten que crías que no sean las suyas las amamanten. [71]
El infanticidio existe en numerosas especies de roedores y puede ser practicado por congéneres adultos de ambos sexos. Se han propuesto varias razones para este comportamiento, incluyendo el estrés nutricional, la competencia por los recursos, evitar desviar el cuidado parental y, en el caso de los machos, intentar hacer que la madre sea sexualmente receptiva. Esta última razón está bien respaldada en primates y leones , pero menos en roedores. [72] El infanticidio parece estar muy extendido en los perros de las praderas de cola negra, incluido el infanticidio de los machos invasores y las hembras inmigrantes, así como el canibalismo ocasional de la propia descendencia de un individuo. [73] Para protegerse contra el infanticidio de otros adultos, los roedores hembra pueden emplear la evitación o la agresión directa contra los perpetradores potenciales, el apareamiento múltiple, la territorialidad o la interrupción temprana del embarazo. [72] El feticidio también puede ocurrir entre roedores; en las marmotas alpinas , las hembras dominantes tienden a suprimir la reproducción de los subordinados siendo antagónicas hacia ellos mientras están embarazadas. El estrés resultante hace que los fetos aborten. [74]

Los roedores tienen capacidades cognitivas avanzadas . Pueden aprender rápidamente a evitar cebos envenenados, lo que los convierte en plagas difíciles de controlar. [2] Los conejillos de indias pueden aprender y recordar rutas complejas para llegar a los alimentos. [75] Las ardillas y las ratas canguro pueden localizar escondites de comida mediante la memoria espacial , en lugar de solo por el olfato. [76] [77]
Debido a que los ratones de laboratorio (ratones domésticos) y las ratas (ratas pardas) se utilizan ampliamente como modelos científicos para ampliar nuestra comprensión de la biología, se ha llegado a saber mucho sobre sus capacidades cognitivas. Las ratas pardas muestran sesgo cognitivo , en el que el procesamiento de la información está sesgado según se encuentren en un estado afectivo positivo o negativo. [78] Por ejemplo, las ratas de laboratorio entrenadas para responder a un tono específico presionando una palanca para recibir una recompensa, y para presionar otra palanca en respuesta a un tono diferente para evitar recibir una descarga eléctrica, tienen más probabilidades de responder a un tono intermedio eligiendo la palanca de recompensa si acaban de hacerles cosquillas (algo que disfrutan), lo que indica "un vínculo entre el estado afectivo positivo medido directamente y la toma de decisiones en condiciones de incertidumbre en un modelo animal". [79]
Las ratas de laboratorio (marrones) pueden tener la capacidad de metacognición —considerar su propio aprendizaje y luego tomar decisiones basadas en lo que saben, o no saben, como lo indican las elecciones que hacen aparentemente negociando la dificultad de las tareas y las recompensas esperadas—, lo que las convierte en los primeros animales, aparte de los primates, que se sabe que tienen esta capacidad, [80] [81] pero estos hallazgos son discutidos, ya que las ratas pueden haber estado siguiendo principios de condicionamiento operante simple, [82] o un modelo económico conductual . [83] Las ratas marrones usan el aprendizaje social en una amplia gama de situaciones, pero quizás especialmente en la adquisición de preferencias alimentarias. [84] [85]

La dentición es la característica clave por la que se reconocen los roedores fósiles y el registro más antiguo de estos mamíferos proviene del Paleoceno , poco después de la extinción de los dinosaurios no aviares hace unos 66 millones de años. Estos fósiles se encuentran en Laurasia , [86] el supercontinente compuesto por la actual América del Norte, Europa y Asia. La divergencia de Glires , un clado que consiste en roedores y lagomorfos (conejos, liebres y pikas), de otros mamíferos placentarios ocurrió unos pocos millones de años después del límite Cretácico-Paleógeno; los roedores y lagomorfos luego irradiaron durante el Cenozoico . [87] Algunos datos del reloj molecular sugieren que los roedores modernos (miembros del orden Rodentia) habían aparecido a fines del Cretácico , [88] aunque otras estimaciones de divergencia molecular concuerdan con el registro fósil. [89] [90]
Se cree que los roedores evolucionaron en Asia, donde las faunas multituberculadas locales se vieron gravemente afectadas por la extinción masiva del Cretácico-Paleógeno y nunca se recuperaron por completo, a diferencia de sus parientes norteamericanos y europeos. En el vacío ecológico resultante, los roedores y otros glires pudieron evolucionar y diversificarse, ocupando los nichos dejados por los multituberculados extintos. La correlación entre la propagación de los roedores y la desaparición de los multituberculados es un tema controvertido, que no se ha resuelto por completo. Los conjuntos multituberculados americanos y europeos disminuyen en diversidad en correlación con la introducción de roedores en estas áreas, pero los multituberculados asiáticos restantes coexistieron con los roedores sin que se produjera un reemplazo observable y, en última instancia, ambos clados coexistieron durante al menos 15 millones de años. [91]
La historia de la colonización de los continentes del mundo por parte de roedores es compleja. Los movimientos de la gran superfamilia Muroidea (que incluye a los hámsteres , jerbos , ratones y ratas ) pueden haber implicado hasta siete colonizaciones de África, cinco de América del Norte, cuatro del sudeste asiático, dos de América del Sur y hasta diez de Eurasia. [92]

Durante el Eoceno , los roedores comenzaron a diversificarse. Los castores aparecieron en Eurasia a finales del Eoceno antes de extenderse a América del Norte a finales del Mioceno. [94] A finales del Eoceno, los histricognatos invadieron África, probablemente habiéndose originado en Asia hace al menos 39,5 millones de años. [95] Desde África, la evidencia fósil muestra que algunos histricognatos ( caviomorfos ) colonizaron América del Sur , que era un continente aislado en ese momento, evidentemente haciendo uso de las corrientes oceánicas para cruzar el Atlántico en escombros flotantes . [96] Los caviomorfos habían llegado a América del Sur hace 41 millones de años (lo que implica una fecha al menos tan temprana como esta para los histricognatos en África), [95] y habían llegado a las Antillas Mayores a principios del Oligoceno , lo que sugiere que deben haberse dispersado rápidamente por América del Sur. [97]
Se cree que los roedores nesomidos llegaron desde África a Madagascar hace entre 20 y 24 millones de años. [98] Las 27 especies de roedores nativos malgaches parecen ser descendientes de un único evento de colonización.
Hace 20 millones de años, aparecieron fósiles que pertenecían a familias actuales como Muridae. [86] En el Mioceno , cuando África colisionó con Asia, los roedores africanos como el puercoespín comenzaron a extenderse a Eurasia . [99] Algunas especies fósiles eran muy grandes en comparación con los roedores modernos e incluían al castor gigante, Castoroides ohioensis , que creció hasta una longitud de 2,5 m (8 pies 2 pulgadas) y un peso de 100 kg (220 libras). [100] El roedor más grande conocido fue Josephoartigasia monesi , una pacarana con una longitud corporal estimada de 3 m (10 pies). [101]
Los primeros roedores llegaron a Australia a través de Indonesia hace unos 5 millones de años. Aunque los marsupiales son los mamíferos más destacados de Australia, muchos roedores , todos pertenecientes a la subfamilia Murinae , se encuentran entre las especies de mamíferos del continente . [102] Hay alrededor de cincuenta especies de "antiguas endémicas", la primera ola de roedores que colonizó el país en el Mioceno y principios del Plioceno , y ocho especies verdaderas de rata ( Rattus ) de "nuevas endémicas", que llegaron en una ola posterior a finales del Plioceno o principios del Pleistoceno . Los primeros roedores fósiles de Australia tienen una edad máxima de 4,5 millones de años, [103] y los datos moleculares son consistentes con la colonización de Nueva Guinea desde el oeste durante finales del Mioceno o principios del Plioceno seguida de una rápida diversificación. Una nueva ola de radiación adaptativa ocurrió después de una o más colonizaciones de Australia unos 2 a 3 millones de años después. [104]
Los roedores participaron en el Gran Intercambio Americano que resultó de la unión de las Américas por la formación del Istmo de Panamá , hace alrededor de 3 millones de años en la era Piacenziana . [105] En este intercambio, un pequeño número de especies como los puercoespines del Nuevo Mundo (Erethizontidae) se dirigieron al norte. [86] Sin embargo, la principal invasión hacia el sur de sigmodontinos precedió a la formación del puente terrestre por al menos varios millones de años, probablemente ocurriendo a través del rafting. [106] [107] [108] Los sigmodontinos se diversificaron explosivamente una vez en América del Sur, aunque es posible que ya se haya producido cierto grado de diversificación en América Central antes de la colonización. [107] [108]
El uso del nombre del orden "Rodentia" se atribuye al viajero y naturalista inglés Thomas Edward Bowdich (1821). [109] La palabra latina moderna Rodentia se deriva de rodens , participio presente de rodere - "roer", "comer". [110] Las liebres , conejos y pikas (orden Lagomorpha) tienen incisivos en continuo crecimiento, al igual que los roedores, y en algún momento estuvieron incluidos en el orden. Sin embargo, tienen un par adicional de incisivos en la mandíbula superior y los dos órdenes tienen historias evolutivas bastante separadas. [111] La filogenia de los roedores los ubica en los clados Glires, Euarchontoglires y Boreoeutheria . El cladograma a continuación muestra las relaciones internas y externas de Rodentia basadas en un intento de 2012 de Wu et al. de alinear el reloj molecular con datos paleontológicos: [112]
Familias de roedores actuales según el estudio realizado por Fabre et al. 2012. [113]
El orden Rodentia puede dividirse en subórdenes , infraórdenes , superfamilias y familias . Existe una gran cantidad de paralelismo y convergencia entre los roedores causado por el hecho de que han tendido a evolucionar para llenar nichos en gran medida similares. Esta evolución paralela incluye no solo la estructura de los dientes, sino también la región infraorbitaria del cráneo (debajo de la cuenca del ojo) y dificulta la clasificación ya que los rasgos similares pueden no deberse a una ascendencia común. [114] [115] Brandt (1855) fue el primero en proponer dividir Rodentia en tres subórdenes, Sciuromorpha, Hystricomorpha y Myomorpha, basándose en el desarrollo de ciertos músculos en la mandíbula y este sistema fue ampliamente aceptado. Schlosser (1884) realizó una revisión exhaustiva de los fósiles de roedores, principalmente utilizando los dientes de las mejillas, y encontró que encajaban en el sistema clásico, pero Tullborg (1899) propuso solo dos subórdenes, Sciurognathi e Hystricognathi. Estos se basaban en el grado de inflexión de la mandíbula inferior y se subdividieron en Sciuromorpha, Myomorpha, Hystricomorpha y Bathyergomorpha. Matthew (1910) creó un árbol filogenético de roedores del Nuevo Mundo pero no incluyó las especies más problemáticas del Viejo Mundo. Los intentos posteriores de clasificación continuaron sin acuerdo, con algunos autores adoptando el sistema clásico de tres subórdenes y otros los dos subórdenes de Tullborg. [114]
Estos desacuerdos siguen sin resolverse, y los estudios moleculares tampoco han resuelto por completo la situación, aunque sí han confirmado la monofilia del grupo y que el clado desciende de un ancestro común del Paleoceno. Carleton y Musser (2005) en Mammal Species of the World han adoptado provisionalmente un sistema de cinco subórdenes: Sciuromorpha, Castorimorpha, Myomorpha, Anomaluromorpha e Hystricomorpha. En 2021, la Sociedad Estadounidense de Mammalogistas reconoce 34 familias recientes que contienen más de 481 géneros y 2277 especies. [116] [117] [118]

Orden Rodentia (del latín rodere , roer)






Aunque los roedores no son el orden de mamíferos más seriamente amenazado, hay 168 especies en 126 géneros que se dice que merecen atención de conservación [119] frente a la limitada apreciación por parte del público. Dado que el 76 por ciento de los géneros de roedores contienen solo una especie, gran parte de la diversidad filogenética podría perderse con un número comparativamente pequeño de extinciones. En ausencia de un conocimiento más detallado de las especies en riesgo y una taxonomía precisa, la conservación debe basarse principalmente en taxones superiores (como familias en lugar de especies) y puntos críticos geográficos. [119] Varias especies de rata arrocera se han extinguido desde el siglo XIX, probablemente a través de la pérdida de hábitat y la introducción de especies exóticas. [120] En Colombia, el puercoespín enano peludo marrón fue registrado solo en dos localidades montañosas en la década de 1920, mientras que la rata espinosa de pelaje suave de cresta roja se conoce solo en su localidad tipo en la costa caribeña, por lo que estas especies se consideran vulnerables. [121] La Comisión de Supervivencia de Especies de la UICN escribe: "Podemos concluir con seguridad que muchos roedores sudamericanos están seriamente amenazados, principalmente por la perturbación ambiental y la caza intensiva". [122]
Las "tres especies de roedores comensales plaga ahora cosmopolitas" [123] (la rata parda, la rata negra y el ratón doméstico) se han dispersado en asociación con los humanos, en parte en barcos de vela en la Era de la Exploración , y con una cuarta especie en el Pacífico, la rata polinesia ( Rattus exulans ), han dañado gravemente las biotas de las islas en todo el mundo. Por ejemplo, cuando la rata negra llegó a la isla Lord Howe en 1918, más del 40 por ciento de las especies de aves terrestres de la isla, incluido el fantail de Lord Howe , [124] se extinguieron en diez años. Se ha visto una destrucción similar en la isla Midway (1943) y la isla Big South Cape (1962). Los proyectos de conservación pueden, con una planificación cuidadosa, erradicar por completo estos roedores plaga de las islas utilizando un rodenticida anticoagulante como el brodifacoum . [123] Este enfoque ha tenido éxito en la isla de Lundy en el Reino Unido, donde la erradicación de aproximadamente 40.000 ratas pardas está dando a las poblaciones de pardela pichoneta y frailecillo atlántico una oportunidad de recuperarse de la casi extinción. [125] [126]
Los roedores también han sido susceptibles al cambio climático , especialmente las especies que viven en islas bajas. El melomys de Bramble Cay , que vivía en el punto más septentrional de la tierra de Australia , fue la primera especie de mamífero en ser declarada extinta como consecuencia del cambio climático provocado por el hombre . [127]

La humanidad ha utilizado desde hace mucho tiempo las pieles de animales para la confección de ropa, ya que el cuero es duradero y el pelaje proporciona un aislamiento adicional. [3] Los pueblos nativos de América del Norte hicieron mucho uso de las pieles de castor, curtiéndolas y cosiéndolas para hacer túnicas. Los europeos apreciaron la calidad de estas y el comercio de pieles en América del Norte se desarrolló y se volvió de suma importancia para los primeros colonos. En Europa, se descubrió que la suave piel interior conocida como "lana de castor" era ideal para el fieltro y se convirtió en sombreros de castor y adornos para la ropa. [128] [129] Más tarde, el coipo se convirtió en una fuente más barata de piel para el fieltro y se crió extensivamente en América y Europa; sin embargo, las modas cambiaron, aparecieron nuevos materiales y esta área de la industria de las pieles animales decayó. [130] La chinchilla tiene un pelaje suave y sedoso y la demanda de su piel era tan alta que casi se extinguió en la naturaleza antes de que la agricultura se convirtiera en la principal fuente de pieles. [130] Las púas y los pelos de los puercoespines se utilizan para la ropa decorativa tradicional. Por ejemplo, sus pelos de los puercoespines se utilizan en la creación del tocado de los nativos americanos llamado "porky roach" . Las púas principales se pueden teñir y luego aplicar en combinación con hilo para embellecer accesorios de cuero, como fundas de cuchillos y bolsos de cuero. Las mujeres Lakota recolectaban las púas para hacer artesanías con púas arrojando una manta sobre un puercoespín y recuperando las púas que quedaban atrapadas en la manta. [131]
Al menos 89 especies de roedores, en su mayoría Hystricomorpha como cobayas, agutíes y capibaras, son consumidas por los humanos; en 1985, había al menos 42 sociedades diferentes en las que la gente come ratas. [132] Los conejillos de indias fueron criados por primera vez como alimento alrededor del 2500 a. C. y para el 1500 a. C. se habían convertido en la principal fuente de carne para el Imperio Inca . Los lirones eran criados por los romanos en ollas especiales llamadas "gliraria", o en grandes recintos al aire libre, donde eran engordados con nueces, castañas y bellotas. Los lirones también eran capturados en estado salvaje en otoño cuando estaban más gordos, y asados y sumergidos en miel o horneados mientras estaban rellenos con una mezcla de carne de cerdo, piñones y otros condimentos. Los investigadores descubrieron que en la Amazonia, donde los grandes mamíferos eran escasos, las pacas y los agutíes comunes representaban alrededor del 40 por ciento de la caza anual realizada por los indígenas, pero en las zonas boscosas donde abundaban los mamíferos más grandes, estos roedores constituían solo alrededor del 3 por ciento de la captura. [132]
Los conejillos de indias se utilizan en la cocina de Cuzco , Perú, en platos como el cuy al horno , cuy al horno. [3] [133] El horno tradicional andino, conocido como qoncha o fogón , está hecho de barro y arcilla reforzados con paja y pelo de animales como los conejillos de indias. [134] En Perú, hay en cualquier momento 20 millones de conejillos de indias domésticos, que producen anualmente 64 millones de cadáveres comestibles. Este animal es una excelente fuente de alimento ya que la carne tiene un 19% de proteínas. [132] En los Estados Unidos, los humanos comen principalmente ardillas, pero también ratas almizcleras, puercoespines y marmotas . El pueblo navajo comía perros de las praderas horneados en barro, mientras que los paiute comían tuzas, ardillas y ratas. [132]

Los roedores se utilizan ampliamente como organismos modelo en pruebas con animales. [3] [135] Las ratas mutantes albinas se utilizaron por primera vez para investigación en 1828 y más tarde se convirtieron en el primer animal domesticado con fines puramente científicos. [136] Hoy en día, el ratón doméstico es el roedor de laboratorio más utilizado, y en 1979 se estimó que se utilizaban cincuenta millones anualmente en todo el mundo. Son los preferidos por su pequeño tamaño, fertilidad, corto período de gestación y facilidad de manejo y porque son susceptibles a muchas de las enfermedades e infecciones que afectan a los humanos. Se utilizan en investigaciones sobre genética , biología del desarrollo , biología celular , oncología e inmunología . [137] Los conejillos de indias fueron animales de laboratorio populares hasta finales del siglo XX; alrededor de 2,5 millones de conejillos de indias se utilizaron anualmente en los Estados Unidos para investigación en la década de 1960, [138] pero ese total disminuyó a alrededor de 375.000 a mediados de la década de 1990. [139] En 2007, constituían aproximadamente el 2% de todos los animales de laboratorio. [138] Los conejillos de indias desempeñaron un papel importante en el establecimiento de la teoría de los gérmenes a fines del siglo XIX, a través de los experimentos de Louis Pasteur , Émile Roux y Robert Koch . [140] Se los ha lanzado a vuelos espaciales orbitales varias veces, primero por la URSS en el biosatélite Sputnik 9 el 9 de marzo de 1961, con una recuperación exitosa. [141] La rata topo desnuda es el único mamífero conocido que es poiquilotérmico ; se utiliza en estudios sobre termorregulación . También es inusual que no produzca la sustancia neurotransmisora P , un hecho que los investigadores encuentran útil en estudios sobre el dolor . [142]
Los roedores tienen capacidades olfativas sensibles, que han sido utilizadas por los humanos para detectar olores o sustancias químicas de interés. [143] La rata de Gambia es capaz de detectar bacilos de tuberculosis con una sensibilidad de hasta el 86,6% y una especificidad (detectar la ausencia de bacilos) de más del 93%; la misma especie ha sido entrenada para detectar minas terrestres . [144] [145] Se han estudiado ratas para su posible uso en situaciones peligrosas, como en zonas de desastre. Se las puede entrenar para que respondan a órdenes, que pueden darse a distancia, e incluso se las puede persuadir para que se adentren en zonas muy iluminadas, que las ratas suelen evitar. [146] [147] [148]

Los roedores, incluidos los conejillos de indias, [149] ratones, ratas, hámsters, jerbos, chinchillas, degús y ardillas listadas, son mascotas convenientes capaces de vivir en espacios pequeños, cada especie con sus propias cualidades. [150] La mayoría normalmente se mantienen en jaulas de tamaños adecuados y tienen diversos requisitos de espacio e interacción social. Si se los manipula desde una edad temprana, suelen ser dóciles y no muerden. Los conejillos de indias tienen una larga vida y necesitan una jaula grande. [75] Las ratas también necesitan mucho espacio y pueden volverse muy mansas, pueden aprender trucos y parecen disfrutar de la compañía humana. Los ratones tienen una vida corta pero ocupan muy poco espacio. Los hámsters son solitarios pero tienden a ser nocturnos. Tienen comportamientos interesantes, pero a menos que se los manipule con regularidad pueden estar a la defensiva. Los jerbos no suelen ser agresivos, rara vez muerden y son animales sociables que disfrutan de la compañía de los humanos y de su propia especie. [151]

Some rodent species are serious agricultural pests, eating large quantities of food stored by humans.[152] For example, in 2003, the amount of rice lost to mice and rats in Asia was estimated to be enough to feed 200 million people. Most of the damage worldwide is caused by a relatively small number of species, chiefly rats and mice.[153] In Indonesia and Tanzania, rodents reduce crop yields by around fifteen percent, while in some instances in South America losses have reached ninety percent. Across Africa, rodents including Mastomys and Arvicanthis damage cereals, groundnuts, vegetables and cacao. In Asia, rats, mice and species such as Microtus brandti, Meriones unguiculatus and Eospalax baileyi damage crops of rice, sorghum, tubers, vegetables and nuts. In Europe, as well as rats and mice, species of Apodemus, Microtus and in occasional outbreaks Arvicola terrestris cause damage to orchards, vegetables and pasture as well as cereals. In South America, a wider range of rodent species, such as Holochilus, Akodon, Calomys, Oligoryzomys, Phyllotis, Sigmodon and Zygodontomys, damage many crops including sugar cane, fruits, vegetables, and tubers.[153]
Rodents are also significant vectors of disease.[154] The black rat, with the fleas that it carries, plays a primary role in spreading the bacterium Yersinia pestis responsible for bubonic plague,[155] and carries the organisms responsible for typhus, Weil's disease, toxoplasmosis and trichinosis.[154] A number of rodents carry hantaviruses, including the Puumala, Dobrava and Saaremaa viruses, which can infect humans.[156] Rodents also help to transmit diseases including babesiosis, cutaneous leishmaniasis, human granulocytic anaplasmosis, Lyme disease, Omsk hemorrhagic fever, Powassan virus, rickettsialpox, relapsing fever, Rocky Mountain spotted fever, and West Nile virus.[157]

Because rodents are a nuisance and endanger public health, human societies often attempt to control them. Traditionally, this involved poisoning and trapping, methods that were not always safe or effective. More recently, integrated pest management attempts to improve control with a combination of surveys to determine the size and distribution of the pest population, the establishment of tolerance limits (levels of pest activity at which to intervene), interventions, and evaluation of effectiveness based on repeated surveys. Interventions may include education, making and applying laws and regulations, modifying the habitat, changing farming practices, and biological control using pathogens or predators, as well as poisoning and trapping.[158] The use of pathogens such as Salmonella has the drawback that they can infect man and domestic animals, and rodents often become resistant. The use of predators including ferrets, mongooses and monitor lizards has been found unsatisfactory. Domestic and feral cats are able to control rodents effectively, provided the rodent population is not too large.[159] In the UK, two species in particular, the house mouse and the brown rat, are actively controlled to limit damage in growing crops, loss and contamination of stored crops and structural damage to facilities, as well as to comply with the law.[160]
{{cite journal}}: CS1 maint: numeric names: authors list (link)