El peptidoglicano o mureína es una macromolécula grande única, un polisacárido , que consiste en azúcares y aminoácidos que forman una capa similar a una malla (sáculo) que rodea la membrana citoplasmática bacteriana . [1] El componente de azúcar consiste en residuos alternados de N -acetilglucosamina (NAG) y ácido N -acetilmurámico (NAM) unidos a β-(1,4) . Unida al ácido N -acetilmurámico hay una cadena oligopeptídica compuesta de tres a cinco aminoácidos. La cadena peptídica se puede reticular con la cadena peptídica de otra hebra formando la capa tridimensional similar a una malla. [1] [2] El peptidoglicano cumple una función estructural en la pared celular bacteriana, dándole fuerza estructural, además de contrarrestar la presión osmótica del citoplasma . Esta unión repetitiva da como resultado una densa capa de peptidoglicano que es fundamental para mantener la forma celular y soportar altas presiones osmóticas, y es reemplazada regularmente por la producción de peptidoglicano. La hidrólisis y la síntesis de peptidoglicano son dos procesos que deben ocurrir para que las células crezcan y se multipliquen, una técnica que se lleva a cabo en tres etapas: recorte del material actual, inserción de material nuevo y re-entrecruzamiento del material existente con material nuevo. [3]
La capa de peptidoglicano es sustancialmente más gruesa en las bacterias grampositivas (20 a 80 nanómetros) que en las gramnegativas (7 a 8 nanómetros). [4] Dependiendo de las condiciones de crecimiento del pH, el peptidoglicano forma alrededor del 40 al 90% del peso seco de la pared celular de las bacterias grampositivas, pero solo alrededor del 10% de las cepas gramnegativas. Por lo tanto, la presencia de altos niveles de peptidoglicano es el determinante principal de la caracterización de las bacterias como grampositivas. [5] En las cepas grampositivas, es importante en funciones de adhesión y propósitos de serotipificación . [6] Para las bacterias grampositivas y gramnegativas, las partículas de aproximadamente 2 nm pueden pasar a través del peptidoglicano. [7]
Es difícil determinar si un organismo es grampositivo o gramnegativo usando un microscopio; se requiere la tinción de Gram , creada por Hans Christian Gram en 1884. Las bacterias se tiñen con los colorantes violeta cristal y safranina . Las células grampositivas son moradas después de la tinción, mientras que las gramnegativas se tiñen de rosa. [8]
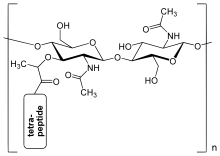
La capa de peptidoglicano dentro de la pared celular bacteriana es una estructura de red cristalina formada a partir de cadenas lineales de dos aminoazúcares alternados , a saber, N -acetilglucosamina (GlcNAc o NAG) y ácido N -acetilmurámico (MurNAc o NAM). Los azúcares alternados están conectados por un enlace β-(1,4)-glicosídico . Cada MurNAc está unido a una cadena corta de aminoácidos (de 4 a 5 residuos) , que contiene L - alanina , ácido D - glutámico , ácido meso -diaminopimélico y D -alanina en el caso de Escherichia coli (una bacteria gramnegativa); o L -alanina, D - glutamina , L - lisina y D -alanina con un puente intermedio de 5- glicina entre tetrapéptidos en el caso de Staphylococcus aureus (una bacteria grampositiva). El peptidoglicano es una de las fuentes más importantes de D -aminoácidos en la naturaleza. [ cita requerida ]
Al encerrar la membrana interna, la capa de peptidoglicano protege a la célula de la lisis causada por la presión de turgencia de la célula. Cuando la pared celular crece, conserva su forma durante toda su vida, por lo que una forma de bastón seguirá siendo una forma de bastón y una forma esférica seguirá siendo una forma esférica durante toda la vida. Esto sucede porque el material septal recién agregado de síntesis se transforma en una pared hemisférica para las células descendientes. [9]
La reticulación entre aminoácidos en diferentes cadenas de aminoazúcares lineales se produce con la ayuda de la enzima DD -transpeptidasa y da como resultado una estructura tridimensional que es fuerte y rígida. La secuencia de aminoácidos específica y la estructura molecular varían según la especie bacteriana . [10]
Se han descrito los diferentes tipos de peptidoglicano de las paredes celulares bacterianas y sus implicaciones taxonómicas. [11] Las arqueas ( dominio Archaea ) [12] no contienen peptidoglicano (mureína). [13] Algunas arqueas contienen pseudopeptidoglicano (pseudomureína, ver más abajo). [14]
El peptidoglicano interviene en la fisión binaria durante la reproducción de las células bacterianas. Las bacterias en forma de L y los micoplasmas , ambos sin paredes celulares de peptidoglicano, no proliferan por fisión binaria, sino por un mecanismo de gemación . [15] [16]
En el curso de la evolución temprana, el desarrollo sucesivo de límites (membranas, paredes) que protegían las primeras estructuras de la vida contra su entorno debe haber sido esencial para la formación de las primeras células ( celularización ).
La invención de paredes celulares rígidas de peptidoglicano (mureína) en bacterias (dominio Bacteria [12] ) fue probablemente el prerrequisito para su supervivencia, la radiación extensiva y la colonización de prácticamente todos los hábitats de la geosfera y la hidrosfera. [17] [18]
Los monómeros de peptidoglicano se sintetizan en el citosol y luego se unen a un transportador de membrana, el bactoprenol . El bactoprenol transporta los monómeros de peptidoglicano a través de la membrana celular, donde se insertan en el peptidoglicano existente. [19]
Cada una de estas reacciones requiere la fuente de energía ATP. [20] Todo esto se conoce como Etapa Uno.
La segunda etapa se produce en la membrana citoplasmática, donde un transportador lipídico llamado bactoprenol transporta los precursores del peptidoglicano a través de la membrana celular.
En algunas arqueas , es decir, miembros de Methanobacteriales y en el género Methanopyrus , se ha encontrado pseudopeptidoglicano (pseudomureína). [14] En el pseudopeptidoglicano, los residuos de azúcar son N -acetilglucosamina y ácido N -acetiltalosaminurónico unidos por β-(1,3) . Esto hace que las paredes celulares de dichas arqueas sean insensibles a la lisozima . [23] Se ha descrito la biosíntesis de pseudopeptidoglicano. [24]
El reconocimiento de peptidoglicano es un proceso conservado evolutivamente. [25] La estructura general es similar entre especies bacterianas, pero varias modificaciones pueden aumentar la diversidad. Estas incluyen modificaciones de la longitud de los polímeros de azúcar, modificaciones en las estructuras de azúcar, variaciones en la reticulación o sustituciones de aminoácidos (principalmente en la tercera posición). [25] [26] El objetivo de estas modificaciones es alterar las propiedades de la pared celular, que desempeña un papel vital en la patogénesis . [25]
Los peptidoglicanos pueden ser degradados por varias enzimas ( lisozima , glucosaminidasa, endopeptidasa ... [25] ), produciendo fragmentos inmunoestimulantes (a veces llamados muropéptidos [27] ) que son críticos para mediar las interacciones huésped-patógeno . [26] Estos incluyen MDP ( dipéptido de muramilo ), NAG ( N-acetilglucosamina ) o iE-DAP (ácido γ-d-glutamil-meso-diaminopimélico). [25] [27]
El peptidoglicano de las bacterias intestinales (tanto patógenos como comensales) cruza la barrera intestinal incluso en condiciones fisiológicas. [27] Los mecanismos a través de los cuales el peptidoglicano o sus fragmentos entran en las células huésped pueden ser directos (independientes del transportador) o indirectos (dependientes del transportador), y están mediados por bacterias (sistemas de secreción, vesículas de membrana ) o por células huésped (mediados por receptores, transportadores de péptidos). [27] Los sistemas de secreción bacteriana son complejos proteicos utilizados para la entrega de factores de virulencia a través de la envoltura celular bacteriana al ambiente exterior. [28] Los patógenos bacterianos intracelulares invaden células eucariotas (lo que puede conducir a la formación de fagolisosomas y/o activación de la autofagia ), o las bacterias pueden ser engullidas por fagocitos ( macrófagos , monocitos , neutrófilos ...). El fagosoma que contiene bacterias puede luego fusionarse con endosomas y lisosomas , lo que lleva a la degradación de las bacterias y a la generación de fragmentos poliméricos de peptidoglicano y muropéptidos. [27]
El sistema inmune innato detecta peptidoglicano intacto y fragmentos de peptidoglicano utilizando numerosos PRR ( receptores de reconocimiento de patrones ) que se secretan, se expresan intracelularmente o se expresan en la superficie celular. [25]
Las PGLYRP se conservan desde los insectos hasta los mamíferos . [27] Los mamíferos producen cuatro proteínas de reconocimiento de peptidoglicano solubles secretadas ( PGLYRP-1 , PGLYRP-2 , PGLYRP-3 y PGLYRP-4 ) que reconocen el pentapéptido o tetrapéptido de muramilo. [25] También pueden unirse a LPS y otras moléculas utilizando sitios de unión fuera del surco de unión del peptidoglicano. [28] Después del reconocimiento del peptidoglicano, las PGLYRP activan las moléculas de polifenol oxidasa (PPO), Toll o vías de señalización de inmunodeficiencia (IMD). Eso conduce a la producción de péptidos antimicrobianos (AMP). [28]
Cada uno de los PGLYRP de mamíferos muestra patrones de expresión tisular únicos. PGLYRP-1 se expresa principalmente en los gránulos de neutrófilos y eosinófilos . [25] PGLYRP-3 y 4 se expresan en varios tejidos como la piel, las glándulas sudoríparas, los ojos o el tracto intestinal. [27] PGLYRP-1, 3 y 4 forman homodímeros y heterodímeros unidos por disulfuro esenciales para su actividad bactericida. [27] Su unión a los peptidoglicanos de la pared celular bacteriana puede inducir la muerte celular bacteriana mediante la interacción con varias proteínas reguladoras de la transcripción bacteriana. [25] Es probable que los PGLYRP ayuden a matar bacterias al cooperar con otros PRR para mejorar el reconocimiento de las bacterias por los fagocitos. [25]
PGLYRP-2 se expresa principalmente en el hígado y se secreta en la circulación. [25] Además, su expresión puede inducirse en queratinocitos de la piel y células epiteliales orales e intestinales . [27] A diferencia de los otros PGLYRP, PGLYRP-2 no tiene actividad bactericida directa. Posee actividad de amidasa de peptidoglicano, hidroliza el enlace lactil-amida entre el MurNAc y el primer aminoácido del péptido madre del peptidoglicano. [25] [27] Se propone que la función de PGLYRP-2 es prevenir la sobreactivación del sistema inmunológico y el daño tisular inducido por la inflamación en respuesta a los ligandos NOD2 (ver más abajo), ya que estos muropéptidos ya no pueden ser reconocidos por NOD2 tras la separación del componente peptídico de MurNAc. [27] Cada vez hay más evidencia que sugiere que los miembros de la familia de proteínas de reconocimiento de peptidoglicano desempeñan un papel dominante en la tolerancia de las células epiteliales intestinales hacia la microbiota comensal. [28] [29] Se ha demostrado que la expresión de PGLYRP-2 y 4 puede influir en la composición de la microbiota intestinal . [28]
Recientemente, se ha descubierto que los PGLYRP (y también los receptores tipo NOD y los transportadores de peptidoglicano) se expresan en gran medida en el cerebro de ratón en desarrollo . [30] PGLYRP-2 y se expresa en gran medida en neuronas de varias regiones cerebrales, incluida la corteza prefrontal , el hipocampo y el cerebelo , lo que indica posibles efectos directos del peptidoglicano en las neuronas. PGLYRP-2 también se expresa en gran medida en la corteza cerebral de niños pequeños, pero no en la mayoría de los tejidos corticales adultos. PGLYRP-1 también se expresa en el cerebro y continúa expresándose en la edad adulta. [30]
Probablemente los receptores más conocidos de peptidoglicano son los receptores tipo NOD (NLRs), principalmente NOD1 y NOD2 . El receptor NOD1 se activa después de la unión de iE-DAP (ácido γ-d-glutamil-meso-diaminopimélico), mientras que NOD2 reconoce MDP (dipéptido de muramilo), por sus dominios LRR . [28] La activación conduce a la autooligomerización, lo que resulta en la activación de dos cascadas de señalización. Una desencadena la activación de NF-κB (a través de RIP2, TAK1 e IKK [31] ), la segunda conduce a la cascada de señalización de MAPK . La activación de estas vías induce la producción de citocinas inflamatorias y quimiocinas . [25]
NOD1 se expresa en diversos tipos de células, incluidos los fagocitos mieloides, las células epiteliales [25] y las neuronas. [30] NOD2 se expresa en monocitos y macrófagos, células epiteliales intestinales, células de Paneth , células dendríticas , osteoblastos , queratinocitos y otros tipos de células epiteliales. [27] Como sensores citosólicos , NOD1 y NOD2 deben detectar bacterias que ingresan al citosol o el peptidoglicano debe degradarse para generar fragmentos que deben transportarse al citosol para que estos sensores funcionen. [25]
Recientemente, se demostró que NLRP3 es activado por el peptidoglicano, a través de un mecanismo que es independiente de NOD1 y NOD2. [27] En macrófagos, se encontró que la N-acetilglucosamina generada por la degradación del peptidoglicano inhibe la actividad de la hexoquinasa e induce su liberación de la membrana mitocondrial . Promueve la activación del inflamasoma NLRP3 a través de un mecanismo desencadenado por el aumento de la permeabilidad de la membrana mitocondrial. [27]
El NLRP1 también se considera un sensor citoplasmático del peptidoglicano. Puede detectar MDP y promover la secreción de IL-1 mediante la unión a NOD2. [28] [26]
Las lectinas de tipo C son una superfamilia diversa de proteínas principalmente dependientes de Ca 2+ que se unen a una variedad de carbohidratos (incluido el esqueleto de glicano del peptidoglicano) y funcionan como receptores inmunes innatos. [27] Las proteínas CLR que se unen al peptidoglicano incluyen MBL ( lectina de unión a manosa ), ficolinas , Reg3A (proteína 3A de la familia de genes de regeneración) y PTCLec1. [28] En los mamíferos, inician la vía de la lectina de la cascada del complemento . [27]
El papel de los TLR en el reconocimiento directo del peptidoglicano es controvertido. [25] En algunos estudios, se ha informado que el peptidoglicano es detectado por TLR2 . [32] Pero esta actividad inductora de TLR2 podría deberse a las lipoproteínas de la pared celular y los ácidos lipoteicoicos que comúnmente se copurifican con el peptidoglicano. También la variación en la estructura del peptidoglicano en bacterias de una especie a otra puede contribuir a los diferentes resultados sobre este tema. [25] [27]
El peptidoglicano es inmunológicamente activo, lo que puede estimular las células inmunes para aumentar la expresión de citocinas y mejorar la respuesta específica dependiente de anticuerpos cuando se combina con la vacuna o como adyuvante solo. [28] El MDP, que es la unidad básica del peptidoglicano, se utilizó inicialmente como componente activo del adyuvante de Freund . [28] El peptidoglicano de Staphylococcus aureus se utilizó como vacuna para proteger a los ratones, demostrando que después de la inyección de la vacuna durante 40 semanas, los ratones sobrevivieron al desafío de S. aureus a una dosis letal aumentada . [33]
Algunos fármacos antibacterianos como la penicilina interfieren en la producción de peptidoglicano al unirse a enzimas bacterianas conocidas como proteínas de unión a penicilina o DD -transpeptidasas . [6] Las proteínas de unión a penicilina forman los enlaces entre los enlaces cruzados de oligopéptidos en peptidoglicano. Para que una célula bacteriana se reproduzca a través de fisión binaria , más de un millón de subunidades de peptidoglicano (NAM-NAG+oligopéptido) deben estar unidas a subunidades existentes. [34] Las mutaciones en genes que codifican transpeptidasas que conducen a interacciones reducidas con un antibiótico son una fuente importante de resistencia emergente a los antibióticos . [35] Dado que el peptidoglicano también falta en las bacterias en forma L y en los micoplasmas, ambos son resistentes a la penicilina.
También se pueden atacar otros pasos de la síntesis de peptidoglicano. El antibiótico tópico bacitracina se dirige a la utilización del pirofosfato de isoprenilo C55 . Los lantibióticos , que incluyen el conservante de alimentos nisina , atacan al lípido II. [36]
La lisozima , que se encuentra en las lágrimas y constituye parte del sistema inmunológico innato del cuerpo , ejerce su efecto antibacteriano rompiendo los enlaces β-(1,4)-glicosídicos en el peptidoglicano (ver arriba). La lisozima es más eficaz al actuar contra bacterias grampositivas , en las que la pared celular del peptidoglicano está expuesta, que contra bacterias gramnegativas , que tienen una capa externa de LPS que cubre la capa de peptidoglicano. [31] Varias modificaciones bacterianas del peptidoglicano pueden resultar en resistencia a la degradación por la lisozima. La susceptibilidad de las bacterias a la degradación también se ve considerablemente afectada por la exposición a antibióticos . Las bacterias expuestas sintetizan peptidoglicano que contiene cadenas de azúcar más cortas que están mal reticuladas y este peptidoglicano es luego degradado más fácilmente por la lisozima. [28]