Los esteroides anabólicos , también conocidos como esteroides anabólico-androgénicos (EAA), son una clase de fármacos que están estructuralmente relacionados con la testosterona , la principal hormona sexual masculina , y producen efectos al unirse al receptor de andrógenos (AR). Los esteroides anabólicos tienen varios usos médicos, [1] pero también los usan los atletas para aumentar el tamaño muscular, la fuerza y el rendimiento.
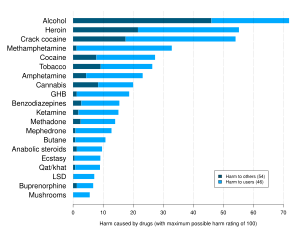
Los riesgos para la salud pueden producirse por el uso a largo plazo o dosis excesivas de AAS. [2] [3] Estos efectos incluyen cambios nocivos en los niveles de colesterol (aumento de lipoproteínas de baja densidad y disminución de lipoproteínas de alta densidad ), acné , presión arterial alta , daño hepático (principalmente con la mayoría de los AAS orales) e hipertrofia ventricular izquierda . [4] Estos riesgos aumentan aún más cuando los atletas toman esteroides junto con otras drogas, lo que causa significativamente más daño a sus cuerpos. [5] El efecto de los esteroides anabólicos en el corazón puede causar infarto de miocardio y accidentes cerebrovasculares . [5] Las afecciones relacionadas con los desequilibrios hormonales , como la ginecomastia y la reducción del tamaño testicular, también pueden ser causadas por AAS. [6] En mujeres y niños, los AAS pueden causar masculinización irreversible . [6]
Los usos ergogénicos de los AAS en los deportes, las carreras y el culturismo como drogas para mejorar el rendimiento son controvertidos debido a sus efectos adversos y al potencial de obtener ventajas en las competiciones físicas. Su uso se conoce como dopaje y está prohibido por la mayoría de los organismos deportivos importantes. Los atletas han estado buscando drogas para mejorar sus habilidades atléticas desde que comenzaron los Juegos Olímpicos en la Antigua Grecia. [5] Durante muchos años, los AAS han sido, con mucho, las sustancias dopantes más detectadas en los laboratorios acreditados por el COI . [7] [8] Los esteroides anabólicos están clasificados como sustancias controladas de la Lista III en muchos países, [9] lo que significa que los AAS tienen un uso médico reconocido, pero también se reconoce que tienen un potencial de abuso y dependencia, lo que lleva a su regulación y control. En los países donde los AAS son sustancias controladas , a menudo existe un mercado negro en el que se venden a los usuarios medicamentos de contrabando, fabricados clandestinamente o incluso falsificados .

Desde el descubrimiento y la síntesis de la testosterona en la década de 1930, los médicos han utilizado los esteroides anabólicos para diversos fines, con distintos grados de éxito. Estos pueden agruparse en general en usos anabólicos, androgénicos y otros.

La mayoría de los usuarios de esteroides no son deportistas. [52] En Estados Unidos, se cree que entre 1 y 3 millones de personas (1% de la población) han utilizado esteroides anabólicos. [53] Estudios realizados en Estados Unidos han demostrado que los usuarios de esteroides anabólicos tienden a ser en su mayoría hombres de clase media con una edad media de unos 25 años que son culturistas no competitivos y no deportistas y utilizan las drogas con fines cosméticos. [54] "Entre los chicos de 12 a 17 años, el uso de esteroides y drogas similares aumentó un 25 por ciento entre 1999 y 2000, y el 20 por ciento dijo que las utiliza por estética más que por deporte, según un estudio de la aseguradora Blue Cross Blue Shield". [55] Otro estudio encontró que el uso no médico de esteroides anabólicos entre los estudiantes universitarios era igual o inferior al 1%. [56] Según una encuesta reciente, el 78,4% de los usuarios de esteroides eran culturistas no competitivos y no atletas, mientras que alrededor del 13% informó prácticas de inyección inseguras, como reutilizar agujas, compartir agujas y compartir viales multidosis, [57] aunque un estudio de 2007 encontró que compartir agujas era extremadamente poco común entre las personas que usaban AAS para fines no médicos, menos del 1%. [58] Otro estudio de 2007 encontró que el 74% de los usuarios de AAS no médicos tenían títulos postsecundarios y más habían completado la universidad y menos no habían terminado la escuela secundaria de lo que se espera de la población general. [58] El mismo estudio encontró que las personas que usaban AAS para fines no médicos tenían una tasa de empleo más alta y un ingreso familiar más alto que la población general. [58] Los usuarios de AAS tienden a investigar las drogas que están tomando más que otros usuarios de sustancias controladas; [ cita requerida ] Sin embargo, las principales fuentes consultadas por los usuarios de esteroides incluyen amigos, manuales no médicos, foros en Internet, blogs y revistas de fitness, que pueden proporcionar información cuestionable o inexacta. [59]
Los usuarios de AAS tienden a estar descontentos con la representación de los AAS como mortales en los medios y en la política. [60] Según un estudio, los usuarios de AAS también desconfían de sus médicos y en la muestra el 56% no había revelado su uso de AAS a sus médicos. [61] Otro estudio de 2007 tuvo hallazgos similares, mostrando que, mientras que el 66% de las personas que usaban AAS para fines no médicos estaban dispuestas a buscar supervisión médica para su uso de esteroides, el 58% no confiaba en sus médicos, el 92% sentía que el conocimiento de la comunidad médica sobre el uso no médico de AAS era deficiente, y el 99% sentía que el público tiene una visión exagerada de los efectos secundarios del uso de AAS. [58] Un estudio reciente también ha demostrado que los usuarios de AAS a largo plazo tenían más probabilidades de tener síntomas de dismorfia muscular y también mostraron un respaldo más fuerte a los roles masculinos más convencionales. [62] Un estudio reciente en el Journal of Health Psychology mostró que muchos usuarios creían que los esteroides utilizados con moderación eran seguros. [63]
Los esteroides anabólicos han sido utilizados por hombres y mujeres en muchos tipos diferentes de deportes profesionales para lograr una ventaja competitiva o para ayudar en la recuperación de lesiones. Estos deportes incluyen el culturismo , el levantamiento de pesas , el lanzamiento de peso y otras disciplinas de atletismo , el ciclismo , el béisbol , la lucha libre , las artes marciales mixtas , el boxeo , el fútbol y el cricket . Dicho uso está prohibido por las reglas de los organismos rectores de la mayoría de los deportes. El uso de esteroides anabólicos ocurre entre adolescentes, especialmente entre aquellos que participan en deportes competitivos. Se ha sugerido que la prevalencia de uso entre estudiantes de secundaria en los EE. UU. puede ser tan alta como 2.7%. [64]
Los AAS que se han utilizado más comúnmente en medicina son la testosterona y sus muchos ésteres (pero más típicamente el undecanoato de testosterona , el enantato de testosterona , el cipionato de testosterona y el propionato de testosterona ), [74] los ésteres de nandrolona (típicamente el decanoato de nandrolona y el fenilpropionato de nandrolona ), el estanozolol y la metandienona (metandrostenolona). [75] Otros que también han estado disponibles y se han utilizado comúnmente pero en menor medida incluyen la metiltestosterona , la oxandrolona , la mesterolona y la oximetolona , así como el propionato de drostanolona (propionato de dromostanolona), los ésteres de metenolona (metilandrostenolona) (específicamente el acetato de metenolona y el enantato de metenolona ) y la fluoximesterona . [75] La dihidrotestosterona (DHT), conocida como androstanolona o estanolona cuando se usa con fines médicos, y sus ésteres también son notables, aunque no se usan ampliamente en medicina. [70] El undecilenato de boldenona y el acetato de trembolona se utilizan en medicina veterinaria . [75]
Los esteroides de diseño son AAS que no han sido aprobados ni comercializados para uso médico, pero se han distribuido a través del mercado negro. [76] Algunos ejemplos de esteroides de diseño notables incluyen 1-testosterona (dihidroboldenona), metasterona , enantato de trembolona , desoximetiltestosterona , tetrahidrogestrinona y metilstenbolona . [76]

Existen cuatro formas comunes en las que se administran los AAS: píldoras orales; esteroides inyectables; cremas/geles para aplicación tópica; y parches cutáneos. La administración oral es la más conveniente. La testosterona administrada por vía oral se absorbe rápidamente, pero se convierte en gran parte en metabolitos inactivos, y solo alrededor de una sexta parte está disponible en forma activa. Para que sean suficientemente activos cuando se administran por vía oral, los derivados de la testosterona se alquilan en la posición 17α, por ejemplo, la metiltestosterona y la fluoximesterona . Esta modificación reduce la capacidad del hígado para descomponer estos compuestos antes de que lleguen a la circulación sistémica.
La testosterona se puede administrar por vía parenteral , pero tiene un tiempo de absorción prolongado más irregular y una mayor actividad en el músculo en forma de enantato , undecanoato o éster cipionato . Estos derivados se hidrolizan para liberar testosterona libre en el sitio de la inyección; la tasa de absorción (y, por lo tanto, el programa de inyección) varía entre diferentes ésteres, pero las inyecciones médicas normalmente se realizan en cualquier momento entre quincenalmente y una vez cada 12 semanas. Puede ser deseable un programa más frecuente para mantener un nivel más constante de hormona en el sistema. [77] Los esteroides inyectables generalmente se administran en el músculo, no en la vena, para evitar cambios repentinos en la cantidad del fármaco en el torrente sanguíneo. Además, debido a que la testosterona esterificada se disuelve en aceite, la inyección intravenosa tiene el potencial de causar una embolia peligrosa (coágulo) en el torrente sanguíneo.
También se pueden utilizar parches transdérmicos (parches adhesivos que se colocan sobre la piel) para administrar una dosis constante a través de la piel y hacia el torrente sanguíneo. También existen cremas y geles que contienen testosterona que se aplican diariamente sobre la piel, pero la absorción es ineficiente (aproximadamente el 10%, que varía de una persona a otra) y estos tratamientos tienden a ser más caros. Las personas que son especialmente activas físicamente y/o se bañan a menudo pueden no ser buenos candidatos, ya que el medicamento se puede lavar y puede tardar hasta seis horas en absorberse por completo. También existe el riesgo de que una pareja íntima o un niño entren en contacto con el lugar de aplicación y se administren la dosis inadvertidamente; los niños y las mujeres son muy sensibles a la testosterona y pueden desarrollar masculinización no deseada y efectos sobre la salud, incluso con pequeñas dosis. La inyección es el método más común utilizado por las personas que administran esteroides anabólicos con fines no médicos. [58]
Las vías tradicionales de administración no tienen efectos diferenciales sobre la eficacia del fármaco. Los estudios indican que las propiedades anabólicas de los AAS son relativamente similares a pesar de las diferencias en los principios farmacocinéticos, como el metabolismo de primer paso . Sin embargo, las formas orales de AAS pueden causar daño hepático en dosis altas. [8] [78]
Los posibles efectos secundarios conocidos de los AAS incluyen: [6] [80] [81] [82] [83]
Dependiendo de la duración del uso de la droga, existe la posibilidad de que el sistema inmunológico se dañe. La mayoría de estos efectos secundarios dependen de la dosis, siendo el más común la presión arterial elevada, especialmente en aquellos con hipertensión preexistente . [90] Además de los cambios morfológicos del corazón que pueden tener un efecto adverso permanente en la eficiencia cardiovascular.
Se ha demostrado que los AAS alteran los niveles de azúcar en sangre en ayunas y las pruebas de tolerancia a la glucosa. [91] Los AAS como la testosterona también aumentan el riesgo de enfermedad cardiovascular [2] o enfermedad de la arteria coronaria . [92] [93] El acné es bastante común entre los usuarios de AAS, principalmente debido a la estimulación de las glándulas sebáceas por el aumento de los niveles de testosterona. [7] [94] La conversión de testosterona a DHT puede acelerar la tasa de calvicie prematura en los hombres genéticamente predispuestos, pero la testosterona en sí misma puede producir calvicie en las mujeres. [95]
El uso de esteroides anabólicos en adolescentes puede provocar una serie de efectos secundarios graves. Por ejemplo, los esteroides anabólicos pueden detener prematuramente el alargamiento de los huesos ( fusión epifisaria prematura a través del aumento de los niveles de metabolitos de estrógeno ), lo que da lugar a un retraso del crecimiento . Otros efectos incluyen, entre otros, la maduración ósea acelerada , el aumento de la frecuencia y duración de las erecciones y el desarrollo sexual prematuro. El uso de esteroides anabólicos en la adolescencia también se correlaciona con actitudes más pobres en relación con la salud. [96]
La Agencia Internacional para la Investigación sobre el Cáncer (IARC) de la OMS clasifica los AAS en el Grupo 2A : Probablemente cancerígenos para los seres humanos. [97]
Otros efectos secundarios pueden incluir alteraciones en la estructura del corazón , como agrandamiento y engrosamiento del ventrículo izquierdo , lo que altera su contracción y relajación , y por lo tanto reduce el volumen de sangre eyectada. [4] Los posibles efectos de estas alteraciones en el corazón son hipertensión, arritmias cardíacas , insuficiencia cardíaca congestiva , ataques cardíacos y muerte cardíaca súbita . [98] Estos cambios también se observan en atletas que no consumen drogas , pero el uso de esteroides puede acelerar este proceso. [99] [100] Sin embargo, tanto la conexión entre los cambios en la estructura del ventrículo izquierdo y la disminución de la función cardíaca, como la conexión con el uso de esteroides han sido cuestionadas. [101] [102]
El uso de AAS puede causar cambios perjudiciales en los niveles de colesterol : algunos esteroides causan un aumento del colesterol LDL y una disminución del colesterol HDL . [103]
El uso de AAS en adolescentes acelera la maduración ósea y puede reducir la estatura adulta en dosis altas. [ cita requerida ] Se utilizan dosis bajas de AAS como la oxandrolona en el tratamiento de la baja estatura idiopática , pero esto solo puede acelerar la maduración en lugar de aumentar la estatura adulta. [104]
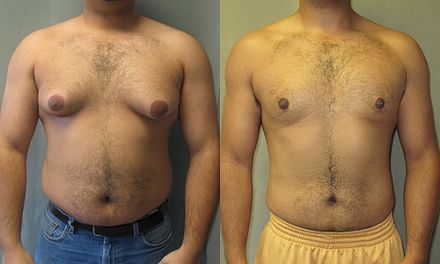
Aunque todos los esteroides anabólicos tienen efectos androgénicos , algunos de ellos paradójicamente resultan en feminización, como el tejido mamario en los hombres, una condición llamada ginecomastia . Estos efectos secundarios son causados por la conversión natural de testosterona en estrógeno y estradiol por la acción de la enzima aromatasa , codificada por el gen CYP19A1 . [105]
El uso prolongado de esteroides androgénicos-anabólicos por parte de los hombres da como resultado el cierre temporal de su producción natural de testosterona debido a una inhibición del eje hipotálamo-hipofisario-gonadal . Esto se manifiesta en atrofia testicular , inhibición de la producción de esperma , función sexual e infertilidad . [106] [107] [108] Un uso corto (1-2 meses) de esteroides androgénicos-anabólicos por parte de los hombres seguido de un ciclo de terapia para aumentar la testosterona (por ejemplo, clomifeno y gonadotropina coriónica humana ) generalmente da como resultado el retorno a la producción normal de testosterona. [109] )
Los efectos secundarios específicos de las mujeres incluyen aumento del vello corporal , profundización permanente de la voz, agrandamiento del clítoris y disminución temporal de los ciclos menstruales . También pueden producirse alteraciones de la fertilidad y quistes ováricos en las mujeres. [110] Cuando se toman durante el embarazo, los AAS pueden afectar el desarrollo fetal al provocar el desarrollo de características masculinas en el feto femenino y características femeninas en el feto masculino. [111]
Los análisis renales revelaron que nueve de los diez usuarios de esteroides desarrollaron una afección llamada glomeruloesclerosis focal y segmentaria , un tipo de cicatrización en los riñones. El daño renal en los culturistas tiene similitudes con el que se observa en pacientes con obesidad mórbida, pero parece ser incluso más grave. [112]
Las dosis altas de compuestos AAS orales pueden causar daño hepático . [3] La peliosis hepática se ha reconocido cada vez más con el uso de AAS.

Una revisión de 2005 en CNS Drugs determinó que "síntomas psiquiátricos significativos que incluyen agresión y violencia, manía y, con menor frecuencia, psicosis y suicidio se han asociado con el abuso de esteroides . Los abusadores de esteroides a largo plazo pueden desarrollar síntomas de dependencia y abstinencia al suspender los AAS". [85] Las altas concentraciones de AAS, comparables a las que probablemente sufren muchos usuarios recreativos de AAS, producen efectos apoptóticos en las neuronas , [ cita requerida ] planteando el espectro de una posible neurotoxicidad irreversible. El uso recreativo de AAS parece estar asociado con una variedad de efectos psiquiátricos potencialmente prolongados, incluidos síndromes de dependencia, trastornos del estado de ánimo y progresión a otras formas de consumo de sustancias, pero la prevalencia y la gravedad de estos diversos efectos siguen siendo poco conocidas. [114] No hay evidencia de que la dependencia de esteroides se desarrolle a partir del uso terapéutico de AAS para tratar trastornos médicos, pero se han informado casos de dependencia de AAS entre levantadores de pesas y culturistas que administraron dosis suprafisiológicas crónicas. [115] Es probable que los trastornos del estado de ánimo (por ejemplo, depresión, [hipo]manía, características psicóticas) dependan de la dosis y del fármaco, pero la dependencia de los EAA o los efectos de abstinencia parecen ocurrir solo en un pequeño número de usuarios de EAA. [7] Actualmente no se dispone de estudios a largo plazo a gran escala sobre los efectos psiquiátricos en los usuarios de EAA. [114]
El DSM-IV enumera los criterios generales de diagnóstico para un trastorno de la personalidad y establece que "el patrón no debe atribuirse mejor a una manifestación de otro trastorno mental, ni a los efectos fisiológicos directos de una sustancia (por ejemplo, fármaco o medicamento) o de una afección médica general (por ejemplo, traumatismo craneal)". Como resultado, los usuarios de EAA pueden recibir un diagnóstico erróneo por parte de un psiquiatra que no haya sido informado sobre su hábito. [116]
Cooper, Noakes, Dunne, Lambert y Rochford identificaron que las personas que usan AAS tienen más probabilidades de obtener puntuaciones más altas en perfiles de personalidad limítrofe (4,7 veces), antisocial (3,8 veces), paranoide (3,4 veces), esquizotípica (3,1 veces), histriónica (2,9 veces), pasivo-agresiva (2,4 veces) y narcisista (1,6 veces) que los no usuarios. [117] Otros estudios han sugerido que el trastorno de personalidad antisocial es ligeramente más probable entre los usuarios de AAS que entre los no usuarios (Pope y Katz, 1994). [116] La disfunción bipolar , [118] la dependencia de sustancias y el trastorno de conducta también se han asociado con el uso de AAS. [119]
Los trastornos afectivos se reconocen desde hace tiempo como una complicación del consumo de esteroides anabólicos. Los informes de casos describen tanto hipomanía como manía, junto con irritabilidad, euforia, imprudencia, pensamientos acelerados y sentimientos de poder e invencibilidad que no cumplen los criterios de manía/hipomanía. [120] De 53 culturistas que consumieron esteroides anabólicos, 27 (51%) informaron de trastornos del estado de ánimo no especificados. [121]
Desde mediados de la década de 1980 en adelante, los medios de comunicación informaron que la "rabia por esteroides" era un efecto secundario de los AAS. [122] : 23
Una revisión de 2005 determinó que algunos estudios controlados aleatorios, pero no todos, han encontrado que el uso de AAS se correlaciona con la hipomanía y el aumento de la agresividad, pero señaló que los intentos de determinar si el uso de AAS desencadena el comportamiento violento han fracasado, principalmente debido a las altas tasas de no participación. [123] Un estudio de 2008 sobre una muestra representativa a nivel nacional de hombres adultos jóvenes en los Estados Unidos encontró una asociación entre el uso de AAS autodeclarado durante la vida y el año anterior y la participación en actos violentos. En comparación con las personas que no usaban esteroides, los hombres adultos jóvenes que usaban AAS informaron una mayor participación en comportamientos violentos incluso después de controlar los efectos de las variables demográficas clave, el comportamiento violento previo y el uso de múltiples drogas. [124] Una revisión de 1996 que examinó los estudios ciegos disponibles en ese momento también encontró que estos habían demostrado un vínculo entre la agresión y el uso de esteroides, pero señaló que con estimaciones de más de un millón de usuarios de esteroides pasados o actuales en los Estados Unidos en ese momento, un porcentaje extremadamente pequeño de los que usaban esteroides parecían haber experimentado trastornos mentales lo suficientemente graves como para dar lugar a tratamientos clínicos o informes de casos médicos. [125]
La relación entre el uso de AAS y la depresión no es concluyente. Una revisión de 1992 [ necesita actualización ] encontró que los AAS pueden aliviar y causar depresión, y que el cese o la disminución del uso de AAS también puede causar depresión, pero exigieron estudios adicionales debido a la disparidad de datos. [126]
Los andrógenos como la testosterona , la androstenediona y la dihidrotestosterona son necesarios para el desarrollo de los órganos del sistema reproductor masculino , incluidas las vesículas seminales , el epidídimo , el conducto deferente , el pene y la próstata . [127] Los AAS son derivados de la testosterona diseñados para maximizar los efectos anabólicos de la testosterona. [75] Los AAS son consumidos por atletas de élite que compiten en deportes como el levantamiento de pesas , el culturismo y el atletismo . [128] Los atletas recreativos masculinos toman AAS para lograr una apariencia física "mejorada" . [129]
El consumo de AAS altera el eje hipotálamo-hipofisario-gonadal (eje HPG) en los hombres. [127] En el eje HPG, la hormona liberadora de gonadotropina (GnRH) se secreta desde el núcleo arqueado del hipotálamo y estimula la hipófisis anterior para secretar las dos gonadotropinas , la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). [130] En los hombres adultos, la LH estimula las células de Leydig en los testículos para producir testosterona que se requiere para formar nuevos espermatozoides a través de la espermatogénesis . [127] El consumo de AAS conduce a una supresión dependiente de la dosis de la liberación de gonadotropina a través de la supresión de GnRH del hipotálamo (mecanismo de bucle largo) o de la retroalimentación negativa directa sobre la hipófisis anterior para inhibir la liberación de gonadotropina (mecanismo de bucle corto), lo que conduce al hipogonadismo inducido por AAS . [127]
La farmacodinámica de los AAS es diferente a la de las hormonas peptídicas . Las hormonas peptídicas solubles en agua no pueden penetrar la membrana de las células grasas y solo afectan indirectamente al núcleo de las células diana a través de su interacción con los receptores de superficie de la célula . Sin embargo, como hormonas liposolubles, los AAS son permeables a la membrana e influyen en el núcleo de las células por acción directa. La acción farmacodinámica de los AAS comienza cuando la hormona exógena penetra la membrana de la célula diana y se une a un receptor de andrógenos (AR) ubicado en el citoplasma de esa célula. Desde allí, el compuesto hormona-receptor se difunde al núcleo, donde altera la expresión de genes [132] o activa procesos que envían señales a otras partes de la célula. [133] Diferentes tipos de AAS se unen al AAR con diferentes afinidades , dependiendo de su estructura química. [7]
El efecto de los AAS sobre la masa muscular se produce de al menos dos maneras: [134] primero, aumentan la producción de proteínas ; segundo, reducen el tiempo de recuperación al bloquear los efectos de la hormona del estrés cortisol sobre el tejido muscular, de modo que el catabolismo muscular se reduce en gran medida. Se ha planteado la hipótesis de que esta reducción en la degradación muscular puede ocurrir a través de la inhibición de los AAS de la acción de otras hormonas esteroides llamadas glucocorticoides que promueven la degradación de los músculos. [64] Los AAS también afectan al número de células que se convierten en células de almacenamiento de grasa, al favorecer la diferenciación celular en células musculares. [135]
Los esteroides anabólicos interactúan con los AR en varios tejidos, incluidos los músculos, los huesos y los sistemas reproductivos. [136] Al unirse al AR, los esteroides anabólicos desencadenan una translocación del complejo hormona-receptor al núcleo celular, donde alteran la expresión genética o activan las vías de señalización celular; esto da como resultado una mayor síntesis de proteínas, un mayor crecimiento muscular y una reducción del catabolismo muscular. [137]
Los esteroides anabólicos influyen en la diferenciación celular al tiempo que favorecen el desarrollo de células musculares sobre las células de almacenamiento de grasa. [138] La investigación en este campo ha demostrado que las modificaciones estructurales en los esteroides anabólicos son fundamentales para determinar su afinidad de unión a los AR y sus actividades anabólicas y androgénicas resultantes. [82] Estas modificaciones afectan la capacidad de un esteroide para influir en la expresión genética y los procesos celulares, lo que resalta las complejas interacciones biofísicas de los esteroides anabólicos a nivel celular. [136]
Como sugiere su nombre, los AAS tienen dos tipos de efectos diferentes, pero superpuestos: anabólicos , lo que significa que promueven el anabolismo (crecimiento celular), y androgénicos (o virilizantes ), lo que significa que afectan el desarrollo y mantenimiento de las características masculinas.
Algunos ejemplos de los efectos anabólicos de estas hormonas son el aumento de la síntesis de proteínas a partir de aminoácidos , el aumento del apetito, el aumento de la remodelación y el crecimiento óseo y la estimulación de la médula ósea , que aumenta la producción de glóbulos rojos . A través de una serie de mecanismos, los AAS estimulan la formación de células musculares y, por lo tanto, provocan un aumento del tamaño de los músculos esqueléticos , lo que conduce a un aumento de la fuerza. [139] [12] [140]
Los efectos androgénicos de los AAS son numerosos. Dependiendo de la duración del uso, los efectos secundarios del esteroide pueden ser irreversibles. Los procesos afectados incluyen el crecimiento puberal, la producción de aceite de las glándulas sebáceas y la sexualidad (especialmente en el desarrollo fetal). Algunos ejemplos de efectos virilizantes son el crecimiento del clítoris en las mujeres y el pene en los niños varones (el tamaño del pene adulto no cambia debido a los esteroides [ cita médica requerida ] ), el aumento del tamaño de las cuerdas vocales , el aumento de la libido , la supresión de las hormonas sexuales naturales y la producción deficiente de esperma . [ 141 ] Los efectos en las mujeres incluyen la profundización de la voz, el crecimiento del vello facial y posiblemente una disminución del tamaño de los senos. Los hombres pueden desarrollar un agrandamiento del tejido mamario, conocido como ginecomastia, atrofia testicular y un recuento reducido de espermatozoides. [ cita requerida ] La relación androgénica:anabólica de un AAS es un factor importante a la hora de determinar la aplicación clínica de estos compuestos. Los compuestos con una alta proporción de efectos androgénicos y anabólicos son el fármaco de elección en la terapia de reemplazo de andrógenos (p. ej., tratamiento del hipogonadismo en hombres), mientras que los compuestos con una proporción androgénica:anabólica reducida son los preferidos para la anemia y la osteoporosis, y para revertir la pérdida de proteínas después de un traumatismo, una cirugía o una inmovilización prolongada. La determinación de la proporción androgénica:anabólica se realiza normalmente en estudios con animales, lo que ha llevado a la comercialización de algunos compuestos que se afirma que tienen actividad anabólica con efectos androgénicos débiles. Esta disociación es menos marcada en humanos, donde todos los EAA tienen efectos androgénicos significativos. [77]
Un protocolo comúnmente utilizado para determinar la relación androgénica:anabólica, que data de la década de 1950, utiliza los pesos relativos de la próstata ventral (VP) y el músculo elevador del ano (LA) de ratas macho . El peso de VP es un indicador del efecto androgénico, mientras que el peso de LA es un indicador del efecto anabólico. Se castran dos o más lotes de ratas y no se les da ningún tratamiento y respectivamente algún AAS de interés. La relación LA/VP para un AAS se calcula como la relación de las ganancias de peso LA/VP producidas por el tratamiento con ese compuesto utilizando ratas castradas pero no tratadas como línea de base: (LA c,t –LA c )/(VP c,t –VP c ). La relación de ganancia de peso LA/VP de los experimentos con ratas no es unitaria para la testosterona (normalmente 0,3–0,4), pero está normalizada para fines de presentación y se utiliza como base de comparación para otros AAS, que tienen sus proporciones androgénicas:anabólicas escaladas en consecuencia (como se muestra en la tabla anterior). [142] [143] A principios de la década de 2000, este procedimiento se estandarizó y se generalizó en toda la OCDE en lo que ahora se conoce como el ensayo de Hershberger.
Los esteroides anabólicos influyen notablemente en las características de las fibras musculares, afectando tanto al tamaño como al tipo de fibras musculares. Esta alteración contribuye significativamente a mejorar la fuerza y la resistencia muscular. [144] Los esteroides anabólico-androgénicos (EAA) causan estos cambios al afectar directamente a los componentes celulares del tejido muscular. Los estudios han demostrado que estos cambios no son meramente superficiales, sino que representan una transformación profunda en las propiedades estructurales y funcionales del músculo. Esta transformación es un factor clave en la capacidad de los esteroides para mejorar el rendimiento físico y la resistencia. [145]
El peso corporal en los hombres puede aumentar de 2 a 5 kg como resultado del uso de esteroides anabólicos a corto plazo (<10 semanas), lo que puede atribuirse principalmente a un aumento de la masa magra. Los estudios realizados en animales también han demostrado que la masa grasa se reduce, pero la mayoría de los estudios realizados en humanos no han logrado dilucidar disminuciones significativas de la masa grasa. Se ha demostrado que los efectos sobre la masa corporal magra dependen de la dosis. Se ha observado tanto hipertrofia muscular como formación de nuevas fibras musculares . La hidratación de la masa magra no se ve afectada por el uso de esteroides anabólicos, aunque no se pueden descartar pequeños aumentos del volumen sanguíneo. [7]
La región superior del cuerpo (tórax, cuello, hombros y parte superior del brazo) parece ser más susceptible a los AAS que otras regiones del cuerpo debido al predominio de los AR en la parte superior del cuerpo. [ cita requerida ] La mayor diferencia en el tamaño de las fibras musculares entre los usuarios de AAS y los no usuarios se observó en las fibras musculares tipo I del vasto lateral y el músculo trapecio como resultado de la autoadministración de AAS a largo plazo. Después de la abstinencia del fármaco, los efectos desaparecen lentamente, pero pueden persistir durante más de 6 a 12 semanas después de dejar de usar AAS. [7]
Mejoras de fuerza en el rango de 5 a 20% de la fuerza inicial, dependiendo en gran medida de los fármacos y la dosis utilizados, así como del período de administración. En general, el ejercicio donde se observaron las mejoras más significativas fue el press de banca . [7] Durante casi dos décadas, se asumió que los AAS ejercían efectos significativos solo en atletas de fuerza experimentados. [146] [147] Sin embargo, un ensayo controlado aleatorio demostró que incluso en atletas novatos, un programa de entrenamiento de fuerza de 10 semanas acompañado de enantato de testosterona a 600 mg/semana puede mejorar la fuerza más que el entrenamiento solo. [7] [148] Esta dosis es suficiente para mejorar significativamente la masa muscular magra en relación con el placebo incluso en sujetos que no hicieron ejercicio en absoluto. [148] Los efectos anabólicos del enantato de testosterona fueron altamente dependientes de la dosis. [7] [149]
Los AAS endógenos/naturales como la testosterona y la DHT y los AAS sintéticos median sus efectos uniéndose y activándose el AR. [75] Sobre la base de bioensayos animales , los efectos de estos agentes se han dividido en dos tipos parcialmente disociables: anabólicos (miotróficos) y androgénicos. [75] La disociación entre las proporciones de estos dos tipos de efectos en relación con la proporción observada con la testosterona se observa en bioensayos en ratas con varios AAS. [75] Las teorías para la disociación incluyen diferencias entre los AAS en términos de su metabolismo intracelular , selectividad funcional (reclutamiento diferencial de coactivadores ) y mecanismos no genómicos (es decir, señalización a través de receptores de andrógenos de membrana no AR , o mAR). [75] El apoyo a las dos últimas teorías es limitado y más hipotético, pero hay un buen apoyo a la teoría del metabolismo intracelular. [75]
La medición de la disociación entre los efectos anabólicos y androgénicos entre los AAS se basa en gran medida en un modelo simple pero obsoleto y poco sofisticado que utiliza bioensayos de tejido de rata. [75] Se lo ha denominado " índice miotrófico-androgénico ". [75] En este modelo, la actividad miotrófica o anabólica se mide por el cambio en el peso del músculo bulbocavernoso / elevador del ano de la rata , y la actividad androgénica se mide por el cambio en el peso de la próstata ventral de la rata (o, alternativamente, las vesículas seminales de la rata ), en respuesta a la exposición a los AAS. [75] Luego, las mediciones se comparan para formar una proporción. [75]
La testosterona es metabolizada en varios tejidos por la 5α-reductasa en DHT, que es 3 a 10 veces más potente como agonista de AR, y por la aromatasa en estradiol , que es un estrógeno y carece de afinidad significativa por AR. [75] Además, la DHT es metabolizada por la 3α-hidroxiesteroide deshidrogenasa (3α-HSD) y la 3β-hidroxiesteroide deshidrogenasa (3β-HSD) en 3α-androstanodiol y 3β-androstanodiol , respectivamente, que son metabolitos con poca o ninguna afinidad por AR. [75] La 5α-reductasa se distribuye ampliamente por todo el cuerpo y se concentra en diversos grados en la piel (particularmente el cuero cabelludo, la cara y las áreas genitales), la próstata, las vesículas seminales, el hígado y el cerebro. [75] Por el contrario, la expresión de 5α-reductasa en el músculo esquelético es indetectable. [75] La aromatasa se expresa en gran medida en el tejido adiposo y el cerebro, y también se expresa significativamente en el músculo esquelético. [75] La 3α-HSD también se expresa en gran medida en el músculo esquelético. [70]
Los AAS naturales como la testosterona y la DHT y los AAS sintéticos son análogos y son muy similares estructuralmente. [75] Por esta razón, tienen la capacidad de unirse y ser metabolizados por las mismas enzimas metabolizadoras de esteroides . [75] Según la explicación del metabolismo intracelular, la relación androgénico-anabólico de un agonista de AR dado está relacionada con su capacidad de ser transformado por las enzimas mencionadas anteriormente junto con la actividad de AR de cualquier producto resultante. [75] Por ejemplo, mientras que la actividad de AR de la testosterona se potencia en gran medida por la conversión local a través de la 5α-reductasa en DHT en los tejidos donde se expresa la 5α-reductasa, un AAS que no es metabolizado por la 5α-reductasa o que ya está 5α-reducido, como la propia DHT o un derivado (como la mesterolona o la drostanolona ), no sufriría dicha potenciación en dichos tejidos. [75] Además, la nandrolona es metabolizada por la 5α-reductasa, pero a diferencia del caso de la testosterona y la DHT, el metabolito 5α-reducido de la nandrolona tiene una afinidad mucho menor por el AR que la propia nandrolona, y esto da como resultado una activación reducida del AR en los tejidos que expresan 5α-reductasa. [75] Como los llamados tejidos "androgénicos", como la piel/folículos pilosos y los tejidos reproductivos masculinos, tienen una expresión muy alta de 5α-reductasa, mientras que el músculo esquelético está prácticamente desprovisto de 5α-reductasa, esto puede explicar principalmente la alta relación miotrófica-androgénica y la disociación observada con la nandrolona, así como con varios otros EAA. [75]
Aparte de la 5α-reductasa, la aromatasa puede inactivar la señalización de testosterona en el músculo esquelético y el tejido adiposo, por lo que se podría esperar que los AAS que carecen de afinidad por la aromatasa, además de estar libres del posible efecto secundario de la ginecomastia , tengan una relación miotrófica-androgénica más alta en comparación. [75] Además, la DHT se inactiva por la alta actividad de 3α-HSD en el músculo esquelético (y el tejido cardíaco), y se podría esperar de manera similar que los AAS que carecen de afinidad por la 3α-HSD tengan una relación miotrófica-androgénica más alta (aunque quizás también mayores riesgos cardiovasculares a largo plazo). [75] De acuerdo con esto, la DHT, la mestanolona (17α-metil-DHT) y la mesterolona (1α-metil-DHT) se describen como muy poco anabólicos debido a la inactivación por 3α-HSD en el músculo esquelético, mientras que otros derivados de DHT con otras características estructurales como la metenolona , oxandrolona , oximetolona , drostanolona y estanozolol son todos sustratos pobres para 3α-HSD y se describen como anabólicos potentes. [70]
La teoría del metabolismo intracelular explica cómo y por qué puede ocurrir una notable disociación entre los efectos anabólicos y androgénicos a pesar del hecho de que estos efectos están mediados por el mismo receptor de señalización, y por qué esta disociación es invariablemente incompleta. [75] En apoyo del modelo está la rara condición de deficiencia congénita de 5α-reductasa tipo 2 , en la que la enzima 5α-reductasa tipo 2 es defectuosa, la producción de DHT está alterada y los niveles de DHT son bajos mientras que los niveles de testosterona son normales. [150] [151] Los varones con esta condición nacen con genitales ambiguos y una glándula prostática severamente subdesarrollada o incluso ausente. [150] [151] Además, en el momento de la pubertad, estos varones desarrollan una musculatura normal, voz más grave y libido, pero tienen menos vello facial, un patrón femenino de vello corporal (es decir, en gran medida restringido al triángulo púbico y las axilas), no hay incidencia de pérdida de cabello de patrón masculino y no hay agrandamiento de próstata ni incidencia de cáncer de próstata . [151] [152] [153] [154] [155] Cabe destacar que tampoco desarrollan ginecomastia como consecuencia de su condición. [153]
Un estudio en animales descubrió que dos tipos diferentes de elementos de respuesta a los andrógenos podrían responder de manera diferente a la testosterona y la DHT tras la activación del AR. [10] [156] Sin embargo, se desconoce si esto está involucrado en las diferencias en las proporciones del efecto anabólico a miotrófico de diferentes EAA. [10] [156] [75]
Las señales de testosterona no solo se transmiten a través del AR nuclear, sino también a través de los mAR, incluidos ZIP9 y GPRC6A . [157] [158] Se ha propuesto que la señalización diferencial a través de los mAR puede estar involucrada en la disociación de los efectos anabólicos y androgénicos de los AAS. [75] De hecho, la DHT tiene menos del 1% de la afinidad de la testosterona por ZIP9, y los AAS sintéticos metribolona y mibolerona son competidores ineficaces para el receptor de manera similar. [158] Esto indica que los AAS muestran interacciones diferenciales con el AR y los mAR. [158] Sin embargo, las mujeres con síndrome de insensibilidad completa a los andrógenos (CAIS), que tienen un genotipo 46,XY ("masculino") y testículos pero un defecto en el AR tal que no es funcional, son un desafío a esta noción. [159] Son completamente insensibles a los efectos mediados por AR de los andrógenos como la testosterona, y muestran un fenotipo perfectamente femenino a pesar de tener niveles de testosterona en el extremo superior del rango masculino normal. [159] Estas mujeres tienen poca o ninguna producción de sebo , incidencia de acné o crecimiento de vello corporal (incluso en las áreas púbica y axilar). [159] Además, las mujeres CAIS tienen una masa corporal magra que es normal para las mujeres pero, por supuesto, está muy reducida en relación con los hombres. [160] Estas observaciones sugieren que el AR es principal o exclusivamente responsable de la masculinización y miotrofia causadas por los andrógenos. [159] [160] [161] Sin embargo, se ha descubierto que los mAR están involucrados en algunos de los efectos relacionados con la salud de la testosterona, como la modulación del riesgo y la progresión del cáncer de próstata. [158] [162]
Los cambios en los niveles endógenos de testosterona también pueden contribuir a las diferencias en la relación miotrófica-androgénica entre la testosterona y los AAS sintéticos. [70] Los agonistas de AR son antigonadotrópicos , es decir, suprimen de forma dosis-dependiente la producción de testosterona gonadal y, por lo tanto, reducen las concentraciones sistémicas de testosterona. [70] Al suprimir los niveles endógenos de testosterona y reemplazar eficazmente la señalización de AR en el cuerpo con la de los AAS exógenos, la relación miotrófica-androgénica de un AAS determinado puede aumentar aún más, de forma dosis-dependiente, y esto, por lo tanto, puede ser un factor adicional que contribuya a las diferencias en la relación miotrófica-androgénica entre diferentes AAS. [70] Además, algunos AAS, como los derivados de la 19-nortestosterona como la nandrolona, también son progestágenos potentes , y la activación del receptor de progesterona (PR) es antigonadotrópica de manera similar a la activación del AR. [70] La combinación de una activación suficiente de AR y PR puede suprimir los niveles de testosterona circulante hasta el rango de castración en los hombres (es decir, la supresión completa de la producción de testosterona gonadal y los niveles de testosterona circulante disminuyeron en aproximadamente un 95%). [50] [163] Como tal, la actividad progestágena combinada puede servir para aumentar aún más la relación miotrófica-androgénica para un AAS determinado. [70]
Se ha descubierto que algunos AAS, como la testosterona, la DHT, el estanozolol y la metiltestosterona, modulan el receptor GABA A de manera similar a los neuroesteroides endógenos como la alopregnanolona , el 3α-androstanodiol , el sulfato de dehidroepiandrosterona y el sulfato de pregnenolona . [75] Se ha sugerido que esto puede contribuir como un mecanismo alternativo o adicional a los efectos neurológicos y conductuales de los AAS. [75] [164] [165] [166] [167] [168] [169]
Los AAS difieren en una variedad de formas, incluyendo en sus capacidades para ser metabolizados por enzimas esteroidogénicas como la 5α-reductasa , las 3-hidroxiesteroide deshidrogenasas y la aromatasa , en si su potencia como agonistas de AR es potenciada o disminuida por la 5α-reducción, en sus proporciones de efecto anabólico / miotrófico a androgénico , en sus actividades estrogénicas , progestágenas y neuroesteroides , en su actividad oral y en su capacidad para producir hepatotoxicidad . [70] [75] [170]
La testosterona puede ser convertida robustamente por la 5α-reductasa en DHT en los llamados tejidos androgénicos como la piel , el cuero cabelludo , la próstata y las vesículas seminales , pero no en los músculos o los huesos , donde la 5α-reductasa no se expresa o solo se expresa mínimamente. [75] Como la DHT es de 3 a 10 veces más potente como agonista del AR que la testosterona, la actividad agonista del AR de la testosterona se potencia de forma marcada y selectiva en dichos tejidos. [75] A diferencia de la testosterona, la DHT y otros AAS 4,5α-dihidrogenados ya están 5α-reducidos y, por esta razón, no se pueden potenciar en los tejidos androgénicos. [75] Los derivados de 19-nortestosterona como la nandrolona pueden ser metabolizados por la 5α-reductasa de manera similar a la testosterona, pero los metabolitos 5α-reducidos de los derivados de 19-nortestosterona (por ejemplo, 5α-dihidronandrolona ) tienden a tener una actividad reducida como agonistas de AR, lo que resulta en una actividad androgénica reducida en los tejidos que expresan 5α-reductasa. [75] Además, algunos derivados de 19-nortestosterona, incluyendo trestolona (7α-metil-19-nortestosterona (MENT)), 11β-metil-19-nortestosterona (11β-MNT) y dimetandrolona (7α,11β-dimetil-19-nortestosterona), no pueden ser 5α-reducidos. [171] Por el contrario, ciertos AAS 17α-alquilados como la metiltestosterona son 5α-reducidos y potenciados en los tejidos androgénicos de manera similar a la testosterona. [75] [70] Sin embargo, los derivados de DHT 17α-alquilados no pueden ser potenciados a través de la 5α-reductasa, ya que ya están 4,5α-reducidos. [75] [70]
La capacidad de ser metabolizado por la 5α-reductasa y la actividad AR de los metabolitos resultantes parece ser uno de los principales, si no el más importante, determinante de la relación androgénico-miotrófico para un EAA determinado. [75] Los EAA que no son potenciados por la 5α-reductasa o que son debilitados por la 5α-reductasa en los tejidos androgénicos tienen un riesgo reducido de efectos secundarios androgénicos como acné , alopecia androgénica (calvicie de patrón masculino), hirsutismo (crecimiento excesivo de vello de patrón masculino), hiperplasia prostática benigna (agrandamiento de la próstata) y cáncer de próstata , mientras que la incidencia y magnitud de otros efectos como hipertrofia muscular , cambios óseos, [172] profundización de la voz y cambios en el impulso sexual no muestran diferencias. [75] [173]
La testosterona puede ser metabolizada por la aromatasa en estradiol , y muchos otros AAS también pueden ser metabolizados en sus metabolitos estrogénicos correspondientes. [75] Como ejemplo, los AAS 17α-alquilados metiltestosterona y metandienona son convertidos por la aromatasa en metilestradiol . [174] Los derivados 4,5α-dihidrogenados de la testosterona como la DHT no pueden ser aromatizados, mientras que los derivados de 19-nortestosterona como la nandrolona pueden serlo, pero en un grado muy reducido. [75] [175] Algunos derivados de 19-nortestosterona, como la dimetandrolona y la 11β-MNT, no se pueden aromatizar debido al impedimento estérico proporcionado por su grupo 11β-metilo, mientras que el AAS estrechamente relacionado trestolona (7α-metil-19-nortestosterona), en relación con su falta de un grupo 11β-metilo, se puede aromatizar. [175] Los AAS que están 17α-alquilados (y no también 4,5α-reducidos o 19-desmetilados) también se aromatizan, pero en menor medida que la testosterona. [75] [176] Sin embargo, es notable que los estrógenos que están sustituidos en 17α (por ejemplo, etinilestradiol y metilestradiol) tienen una potencia estrogénica notablemente mayor debido a una estabilidad metabólica mejorada , [174] y por esta razón, los AAS 17α-alquilados en realidad pueden tener una alta estrogenicidad y efectos estrogénicos comparativamente mayores que la testosterona. [174] [70]
El principal efecto de la estrogenicidad es la ginecomastia (pechos parecidos a los de una mujer). [75] Los AAS que tienen un alto potencial de aromatización como la testosterona y particularmente la metiltestosterona muestran un alto riesgo de ginecomastia en dosis suficientemente altas, mientras que los AAS que tienen un potencial reducido de aromatización como la nandrolona muestran un riesgo mucho menor (aunque todavía potencialmente significativo en dosis altas). [75] Por el contrario, los AAS que son 4,5α-reducidos y algunos otros AAS (por ejemplo, derivados de 19-nortestosterona 11β-metilados), no tienen riesgo de ginecomastia. [75] Además de la ginecomastia, los AAS con alta estrogenicidad tienen una actividad antigonadotrópica aumentada, lo que resulta en una mayor potencia en la supresión del eje hipotálamo-hipofisario-gonadal y la producción de testosterona gonadal . [177]
Muchos derivados de la 19-nortestosterona, incluyendo la nandrolona, la trembolona , el etilestrenol (etilnandrol), la metribolona (R-1881), la trestolona, la 11β-MNT, la dimetandrolona y otros, son potentes agonistas del receptor de progesterona (PR) y, por lo tanto, son progestágenos además de los AAS. [75] [178] De manera similar al caso de la actividad estrogénica, la actividad progestágena de estos fármacos sirve para aumentar su actividad antigonadotrópica. [178] Esto da como resultado una mayor potencia y eficacia de estos AAS como agentes antiespermatogénicos y anticonceptivos masculinos (o, dicho de otra manera, una mayor potencia y eficacia en la producción de azoospermia e infertilidad masculina reversible ). [178]
Los derivados de testosterona no 17α-alquilados, como la propia testosterona, la DHT y la nandrolona, tienen una biodisponibilidad oral deficiente debido a un extenso metabolismo hepático de primer paso y, por lo tanto, no son activos por vía oral. [75] Una notable excepción a esto son los AAS que son precursores de andrógenos o prohormonas , entre ellos la dehidroepiandrosterona (DHEA), androstenediol , androstenediona , boldiona (androstadienediona), bolandiol (norandrostenediol), bolandiona (norandrostenediona), dienediona , mentabolan (MENT diona, trestiona) y metoxidienona (metoxigonadieno) (aunque estos son AAS relativamente débiles). [179] [180] Los AAS que no son activos por vía oral se utilizan casi exclusivamente en forma de ésteres administrados por inyección intramuscular , que actúan como depósitos y funcionan como profármacos de acción prolongada . [75] Los ejemplos incluyen testosterona, como cipionato de testosterona , enantato de testosterona y propionato de testosterona , y nandrolona, como fenilpropionato de nandrolona y decanoato de nandrolona , entre muchos otros (consulte aquí una lista completa de ésteres de testosterona y nandrolona). [75] Una excepción es el éster de cadena muy larga undecanoato de testosterona , que es activo por vía oral, aunque con una biodisponibilidad oral muy baja (aproximadamente el 3%). [181] A diferencia de la mayoría de los otros AAS, los derivados de testosterona 17α-alquilados muestran resistencia al metabolismo debido al impedimento estérico y son activos por vía oral, aunque también pueden esterificarse y administrarse mediante inyección intramuscular. [75]
Además de la actividad oral, la 17α-alquilación también confiere un alto potencial de hepatotoxicidad , y todos los AAS 17α-alquilados se han asociado, aunque de manera poco común y solo después de un uso prolongado (diferentes estimaciones entre 1 y 17%), [182] [183] con hepatotoxicidad. [75] [184] [185] Por el contrario, los ésteres de testosterona solo se han asociado de manera extremadamente rara o nunca con hepatotoxicidad, [183] y otros AAS no 17α-alquilados solo raramente, [ cita requerida ] aunque se informa que el uso a largo plazo aún puede aumentar el riesgo de cambios hepáticos (pero a una tasa mucho menor que los AAS 17α-alquilados y, según se informa, no en dosis de reemplazo). [182] [186] [74] [ cita(s) adicional(es) necesaria(s ) ] De acuerdo con esto, se ha descubierto que los glucurónidos del anillo D de la testosterona y la DHT son colestásicos. [187]
Aparte de las prohormonas y el undecanoato de testosterona, casi todos los AAS activos por vía oral están 17α-alquilados. [188] Algunos AAS que no están 17α-alquilados son activos por vía oral. [75] Algunos ejemplos incluyen los 17-éteres de testosterona cloxotestosterona , quinbolona y silandrona , [ cita requerida ] que son profármacos (a la testosterona, boldenona (Δ 1 -testosterona) y testosterona, respectivamente), los 17-éteres de DHT mepitiostano , mesabolona y prostanozol (que también son profármacos), los derivados de DHT 1-metilados mesterolona y metenolona (aunque estos son AAS relativamente débiles), [75] [74] y los derivados de 19-nortestosterona dimetandrolona y 11β-MNT, que tienen una resistencia mejorada al metabolismo hepático de primer paso debido a sus grupos 11β-metilo (en contraste con ellos, el AAS relacionado trestolona (7α-metil-19-nortestosterona) no es activo por vía oral). [75] [178] Como estos AAS no están 17α-alquilados, muestran un potencial mínimo de hepatotoxicidad. [75]
La DHT, a través de su metabolito 3α-androstanodiol (producido por la 3α-hidroxiesteroide deshidrogenasa (3α-HSD)), es un neurosteroide que actúa a través de la modulación alostérica positiva del receptor GABA A. [75] La testosterona, a través de la conversión en DHT , también produce 3α-androstanodiol como metabolito y, por lo tanto, tiene una actividad similar. [75] Algunos AAS que son o pueden ser reducidos en 5α, incluyendo la testosterona, la DHT, el estanozolol y la metiltestosterona, entre muchos otros, pueden o pueden modular el receptor GABA A , y esto puede contribuir como un mecanismo alternativo o adicional a sus efectos en el sistema nervioso central en términos de estado de ánimo, ansiedad, agresión y deseo sexual. [75] [164] [165] [166] [167] [168] [169]
Los AAS son esteroides androstanos o estranos . Entre ellos se encuentran la testosterona (androst-4-en-17β-ol-3-ona) y derivados con diversas modificaciones estructurales como: [75] [189] [70]
Así como otros como 1-deshidrogenación (p. ej., metandienona , boldenona ), 1-sustitución (p. ej., mesterolona , metenolona ), 2-sustitución (p. ej., drostanolona , oximetolona , estanozolol ), 4-sustitución (p. ej., clostebol , oxabolona ) y varias otras modificaciones. [75] [189] [70]
Conversión a DHT, [190] nandrolona, [75] metandienona (Dianabol), [191] clorodehidrometiltestosterona (Turinabol), [192] fluoximesterona (Halotestin), [193] y boldenona (Equipoise): [194]

DHT a estanozolol (Winstrol), [195] acetato de metenolona (Primobolan), [196] oximetolona (Anadrol), [197] y metasterona (Superdrol): [198]

Nandrolona a trestolona, [199] trembolona, [200] norboletona, [201] y etilestrenol: [202]

La muestra fisiológica humana más comúnmente empleada para detectar el uso de esteroides anabólicos es la orina, aunque se han investigado tanto la sangre como el cabello para este propósito. Los esteroides anabólicos, ya sean de origen endógeno o exógeno, están sujetos a una biotransformación hepática extensa por una variedad de vías enzimáticas. Los metabolitos urinarios primarios pueden ser detectables hasta 30 días después del último uso, dependiendo del agente específico, la dosis y la vía de administración. Varios de los fármacos tienen vías metabólicas comunes y sus perfiles de excreción pueden superponerse a los de los esteroides endógenos, lo que hace que la interpretación de los resultados de las pruebas sea un desafío muy importante para el químico analítico. Los métodos para la detección de las sustancias o sus productos de excreción en muestras de orina generalmente involucran cromatografía de gases-espectrometría de masas o cromatografía líquida-espectrometría de masas. [203] [204] [205] [206]
El uso de esteroides gonadales es anterior a su identificación y aislamiento. El uso de orina de vaca para el tratamiento de ascitis, insuficiencia cardíaca, insuficiencia renal y vitíligo ha sido descrito detalladamente en Sushruta Samhita , lo que sugiere que los antiguos indios tenían algún conocimiento de las propiedades esteroidales de la orina de vaca alrededor del siglo VI a. C. [207] La extracción de hormonas de la orina comenzó en China alrededor del año 100 a. C. [ cita requerida ] El uso médico del extracto de testículo comenzó a fines del siglo XIX, mientras aún se estudiaban sus efectos sobre la fuerza. [141] El aislamiento de esteroides gonadales se remonta a 1931, cuando Adolf Butenandt , un químico de Marburgo , purificó 15 miligramos de la hormona masculina androstenona de decenas de miles de litros de orina. Este esteroide fue sintetizado posteriormente en 1934 por Leopold Ružička , un químico de Zúrich . [208]
En la década de 1930, ya se sabía que los testículos contienen un andrógeno más potente que la androstenona , y tres grupos de científicos, financiados por compañías farmacéuticas competidoras en los Países Bajos, Alemania y Suiza, se apresuraron a aislarlo. [208] [209] Esta hormona fue identificada por primera vez por Karoly Gyula David, E. Dingemanse, J. Freud y Ernst Laqueur en un artículo de mayo de 1935 "Sobre la hormona masculina cristalina de los testículos (testosterona)". [210] Llamaron a la hormona testosterona , de las raíces de testículo y esterol , y el sufijo de cetona . La síntesis química de la testosterona se logró en agosto de ese año, cuando Butenandt y G. Hanisch publicaron un artículo que describía "Un método para preparar testosterona a partir del colesterol". [211] Sólo una semana después, el tercer grupo, Ruzicka y A. Wettstein, anunciaron una solicitud de patente en un artículo "Sobre la preparación artificial de la hormona testicular testosterona (Androsten-3-ona-17-ol)". [212] A Ruzicka y Butenandt se les ofreció el Premio Nobel de Química de 1939 por su trabajo, pero el gobierno nazi obligó a Butenandt a rechazar el honor, aunque aceptó el premio después del final de la Segunda Guerra Mundial. [208] [209]
Los ensayos clínicos en humanos, que involucraban dosis orales de metiltestosterona o inyecciones de propionato de testosterona , comenzaron ya en 1937. [208] A menudo hay rumores de que a los soldados alemanes se les administró AAS durante la Segunda Guerra Mundial, con el objetivo de aumentar su agresividad y resistencia, pero estos, hasta ahora, no están probados. [122] : 6 El propio Adolf Hitler , según su médico, fue inyectado con derivados de testosterona para tratar varias dolencias. [213] Los AAS se utilizaron en experimentos realizados por los nazis en reclusos de campos de concentración, [213] y más tarde por los aliados que intentaban tratar a las víctimas desnutridas que sobrevivieron a los campos nazis. [122] : 6 Al presidente John F. Kennedy se le administraron esteroides tanto antes como durante su presidencia. [214]
El desarrollo de las propiedades de la testosterona para el desarrollo muscular se llevó a cabo en la década de 1940, en la Unión Soviética y en los países del Bloque del Este , como Alemania del Este, donde se utilizaron programas de esteroides para mejorar el rendimiento de los levantadores de pesas olímpicos y otros levantadores de pesas aficionados . En respuesta al éxito de los levantadores de pesas rusos, el médico del equipo olímpico de EE. UU., John Ziegler, trabajó con químicos sintéticos para desarrollar un AAS con efectos androgénicos reducidos. [215] El trabajo de Ziegler resultó en la producción de metandrostenolona , que Ciba Pharmaceuticals comercializó como Dianabol. El nuevo esteroide fue aprobado para su uso en los EE. UU. Por la Administración de Alimentos y Medicamentos (FDA) en 1958. Se administraba con mayor frecuencia a víctimas de quemaduras y ancianos. Los usuarios fuera de etiqueta del fármaco eran principalmente culturistas y levantadores de pesas. Aunque Ziegler prescribía solo pequeñas dosis a los atletas, pronto descubrió que aquellos que habían usado Dianabol desarrollaban próstatas agrandadas y testículos atrofiados. [216] Los AAS fueron incluidos en la lista de sustancias prohibidas del Comité Olímpico Internacional (COI) en 1976, y una década más tarde, el comité introdujo pruebas de dopaje "fuera de competición" porque muchos atletas usaban AAS en su período de entrenamiento en lugar de durante la competición. [7]
Tres ideas principales gobernaron las modificaciones de la testosterona en una multitud de AAS: la alquilación en la posición C17α con un grupo metilo o etilo creó compuestos activos de polioxietilo porque retarda la degradación del fármaco por el hígado; la esterificación de testosterona y nortestosterona en la posición C17β permite que la sustancia se administre por vía parenteral y aumenta la duración de la eficacia porque los agentes solubles en líquidos aceitosos pueden estar presentes en el cuerpo durante varios meses; y se aplicaron alteraciones de la estructura del anillo tanto para agentes de polioxietilo como parenterales con el fin de obtener diferentes proporciones de efectos anabólicos a androgénicos. [7]
Los andrógenos se descubrieron en la década de 1930 y se caracterizaron por tener efectos descritos como androgénicos (es decir, virilizantes) y anabólicos (por ejemplo, miotróficos, renotróficos). [70] [75] El término esteroide anabólico se remonta al menos a mediados de la década de 1940, cuando se utilizó para describir el concepto hipotético de ese momento de un esteroide derivado de la testosterona con efectos anabólicos pero con efectos androgénicos mínimos o nulos. [217] Este concepto se formuló con base en la observación de que los esteroides tenían proporciones de potencia renotrófica a androgénica que diferían significativamente, lo que sugería que los efectos anabólicos y androgénicos podrían ser disociables. [217]
En 1953, un esteroide derivado de la testosterona conocido como noretandrolona (17α-etil-19-nortestosterona) se sintetizó en GD Searle & Company y se estudió como progestina , pero no se comercializó. [218] Posteriormente, en 1955, se volvió a examinar para determinar su actividad similar a la de la testosterona en animales y se descubrió que tenía una actividad anabólica similar a la testosterona, pero solo un dieciseisavo de su potencia androgénica. [218] [219] Fue el primer esteroide con una marcada y favorable separación de efecto anabólico y androgénico que se descubrió y, en consecuencia, se lo ha descrito como el "primer esteroide anabólico". [220] [221] La noretandrolona se introdujo para uso médico en 1956, y rápidamente fue seguida por numerosos esteroides similares, por ejemplo, el fenilpropionato de nandrolona en 1959 y el estanozolol en 1962. [220] [221] [222] [223] Con estos desarrollos, el esteroide anabólico se convirtió en el término preferido para referirse a dichos esteroides (por encima de "andrógeno"), y entró en uso generalizado.
Aunque originalmente el término esteroide anabólico se concibió para describir específicamente los esteroides derivados de la testosterona con una marcada disociación del efecto anabólico y androgénico, hoy en día se aplica indiscriminadamente a todos los esteroides con efectos anabólicos basados en el agonismo AR, independientemente de su potencia androgénica, incluidos incluso los esteroides no sintéticos y no preferentemente anabólicos como la testosterona. [70] [75] [218] Si bien muchos esteroides anabólicos tienen una potencia androgénica disminuida en comparación con la potencia anabólica, no existe ningún esteroide anabólico que sea exclusivamente anabólico y, por lo tanto, todos los esteroides anabólicos conservan al menos algún grado de androgenicidad. [70] [75] [218] (Asimismo, todos los "andrógenos" son inherentemente anabólicos). [70] [75] [218] De hecho, probablemente no sea posible disociar completamente los efectos anabólicos de los efectos androgénicos, ya que ambos tipos de efectos están mediados por el mismo receptor de señalización, el AR. [75] Como tal, la distinción entre los términos esteroide anabólico y andrógeno es cuestionable, y esta es la base para el término revisado y más reciente esteroide anabólico-androgénico ( EAA ). [70] [75] [218]
David Handelsman ha criticado la terminología y la comprensión que rodea a los AAS en muchas publicaciones. [224] [225] [226 ] [227] [ 228] [229] [230] [231] Según Handelsman, la industria farmacéutica intentó disociar los llamados efectos "androgénicos" y "anabólicos" de los AAS a mediados del siglo XX para crear agentes anabólicos no masculinizantes que fueran más adecuados para su uso en mujeres y niños. [224] Sin embargo, este esfuerzo fracasó estrepitosamente y fue abandonado en la década de 1970. [224] [225] Este fracaso se debió al descubrimiento posterior de un receptor de andrógenos singular (AR) que media los efectos de los AAS tanto en el tejido muscular como en el reproductivo, junto con la mala interpretación de bioensayos de andrógenos animales defectuosos empleados para distinguir entre efectos androgénicos o virilizantes y efectos anabólicos o miotróficos (es decir, el ensayo de Hershberger que involucra al músculo elevador del ano no representativo). [224] [225] En realidad, todos los AAS tienen efectos mediados por AR esencialmente similares, [231] incluso si algunos pueden diferir en potencia hasta cierto punto en ciertos tejidos (por ejemplo, piel, folículos pilosos, glándula prostática) en función de la susceptibilidad a la reducción de 5α y la amplificación o inactivación metabólica asociada o la falta de ella. [231] [8] Según Handelsman, los términos "esteroide anabólico" y "esteroide anabólico-androgénico" son obsoletos, sin sentido y distinguen falsamente a estos agentes de los andrógenos cuando no hay una base fisiológica para tal distinción. [224] [225] De hecho, se ha observado que el uso y la distinción de los conceptos "anabólico" y "androgénico", así como el término "esteroide anabólico-androgénico" son oxímoron, ya que anabólico se refiere al desarrollo muscular, mientras que androgénico se refiere a la inducción y mantenimiento de las características sexuales secundarias masculinas (que en principio incluirían efectos anabólicos o de desarrollo muscular). [224] [225] [232] Handelsman ha argumentado que estos términos deberían descartarse y, en su lugar, todos los AAS deberían simplemente denominarse "andrógenos", y él utiliza este término exclusivamente para referirse a estos agentes en sus publicaciones. [224] [225] Aunque el término "esteroide anabólico-androgénico" es técnicamente válido para describir dos tipos de acciones de estos agentes, Handelsman considera que el término es innecesario y redundante y lo compara con términos hipotéticos nunca utilizados como "progestinas lúteas-gestacionales" o "estrógenos mamarios-uterinos".[224] Handelsman también señala que los "esteroides anabólicos" se confunden fácil e innecesariamente con los corticosteroides . [224]Además de los AAS, Handelsman ha criticado el término " modulador selectivo del receptor de andrógenos (SARM)" y las afirmaciones sobre estos agentes también. [226] [224] [225] [230]
El estatus legal de los AAS varía de un país a otro: algunos tienen controles más estrictos sobre su uso o prescripción que otros, aunque en muchos países no son ilegales. En los EE. UU., los AAS están actualmente listados como sustancias controladas de la Lista III bajo la Ley de Sustancias Controladas , que hace que la simple posesión de tales sustancias sin receta sea un delito federal punible con hasta un año de prisión por la primera infracción. La distribución ilegal o posesión con intención de distribuir AAS como primera infracción se castiga con hasta diez años de prisión. [233] En Canadá, los AAS y sus derivados son parte de la Ley de Sustancias y Drogas Controladas y son sustancias de la Lista IV , lo que significa que es ilegal obtenerlos o venderlos sin receta; sin embargo, la posesión no es punible, una consecuencia reservada para las sustancias de las listas I, II o III. Los culpables de comprar o vender AAS en Canadá pueden ser encarcelados por hasta 18 meses. [234] La importación y exportación también conllevan sanciones similares.
En Canadá, los investigadores han llegado a la conclusión de que el uso de esteroides entre los deportistas estudiantes está muy extendido. Un estudio realizado en 1993 por el Centro Canadiense para un Deporte Libre de Drogas descubrió que casi 83.000 canadienses de entre 11 y 18 años consumen esteroides. [235] Los esteroides anabólicos también son ilegales sin receta en Australia, [236] Argentina, [ cita requerida ] Brasil, [ cita requerida ] y Portugal, [ cita requerida ] y están catalogados como Drogas Controladas de Clase C en el Reino Unido. Los esteroides anabólicos están fácilmente disponibles sin receta en algunos países como México y Tailandia.
La historia de la legislación estadounidense sobre los esteroides anabólicos se remonta a finales de la década de 1980, cuando el Congreso de Estados Unidos consideró colocar los esteroides anabólicos bajo la Ley de Sustancias Controladas tras la controversia sobre la victoria de Ben Johnson en los Juegos Olímpicos de Verano de 1988 en Seúl . Los esteroides anabólicos se agregaron al Anexo III de la Ley de Sustancias Controladas en la Ley de Control de Esteroides Anabólicos de 1990. [240]
La misma ley también introdujo controles más estrictos con sanciones penales más altas para los delitos que involucraran la distribución ilegal de AAS y hormona de crecimiento humano. A principios de la década de 1990, después de que los AAS se programaran en los EE. UU., varias compañías farmacéuticas dejaron de fabricar o comercializar los productos en los EE. UU., incluidas Ciba , Searle , Syntex y otras. En la Ley de Sustancias Controladas, los AAS se definen como cualquier fármaco o sustancia hormonal química y farmacológicamente relacionada con la testosterona (excepto estrógenos , progestinas y corticosteroides ) que promueven el crecimiento muscular. La ley fue enmendada por la Ley de Control de Esteroides Anabólicos de 2004, que agregó prohormonas a la lista de sustancias controladas , con efecto a partir del 20 de enero de 2005. [241]
Si bien todavía pueden ser recetados por un médico en los EE. UU., el uso de esteroides anabólicos para la recuperación de lesiones ha sido un tema tabú, incluso entre la mayoría de los médicos deportivos y endocrinólogos.
En el Reino Unido, los AAS se clasifican como medicamentos de clase C, lo que los coloca en la misma clase que las benzodiazepinas . Los AAS están en la Lista 4, que se divide en 2 partes: la Parte 1 contiene la mayoría de las benzodiazepinas y la Parte 2 contiene los AAS.
Los medicamentos de la Parte 1 están sujetos a controles completos de importación y exportación, y su posesión constituye un delito sin una receta médica adecuada. No hay restricciones a la posesión cuando forma parte de un medicamento. Los medicamentos de la Parte 2 requieren una licencia del Ministerio del Interior para su importación y exportación, a menos que la sustancia se presente en forma de medicamento y esté destinada a la autoadministración por una persona. [242]
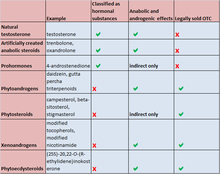
Los AAS están prohibidos por todos los organismos deportivos importantes, incluyendo la Asociación de Profesionales del Tenis , las Grandes Ligas de Béisbol , la Federación Internacional de Fútbol Asociación , [243] los Juegos Olímpicos , [244] la Asociación Nacional de Baloncesto , [245] la Liga Nacional de Hockey , [246] la World Wrestling Entertainment y la Liga Nacional de Fútbol . [247] La Agencia Mundial Antidopaje (AMA) mantiene la lista de sustancias para mejorar el rendimiento utilizadas por muchos organismos deportivos importantes e incluye todos los agentes anabólicos, que incluyen todos los AAS y precursores, así como todas las hormonas y sustancias relacionadas. [248] [249]
Los funcionarios encargados de hacer cumplir la ley federal de los Estados Unidos han expresado su preocupación por el uso de esteroides anabólicos por parte de los agentes de policía. "Es un gran problema y, a juzgar por la cantidad de casos, es algo que no deberíamos ignorar. No es que nos propusiéramos atacar a los policías, pero cuando estamos en medio de una investigación activa sobre esteroides , ha habido bastantes casos que han llevado a los agentes de policía", dice Lawrence Payne, portavoz de la Administración de Control de Drogas de los Estados Unidos . [250] El Boletín de Aplicación de la Ley del FBI afirmó que "el abuso de esteroides anabólicos por parte de los agentes de policía es un problema grave que merece una mayor concienciación por parte de los departamentos de todo el país". [251] También se cree que los agentes de policía de todo el Reino Unido "están utilizando a los delincuentes para comprar esteroides", lo que, según afirma, es un factor de riesgo importante para la corrupción policial .
Tras el doble asesinato y suicidio de Chris Benoit en 2007, el Comité de Supervisión y Reforma Gubernamental investigó el uso de esteroides en la industria de la lucha libre. [252] El Comité investigó a la WWE y a la Total Nonstop Action Wrestling (ahora conocida como Impact Wrestling ), pidiendo documentación de las políticas de drogas de sus empresas. El director ejecutivo y presidente de la WWE, Linda y Vince McMahon respectivamente, ambos testificaron. Los documentos indicaron que 75 luchadores, aproximadamente el 40 por ciento, habían dado positivo por consumo de drogas desde 2006, más comúnmente por esteroides. [253] [254]

Los esteroides anabólicos se producen frecuentemente en laboratorios farmacéuticos, pero en países donde existen leyes más estrictas, también se producen en pequeños laboratorios clandestinos caseros, generalmente a partir de materias primas importadas del extranjero. [255] En estos países, la mayoría de los esteroides se obtienen ilegalmente a través del mercado negro . [256] [257] Estos esteroides generalmente se fabrican en otros países y, por lo tanto, deben contrabandearlos a través de las fronteras internacionales. Como en la mayoría de las operaciones de contrabando importantes, está involucrado el crimen organizado . [258]
A finales de la década de 2000, el comercio mundial de AAS ilícitos aumentó significativamente y las autoridades anunciaron incautaciones récord en tres continentes. En 2006, las autoridades finlandesas anunciaron una incautación récord de 11,8 millones de tabletas de AAS. Un año después, la DEA incautó 11,4 millones de unidades de AAS en la mayor incautación jamás realizada en Estados Unidos. En los primeros tres meses de 2008, las aduanas australianas informaron de una cifra récord de 300 incautaciones de cargamentos de AAS. [114]
En los Estados Unidos, Canadá y Europa, los esteroides ilegales a veces se compran como cualquier otra droga ilegal, a través de distribuidores que pueden obtenerlos de varias fuentes. Los esteroides anabólicos ilegales a veces se venden en gimnasios y competiciones, y por correo, pero también se pueden obtener a través de farmacias, veterinarios y médicos. [259] Además, una cantidad significativa de productos falsificados se venden como esteroides anabólicos, en particular a través de pedidos por correo desde sitios web que se hacen pasar por farmacias extranjeras. En los Estados Unidos, la importación en el mercado negro continúa desde México, Tailandia y otros países donde los esteroides están más fácilmente disponibles, ya que son legales. [260]
Los AAS, solos y en combinación con progestágenos , se han estudiado como posibles anticonceptivos hormonales masculinos . [50] Los AAS duales y las progestinas como la trestolona y el undecanoato de dimetandrolona también se han estudiado como anticonceptivos masculinos, y este último se encuentra bajo investigación activa a partir de 2018. [261] [178] [262]
Los andrógenos tópicos se han utilizado y estudiado en el tratamiento de la celulitis en mujeres. [263] Se ha descubierto que la androstanolona tópica en el abdomen disminuye significativamente la grasa abdominal subcutánea en las mujeres y, por lo tanto, puede ser útil para mejorar la silueta corporal. [263] Sin embargo, los hombres y las mujeres hiperandrogénicas tienen mayores cantidades de grasa abdominal que las mujeres sanas, y se ha descubierto que los andrógenos aumentan la grasa abdominal también en mujeres posmenopáusicas y hombres transgénero . [264]
Los esteroides anabólicos endógenos, como la testosterona y la dihidrotestosterona, y los esteroides anabólicos sintéticos median sus efectos uniéndose a los receptores de andrógenos y activándolos.
[...] en un estudio reciente en animales, Hsiao et al. (10) encontraron dos tipos diferentes de elementos de respuesta a los andrógenos que podrían responder de manera diferencial a T y DHT. Por lo tanto, es posible que una secuencia selectiva de elementos de respuesta a los andrógenos pueda desempeñar un papel en la transactivación diferencial de AR T vs. DHT.
{{cite web}}: CS1 maint: bot: original URL status unknown (link){{cite web}}: CS1 maint: unfit URL (link)Aunque tanto la testosterona como la dihidrotestosterona activan el mismo receptor de andrógenos, las diferencias en la secuencia de elementos de respuesta a los andrógenos son responsables de la regulación diferencial de estas hormonas (21).
Los andrógenos, estrógenos y progestinas ejercen un efecto de retroalimentación negativa sobre la secreción de GnRH y LH por sus acciones sobre la hipófisis y el hipotálamo. La mayor parte del efecto de retroalimentación negativa de los andrógenos es causado por sus metabolitos estrogénicos producidos por aromatización. La 5α-reducción no parece ser necesaria para el efecto de retroalimentación negativa de la testosterona. (Rittmaster et al, 1992; Kumar et al, 1995a; Hayes et al, 2000).
En los últimos años, varios laboratorios (Kochakian, Albright, Wilkins) han abrigado la esperanza de encontrar un esteroide anabólico proteico sin efectos sexuales o con efectos menores. Estos estudios han recibido un impulso y un estímulo especiales a partir de la observación de Kochakian de que ciertos esteroides tienen mayores efectos renotróficos (¿anabólicos?) que androgénicos.
Sin embargo, una tercera gran búsqueda, para el desarrollo de un andrógeno no virilizante ("esteroide anabólico") adecuado para su uso en mujeres y niños, basada en disociar los efectos virilizantes de los anabólicos de los andrógenos, fracasó estrepitosamente (36). Ahora se entiende que este fracaso se debe al descubrimiento de un receptor de andrógenos (AR) singular junto con la interpretación errónea de bioensayos de andrógenos inespecíficos en animales completos empleados para distinguir entre efectos anabólicos y virilizantes (37). El término "andrógeno" se utiliza aquí tanto para los andrógenos endógenos como para los sintéticos, incluidas las referencias a sustancias químicas denominadas en otros lugares como "esteroides anabólicos", "esteroides anabólico-androgénicos" o "moduladores específicos de AR" (SARM), que siguen haciendo una distinción obsoleta y oxímoron entre los efectos virilizantes y anabólicos de los andrógenos cuando no hay diferencia (36).
Estos hallazgos también resaltan cuán obsoleto es el término "esteroide anabólico", cuando se lo distingue falsamente de "andrógeno", una dicotomía carente de significado fisiológico y que persiste principalmente como una piñata mediática.10
todos los andrógenos combinan propiedades anabólicas y androgénicas intrínsecas, que nunca se han separado significativamente [67], que se manifiestan a través del receptor de andrógenos, una proteína codificada por un gen de copia única. Por lo tanto, la singularidad de la acción de los andrógenos significa que los términos "esteroide anabólico" o "esteroides androgénicos-anabólicos" siguen siendo una terminología obsoleta que hace una distinción entre efectos androgénicos y anabólicos cuando no hay una diferencia real [67]. Esta terminología obsoleta pero ampliamente utilizada representa un vestigio de la búsqueda infructuosa de la industria farmacéutica para disociar las propiedades virilizantes de las anabólicas y permanece en la mente del público principalmente como una piñata mediática. El abuso de andrógenos, un término más apropiado que abarca el uso ilícito de todos los andrógenos disponibles, se utilizará en este capítulo.
Tras la pausa de la Segunda Guerra Mundial, el desarrollo de esteroides sintéticos por parte de la industria farmacéutica incluyó la búsqueda del objetivo de un andrógeno no virilizante ('esteroide anabólico') potencialmente adecuado para su uso para obtener efectos andrógenos farmacológicos en mujeres y niños. [...] la búsqueda industrial de un 'esteroide anabólico' basada en disociar los efectos virilizantes de los anabólicos de los andrógenos fracasó. Esto se entiende ahora a la luz del descubrimiento posterior del AR singular junto con las interpretaciones erróneas de bioensayos animales completos relativamente inespecíficos utilizados entonces para examinar esteroides sintéticos en busca de efectos anabólicos y virilizantes supuestamente distintos. Sin embargo, a pesar del abandono por parte de la industria de este esfuerzo infructuoso en 1980, y su reciente reencarnación bajo el disfraz de desarrollar un 'modulador selectivo de AR' (SARM) [6], el concepto vacío de un 'esteroide anabólico' persiste como una terminología científica mal definida y engañosa [7, 8]. En este artículo, se utiliza el término más preciso y claro "andrógeno" exclusivamente para los andrógenos endógenos y sintéticos, pero incluye referencias a sustancias químicas definidas vagamente en otros lugares como "esteroides anabólicos" o "esteroides anabólico-androgénicos", que confunden al hacer una distinción obsoleta donde no hay diferencia.
, comercializados como "moduladores selectivos del receptor de andrógenos" (SARM), ofrece nuevas posibilidades para la terapia farmacológica adyuvante con andrógenos. A diferencia del espectro completo de efectos andrógenos de la testosterona, estos SARM serían andrógenos puros no sujetos a activación tisular específica por aromatización a un estrógeno correspondiente o a la amplificación de la potencia androgénica por reducción de 5a. En este contexto, los andrógenos puros endógenos nandrolona y DHT pueden considerarse SARM prototipo. Los SARM no son la encarnación moderna de los llamados "esteroides anabólicos", un término obsoleto que se refiere a andrógenos no virilizantes hipotéticos pero inexistentes dirigidos exclusivamente al músculo, un concepto fallido que carece de prueba biológica de principio (Handelsman 2011).
La identificación de un único gen y proteína para el receptor de andrógenos en 1988 (584-586) explica la observación fisiológica de que, en dosis equivalentes, todos los andrógenos tienen efectos esencialmente similares (587). El término "esteroide anabólico" fue inventado Durante la era dorada de la farmacología de esteroides posterior a la Segunda Guerra Mundial, se intentó definir un andrógeno idealizado que careciera de características virilizantes pero que mantuviera propiedades miotrópicas para que pudiera usarse de manera segura en niños y mujeres. Aunque esta búsqueda resultó ilusoria y se abandonó después de que todos los esfuerzos de la industria fracasaran en identificar dicho andrógeno idealizado, un andrógeno sintético hipotético, el término obsoleto "esteroide anabólico" persiste principalmente como una descripción escabrosa en los medios populares a pesar de seguir haciendo una distinción falsa donde no hay diferencia. Una mejor comprensión de la activación metabólica de los andrógenos a través de la reducción 5α y la aromatización en los tejidos diana y las propiedades agonistas/antagonistas parciales específicas de los tejidos de algunos andrógenos sintéticos pueden conducir a conceptos más fisiológicos de la acción de los andrógenos específicos de los tejidos ("modulador específico del receptor de andrógenos"). ) gobernada por los procesos fisiológicos de activación de andrógenos prerreceptores así como la interacción postreceptor con proteínas correguladoras análogas al desarrollo de agonistas parciales de estrógenos sintéticos con especificidad tisular ("modulador específico del receptor de estrógeno") (588). Aún quedan por evaluar en su totalidad las nuevas indicaciones terapéuticas clínicas de los nuevos andrógenos selectivos de tejidos en desarrollo clínico (589).
Los esteroides anabólico-androgénicos (EAA) son una clase de hormonas naturales y sintéticas que deben su nombre a su estructura química (el núcleo esteroide, ver Figura 1) y los efectos biológicos (anabólicos y androgénicos) que inducen. Anabólico se refiere a las propiedades de desarrollo muscular esquelético de los EAA, mientras que androgénico se refiere a la inducción y mantenimiento de las características sexuales secundarias masculinas (que en principio incluye la acción anabólica, lo que convierte al término en un oxímoron (1)).