Luciferina (molécula)
Las luciferinas son compuestos que se utilizan para la obtención de luz en organismos bioluminiscentes.
A comienzos del siglo XVIII René Réaumur observó que el polvo seco y molido de organismos bioluminiscentes brillaba al ponerles en contacto con agua.
[1] Las siguientes investigaciones fueron realizadas por el estadounidense Edmund Newton Harvey a principio del Siglo XX.
Por último, cualquier sistema bioluminiscente requiere oxígeno, lo que ya había sido observado por Robert Boyle en el siglo XIX.
Dichos procesos se presentan en unos 17 grupos de insectos diferentes y en por lo menos unas 700 especies adicionales, en su gran mayoría marinas.
En algunos casos la fluorescencia no actúa como se espera, por ejemplo en estudios en vitro (en tubos de ensayo).
Así se emiten en el complejo enzima-luciferina durante la oxidación diferencias que las luciferinas libres al estímulo de la luz.
Los insectos bioluminiscentes se encuentran presentes en los cuatro órdenes Collembola, Hemiptera, Coleoptera y Diptera.
En coleoptera (escarabajos) se encuentran representantes que emiten luz de las familias: phengodidae, elateridae (elatéridos) así como Lampyridae (lampíridos).
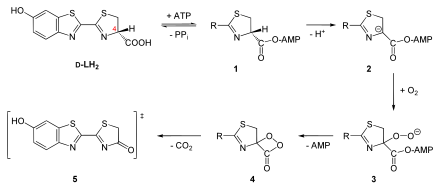
En la reacción, gracias a la luciferasa se transforma el sustrato D-Luciferina (LH2), un benzotiazol, bajo consumo de oxígeno.
Sin sustrato unido, las luciferasas están en una conformación abierta; una región con un aminoácido grande N-terminal y uno pequeño C-terminal forman un profundo surco.
Se sospecha que la molécula de luciferina tuvo lugar en caminos evolutivos posteriores y originó una reacción luminosa.
Debido a esta actividad catalítica extra pudo ser la luciferasa primitiva una CoA-ligasa de ácidos grasos largos.
Por el contrario los Diptera (Arachnocampa o Orfelia) no tienen ninguna característica igual a la luciferina de las luciérnagas.
[22] Las investigaciones del sistema lucifeina-luciferas comenzaron en los finales de 1950 en los dinoflagelados Lingulodinium polyedra por J.Woodland y sus cooperadores.
[28] Una luciferina con estructura casi idéntica se encontró en Euphausiidae (krill), por ejemplo en Meganyctiphanes norvegica o Euphausia pacifica.
Muchos peces de profundidad se encuentran como simbiontes en los fotóforos (photobacterium), que son órganos especiales.
Sin embargo al estar unida a la enzima se mejora la estabilidad y por medio de oxígeno sufre en la posición C4a un ataque nucleofílico.
La segunda clase la conforman las proteínas fluorescentes amarillas (YFPs), que se presentan como chromóforo FMN o riboflavina (P. fischeri Stamm Y-1).
Para la transferencia de energía vía FRET se necesita que en el complejo luciferina-luciferasa estén unidas proteínas fluorescentes.
Está presente en especies bioluminiscentes marinas, por ejemplo con integrantes de Cnidaria, Ctenophora, Mollusca, Arthropoda y Chordata.
En algunos casos está presente en organismos que no producen luz, pero en pequeñas cantidades como en Microcina prolifera, pero tampoco tiene luciferasa.
Sus derivados también son utilizados por múltiples organismos marinos.La coelenteracina sin modificar no es estable en soluciones acuosas neutrales, se oxida fácilmente por el oxígeno del aire.
Invesitgaciones bioquímicas sobre el sistema luciferina-luciferasa se condujeron a principios de siglo XX por Harvey.
[50][51] El Symplectoteuthis oualaniensis (nombre japonés Tobi-ika) es un calamar ampliamente distribuido en los océanos Pacífico e Índico.
[52] El calamar establece la Coelenteracina a través de una fotoproteína especial, que se le conoce como "simplectina".
La luciferina-Latia se cataliza a una cetona (oxy-luciferina) por una luciferasa (EC 1.14.99.21) de 173 kDa, incolora y no fluorescente.
[56] Para la reacción se utiliza junto con la luciferina, la luciferasa y oxígeno un cofactor, la proteína púrpura fluorescente.
[56] Para ello no es indispensable[57] ya que se le puede sustituir por ascorbato y NADH.
[58] Por consiguiente la mucosidad del caracol, que por ejemplo es secretada por estímulos mecánicos, brilla con tono verde oscuro.