Historia de la química
Sin embargo, a base de realizar experimentos y registrar sus resultados los alquimistas establecieron los cimientos para la química moderna.
Al mezclarse el cobre con estaño o arsénico intencionadamente se consiguieron metales de mejores cualidades, las aleaciones denominadas bronces.
Las sociedades antiguas usaban un reducido número de transformaciones químicas naturales como las fermentaciones del vino, la cerveza o la leche.
Varias civilizaciones diferentes coincidieron en muchos de estos conceptos, incluso entre culturas sin contacto, por ejemplo los filósofos griegos, indios, chinos y mayas consideraban que el agua, la tierra y el fuego eran elementos primarios, aunque cada una de estas culturas incluía uno o dos elementos diferentes más en su propio listado.
En la Grecia Clásica alrededor del 450 a. C. Empédocles afirmó que toda la materia estaba formada por cuatro sustancias elementales: tierra, fuego, aire y agua.
En los últimos siglos de la Edad Media, en torno a 1250, Alberto Magno consiguió aislar el arsénico, aunque sus compuestos eran ya conocidos desde la antigüedad.
La naturaleza esotérica y el vocabulario codificado de la alquimia al parecer servían sobre todo para ocultar que en realidad no tenían demasiadas certezas.
[50] En 1637 René Descartes publicó Discours de la méthode (El discurso del método), un ensayo que basa la investigación científica en los cálculos matemáticos y la desconfianza en los hechos no probados.
La ley describe la relación inversamente proporcional que existe entre la presión y el volumen de un gas, si se mantiene constante la temperatura en un sistema cerrado.
Un hecho sin precedentes desde la antigüedad, ya que en los dos milenios anteriores se habían descubierto solo cinco (arsénico, antimonio, zinc,[59] bismuto y fósforo).
Alrededor de 1735 el químico sueco Georg Brandt analizó un pigmento azul oscuro encontrado en la mena del cobre descubriendo lo que posteriormente conoceríamos como cobalto.
Como se indicó en el apartado anterior, en Reflexions sur le Phlogistique (1783) Lavoisier refutó la teoría del flogisto para la combustión.
En 1775 Volta perfeccionó y popularizó el electróforo, un dispositivo con dos discos metálicos separados por un conductor húmedo, pero unidos con un circuito exterior, capaz de producir electricidad estática.
Esto se conoce como la Ley de las proporciones múltiples y fue incluida en su obra New System of Chemical Philosophy.
[90] Davy mandó una carta el 10 de diciembre a la Royal Society of London donde afirmaba que había identificado un nuevo elemento.
Gay-Lussac también participó junto a su colega profesor en la École Polytechnique, Louis Jacques Thénard, en las primeras investigaciones electroquímicas, y analizó los elementos descubiertos por este medio.
En 1856, William Henry Perkin, con 18 años, desafiado por su profesor August Wilhelm von Hofmann intentaba sintetizar, usando como precursor alquitrán de hulla, la quinina, el medicamento contra la malaria, que hasta entonces era escasa por ser un producto natural.
Además su amigo Angelo Pavesi distribuyó su folleto entre todos los asistentes al final de la reunión, cuya lectura convenció definitivamente a la mayoría.
Demostró que los rayos catódicos se desplazaban en líneas rectas y producían fosforescencia al chocar con determinadas sustancias (luego estaban formados por partículas materiales cargadas negativamente).
Actualmente se sabe que gran parte de los compuestos orgánicos contienen estructuras cíclicas como el benceno, denominadas aromáticas.
En 1864 John Newlands propuso la ley de las octavas y el mismo año Lothar Meyer desarrolló otra clasificación con 28 elementos organizados según su valencia.
Este principio sería ampliado al año siguiente por Henry Louis Le Châtelier, incluyendo los cambios de volumen y presión.
Esta regla denominado principio de Le Chatelier, explica los efectos que ejercen las influencias externas sobre la dinámica del equilibrio químico.
[111] En 1903, el botánico ruso Mijaíl Tsvet inventó la cromatografía, una técnica trascendental para la química analítica, con la intención de separar sustancias contenidas en las plantas.
Si los átomos de oro se ajustaban a este modelo las partículas α los atravesarían sin desviarse o haciéndolo pocos grados.
[112] En el modelo de Bohr los electrones giran en órbitas circulares alrededor del núcleo en niveles cuantizados, es decir, solo determinados radios estaban permitidos.
En los años siguientes se fueron acumulando progresos con los trabajos de Edward Teller, Friedrich Hund, Robert S. Mulliken, Max Born, J. Robert Oppenheimer, Linus Pauling, Erich Hückel, Douglas Hartree, Vladimir Aleksandrovich Fock, entre otros, que dilucidaron que las propiedades químicas estaban determinadas por las estructuras electrónicas de los átomos y sus compuestos.
La indagación relativa a fusión controlada con fines civiles se inició en la década de 1950, y continúa hasta el presente.
Aunque la clorofila había sido aislada en 1817 por los químicos franceses Pelletier y Caventou,[124] su estructura no fue deducida hasta 1940 por Hans Fischer.
[138] En 1991 Sumio Iijima usó el microscopio electrónico para descubrir un tipo de fullereno cilíndrico denominado nanotubo, aunque los primeros trabajos en este campo se habían realizado en 1951.






 fuego •
fuego •
 tierra •
tierra •
 aire •
aire •
 agua
agua
en relación con sus propiedades y los demás elementos.























Clave de colores:
carbono
•
oxígeno
nitrógeno
•
hidrógeno
















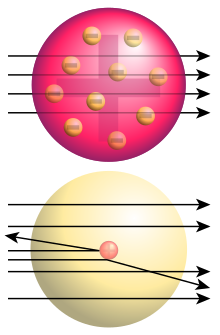
Arriba: el resultado previsto si hubiera sido válido el modelo atómico de Thomson . Abajo: el resultado del experimento que demostró la existencia de un núcleo central positivo en el átomo.