Una vacuna es una preparación biológica que proporciona inmunidad adquirida activa contra una enfermedad infecciosa o maligna particular . [1] [2] La seguridad y eficacia de las vacunas ha sido ampliamente estudiada y verificada. [3] [4] Una vacuna generalmente contiene un agente que se asemeja a un microorganismo que causa enfermedades y, a menudo, se elabora a partir de formas debilitadas o muertas del microbio, sus toxinas o una de sus proteínas de superficie. El agente estimula el sistema inmunológico del cuerpo para que lo reconozca como una amenaza, lo destruya y reconozca y destruya cualquiera de los microorganismos asociados con ese agente que pueda encontrar en el futuro.
Las vacunas pueden ser profilácticas (para prevenir o paliar los efectos de una futura infección por un patógeno natural o "salvaje" ), o terapéuticas (para combatir una enfermedad ya producida, como el cáncer ). [5] [6] [7] [8] Algunas vacunas ofrecen inmunidad esterilizante total , en la que la infección se previene por completo. [9]
La administración de vacunas se llama vacunación . La vacunación es el método más eficaz para prevenir enfermedades infecciosas; [10] La inmunidad generalizada debida a la vacunación es en gran medida responsable de la erradicación mundial de la viruela y de la restricción de enfermedades como la polio , el sarampión y el tétanos en gran parte del mundo. La Organización Mundial de la Salud (OMS) informa que actualmente hay vacunas autorizadas disponibles para veinticinco infecciones prevenibles diferentes . [11]
El primer uso registrado de la inoculación para prevenir la viruela se produjo en el siglo XVI en China, y los primeros indicios de esta práctica en China se produjeron durante el siglo X. [12] También fue la primera enfermedad para la que se produjo una vacuna. [13] [14] La práctica popular de la inoculación contra la viruela fue traída de Turquía a Gran Bretaña en 1721 por Lady Mary Wortley Montagu . [15] Los términos vacuna y vacunación se derivan de Variolae vaccinae (viruela de la vaca), el término ideado por Edward Jenner (quienes desarrollaron el concepto de vacunas y crearon la primera vacuna) para denotar la viruela vacuna . Usó la frase en 1798 para el título largo de su Investigación sobre las Variolae vaccinae conocidas como viruela vacuna , en la que describió el efecto protector de la viruela vacuna contra la viruela. [16] En 1881, en honor a Jenner, Louis Pasteur propuso que los términos deberían ampliarse para cubrir las nuevas inoculaciones protectoras que se estaban desarrollando en ese momento. [17] La ciencia del desarrollo y producción de vacunas se denomina vacunología .


Existe un consenso científico abrumador de que las vacunas son una forma muy segura y eficaz de combatir y erradicar las enfermedades infecciosas. [19] [20] [21] [22] El sistema inmunológico reconoce los agentes vacunales como extraños, los destruye y los "recuerda". Cuando se encuentra la versión virulenta de un agente, el cuerpo reconoce la cubierta proteica del agente y, por lo tanto, está preparado para responder, primero neutralizando el agente objetivo antes de que pueda ingresar a las células y, segundo, reconociendo y destruyendo las células infectadas antes que ese agente. puede multiplicarse en grandes cantidades. [23] [24]
Sin embargo, existen limitaciones a su eficacia. [25] A veces, la protección falla por razones relacionadas con la vacuna, como fallas en la atenuación de la vacuna, los regímenes de vacunación o la administración. [26]
La falla también puede ocurrir por razones relacionadas con el huésped si el sistema inmunológico del huésped no responde adecuadamente o no responde en absoluto. Se estima que entre el 2% y el 10% de los individuos carecen de respuesta relacionada con el huésped, debido a factores que incluyen la genética, el estado inmunológico, la edad, la salud y el estado nutricional. [26] Un tipo de trastorno de inmunodeficiencia primaria que resulta en falla genética es la agammaglobulinemia ligada al cromosoma X , en la cual la ausencia de una enzima esencial para el desarrollo de las células B impide que el sistema inmunológico del huésped genere anticuerpos contra un patógeno . [27] [28]
Las interacciones huésped-patógeno y las respuestas a la infección son procesos dinámicos que involucran múltiples vías en el sistema inmunológico. [29] [30] Un huésped no desarrolla anticuerpos instantáneamente: mientras que la inmunidad innata del cuerpo puede activarse en tan solo doce horas, la inmunidad adaptativa puede tardar entre 1 y 2 semanas en desarrollarse por completo. Durante ese tiempo, el huésped aún puede infectarse. [31]
Una vez que se producen los anticuerpos, pueden promover la inmunidad de varias maneras, según la clase de anticuerpos involucrados. Su éxito en eliminar o inactivar un patógeno dependerá de la cantidad de anticuerpos producidos y del grado en que esos anticuerpos sean efectivos para contrarrestar la cepa del patógeno involucrado, ya que diferentes cepas pueden ser de manera diferente susceptibles a una reacción inmune determinada. [30] En algunos casos, las vacunas pueden dar lugar a una protección inmunitaria parcial (en la que la inmunidad es menos del 100% efectiva pero aun así reduce el riesgo de infección) o en una protección inmunitaria temporal (en la que la inmunidad disminuye con el tiempo) en lugar de una inmunidad total o permanente. Aún pueden elevar el umbral de reinfección para la población en su conjunto y tener un impacto sustancial. [32] También pueden mitigar la gravedad de la infección, lo que resulta en una menor tasa de mortalidad , menor morbilidad , una recuperación más rápida de la enfermedad y una amplia gama de otros efectos. [33] [34]
Las personas mayores suelen mostrar menos respuesta que los más jóvenes, un patrón conocido como inmunosenescencia . [35] Los adyuvantes se utilizan comúnmente para estimular la respuesta inmune, particularmente en personas mayores cuya respuesta inmune a una vacuna simple puede haberse debilitado. [36]
La eficacia o rendimiento de la vacuna depende de varios factores:
Si un individuo vacunado desarrolla la enfermedad contra la que está vacunado ( infección irruptiva ), es probable que la enfermedad sea menos virulenta que en los casos no vacunados. [38]
Consideraciones importantes en un programa de vacunación eficaz: [39]
En 1958, hubo 763.094 casos de sarampión en Estados Unidos; Se produjeron 552 muertes. [40] [41] Después de la introducción de nuevas vacunas, el número de casos se redujo a menos de 150 por año (mediana de 56). [41] A principios de 2008, había 64 casos sospechosos de sarampión. Cincuenta y cuatro de esas infecciones estuvieron asociadas con la importación de otro país, aunque en realidad sólo el trece por ciento se adquirieron fuera de los Estados Unidos; 63 de los 64 individuos nunca habían sido vacunados contra el sarampión o no estaban seguros de si lo habían sido. [41]
Las vacunas condujeron a la erradicación de la viruela , una de las enfermedades más contagiosas y mortales en humanos. [42] Otras enfermedades como la rubéola, la polio , el sarampión, las paperas, la varicela y la fiebre tifoidea no son tan comunes como lo eran hace cien años gracias a los programas de vacunación generalizados. Mientras la gran mayoría de las personas estén vacunadas, es mucho más difícil que se produzca un brote de enfermedad, y mucho menos se propague. Este efecto se llama inmunidad colectiva . La polio, que se transmite sólo entre humanos, es el objetivo de una extensa campaña de erradicación que ha restringido la polio endémica a sólo partes de tres países (Afganistán, Nigeria y Pakistán). [43] Sin embargo, la dificultad de llegar a todos los niños, los malentendidos culturales y la desinformación han hecho que se pierda varias veces la fecha prevista de erradicación. [44] [45] [46] [47]
Las vacunas también ayudan a prevenir el desarrollo de resistencia a los antibióticos. Por ejemplo, al reducir en gran medida la incidencia de la neumonía causada por Streptococcus pneumoniae , los programas de vacunación han reducido en gran medida la prevalencia de infecciones resistentes a la penicilina u otros antibióticos de primera línea. [48]
Se estima que la vacuna contra el sarampión previene un millón de muertes cada año. [49]
Las vacunas administradas a niños, adolescentes o adultos generalmente son seguras. [50] [51] Los efectos adversos, si los hay, generalmente son leves. [52] La tasa de efectos secundarios depende de la vacuna en cuestión. [52] Algunos efectos secundarios comunes incluyen fiebre, dolor alrededor del lugar de la inyección y dolores musculares. [52] Además, algunas personas pueden ser alérgicas a los ingredientes de la vacuna. [53] La vacuna MMR rara vez se asocia con convulsiones febriles . [51]
Los determinantes relacionados con el huésped ("vacunado") que hacen que una persona sea susceptible a la infección, como la genética , el estado de salud (enfermedad subyacente, nutrición, embarazo, sensibilidades o alergias ), la competencia inmune , la edad y el impacto económico o el entorno cultural pueden ser Factores primarios o secundarios que afectan la gravedad de la infección y la respuesta a una vacuna. [26] Las personas mayores (mayores de 60 años), hipersensibles a los alérgenos y obesas tienen susceptibilidad a una inmunogenicidad comprometida, lo que previene o inhibe la eficacia de la vacuna, lo que posiblemente requiera tecnologías de vacunas separadas para estas poblaciones específicas o vacunas de refuerzo repetitivas para limitar la transmisión del virus . [26]
Los efectos secundarios graves son extremadamente raros. [51] La vacuna contra la varicela rara vez se asocia con complicaciones en personas inmunodeficientes , y las vacunas contra el rotavirus se asocian moderadamente con la intususcepción . [51]
Al menos 19 países tienen programas de compensación sin culpa para compensar a quienes sufren efectos adversos graves de la vacunación. [54] El programa de los Estados Unidos se conoce como Ley Nacional sobre Lesiones por Vacunas en la Infancia , y el Reino Unido emplea el Pago por Daños por Vacunas .

Las vacunas suelen contener organismos atenuados, inactivados o muertos o productos purificados derivados de ellos. Hay varios tipos de vacunas en uso. [55] Estos representan diferentes estrategias utilizadas para tratar de reducir el riesgo de enfermedad manteniendo al mismo tiempo la capacidad de inducir una respuesta inmune beneficiosa.
Algunas vacunas contienen microorganismos vivos atenuados . Muchos de estos son virus activos que han sido cultivados en condiciones que desactivan sus propiedades virulentas, o que utilizan organismos estrechamente relacionados pero menos peligrosos para producir una respuesta inmune amplia. Aunque la mayoría de las vacunas atenuadas son virales, algunas son de naturaleza bacteriana. Los ejemplos incluyen las enfermedades virales fiebre amarilla , sarampión , paperas y rubéola , y la enfermedad bacteriana tifoidea . La vacuna viva contra Mycobacterium tuberculosis desarrollada por Calmette y Guérin no está hecha de una cepa contagiosa , sino que contiene una cepa modificada virulentamente llamada " BCG " que se utiliza para provocar una respuesta inmune a la vacuna. Para la inmunización contra la peste se utiliza la vacuna viva atenuada que contiene la cepa Yersinia pestis EV. Las vacunas atenuadas tienen algunas ventajas y desventajas. Las vacunas atenuadas o vivas debilitadas suelen provocar respuestas inmunológicas más duraderas. Pero es posible que no sean seguros para su uso en personas inmunocomprometidas y, en raras ocasiones, mutan a una forma virulenta y causan enfermedades. [56]
Algunas vacunas contienen microorganismos inactivados, pero previamente virulentos, que han sido destruidos con productos químicos, calor o radiación [57] : "fantasmas", con envolturas celulares bacterianas intactas pero vacías. Se consideran una fase intermedia entre las vacunas inactivadas y atenuadas. [58] Los ejemplos incluyen IPV ( vacuna contra la polio ), vacuna contra la hepatitis A , vacuna contra la rabia y la mayoría de las vacunas contra la influenza . [59]

Las vacunas toxoides se elaboran a partir de compuestos tóxicos inactivados que causan la enfermedad en lugar del microorganismo. [60] Ejemplos de vacunas basadas en toxoides incluyen el tétanos y la difteria . [59] No todos los toxoides son para microorganismos; por ejemplo, el toxoide Crotalus atrox se utiliza para vacunar a los perros contra las picaduras de serpientes de cascabel . [61]
En lugar de introducir un microorganismo inactivado o atenuado en un sistema inmunológico (lo que constituiría una vacuna de "agente completo"), una vacuna de subunidad utiliza un fragmento del mismo para crear una respuesta inmune. Un ejemplo es la vacuna subunitaria contra la hepatitis B , que se compone únicamente de las proteínas de superficie del virus (anteriormente extraídas del suero sanguíneo de pacientes con infección crónica pero ahora producidas por recombinación de genes virales en levaduras ). [62] Otro ejemplo son las vacunas de algas comestibles , como la vacuna de partículas similares a virus (VLP) contra el virus del papiloma humano (VPH), que está compuesta por la proteína de la cápside principal del virus . [63] Otro ejemplo son las subunidades de hemaglutinina y neuraminidasa del virus de la influenza . [59] Se está utilizando una vacuna subunitaria para la inmunización contra la peste. [64]
Ciertas bacterias tienen una capa exterior de polisacárido que es poco inmunogénica . Al vincular estas capas externas a proteínas (p. ej., toxinas), se puede hacer que el sistema inmunológico reconozca el polisacárido como si fuera un antígeno proteico. Este enfoque se utiliza en la vacuna contra Haemophilus influenzae tipo B. [sesenta y cinco]
Las vesículas de membrana externa (OMV) son naturalmente inmunogénicas y pueden manipularse para producir vacunas potentes. Las vacunas OMV más conocidas son las desarrolladas para la enfermedad meningocócica del serotipo B. [66] [67]
Las vacunas heterólogas, también conocidas como "vacunas jennerianas", son vacunas que son patógenas de otros animales y que no causan enfermedad o causan una enfermedad leve en el organismo que se está tratando. El ejemplo clásico es el uso que hace Jenner de la viruela vacuna para protegerse contra la viruela. Un ejemplo actual es el uso de la vacuna BCG elaborada a partir de Mycobacterium bovis para proteger contra la tuberculosis . [68]
Las vacunas genéticas se basan en el principio de la absorción de un ácido nucleico por las células, tras lo cual se produce una proteína según el molde de ácido nucleico. Esta proteína suele ser el antígeno inmunodominante del patógeno o una proteína de superficie que permite la formación de anticuerpos neutralizantes. El subgrupo de vacunas genéticas abarca las vacunas de vectores virales, las vacunas de ARN y las vacunas de ADN. [ cita necesaria ]
Las vacunas de vectores virales utilizan un virus seguro para insertar genes patógenos en el cuerpo para producir antígenos específicos , como proteínas de superficie , para estimular una respuesta inmune . [69] [70]
Una vacuna de ARNm (o vacuna de ARN ) es un nuevo tipo de vacuna que se compone de ARN de ácido nucleico, empaquetado dentro de un vector como nanopartículas lipídicas . [71] Entre las vacunas contra la COVID-19 se encuentran varias vacunas de ARN para combatir la pandemia de COVID-19 y algunas han sido aprobadas o han recibido autorización de uso de emergencia en algunos países. Por ejemplo, la vacuna Pfizer-BioNTech y la vacuna de ARNm de Moderna están aprobadas para su uso en adultos y niños en EE. UU. [72] [73] [74]
Una vacuna de ADN utiliza un plásmido de ADN (pDNA) que codifica una proteína antigénica que se origina en el patógeno al que se dirigirá la vacuna. El pDNA es económico, estable y relativamente seguro, lo que lo convierte en una excelente opción para la administración de vacunas. [75]
Este enfoque ofrece una serie de ventajas potenciales sobre los enfoques tradicionales, incluida la estimulación de las respuestas de las células B y T, una mayor estabilidad de la vacuna, la ausencia de cualquier agente infeccioso y la relativa facilidad de fabricación a gran escala. [76]
También se están desarrollando y utilizando muchas vacunas innovadoras.
Si bien la mayoría de las vacunas se crean utilizando compuestos inactivados o atenuados de microorganismos, las vacunas sintéticas se componen principal o totalmente de péptidos, carbohidratos o antígenos sintéticos.
Las vacunas pueden ser monovalentes (también llamadas univalentes ) o multivalentes (también llamadas polivalentes ). Una vacuna monovalente está diseñada para inmunizar contra un único antígeno o un único microorganismo. [82] Una vacuna multivalente o polivalente está diseñada para inmunizar contra dos o más cepas del mismo microorganismo, o contra dos o más microorganismos. [83] La valencia de una vacuna multivalente puede indicarse con un prefijo griego o latino (p. ej., bivalente , trivalente o tetravalente/cuadrivalente ). En ciertos casos, puede ser preferible una vacuna monovalente para desarrollar rápidamente una respuesta inmune fuerte. [84]
Cuando se mezclan dos o más vacunas en la misma formulación, las dos vacunas pueden interferir. Esto ocurre con mayor frecuencia con las vacunas vivas atenuadas, donde uno de los componentes de la vacuna es más robusto que los demás y suprime el crecimiento y la respuesta inmune a los otros componentes. [85]
Este fenómeno fue por primera vez [ ¿cuándo? ] señaló en la vacuna trivalente contra la polio Sabin , donde la cantidad de virus de serotipo 2 en la vacuna tuvo que reducirse para evitar que interfiriera con la "toma" de los virus de serotipo 1 y 3 en la vacuna. [86] También se observó en un estudio de 2001 que había un problema con las vacunas contra el dengue , donde se encontró que el serotipo DEN-3 predominaba y suprimía la respuesta a los serotipos DEN-1, -2 y -4. [87]

Las vacunas suelen contener uno o más adyuvantes , que se utilizan para estimular la respuesta inmunitaria. El toxoide tetánico, por ejemplo, suele adsorberse en el alumbre . Éste presenta el antígeno de tal manera que produce una acción mayor que el toxoide tetánico acuoso simple. Las personas que tienen una reacción adversa al toxoide tetánico absorbido pueden recibir la vacuna simple cuando llegue el momento de un refuerzo. [88]
En la preparación para la campaña del Golfo Pérsico de 1990, se utilizó la vacuna de células enteras contra la tos ferina como adyuvante de la vacuna contra el ántrax . Esto produce una respuesta inmunitaria más rápida que administrar sólo la vacuna contra el ántrax, lo que supone cierto beneficio si la exposición puede ser inminente. [89]
Las vacunas también pueden contener conservantes para evitar la contaminación con bacterias u hongos . Hasta hace poco, el conservante tiomersal ( también conocido como Timerosal en EE. UU. y Japón) se utilizaba en muchas vacunas que no contenían virus vivos. En 2005, la única vacuna infantil en los EE. UU. que contiene tiomersal en cantidades superiores a las mínimas es la vacuna contra la influenza, [90] que actualmente se recomienda sólo para niños con ciertos factores de riesgo. [91] Las vacunas contra la influenza de dosis única suministradas en el Reino Unido no incluyen tiomersal entre sus ingredientes. Los conservantes pueden utilizarse en diversas etapas de la producción de vacunas, y los métodos de medición más sofisticados pueden detectar trazas de ellos en el producto terminado, así como en el medio ambiente y en la población en su conjunto. [92]
Muchas vacunas necesitan conservantes para prevenir efectos adversos graves, como la infección por estafilococos , que en un incidente de 1928 mató a 12 de 21 niños inoculados con una vacuna contra la difteria que carecía de conservantes. [93] Hay varios conservantes disponibles, incluidos tiomersal, fenoxietanol y formaldehído . El tiomersal es más eficaz contra las bacterias, tiene una mejor vida útil y mejora la estabilidad, potencia y seguridad de la vacuna; pero en Estados Unidos, la Unión Europea y algunos otros países ricos ya no se utiliza como conservante en las vacunas infantiles, como medida de precaución debido a su contenido de mercurio . [94] Aunque se han hecho afirmaciones controvertidas de que el tiomersal contribuye al autismo , ninguna evidencia científica convincente respalda estas afirmaciones. [95] Además, un estudio de 10 a 11 años de duración de 657,461 niños encontró que la vacuna triple vírica no causa autismo y en realidad redujo el riesgo de autismo en un siete por ciento. [96] [97]
Además de la vacuna activa en sí, los siguientes excipientes y compuestos residuales de fabricación están presentes o pueden estar presentes en las preparaciones de vacunas: [98]
Se han desarrollado varias abreviaturas bastante estandarizadas para los nombres de las vacunas, aunque la estandarización no es de ninguna manera centralizada ni global. Por ejemplo, los nombres de las vacunas utilizadas en Estados Unidos tienen abreviaturas bien establecidas que también son ampliamente conocidas y utilizadas en otros lugares. Una lista extensa de ellos proporcionada en una tabla ordenable y de libre acceso está disponible en la página web de los Centros para el Control y la Prevención de Enfermedades de EE. UU. [100] La página explica que "Las abreviaturas [en] esta tabla (Columna 3) fueron estandarizadas conjuntamente por el personal de los Centros para el Control y la Prevención de Enfermedades, los Grupos de Trabajo del ACIP , el editor del Informe Semanal de Morbilidad y Mortalidad (MMWR), el editor de Epidemiología y Prevención de Enfermedades Prevenibles por Vacunación (el Libro Rosa), miembros del ACIP y organizaciones de enlace con el ACIP". [100]
Algunos ejemplos son " DTaP " para los toxoides diftérico y tetánico y la vacuna acelular contra la tos ferina, "DT" para los toxoides diftérico y tetánico y "Td" para los toxoides tetánico y diftérico. En su página sobre la vacunación contra el tétanos, [101] los CDC explican además que "las letras mayúsculas en estas abreviaturas indican dosis completas de toxoides contra la difteria (D) y el tétanos (T) y la vacuna contra la tos ferina (P). Minúsculas " d" y "p" denotan dosis reducidas de difteria y tos ferina utilizadas en formulaciones para adolescentes y adultos. La 'a' en DTaP y Tdap significa 'acelular', lo que significa que el componente de tos ferina contiene solo una parte del organismo de la tos ferina. " [101]
Otra lista de abreviaturas de vacunas establecidas se encuentra en la página de los CDC llamada "Acrónimos y abreviaturas de vacunas", con abreviaturas utilizadas en los registros de vacunación de EE. UU. [102] El sistema de nombres adoptados de los Estados Unidos tiene algunas convenciones para el orden de las palabras de los nombres de las vacunas, colocando los sustantivos principales primero y los adjetivos en posición pospositiva . Esta es la razón por la que la USAN para " OPV " es "vacuna contra la poliovirus viva oral" en lugar de "vacuna contra la poliovirus oral".
La licencia de una vacuna se produce después de la conclusión exitosa del ciclo de desarrollo y de la continuación de los ensayos clínicos y otros programas involucrados a través de las Fases I a III que demuestran seguridad, inmunoactividad, seguridad inmunogenética en una dosis específica determinada, efectividad comprobada en la prevención de infecciones para las poblaciones objetivo y durabilidad. efecto preventivo (se debe estimar el tiempo de resistencia o la necesidad de revacunación). [103] Debido a que las vacunas preventivas se evalúan predominantemente en cohortes de población sana y se distribuyen entre la población general, se requiere un alto estándar de seguridad. [104] Como parte de una concesión de licencia multinacional para una vacuna, el Comité de Expertos en Normalización Biológica de la Organización Mundial de la Salud desarrolló directrices de normas internacionales para la fabricación y el control de calidad de vacunas, un proceso pensado como plataforma para que las agencias reguladoras nacionales soliciten sus propias vacunas. proceso de concesión de licencias. [103] Los fabricantes de vacunas no reciben licencia hasta que un ciclo clínico completo de desarrollo y ensayos demuestre que la vacuna es segura y tiene eficacia a largo plazo, tras una revisión científica realizada por una organización reguladora nacional o multinacional, como la Agencia Europea de Medicamentos (EMA). o la Administración de Medicamentos y Alimentos de EE. UU. (FDA). [105] [106]
Una vez que los países en desarrollo adoptan las directrices de la OMS para el desarrollo y la licencia de vacunas, cada país tiene su propia responsabilidad de emitir una licencia nacional y de gestionar, implementar y monitorear la vacuna durante su uso en cada nación. [103] Generar confianza y aceptación de una vacuna autorizada entre el público es una tarea de comunicación por parte de los gobiernos y el personal de atención médica para garantizar que la campaña de vacunación se desarrolle sin problemas, salve vidas y permita la recuperación económica. [107] [108] Cuando se autoriza una vacuna, inicialmente tendrá un suministro limitado debido a factores variables de fabricación, distribución y logística, lo que requerirá un plan de asignación para el suministro limitado y qué segmentos de la población deben tener prioridad para recibir primero la vacuna. . [107]
Las vacunas desarrolladas para distribución multinacional a través del Fondo de las Naciones Unidas para la Infancia (UNICEF) requieren una calificación previa por parte de la OMS para garantizar estándares internacionales de calidad, seguridad, inmunogenicidad y eficacia para su adopción por numerosos países. [103]
El proceso requiere consistencia en la fabricación en laboratorios contratados por la OMS que sigan buenas prácticas de fabricación (GMP). [103] Cuando las agencias de la ONU participan en la concesión de licencias de vacunas, las naciones individuales colaboran 1) emitiendo una autorización de comercialización y una licencia nacional para la vacuna, sus fabricantes y socios de distribución; y 2) realizar vigilancia poscomercialización , incluidos registros de eventos adversos después del programa de vacunación. La OMS trabaja con agencias nacionales para monitorear las inspecciones de las instalaciones de fabricación y los distribuidores para verificar el cumplimiento de las BPF y la supervisión regulatoria. [103]
Algunos países optan por comprar vacunas autorizadas por organizaciones nacionales acreditadas, como la EMA, la FDA o agencias nacionales de otros países ricos, pero dichas compras suelen ser más caras y es posible que no cuenten con recursos de distribución adecuados a las condiciones locales de los países en desarrollo. [103]
En la Unión Europea (UE), las vacunas contra patógenos pandémicos, como la influenza estacional , tienen licencia en toda la UE donde todos los estados miembros cumplen ("centralizadas"), tienen licencia solo para algunos estados miembros ("descentralizadas") o están Licenciado a nivel nacional individual. [105] En general, todos los estados de la UE siguen las directrices reglamentarias y los programas clínicos definidos por el Comité Europeo de Medicamentos de Uso Humano (CHMP), un panel científico de la Agencia Europea de Medicamentos (EMA) responsable de la aprobación de vacunas. [105] El CHMP cuenta con el apoyo de varios grupos de expertos que evalúan y supervisan el progreso de una vacuna antes y después de su autorización y distribución. [105]
Según la FDA, el proceso de establecimiento de evidencia de seguridad y eficacia clínica de las vacunas es el mismo que el proceso de aprobación de medicamentos recetados . [109] Si tiene éxito en las etapas de desarrollo clínico, al proceso de concesión de licencia de la vacuna le sigue una Solicitud de Licencia de Productos Biológicos que debe proporcionar un equipo de revisión científica (de diversas disciplinas, como médicos, estadísticos, microbiólogos, químicos) y documentación completa para el candidato vacunal que tenga eficacia y seguridad durante todo su desarrollo. También durante esta etapa, revisores expertos examinan la instalación de fabricación propuesta para verificar el cumplimiento de las GMP, y la etiqueta debe tener una descripción compatible para permitir que los proveedores de atención médica definan el uso específico de la vacuna, incluidos sus posibles riesgos, para comunicar y administrar la vacuna. para el publico. [109] Después de la licencia, el seguimiento de la vacuna y su producción, incluidas las inspecciones periódicas para comprobar el cumplimiento de las BPF, continúa mientras el fabricante conserve su licencia, lo que puede incluir presentaciones adicionales a la FDA de pruebas de potencia, seguridad y pureza para cada vacuna. Paso de fabricación de vacunas. [109]
El Contralor General de Medicamentos de la India es el jefe del departamento de la Organización Central de Control de Estándares de Medicamentos del Gobierno de la India, responsable de la aprobación de licencias de categorías específicas de medicamentos, como vacunas Y otros como sangre y productos sanguíneos, líquidos intravenosos y sueros en la India. . [110]
Hasta que se utilice una vacuna para la población general, es posible que no se conozcan todos los posibles efectos adversos de la vacuna, lo que obligará a los fabricantes a realizar estudios de fase IV para la vigilancia poscomercialización de la vacuna mientras se utiliza ampliamente entre el público. [103] [109] La OMS trabaja con los estados miembros de la ONU para implementar la vigilancia posterior a la concesión de licencias. [103] La FDA se basa en un sistema de notificación de eventos adversos a las vacunas para monitorear las preocupaciones de seguridad sobre una vacuna durante su uso en el público estadounidense. [109]
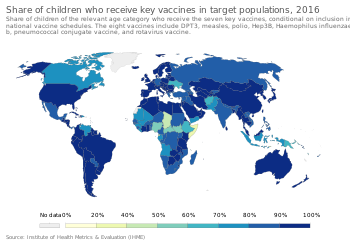
Para brindar la mejor protección, se recomienda que los niños reciban vacunas tan pronto como su sistema inmunológico esté lo suficientemente desarrollado para responder a determinadas vacunas, y a menudo se requieren inyecciones adicionales de "refuerzo" para lograr la "inmunidad total". Esto ha llevado al desarrollo de calendarios de vacunación complejos. Las recomendaciones globales sobre el calendario de vacunación son emitidas por un Grupo Asesor Estratégico de Expertos y serán traducidas por un comité asesor a nivel nacional teniendo en cuenta factores locales como la epidemiología de la enfermedad, la aceptabilidad de la vacunación, la equidad en las poblaciones locales y las limitaciones programáticas y financieras. [111] En los Estados Unidos, el Comité Asesor sobre Prácticas de Inmunización , que recomienda adiciones al calendario de los Centros para el Control y la Prevención de Enfermedades , recomienda la vacunación rutinaria de los niños contra [112] la hepatitis A , la hepatitis B , la polio, las paperas, el sarampión y la rubéola. , difteria , tos ferina , tétanos , HiB , varicela , rotavirus , influenza , enfermedad meningocócica y neumonía . [113]
El gran número de vacunas y refuerzos recomendados (hasta 24 inyecciones a los dos años) ha generado problemas para lograr un cumplimiento total. Para combatir la disminución de las tasas de cumplimiento, se han instituido varios sistemas de notificación y ahora se comercializan muchas inyecciones combinadas (por ejemplo, la vacuna pentavalente y la vacuna MMRV ), que protegen contra múltiples enfermedades.
Además de las recomendaciones sobre vacunas y refuerzos infantiles, se recomiendan muchas vacunas específicas para otras edades o para inyecciones repetidas a lo largo de la vida, más comúnmente contra el sarampión, el tétanos, la influenza y la neumonía. Las mujeres embarazadas suelen ser sometidas a pruebas de detección de resistencia continua a la rubéola. La vacuna contra el virus del papiloma humano se recomienda en EE. UU. (a partir de 2011) [114] y el Reino Unido (a partir de 2009). [115] Las recomendaciones de vacunas para las personas mayores se concentran en la neumonía y la influenza, que son más mortales para ese grupo. En 2006 se introdujo una vacuna contra el herpes zóster , una enfermedad causada por el virus de la varicela, que suele afectar a las personas mayores. [116]
La programación y la dosificación de una vacuna se pueden adaptar al nivel de inmunocompetencia de un individuo [117] y para optimizar el despliegue de una vacuna en toda la población cuando su suministro es limitado, [118] por ejemplo, en el contexto de una pandemia.
Un desafío en el desarrollo de vacunas es económico: muchas de las enfermedades que más exigen una vacuna, incluidas el VIH , la malaria y la tuberculosis, existen principalmente en los países pobres. Las empresas farmacéuticas y de biotecnología tienen pocos incentivos para desarrollar vacunas para estas enfermedades porque hay poco potencial de ingresos. Incluso en los países más ricos, los rendimientos financieros suelen ser mínimos y los riesgos financieros y de otro tipo, grandes. [119]
La mayor parte del desarrollo de vacunas hasta la fecha se ha basado en financiación "de impulso" por parte del gobierno, universidades y organizaciones sin fines de lucro. [120] Muchas vacunas han sido muy rentables y beneficiosas para la salud pública . [121] El número de vacunas realmente administradas ha aumentado dramáticamente en las últimas décadas. [122] Este aumento, particularmente en el número de diferentes vacunas administradas a los niños antes de ingresar a las escuelas, puede deberse a mandatos y apoyo gubernamentales, más que a incentivos económicos. [123]
Según la Organización Mundial de la Salud, la mayor barrera para la producción de vacunas en los países menos desarrollados no han sido las patentes , sino los importantes requisitos financieros, de infraestructura y de mano de obra necesarios para entrar en el mercado. Las vacunas son mezclas complejas de compuestos biológicos y, a diferencia de los medicamentos recetados , no existen verdaderas vacunas genéricas . La vacuna producida por una nueva instalación debe someterse a pruebas clínicas completas de seguridad y eficacia por parte del fabricante. Para la mayoría de las vacunas, se patentan procesos tecnológicos específicos. Estos pueden evitarse mediante métodos de fabricación alternativos, pero esto requería infraestructura de I+D y una mano de obra adecuadamente cualificada. En el caso de algunas vacunas relativamente nuevas, como la vacuna contra el virus del papiloma humano , las patentes pueden imponer una barrera adicional. [124]
Cuando se necesitaba con urgencia una mayor producción de vacunas durante la pandemia de COVID-19 en 2021, la Organización Mundial del Comercio y los gobiernos de todo el mundo evaluaron si renunciar a los derechos de propiedad intelectual y las patentes sobre las vacunas COVID-19 , lo que "eliminaría todas las barreras potenciales a la acceso oportuno a productos médicos asequibles contra la COVID-19, incluidas vacunas y medicamentos, y ampliar la fabricación y el suministro de productos médicos esenciales". [125]

La producción de vacunas es fundamentalmente diferente de otros tipos de fabricación –incluida la fabricación farmacéutica habitual– en que las vacunas están destinadas a ser administradas a millones de personas, de las cuales la gran mayoría están perfectamente sanas. [126] Este hecho impulsa un proceso de producción extraordinariamente riguroso con estrictos requisitos de cumplimiento que van mucho más allá de lo que se requiere de otros productos. [126]
Dependiendo del antígeno, construir una instalación de producción de vacunas puede costar entre 50 y 500 millones de dólares, lo que requiere equipos altamente especializados, salas limpias y salas de contención. [127] Existe una escasez mundial de personal con la combinación adecuada de habilidades, experiencia, conocimiento, competencia y personalidad para dotar de personal a las líneas de producción de vacunas. [127] Con las notables excepciones de Brasil, China e India, los sistemas educativos de muchos países en desarrollo no pueden proporcionar suficientes candidatos calificados, y los fabricantes de vacunas con sede en esos países deben contratar personal expatriado para mantener la producción. [127]
La producción de vacunas tiene varias etapas. Primero, se genera el propio antígeno. Los virus se cultivan en células primarias como huevos de gallina (p. ej., en el caso de la gripe) o en líneas celulares continuas, como células humanas cultivadas (p. ej., en el caso de la hepatitis A ). [128] Las bacterias se cultivan en biorreactores (p. ej., Haemophilus influenzae tipo b). Asimismo, se puede generar una proteína recombinante derivada de virus o bacterias en cultivos de levaduras, bacterias o células. [129] [130]
Una vez generado el antígeno, se aísla de las células utilizadas para generarlo. Es posible que sea necesario inactivar un virus, posiblemente sin necesidad de purificación adicional. Las proteínas recombinantes necesitan muchas operaciones que implican ultrafiltración y cromatografía en columna. Finalmente, la vacuna se formula añadiendo adyuvantes, estabilizadores y conservantes según sea necesario. El adyuvante mejora la respuesta inmune al antígeno, los estabilizadores aumentan la vida útil y los conservantes permiten el uso de viales multidosis. [129] [130] Las vacunas combinadas son más difíciles de desarrollar y producir debido a posibles incompatibilidades e interacciones entre los antígenos y otros ingredientes involucrados. [131]
La etapa final en la fabricación de vacunas antes de la distribución es el llenado y acabado , que es el proceso de llenar viales con vacunas y empaquetarlos para su distribución. Aunque esta es una parte conceptualmente simple del proceso de fabricación de vacunas, a menudo constituye un cuello de botella en el proceso de distribución y administración de vacunas. [132] [133] [134]
Las técnicas de producción de vacunas están evolucionando. Se espera que las células de mamíferos cultivadas adquieran cada vez más importancia, en comparación con las opciones convencionales como los huevos de gallina, debido a una mayor productividad y una baja incidencia de problemas de contaminación. Se espera que la tecnología de recombinación que produce vacunas genéticamente desintoxicadas gane popularidad para la producción de vacunas bacterianas que utilizan toxoides. Se espera que las vacunas combinadas reduzcan las cantidades de antígenos que contienen y, por lo tanto, disminuyan las interacciones indeseables, mediante el uso de patrones moleculares asociados a patógenos . [131]
Las empresas con mayor cuota de mercado en la producción de vacunas son Merck , Sanofi , GlaxoSmithKline , Pfizer y Novartis , con el 70% de las ventas de vacunas concentradas en la UE o EE.UU. (2013). [135] : 42 Las plantas de fabricación de vacunas requieren grandes inversiones de capital (entre 50 y 300 millones de dólares) y su construcción puede tardar entre 4 y 6 años, mientras que el proceso completo de desarrollo de vacunas demora entre 10 y 15 años. [135] : 43 La fabricación en los países en desarrollo está desempeñando un papel cada vez más importante en el suministro de estos países, específicamente en lo que respecta a vacunas más antiguas y en Brasil, India y China. [135] : 47 Los fabricantes de la India son los más avanzados del mundo en desarrollo e incluyen al Serum Institute of India , uno de los mayores productores de vacunas por número de dosis y un innovador en los procesos, que recientemente mejoró la eficiencia de la producción de la vacuna contra el sarampión. entre 10 y 20 veces, debido al cambio a un cultivo de células MRC-5 en lugar de huevos de gallina. [135] : 48 Las capacidades de fabricación de China se centran en satisfacer sus propias necesidades internas, y Sinopharm (CNPGC) por sí sola proporciona más del 85% de las dosis para 14 vacunas diferentes en China. [135] : 48 Brasil se está acercando al punto de satisfacer sus propias necesidades internas utilizando tecnología transferida del mundo desarrollado. [135] : 49

Uno de los métodos más comunes para administrar vacunas en el cuerpo humano es la inyección .
El desarrollo de nuevos sistemas de administración genera esperanzas de vacunas que sean más seguras y eficientes de administrar. Sus líneas de investigación incluyen liposomas e ISCOM (complejo inmunoestimulante). [136]
Entre los avances notables en las tecnologías de administración de vacunas se incluyen las vacunas orales. Los primeros intentos de aplicar vacunas orales mostraron diversos grados de promesa, comenzando a principios del siglo XX, en un momento en que la posibilidad misma de una vacuna antibacteriana oral eficaz era controvertida. [137] En la década de 1930 hubo un interés creciente en el valor profiláctico de una vacuna oral contra la fiebre tifoidea, por ejemplo. [138]
Una vacuna oral contra la polio resultó eficaz cuando las vacunas fueron administradas por personal voluntario sin formación formal; Los resultados también demostraron una mayor facilidad y eficiencia en la administración de las vacunas. Las vacunas orales eficaces tienen muchas ventajas; por ejemplo, no hay riesgo de contaminación de la sangre. Las vacunas destinadas a la administración oral no necesitan ser líquidas y, como sólidas, suelen ser más estables y menos propensas a sufrir daños o deterioro por congelación durante el transporte y el almacenamiento. [139] Tal estabilidad reduce la necesidad de una " cadena de frío ": los recursos necesarios para mantener las vacunas dentro de un rango de temperatura restringido desde la etapa de fabricación hasta el punto de administración, lo que, a su vez, puede disminuir los costos de las vacunas.
Un enfoque con microagujas, que aún se encuentra en etapas de desarrollo, utiliza "proyecciones puntiagudas fabricadas en matrices que pueden crear vías de administración de vacunas a través de la piel". [140]
Se están realizando pruebas en animales con un sistema experimental de administración de vacunas sin agujas [141] . [142] [143] Un parche del tamaño de un sello similar a una venda adhesiva contiene aproximadamente 20.000 proyecciones microscópicas por cm cuadrado. [144] Esta administración dérmica aumenta potencialmente la eficacia de la vacunación, al tiempo que requiere menos vacuna que la inyección. [145]

Las vacunas de los animales se utilizan tanto para prevenir que contraigan enfermedades como para prevenir la transmisión de enfermedades a los humanos. [146] Tanto los animales mantenidos como mascotas como los animales criados como ganado se vacunan de forma rutinaria. En algunos casos, se pueden vacunar poblaciones silvestres. Esto a veces se logra esparciendo alimentos con vacunas en un área propensa a enfermedades y se ha utilizado para intentar controlar la rabia en mapaches .
Cuando ocurre la rabia, la ley puede exigir la vacunación de los perros contra la rabia. Otras vacunas caninas incluyen el moquillo canino , el parvovirus canino , la hepatitis infecciosa canina , el adenovirus-2 , la leptospirosis , la Bordetella , el virus de la parainfluenza canina y la enfermedad de Lyme , entre otras.
Se han documentado casos de vacunas veterinarias utilizadas en humanos, ya sea intencional o accidental, con algunos casos de enfermedad resultante, sobre todo brucelosis . [147] Sin embargo, la notificación de tales casos es rara y se ha estudiado muy poco sobre la seguridad y los resultados de tales prácticas. Con la llegada de la vacunación en aerosol en las clínicas veterinarias, es probable que la exposición humana a patógenos que no se transmiten naturalmente en los humanos, como Bordetella bronchiseptica , haya aumentado en los últimos años. [147] En algunos casos, sobre todo la rabia , la vacuna veterinaria paralela contra un patógeno puede ser mucho más económica que la vacuna humana.
Las vacunas DIVA (Diferenciación de animales infectados de vacunados), también conocidas como vacunas SIVA (Segregación de animales infectados de vacunados), permiten diferenciar entre animales infectados y vacunados. Las vacunas DIVA contienen al menos un epítopo menos que el microorganismo silvestre equivalente. Una prueba de diagnóstico adjunta que detecta el anticuerpo contra ese epítopo ayuda a identificar si el animal ha sido vacunado o no. [ cita necesaria ]
Las primeras vacunas DIVA (anteriormente denominadas vacunas marcadoras y desde 1999 acuñadas como vacunas DIVA) y las pruebas de diagnóstico complementarias fueron desarrolladas por JT van Oirschot y sus colegas del Instituto Veterinario Central de Lelystad, Países Bajos. [148] [149] Descubrieron que algunas vacunas existentes contra la pseudorrabia (también denominada enfermedad de Aujeszky) tenían deleciones en su genoma viral (entre los cuales se encontraba el gen gE). Se produjeron anticuerpos monoclonales contra esa deleción y se seleccionaron para desarrollar un ELISA que demostrara anticuerpos contra gE. Además, se construyeron nuevas vacunas genéticamente negativas para gE. [150] En la misma línea, se han desarrollado vacunas DIVA y pruebas de diagnóstico complementarias contra las infecciones por herpesvirus bovino 1. [149] [151]
La estrategia DIVA se ha aplicado en varios países para erradicar con éxito el virus de la pseudorrabia de esos países. Las poblaciones porcinas fueron vacunadas intensivamente y monitoreadas mediante la prueba de diagnóstico complementaria y, posteriormente, los cerdos infectados fueron retirados de la población. Las vacunas contra el herpesvirus bovino 1 DIVA también se utilizan ampliamente en la práctica. [ cita necesaria ] Se están realizando esfuerzos considerables para aplicar el principio DIVA a una amplia gama de enfermedades infecciosas, como la peste porcina clásica, [152] influenza aviar, [153] Actinobacillus pleuropneumonia [154] e infecciones por Salmonella en cerdos. [155]

Antes de la introducción de la vacunación con material procedente de casos de viruela vacuna (inmunización heterotípica), la viruela podía prevenirse mediante una variolación deliberada con el virus de la viruela. Los primeros indicios de la práctica de la variolación para la viruela en China se remontan al siglo X. [156] [ se necesita más explicación ] Los chinos también practicaban el uso documentado más antiguo de variolización, que se remonta al siglo XV. Implementaron un método de " insuflación nasal " administrado soplando material de viruela en polvo, generalmente costras, por las fosas nasales. Se han registrado diversas técnicas de insuflación a lo largo de los siglos XVI y XVII en China. [157] : 60 La Royal Society de Londres recibió dos informes sobre la práctica china de inoculación en 1700; uno de Martin Lister que recibió un informe de un empleado de la Compañía de las Indias Orientales destinado en China y otro de Clopton Havers . [158] En Francia, Voltaire informa que los chinos han practicado la variolización "estos cien años". [159]

Mary Wortley Montagu , que había sido testigo de la variolación en Turquía, hizo que su hija de cuatro años fuera variolada en presencia de médicos de la Corte Real en 1721 a su regreso a Inglaterra. [157] Más tarde ese año, Charles Maitland llevó a cabo una variación experimental de seis prisioneros en la prisión de Newgate en Londres. [160] El experimento fue un éxito y pronto la variolación llamó la atención de la familia real, que ayudó a promover el procedimiento. Sin embargo, en 1783, varios días después de que el príncipe Octavio de Gran Bretaña fuera vacunado, murió. [161] En 1796, el médico Edward Jenner tomó pus de la mano de una lechera con viruela vacuna , lo rascó en el brazo de un niño de 8 años, James Phipps , y seis semanas después varió al niño con viruela, observando luego que no contrajo viruela. [162] [163] Jenner amplió sus estudios y, en 1798, informó que su vacuna era segura en niños y adultos y podía transferirse de un brazo a otro, lo que reducía la dependencia de suministros inciertos de vacas infectadas. [161] En 1804, la expedición española de vacunación contra la viruela Balmis a las colonias españolas de México y Filipinas utilizó el método de transporte de brazo a brazo para evitar el hecho de que la vacuna sobrevivió solo 12 días in vitro . Usaron viruela vacuna. [164] Dado que la vacunación con viruela vacuna era mucho más segura que la inoculación contra la viruela, [165] esta última, aunque todavía se practica ampliamente en Inglaterra, fue prohibida en 1840. [166]

Siguiendo el trabajo de Jenner, la segunda generación de vacunas fue introducida en la década de 1880 por Louis Pasteur , quien desarrolló vacunas para el cólera y el ántrax de los pollos , [17] y desde finales del siglo XIX las vacunas se consideraron una cuestión de prestigio nacional. Se adoptaron políticas nacionales de vacunación y se aprobaron leyes de vacunación obligatoria. [162] En 1931, Alice Miles Woodruff y Ernest Goodpasture documentaron que el virus de la viruela aviar podía cultivarse en huevos de gallina embrionados . Pronto los científicos comenzaron a cultivar otros virus en huevos. Los huevos se utilizaron para la propagación del virus en el desarrollo de una vacuna contra la fiebre amarilla en 1935 y una vacuna contra la influenza en 1945. En 1959, los medios de crecimiento y los cultivos celulares reemplazaron a los huevos como método estándar de propagación de virus para las vacunas. [167]
La vacunología floreció en el siglo XX, cuando se introdujeron varias vacunas exitosas, incluidas las contra la difteria , el sarampión , las paperas y la rubéola . Los principales logros incluyeron el desarrollo de la vacuna contra la polio en los años cincuenta y la erradicación de la viruela durante los años sesenta y setenta. Maurice Hilleman fue el más prolífico de los desarrolladores de vacunas en el siglo XX. A medida que las vacunas se volvieron más comunes, muchas personas comenzaron a darlas por sentado. Sin embargo, las vacunas siguen siendo difíciles de alcanzar para muchas enfermedades importantes, como el herpes simple , la malaria , la gonorrea y el VIH . [162] [168]

Las vacunas de primera generación son vacunas de organismo completo: vivas y debilitadas o muertas. [169] Las vacunas vivas atenuadas, como las vacunas contra la viruela y la polio, son capaces de inducir respuestas de células T asesinas (T C o CTL), respuestas de células T auxiliares (T H ) e inmunidad de anticuerpos . Sin embargo, las formas atenuadas de un patógeno pueden convertirse en una forma peligrosa y causar enfermedades en los receptores de vacunas inmunocomprometidos (como aquellos con SIDA ). Si bien las vacunas muertas no tienen este riesgo, no pueden generar respuestas específicas de células T asesinas y es posible que no funcionen en absoluto para algunas enfermedades. [169]
Se desarrollaron vacunas de segunda generación para reducir los riesgos de las vacunas vivas. Se trata de vacunas subunitarias, que constan de antígenos proteicos específicos (como el toxoide tetánico o diftérico ) o componentes proteicos recombinantes (como el antígeno de superficie de la hepatitis B ). Pueden generar respuestas de TH y anticuerpos , pero no respuestas de células T asesinas. [ cita necesaria ]
Las vacunas de ARN y las vacunas de ADN son ejemplos de vacunas de tercera generación. [169] [170] [171] En 2016, una vacuna de ADN para el virus Zika comenzó a probarse en los Institutos Nacionales de Salud . Por otra parte, Inovio Pharmaceuticals y GeneOne Life Science comenzaron las pruebas de una vacuna de ADN diferente contra el Zika en Miami. La fabricación de vacunas en volumen no estaba resuelta en 2016. [172] Se están llevando a cabo ensayos clínicos de vacunas de ADN para prevenir el VIH. [173] Las vacunas de ARNm como BNT162b2 se desarrollaron en el año 2020 con la ayuda de la Operación Warp Speed y se implementaron masivamente para combatir la pandemia de COVID-19 . En 2021, Katalin Karikó y Drew Weissman recibieron el Premio Horwitz de la Universidad de Columbia por su investigación pionera en tecnología de vacunas de ARNm. [174]
Desde al menos 2013, los científicos han intentado desarrollar vacunas sintéticas de tercera generación reconstruyendo la estructura exterior de un virus ; se esperaba que esto ayudara a prevenir la resistencia a las vacunas . [175]
Los principios que gobiernan la respuesta inmune ahora se pueden utilizar en vacunas hechas a medida contra muchas enfermedades humanas no infecciosas, como el cáncer y los trastornos autoinmunes. [176] Por ejemplo, la vacuna experimental CYT006-AngQb se ha investigado como un posible tratamiento para la presión arterial alta . [177] Los factores que afectan las tendencias del desarrollo de vacunas incluyen el progreso en la medicina traductora, la demografía , la ciencia regulatoria y las respuestas políticas, culturales y sociales. [178]
La idea de producir vacunas a través de plantas transgénicas se identificó ya en 2003. Plantas como el tabaco , la papa , el tomate y el plátano pueden tener genes insertados que les permitan producir vacunas utilizables para los humanos. [ 179] En 2005, se desarrollaron plátanos que producen una vacuna humana contra la hepatitis B. [180]
La vacilación ante las vacunas es un retraso en la aceptación o el rechazo de las vacunas a pesar de la disponibilidad de servicios de vacunación. El término cubre la negativa total a vacunar, el retraso de las vacunas, la aceptación de vacunas pero la incertidumbre sobre su uso, o el uso de ciertas vacunas pero no de otras. [181] [182] [183] [184] Existe un consenso científico abrumador de que las vacunas son generalmente seguras y eficaces. [185] [186] [187] [188] La vacilación ante las vacunas a menudo resulta en brotes de enfermedades y muertes por enfermedades prevenibles con vacunas . [189] [190] [191] [192] [193] [194] Por lo tanto, la Organización Mundial de la Salud caracterizó la vacilación ante las vacunas como una de las diez principales amenazas a la salud mundial en 2019. [195] [196]
El efecto de las vacunas en la salud pública es realmente notable. Un estudio que examinó el impacto de la vacunación infantil en la cohorte de nacimientos de Estados Unidos de 2001 encontró que las vacunas evitaron 33.000 muertes y 14 millones de casos de enfermedades (Zhou et al. 2005). Entre 73 países apoyados por la alianza GAVI, los modelos matemáticos proyectan que las vacunas evitarán 23,3 millones de muertes entre 2011 y 2020, en comparación con lo que habría ocurrido si no hubiera vacunas disponibles (Lee et al. 2013). Se han desarrollado vacunas contra una amplia variedad de patógenos humanos.