

Los proteosomas son complejos proteicos que degradan las proteínas marcadas con ubiquitina mediante proteólisis , una reacción química que rompe los enlaces peptídicos . Las enzimas que ayudan en estas reacciones se denominan proteasas .
Los proteosomas forman parte de un mecanismo importante por el cual las células regulan la concentración de proteínas particulares y degradan las proteínas mal plegadas . Las proteínas se marcan para su degradación con una proteína pequeña llamada ubiquitina . La reacción de marcado es catalizada por enzimas llamadas ligasas de ubiquitina . Una vez que una proteína se marca con una sola molécula de ubiquitina, esto es una señal para que otras ligasas adhieran moléculas de ubiquitina adicionales. El resultado es una cadena de poliubiquitina que está unida por el proteosoma, lo que le permite degradar la proteína marcada. [1] El proceso de degradación produce péptidos de aproximadamente siete a ocho aminoácidos de longitud, que luego pueden degradarse aún más en secuencias de aminoácidos más cortas y usarse para sintetizar nuevas proteínas. [1]
Los proteosomas se encuentran en el interior de todos los eucariotas y arqueas , y en algunas bacterias . En los eucariotas, los proteosomas se encuentran tanto en el núcleo como en el citoplasma . [2]
En su estructura , el proteasoma es un complejo cilíndrico que contiene un "núcleo" de cuatro anillos apilados que forman un poro central. Cada anillo está compuesto por siete proteínas individuales. Los dos anillos internos están formados por siete subunidades β que contienen de tres a siete sitios activos de proteasa . Estos sitios están ubicados en la superficie interior de los anillos, de modo que la proteína diana debe ingresar al poro central antes de degradarse. Los dos anillos externos contienen cada uno siete subunidades α cuya función es mantener una "puerta" a través de la cual las proteínas ingresan al barril. Estas subunidades α se controlan mediante la unión a estructuras de "tapa" o partículas reguladoras que reconocen las etiquetas de poliubiquitina unidas a los sustratos proteicos e inician el proceso de degradación. El sistema general de ubiquitinación y degradación proteasomal se conoce como el sistema ubiquitina-proteasoma . [3]
La vía de degradación proteosomal es esencial para muchos procesos celulares, incluido el ciclo celular , la regulación de la expresión génica y las respuestas al estrés oxidativo . La importancia de la degradación proteolítica dentro de las células y el papel de la ubiquitina en las vías proteolíticas fue reconocida en la concesión del Premio Nobel de Química de 2004 a Aaron Ciechanover , Avram Hershko e Irwin Rose . [4]
Antes del descubrimiento del sistema ubiquitina-proteasoma, se pensaba que la degradación de proteínas en las células dependía principalmente de los lisosomas , orgánulos unidos a la membrana con interiores ácidos y llenos de proteasas que pueden degradar y luego reciclar proteínas exógenas y orgánulos envejecidos o dañados. [1] Sin embargo, el trabajo de Joseph Etlinger y Alfred L. Goldberg en 1977 sobre la degradación de proteínas dependiente de ATP en reticulocitos , que carecen de lisosomas, sugirió la presencia de un segundo mecanismo de degradación intracelular. [5] En 1978 se demostró que este estaba compuesto de varias cadenas de proteínas distintas, una novedad entre las proteasas de la época. [6] El trabajo posterior sobre la modificación de las histonas condujo a la identificación de una modificación covalente inesperada de la proteína histona mediante un enlace entre una cadena lateral de lisina de la histona y el residuo de glicina C-terminal de la ubiquitina , una proteína que no tenía una función conocida. [7] Luego se descubrió que una proteína previamente identificada asociada con la degradación proteolítica, conocida como factor de proteólisis dependiente de ATP 1 (APF-1), era la misma proteína que la ubiquitina. [8] Las actividades proteolíticas de este sistema fueron aisladas como un complejo multiproteico originalmente llamado complejo multicatalítico de proteinasa por Sherwin Wilk y Marion Orlowski. [9] Más tarde, se descubrió el complejo proteolítico dependiente de ATP que era responsable de la degradación de proteínas dependiente de ubiquitina y se lo llamó proteasoma 26S. [10] [11]
Gran parte del trabajo inicial que condujo al descubrimiento del sistema del proteasoma ubiquitina se llevó a cabo a fines de la década de 1970 y principios de la de 1980 en el Technion , en el laboratorio de Avram Hershko , donde Aaron Ciechanover trabajaba como estudiante de posgrado. El año sabático de Hershko en el laboratorio de Irwin Rose en el Centro Oncológico Fox Chase proporcionó ideas conceptuales clave, aunque Rose luego restó importancia a su papel en el descubrimiento. [12] Los tres compartieron el Premio Nobel de Química de 2004 por su trabajo en el descubrimiento de este sistema. [4]
Aunque los datos de microscopía electrónica que revelaron la estructura de anillo apilado del proteasoma estuvieron disponibles a mediados de la década de 1980, [13] la primera estructura de la partícula central del proteasoma no se resolvió mediante cristalografía de rayos X hasta 1994. [14] En 2018, las primeras estructuras atómicas de la holoenzima del proteasoma 26S humano en complejo con un sustrato proteico poliubiquitilado se resolvieron mediante microscopía electrónica criogénica , revelando mecanismos por los cuales el sustrato es reconocido, desubiquitilado, desplegado y degradado por el proteasoma 26S humano. [15]
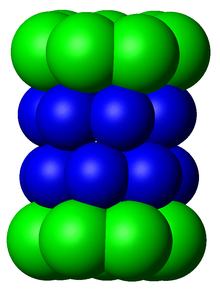
Los subcomponentes del proteasoma se denominan a menudo por su coeficiente de sedimentación de Svedberg (denominado S ). El proteasoma más exclusivamente utilizado en mamíferos es el proteasoma citosólico 26S, que tiene una masa molecular de unos 2000 kilodaltons (kDa) y contiene una subunidad proteica 20S y dos subunidades de tapa reguladora 19S. El núcleo es hueco y proporciona una cavidad cerrada en la que se degradan las proteínas; las aberturas en los dos extremos del núcleo permiten la entrada de la proteína diana. Cada extremo de la partícula del núcleo se asocia con una subunidad reguladora 19S que contiene múltiples sitios activos de ATPasa y sitios de unión de ubiquitina; es esta estructura la que reconoce las proteínas poliubiquitinadas y las transfiere al núcleo catalítico. [15] Una forma alternativa de subunidad reguladora llamada partícula 11S puede asociarse con el núcleo esencialmente de la misma manera que la partícula 19S; la 11S puede desempeñar un papel en la degradación de péptidos extraños como los producidos después de la infección por un virus . [16]
El número y la diversidad de subunidades contenidas en la partícula central 20S depende del organismo; el número de subunidades distintas y especializadas es mayor en organismos multicelulares que unicelulares y mayor en eucariotas que en procariotas. Todas las partículas 20S constan de cuatro estructuras de anillo heptaméricas apiladas que están compuestas por dos tipos diferentes de subunidades; las subunidades α son de naturaleza estructural, mientras que las subunidades β son predominantemente catalíticas . Las subunidades α son pseudoenzimas homólogas a las subunidades β. Se ensamblan con sus extremos N adyacentes al de las subunidades β. [17] Los dos anillos externos en la pila constan de siete subunidades α cada uno, que sirven como dominios de acoplamiento para las partículas reguladoras y los extremos N de las subunidades alfa ( Pfam PF10584) forman una puerta que bloquea el acceso no regulado de sustratos a la cavidad interior. [18] Los dos anillos internos constan cada uno de siete subunidades β y en sus extremos N-terminales contienen los sitios activos de la proteasa que realizan las reacciones de proteólisis. [19] Se identificaron tres actividades catalíticas distintas en el complejo purificado: similar a la quimotripsina, similar a la tripsina e hidrolizante de péptidos peptidilglutamil. [20] El tamaño del proteasoma está relativamente conservado y es de aproximadamente 150 angstroms (Å) por 115 Å. La cámara interior tiene un ancho máximo de 53 Å, aunque la entrada puede ser tan estrecha como 13 Å, lo que sugiere que las proteínas del sustrato deben estar al menos parcialmente desplegadas para entrar. [21]
En arqueas como Thermoplasma acidophilum , todas las subunidades α y β son idénticas, mientras que los proteosomas eucariotas como los de la levadura contienen siete tipos distintos de cada subunidad. En los mamíferos , las subunidades β1, β2 y β5 son catalíticas; aunque comparten un mecanismo común, tienen tres especificidades de sustrato distintas consideradas similares a la quimotripsina , similares a la tripsina e hidrolizantes de péptidos peptidil-glutamil (PHGH). [22] Las formas β alternativas denominadas β1i, β2i y β5i se pueden expresar en células hematopoyéticas en respuesta a la exposición a señales proinflamatorias como las citocinas , en particular, el interferón gamma . El proteosoma ensamblado con estas subunidades alternativas se conoce como inmunoproteosoma , cuya especificidad de sustrato se altera en relación con el proteosoma normal. [21] Recientemente se identificó un proteosoma alternativo en células humanas que carecen de la subunidad central α3. [23] Estos proteosomas (conocidos como proteosomas α4-α4) forman partículas centrales 20S que contienen una subunidad α4 adicional en lugar de la subunidad α3 faltante. Se sabía previamente que estos proteosomas alternativos 'α4-α4' existían en la levadura. [24] Aunque la función precisa de estas isoformas del proteosoma todavía se desconoce en gran medida, las células que expresan estos proteosomas muestran una resistencia mejorada a la toxicidad inducida por iones metálicos como el cadmio. [23] [25]
La partícula 19S en eucariotas consta de 19 proteínas individuales y es divisible en dos subconjuntos, una base de 9 subunidades que se une directamente al anillo α de la partícula central 20S y una tapa de 10 subunidades. Seis de las nueve proteínas base son subunidades de ATPasa de la familia AAA, y existe un homólogo evolutivo de estas ATPasas en las arqueas, llamado PAN (nucleotidasa activadora del proteasoma). [26] La asociación de las partículas 19S y 20S requiere la unión de ATP a las subunidades de ATPasa 19S, y la hidrólisis de ATP es necesaria para que el complejo ensamblado degrade las proteínas plegadas y ubiquitinadas. Tenga en cuenta que solo el paso de desdoblamiento del sustrato requiere energía de la hidrólisis de ATP, mientras que la unión de ATP por sí sola puede soportar todos los demás pasos necesarios para la degradación de proteínas (por ejemplo, ensamblaje del complejo, apertura de la compuerta, translocación y proteólisis). [27] [28] De hecho, la unión de ATP a las ATPasas por sí sola favorece la degradación rápida de las proteínas desdobladas. Sin embargo, aunque la hidrólisis de ATP es necesaria únicamente para el desdoblamiento, aún no está claro si esta energía puede utilizarse en el acoplamiento de algunos de estos pasos. [28] [29]

En 2012, dos esfuerzos independientes han dilucidado la arquitectura molecular del proteasoma 26S mediante microscopía electrónica de partículas individuales . [31] [32] En 2016, tres esfuerzos independientes han determinado la primera estructura de resolución casi atómica del proteasoma 26S humano en ausencia de sustratos mediante crio-EM. [33] [34] [35] En 2018, un esfuerzo importante ha dilucidado los mecanismos detallados de desubiquitilación, inicio de la translocación y despliegue procesivo de sustratos mediante la determinación simultánea de siete estructuras atómicas del proteasoma 26S acoplado al sustrato. [15] En el corazón del 19S, directamente adyacente al 20S, se encuentran las AAA-ATPasas ( proteínas AAA ) que se ensamblan en un anillo heterohexamérico del orden Rpt1/Rpt2/Rpt6/Rpt3/Rpt4/Rpt5. Este anillo es un trímero de dímeros: Rpt1/Rpt2, Rpt6/Rpt3 y Rpt4/Rpt5 dimerizan a través de sus espirales superpuestas N-terminales. Estas espirales superpuestas sobresalen del anillo hexamérico. Las partículas reguladoras más grandes, las no-ATPasas Rpn1 y Rpn2, se unen a las puntas de Rpt1/2 y Rpt6/3, respectivamente. El receptor de ubiquitina Rpn13 se une a Rpn2 y completa el subcomplejo de base. La tapa cubre la mitad del hexámero AAA-ATPasa (Rpt6/Rpt3/Rpt4) e inesperadamente entra en contacto directo con el 20S a través de Rpn6 y, en menor medida, de Rpn5. Las subunidades Rpn9, Rpn5, Rpn6, Rpn7, Rpn3 y Rpn12, que están relacionadas estructuralmente entre sí y con subunidades del complejo COP9 y eIF3 (de ahí el nombre de subunidades PCI) se ensamblan en una estructura en forma de herradura que encierra el heterodímero Rpn8/Rpn11. Rpn11, la enzima desubiquitinante , se coloca en la boca del hexámero AAA-ATPasa, en una posición ideal para eliminar las fracciones de ubiquitina inmediatamente antes de la translocación de sustratos al 20S. El segundo receptor de ubiquitina identificado hasta la fecha, Rpn10, se coloca en la periferia de la tapa, cerca de las subunidades Rpn8 y Rpn9.
Hasta la fecha, se ha observado que la partícula reguladora 19S dentro de la holoenzima del proteasoma 26S presenta seis estados conformacionales muy diferentes en ausencia de sustratos. [36] [37] Un sello distintivo de la configuración AAA-ATPasa en este estado predominante de baja energía es una disposición en escalera o en arandela de seguridad de los dominios AAA. [30] [31] En presencia de ATP pero en ausencia de sustrato, se adoptan tres conformaciones alternativas menos abundantes del 19S, que difieren principalmente en la posición de la tapa con respecto al módulo AAA-ATPasa. [33] [37] En presencia de ATP-γS o un sustrato, se han observado considerablemente más conformaciones que muestran cambios estructurales dramáticos del módulo AAA-ATPasa. [15] [36] [38] [39] Algunas de las conformaciones unidas al sustrato tienen una gran similitud con las libres de sustrato, pero no son completamente idénticas, particularmente en el módulo AAA-ATPasa. [15] [36] Antes del ensamblaje del 26S, la partícula reguladora 19S en forma libre también se ha observado en siete estados conformacionales. [40] Cabe destacar que todos estos confórmeros son algo diferentes y presentan características distintivas. Por lo tanto, la partícula reguladora 19S puede muestrear al menos 20 estados conformacionales en diferentes condiciones fisiológicas.

La partícula reguladora 19S es responsable de estimular la degradación de proteínas por parte de la molécula 20S. Una función principal de las ATPasas reguladoras de la molécula 19S es abrir la compuerta de la molécula 20S que bloquea la entrada de sustratos a la cámara de degradación. [41] Recientemente se ha dilucidado el mecanismo por el cual la ATPasa proteasomal abre esta compuerta. [18] La apertura de la compuerta de la molécula 20S, y por lo tanto la degradación de sustratos, requiere los extremos C de las ATPasas proteasomal, que contienen un motivo específico (es decir, el motivo HbYX). Los extremos C de las ATPasas se unen a los bolsillos de la parte superior de la molécula 20S y unen el complejo de la ATPasa al complejo proteolítico de la molécula 20S, uniendo así el equipo de desdoblamiento de sustratos con la maquinaria de degradación de la molécula 20S. La unión de estos extremos C en estos bolsillos de la molécula 20S por sí sola estimula la apertura de la compuerta de la molécula 20S de forma muy similar a como una "llave en una cerradura" abre una puerta. [18] El mecanismo preciso por el cual funciona este mecanismo de "llave en una cerradura" ha sido dilucidado estructuralmente en el contexto del proteasoma 26S humano a una resolución casi atómica, lo que sugiere que se requiere la inserción de cinco extremos C de las subunidades de ATPasa Rpt1/2/3/5/6 en los bolsillos de la superficie 20S para abrir completamente la compuerta 20S. [36] [15] [33]
Los proteosomas 20S también pueden asociarse con un segundo tipo de partícula reguladora, la partícula reguladora 11S, una estructura heptamérica que no contiene ninguna ATPasa y puede promover la degradación de péptidos cortos pero no de proteínas completas. Se presume que esto se debe a que el complejo no puede desplegar sustratos más grandes. Esta estructura también se conoce como PA28, REG o PA26. [17] Los mecanismos por los cuales se une a la partícula central a través de las colas C-terminales de sus subunidades e induce cambios conformacionales del anillo α para abrir la compuerta 20S sugieren un mecanismo similar para la partícula 19S. [42] La expresión de la partícula 11S es inducida por interferón gamma y es responsable, junto con las subunidades β del inmunoproteosoma, de la generación de péptidos que se unen al complejo mayor de histocompatibilidad . [16]
Otro tipo de partícula reguladora no ATPasa es la Blm10 (levadura) o PA200/ PSME4 (humana). Abre solo una subunidad α en la compuerta 20S y se pliega formando una cúpula con un poro muy pequeño sobre ella. [17]
El ensamblaje del proteosoma es un proceso complejo debido al número de subunidades que deben asociarse para formar un complejo activo. Las subunidades β se sintetizan con "propéptidos" N-terminales que se modifican postraduccionalmente durante el ensamblaje de la partícula 20S para exponer el sitio activo proteolítico. La partícula 20S se ensambla a partir de dos semiproteosomas, cada uno de los cuales consta de un anillo pro-β de siete miembros unido a un anillo α de siete miembros. La asociación de los anillos β de los dos semiproteosomas desencadena la autolisis dependiente de treonina de los propéptidos para exponer el sitio activo. Estas interacciones β están mediadas principalmente por puentes salinos e interacciones hidrofóbicas entre hélices alfa conservadas cuya interrupción por mutación daña la capacidad del proteosoma para ensamblarse. [43] El ensamblaje de los semiproteasomas, a su vez, se inicia con el ensamblaje de las subunidades α en su anillo heptamérico, formando una plantilla para la asociación del anillo pro-β correspondiente. El ensamblaje de las subunidades α no ha sido caracterizado. [44]
Recientemente, el proceso de ensamblaje de la partícula reguladora 19S se ha dilucidado en gran medida. La partícula reguladora 19S se ensambla como dos subcomponentes distintos, la base y la tapa. El ensamblaje del complejo base es facilitado por cuatro chaperonas de ensamblaje , Hsm3/S5b, Nas2/p27, Rpn14/PAAF1 y Nas6/ gankyrin (nombres para levadura/mamíferos). [45] Estas chaperonas de ensamblaje se unen a las subunidades AAA- ATPasa y su función principal parece ser asegurar el ensamblaje adecuado del anillo heterohexamérico AAA- ATPasa . Hasta la fecha, todavía está en debate si el complejo base se ensambla por separado, si el ensamblaje está modelado por la partícula central 20S o si existen vías de ensamblaje alternativas. Además de las cuatro chaperonas de ensamblaje, la enzima desubiquitinante Ubp6/Usp14 también promueve el ensamblaje de bases, pero no es esencial. [46] La tapa se ensambla por separado en un orden específico y no requiere chaperonas de ensamblaje. [47]

Las proteínas son el objetivo de la degradación por el proteasoma con la modificación covalente de un residuo de lisina que requiere las reacciones coordinadas de tres enzimas . En el primer paso, una enzima activadora de ubiquitina (conocida como E1) hidroliza ATP y adenilila una molécula de ubiquitina . Esta luego se transfiere al residuo de cisteína del sitio activo de E1 en concierto con la adenililación de una segunda ubiquitina. [48] Esta ubiquitina adenililada luego se transfiere a una cisteína de una segunda enzima, la enzima conjugadora de ubiquitina (E2). En el último paso, un miembro de una clase altamente diversa de enzimas conocidas como ubiquitina ligasas (E3) reconoce la proteína específica a ser ubiquitinada y cataliza la transferencia de ubiquitina de E2 a esta proteína objetivo. Una proteína diana debe estar marcada con al menos cuatro monómeros de ubiquitina (en forma de una cadena de poliubiquitina) antes de que sea reconocida por la tapa del proteasoma. [49] Por lo tanto, es la E3 la que confiere especificidad de sustrato a este sistema. [50] La cantidad de proteínas E1, E2 y E3 expresadas depende del organismo y del tipo de célula, pero hay muchas enzimas E3 diferentes presentes en los seres humanos, lo que indica que hay una gran cantidad de objetivos para el sistema del proteasoma ubiquitina.
El mecanismo por el cual una proteína poliubiquitinada se dirige al proteasoma no se entiende completamente. Unas pocas instantáneas de alta resolución del proteasoma unido a una proteína poliubiquitinada sugieren que los receptores de ubiquitina podrían estar coordinados con la deubiquitinasa Rpn11 para la orientación y el acoplamiento inicial del sustrato. [15] Las proteínas receptoras de ubiquitina tienen un dominio similar a la ubiquitina (UBL) N-terminal y uno o más dominios asociados a la ubiquitina (UBA). Los dominios UBL son reconocidos por las tapas del proteasoma 19S y los dominios UBA se unen a la ubiquitina a través de haces de tres hélices . Estas proteínas receptoras pueden escoltar a las proteínas poliubiquitinadas al proteasoma, aunque los detalles de esta interacción y su regulación no están claros. [51]
La proteína ubiquitina en sí tiene 76 aminoácidos de longitud y fue nombrada debido a su naturaleza ubicua, ya que tiene una secuencia altamente conservada y se encuentra en todos los organismos eucariotas conocidos. [52] Los genes que codifican la ubiquitina en eucariotas están dispuestos en repeticiones en tándem , posiblemente debido a las fuertes demandas de transcripción de estos genes para producir suficiente ubiquitina para la célula. Se ha propuesto que la ubiquitina es la proteína de evolución más lenta identificada hasta la fecha. [53] La ubiquitina contiene siete residuos de lisina a los que se puede ligar otra ubiquitina, lo que da como resultado diferentes tipos de cadenas de poliubiquitina. [54] Las cadenas en las que cada ubiquitina adicional está unida a la lisina 48 de la ubiquitina anterior tienen un papel en la orientación del proteasoma, mientras que otros tipos de cadenas pueden estar involucradas en otros procesos. [55] [56]

Las cadenas de ubiquitina conjugadas a una proteína destinada a la degradación proteosomal normalmente son eliminadas por cualquiera de las tres enzimas desubiquitilantes asociadas al proteosoma (DUB), que son Rpn11, Ubp6/USP14 y UCH37. Este proceso recicla la ubiquitina y es esencial para mantener el reservorio de ubiquitina en las células. [56] Rpn11 es una subunidad estequiométrica intrínseca de la partícula reguladora 19S y es esencial para la función del proteosoma 26S. La actividad DUB de Rpn11 se mejora en el proteosoma en comparación con su forma monomérica. La forma en que Rpn11 elimina una cadena de ubiquitina en bloque de un sustrato proteico fue capturada por una estructura atómica del proteosoma humano acoplado al sustrato en una conformación denominada E B . [15] Curiosamente, esta estructura también muestra cómo la actividad de DUB está acoplada al reconocimiento del sustrato por la AAA-ATPasa proteosomal. A diferencia de Rpn11, USP14 y UCH37 son los DUB que no siempre se asocian con el proteosoma. En las células, se encontró que entre el 10 y el 40 % de los proteosomas tenían USP14 asociado. Tanto Ubp6/USP14 como UCH37 son activados en gran medida por el proteosoma y exhiben una actividad DUB muy baja por sí solos. Una vez activado, se encontró que USP14 suprimía la función del proteosoma por su actividad DUB y por inducir vías paralelas de transiciones conformacionales del proteosoma, una de las cuales resultó prohibir directamente la inserción del sustrato en la AAA-ATPasa, como se observó intuitivamente mediante microscopía electrónica criogénica resuelta en el tiempo. [57] Parece que USP14 regula la función del proteasoma en múltiples puntos de control tanto compitiendo catalíticamente con Rpn11 como reprogramando alostéricamente los estados AAA-ATPasa, lo que es bastante inesperado para un DUB. [57] Estas observaciones implican que la regulación del proteasoma puede depender de sus transiciones dinámicas de estados conformacionales.
Después de que una proteína ha sido ubiquitinada, es reconocida por la partícula reguladora 19S en un paso de unión dependiente de ATP. [15] [28] La proteína sustrato debe entonces entrar al interior de la subunidad 20S para entrar en contacto con los sitios activos proteolíticos. Debido a que el canal central de la partícula 20S es angosto y está controlado por las colas N-terminales de las subunidades del anillo α, los sustratos deben estar al menos parcialmente desplegados antes de que entren al núcleo. [15] El paso del sustrato desplegado al núcleo se llama translocación y ocurre necesariamente después de la desubiquitinación. [15] [28] Sin embargo, el orden en el que los sustratos son desubiquitinados y desplegados aún no está claro. [58] Cuál de estos procesos es el paso limitante de la velocidad en la reacción de proteólisis general depende del sustrato específico; para algunas proteínas, el proceso de desplegado es limitante de la velocidad, mientras que la desubiquitinación es el paso más lento para otras proteínas. [27] Se sugiere que el grado en el que los sustratos deben desplegarse antes de la translocación es de alrededor de 20 residuos de aminoácidos por la estructura atómica del proteasoma 26S acoplado al sustrato en el estado compatible con la desubiquitilación, [15] pero una estructura terciaria sustancial y, en particular, interacciones no locales como los enlaces disulfuro , son suficientes para inhibir la degradación. [59] También se ha propuesto que la presencia de segmentos proteicos intrínsecamente desordenados de tamaño suficiente, ya sea en el extremo de la proteína o internamente, facilita el inicio eficiente de la degradación. [60] [61]
La compuerta formada por las subunidades α evita que los péptidos de más de cuatro residuos entren al interior de la partícula 20S. Las moléculas de ATP unidas antes del paso de reconocimiento inicial se hidrolizan antes de la translocación. Si bien se necesita energía para el despliegue del sustrato, no se requiere para la translocación. [27] [28] El proteasoma 26S ensamblado puede degradar proteínas desplegadas en presencia de un análogo de ATP no hidrolizable , pero no puede degradar proteínas plegadas, lo que indica que la energía de la hidrólisis del ATP se utiliza para el despliegue del sustrato. [27] El paso del sustrato desplegado a través de la compuerta abierta ocurre a través de difusión facilitada si la tapa 19S está en el estado unido al ATP. [62]
El mecanismo de desdoblamiento de las proteínas globulares es necesariamente general, pero depende en cierta medida de la secuencia de aminoácidos . Se ha demostrado que las secuencias largas de glicina y alanina alternadas inhiben el desdoblamiento del sustrato, lo que disminuye la eficiencia de la degradación proteosomal; esto da como resultado la liberación de subproductos parcialmente degradados, posiblemente debido al desacoplamiento de los pasos de hidrólisis de ATP y de desdoblamiento. [63] Estas repeticiones de glicina-alanina también se encuentran en la naturaleza, por ejemplo en la fibroína de seda ; en particular, ciertos productos génicos del virus de Epstein-Barr que llevan esta secuencia pueden detener el proteosoma, lo que ayuda al virus a propagarse al prevenir la presentación de antígenos en el complejo mayor de histocompatibilidad. [64]
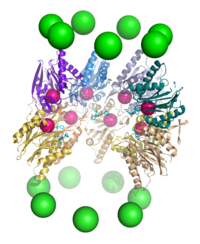
El proteasoma funciona como una endoproteasa . [65] [66] [67] [68] El mecanismo de proteólisis por las subunidades β de la partícula central 20S es a través de un ataque nucleofílico dependiente de treonina . Este mecanismo puede depender de una molécula de agua asociada para la desprotonación del hidroxilo reactivo de treonina . La degradación ocurre dentro de la cámara central formada por la asociación de los dos anillos β y normalmente no libera productos parcialmente degradados, sino que reduce el sustrato a polipéptidos cortos, típicamente de 7 a 9 residuos de longitud, aunque pueden variar de 4 a 25 residuos, dependiendo del organismo y el sustrato. El mecanismo bioquímico que determina la longitud del producto no está completamente caracterizado. [69] Aunque las tres subunidades β catalíticas tienen un mecanismo común, tienen especificidades de sustrato ligeramente diferentes, que se consideran similares a la quimotripsina, similares a la tripsina y similares a la hidrolización de péptidos de peptidil-glutamil (PHGH). Estas variaciones en la especificidad son el resultado de contactos interatómicos con residuos locales cerca de los sitios activos de cada subunidad. Cada subunidad β catalítica también posee un residuo de lisina conservado necesario para la proteólisis. [22]
Aunque el proteosoma normalmente produce fragmentos peptídicos muy cortos, en algunos casos estos productos son en sí mismos moléculas biológicamente activas y funcionales. Ciertos factores de transcripción que regulan la expresión de genes específicos, incluido un componente del complejo mamífero NF-κB , se sintetizan como precursores inactivos cuya ubiquitinación y posterior degradación proteosomal los convierte en una forma activa. Esta actividad requiere que el proteosoma escinda la proteína sustrato internamente, en lugar de degradarla procesivamente desde un extremo. Se ha sugerido que los bucles largos en las superficies de estas proteínas sirven como sustratos proteosomales y entran en la cavidad central, mientras que la mayoría de la proteína permanece fuera. [70] Se han observado efectos similares en proteínas de levadura; este mecanismo de degradación selectiva se conoce como procesamiento dependiente de ubiquitina/proteosoma regulado (RUP). [71]
Aunque la mayoría de los sustratos proteasomales deben ser ubiquitinados antes de ser degradados, existen algunas excepciones a esta regla general, especialmente cuando el proteasoma desempeña un papel normal en el procesamiento postraduccional de la proteína. La activación proteasomal de NF-κB al procesar p105 en p50 mediante proteólisis interna es un ejemplo importante. [ 70] Algunas proteínas que se plantea la hipótesis de que son inestables debido a regiones intrínsecamente no estructuradas , [72] se degradan de una manera independiente de la ubiquitina. El ejemplo más conocido de un sustrato proteasoma independiente de la ubiquitina es la enzima ornitina descarboxilasa . [73] También se han informado mecanismos independientes de la ubiquitina que se dirigen a reguladores clave del ciclo celular como p53 , aunque p53 también está sujeto a la degradación dependiente de la ubiquitina. [74] Finalmente, las proteínas estructuralmente anormales, mal plegadas o altamente oxidadas también están sujetas a degradación independiente de la ubiquitina y del 19S en condiciones de estrés celular. [75]

El proteasoma 20S es ubicuo y esencial en eucariotas y arqueas. El orden bacteriano Actinomycetales también comparte homólogos del proteasoma 20S, mientras que la mayoría de las bacterias poseen genes de choque térmico hslV y hslU , cuyos productos génicos son una proteasa multimérica dispuesta en un anillo de dos capas y una ATPasa. [76] Se ha planteado la hipótesis de que la proteína hslV se parece al probable ancestro del proteasoma 20S. [77] En general, HslV no es esencial en bacterias, y no todas las bacterias lo poseen, mientras que algunos protistas poseen tanto el sistema 20S como el hslV. [76] Muchas bacterias también poseen otros homólogos del proteasoma y una ATPasa asociada, sobre todo ClpP y ClpX . Esta redundancia explica por qué el sistema HslUV no es esencial.
El análisis de secuencias sugiere que las subunidades β catalíticas divergieron antes en la evolución que las subunidades α predominantemente estructurales. En las bacterias que expresan un proteosoma 20S, las subunidades β tienen una alta identidad de secuencia con las subunidades β arqueales y eucariotas, mientras que la identidad de secuencia α es mucho menor. La presencia de proteosomas 20S en bacterias puede ser resultado de la transferencia lateral de genes , mientras que la diversificación de subunidades entre eucariotas se atribuye a múltiples eventos de duplicación de genes . [76]
La progresión del ciclo celular está controlada por la acción ordenada de las quinasas dependientes de ciclina (CDK), activadas por ciclinas específicas que delimitan las fases del ciclo celular . Las ciclinas mitóticas, que persisten en la célula durante solo unos minutos, tienen una de las vidas medias más cortas de todas las proteínas intracelulares. [1] Después de que un complejo CDK-ciclina ha realizado su función, la ciclina asociada es poliubiquitinada y destruida por el proteasoma, lo que proporciona direccionalidad al ciclo celular. En particular, la salida de la mitosis requiere la disociación dependiente del proteasoma del componente regulador ciclina B del complejo del factor promotor de la mitosis . [78] En las células de vertebrados , el "deslizamiento" a través del punto de control mitótico que conduce a la salida prematura de la fase M puede ocurrir a pesar del retraso de esta salida por el punto de control del huso . [79]
Los puntos de control del ciclo celular anteriores, como el control posterior al punto de restricción entre la fase G1 y la fase S , también implican la degradación proteosomal de la ciclina A , cuya ubiquitinación es promovida por el complejo promotor de anafase (APC), una ligasa de ubiquitina E3 . [80] El APC y el complejo proteico Skp1/Cul1/F-box ( complejo SCF ) son los dos reguladores clave de la degradación de la ciclina y el control del punto de control; el propio SCF está regulado por el APC a través de la ubiquitinación de la proteína adaptadora, Skp2, que previene la actividad de SCF antes de la transición G1-S. [81]
Los componentes individuales de la partícula 19S tienen sus propias funciones reguladoras. La ganquirina , una oncoproteína identificada recientemente , es uno de los subcomponentes de la 19S que también se une firmemente a la quinasa dependiente de ciclina CDK4 y desempeña un papel clave en el reconocimiento de p53 ubiquitinado , a través de su afinidad por la ubiquitina ligasa MDM2 . La ganquirina es antiapoptótica y se ha demostrado que se sobreexpresa en algunos tipos de células tumorales como el carcinoma hepatocelular . [82]
Al igual que los eucariotas, algunas arqueas también utilizan el proteasoma para controlar el ciclo celular, específicamente controlando la división celular mediada por ESCRT -III. [83]
En las plantas , la señalización por auxinas , o fitohormonas que ordenan la dirección y el tropismo del crecimiento de la planta, induce la selección de una clase de represores de factores de transcripción conocidos como proteínas Aux/IAA para la degradación proteasomal. Estas proteínas son ubiquitinadas por SCFTIR1, o SCF en complejo con el receptor de auxina TIR1. La degradación de las proteínas Aux/IAA desreprime los factores de transcripción en la familia del factor de respuesta a la auxina (ARF) e induce la expresión génica dirigida por ARF. [84] Las consecuencias celulares de la activación de ARF dependen del tipo de planta y la etapa de desarrollo, pero están involucradas en la dirección del crecimiento en las raíces y las venas de las hojas. Se cree que la respuesta específica a la desrepresión de ARF está mediada por la especificidad en el emparejamiento de proteínas individuales ARF y Aux/IAA. [85]
Tanto las señales internas como las externas pueden conducir a la inducción de la apoptosis o muerte celular programada. La deconstrucción resultante de los componentes celulares se lleva a cabo principalmente por proteasas especializadas conocidas como caspasas , pero el proteasoma también desempeña papeles importantes y diversos en el proceso apoptótico. La participación del proteasoma en este proceso está indicada tanto por el aumento de la ubiquitinación de proteínas como de las enzimas E1, E2 y E3 que se observa mucho antes de la apoptosis. [86] [87] [88] Durante la apoptosis, también se ha observado que los proteasomas localizados en el núcleo se translocan a ampollas de membrana externa características de la apoptosis. [89]
La inhibición del proteasoma tiene diferentes efectos en la inducción de la apoptosis en diferentes tipos de células. En general, el proteasoma no es necesario para la apoptosis, aunque inhibirlo es proapoptótico en la mayoría de los tipos de células que se han estudiado. La apoptosis está mediada por la interrupción de la degradación regulada de las proteínas del ciclo celular pro-crecimiento. [90] Sin embargo, algunas líneas celulares, en particular, cultivos primarios de células quiescentes y diferenciadas como timocitos y neuronas , no pueden experimentar apoptosis al exponerse a inhibidores del proteasoma. El mecanismo de este efecto no está claro, pero se plantea la hipótesis de que es específico de las células en estados quiescentes, o que resulta de la actividad diferencial de la quinasa proapoptótica JNK . [91] La capacidad de los inhibidores del proteasoma para inducir la apoptosis en células que se dividen rápidamente se ha explotado en varios agentes de quimioterapia desarrollados recientemente , como bortezomib y salinosporamida A.
En respuesta a estreses celulares, como infecciones , choque térmico o daño oxidativo , se expresan proteínas de choque térmico que identifican proteínas mal plegadas o desplegadas y las seleccionan para su degradación proteasomal. Tanto Hsp27 como Hsp90 ( proteínas chaperonas ) han sido implicadas en el aumento de la actividad del sistema ubiquitina-proteasoma, aunque no son participantes directos en el proceso. [92] Hsp70 , por otro lado, se une a parches hidrofóbicos expuestos en la superficie de proteínas mal plegadas y recluta ligasas de ubiquitina E3 como CHIP para marcar las proteínas para la degradación proteasomal. [93] La proteína CHIP (extremo carboxilo terminal de la proteína que interactúa con Hsp70) se regula a través de la inhibición de las interacciones entre la enzima E3 CHIP y su pareja de unión E2. [94]
Existen mecanismos similares para promover la degradación de proteínas dañadas oxidativamente a través del sistema del proteasoma. En particular, los proteasomas localizados en el núcleo están regulados por PARP y degradan activamente histonas oxidadas de manera inapropiada . [95] Las proteínas oxidadas, que a menudo forman grandes agregados amorfos en la célula, pueden degradarse directamente por la partícula central 20S sin la tapa reguladora 19S y no requieren hidrólisis de ATP ni marcado con ubiquitina. [75] Sin embargo, los altos niveles de daño oxidativo aumentan el grado de reticulación entre fragmentos de proteínas, lo que hace que los agregados sean resistentes a la proteólisis. Un mayor número y tamaño de estos agregados altamente oxidados se asocia con el envejecimiento . [96]
La desregulación del sistema de proteosoma de ubiquitina puede contribuir a varias enfermedades neuronales. Puede conducir a tumores cerebrales como astrocitomas . [97] En algunas de las enfermedades neurodegenerativas de aparición tardía que comparten la agregación de proteínas mal plegadas como una característica común, como la enfermedad de Parkinson y la enfermedad de Alzheimer , se pueden formar grandes agregados insolubles de proteínas mal plegadas y luego resultar en neurotoxicidad , a través de mecanismos que aún no se comprenden bien. Se ha sugerido que la disminución de la actividad del proteosoma es una causa de la agregación y la formación de cuerpos de Lewy en el Parkinson. [98] Esta hipótesis está respaldada por la observación de que los modelos de levadura de Parkinson son más susceptibles a la toxicidad de la α-sinucleína , el principal componente proteico de los cuerpos de Lewy, en condiciones de baja actividad del proteosoma. [99] La actividad proteosomal deteriorada puede ser la base de trastornos cognitivos como los trastornos del espectro autista y enfermedades musculares y nerviosas como la miopatía por cuerpos de inclusión . [97]
El proteasoma desempeña un papel sencillo pero crítico en la función del sistema inmune adaptativo . Los antígenos peptídicos son mostrados por las proteínas del complejo mayor de histocompatibilidad clase I (MHC) en la superficie de las células presentadoras de antígenos . Estos péptidos son productos de la degradación proteasomal de proteínas originadas por el patógeno invasor . Aunque los proteasomas expresados constitutivamente pueden participar en este proceso, un complejo especializado compuesto de proteínas, cuya expresión es inducida por interferón gamma , son los principales productores de péptidos que son óptimos en tamaño y composición para la unión al MHC. Estas proteínas cuya expresión aumenta durante la respuesta inmune incluyen la partícula reguladora 11S, cuyo principal papel biológico conocido es regular la producción de ligandos del MHC, y subunidades β especializadas llamadas β1i, β2i y β5i con especificidad de sustrato alterada. El complejo formado con las subunidades β especializadas se conoce como inmunoproteasoma . [16] Otra subunidad variante de β5i, β5t, se expresa en el timo, lo que da lugar a un " timoproteasoma " específico del timo cuya función aún no está clara. [100]
La fuerza de unión del ligando del MHC de clase I depende de la composición del extremo C del ligando , ya que los péptidos se unen mediante enlaces de hidrógeno y por contactos estrechos con una región llamada "bolsillo B" en la superficie del MHC. Muchos alelos del MHC de clase I prefieren residuos C-terminales hidrofóbicos, y es más probable que el complejo inmunoproteasoma genere extremos C hidrofóbicos. [101]
Debido a su papel en la generación de la forma activada de NF-κB , un regulador antiapoptótico y proinflamatorio de la expresión de citocinas , la actividad proteasómica se ha relacionado con enfermedades inflamatorias y autoinmunes . Los niveles aumentados de actividad del proteasoma se correlacionan con la actividad de la enfermedad y se han implicado en enfermedades autoinmunes, incluido el lupus eritematoso sistémico y la artritis reumatoide . [16]
El proteasoma también participa en la proteólisis intracelular mediada por anticuerpos de los viriones unidos a ellos. En esta vía de neutralización, TRIM21 (una proteína de la familia de motivos tripartitos) se une a la inmunoglobulina G para dirigir el virión al proteasoma, donde se degrada. [102]
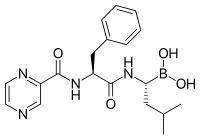
Los inhibidores del proteasoma tienen una actividad antitumoral eficaz en cultivos celulares , induciendo la apoptosis al interrumpir la degradación regulada de las proteínas del ciclo celular pro-crecimiento. [90] Este enfoque de inducir selectivamente la apoptosis en células tumorales ha demostrado ser eficaz en modelos animales y ensayos en humanos.
La lactacistina , un producto natural sintetizado por la bacteria Streptomyces , fue el primer inhibidor no peptídico del proteasoma descubierto [103] y se utiliza ampliamente como herramienta de investigación en bioquímica y biología celular. La lactacistina fue licenciada a Myogenics/Proscript, que fue adquirida por Millennium Pharmaceuticals , ahora parte de Takeda Pharmaceuticals . La lactacistina modifica covalentemente la treonina amino-terminal de las subunidades β catalíticas del proteasoma, particularmente la subunidad β5 responsable de la actividad similar a la quimotripsina del proteasoma. Este descubrimiento ayudó a establecer el proteasoma como una clase de proteasa mecanísticamente novedosa: una proteasa de treonina amino-terminal .
Bortezomib (Boronated MG132), una molécula desarrollada por Millennium Pharmaceuticals y comercializada como Velcade, es el primer inhibidor del proteasoma en alcanzar el uso clínico como agente de quimioterapia . [104] Bortezomib se utiliza en el tratamiento del mieloma múltiple . [105] En particular, se ha observado que el mieloma múltiple produce un aumento de los niveles de péptidos derivados del proteasoma en el suero sanguíneo que disminuyen a niveles normales en respuesta a una quimioterapia exitosa. [106] Estudios en animales han indicado que bortezomib también puede tener efectos clínicamente significativos en el cáncer de páncreas . [107] [108] Se han iniciado estudios preclínicos y clínicos tempranos para examinar la eficacia de bortezomib en el tratamiento de otros cánceres relacionados con las células B , [109] particularmente algunos tipos de linfoma no Hodgkin . [110] Los resultados clínicos también parecen justificar el uso de inhibidores del proteasoma combinados con quimioterapia para la leucemia linfoblástica aguda de células B. [111] Los inhibidores del proteasoma pueden matar algunos tipos de células leucémicas cultivadas que son resistentes a los glucocorticoides. [112]
La molécula ritonavir , comercializada como Norvir, fue desarrollada como un inhibidor de la proteasa y utilizada para atacar la infección por VIH . Sin embargo, se ha demostrado que inhibe los proteasomas así como las proteasas libres; para ser más específicos, la actividad similar a la quimotripsina del proteasoma es inhibida por ritonavir, mientras que la actividad similar a la tripsina es algo mejorada. [113] Estudios en modelos animales sugieren que el ritonavir puede tener efectos inhibidores sobre el crecimiento de células de glioma . [114]
Los inhibidores del proteasoma también han demostrado ser prometedores en el tratamiento de enfermedades autoinmunes en modelos animales. Por ejemplo, estudios en ratones portadores de injertos de piel humana encontraron una reducción en el tamaño de las lesiones de psoriasis después del tratamiento con un inhibidor del proteasoma. [115] Los inhibidores también muestran efectos positivos en modelos de asma en roedores . [116]
El marcado y la inhibición del proteosoma también son de interés en el laboratorio, tanto para el estudio in vitro como in vivo de la actividad proteosomal en las células. Los inhibidores de laboratorio más utilizados son la lactacistina y el péptido aldehído MG132, desarrollado inicialmente por el laboratorio Goldberg. También se han desarrollado inhibidores fluorescentes para marcar específicamente los sitios activos del proteosoma ensamblado. [117]
El proteasoma y sus subunidades tienen importancia clínica por al menos dos razones: (1) un ensamblaje complejo comprometido o un proteasoma disfuncional puede estar asociado con la fisiopatología subyacente de enfermedades específicas, y (2) pueden explotarse como dianas farmacológicas para intervenciones terapéuticas. Más recientemente, se ha hecho un mayor esfuerzo para considerar el proteasoma para el desarrollo de nuevos marcadores y estrategias de diagnóstico. Una comprensión mejor y más completa de la fisiopatología del proteasoma debería conducir a aplicaciones clínicas en el futuro.
Los proteosomas forman un componente fundamental para el sistema ubiquitina-proteosoma (UPS) [118] y el correspondiente Control de Calidad de Proteínas (PQC) celular. La ubiquitinación de proteínas y la posterior proteólisis y degradación por el proteosoma son mecanismos importantes en la regulación del ciclo celular , el crecimiento y la diferenciación celular , la transcripción genética, la transducción de señales y la apoptosis . [119] Los defectos del proteosoma conducen a una actividad proteolítica reducida y a la acumulación de proteínas dañadas o mal plegadas, lo que puede contribuir a enfermedades neurodegenerativas, [120] [121] enfermedades cardiovasculares, [122] [123] [124] respuestas inflamatorias y enfermedades autoinmunes, [125] y respuestas sistémicas al daño del ADN que conducen a neoplasias malignas . [126]
La investigación ha implicado defectos del UPS en la patogénesis de trastornos neurodegenerativos y miodegenerativos, incluyendo la enfermedad de Alzheimer , [127] la enfermedad de Parkinson [128] y la enfermedad de Pick , [129] la esclerosis lateral amiotrófica (ELA), [129] la enfermedad de Huntington , [128] la enfermedad de Creutzfeldt-Jakob , [130] y enfermedades de la neurona motora, enfermedades de poliglutamina (PolyQ), distrofias musculares [131] y varias formas raras de enfermedades neurodegenerativas asociadas con la demencia . [132] Como parte del sistema ubiquitina-proteasoma (UPS), el proteasoma mantiene la homeostasis de proteínas cardíacas y, por lo tanto, juega un papel importante en la lesión isquémica cardíaca , [133] la hipertrofia ventricular [134] y la insuficiencia cardíaca . [135] Además, se está acumulando evidencia de que el UPS juega un papel esencial en la transformación maligna. La proteólisis del UPS desempeña un papel importante en las respuestas de las células cancerosas a las señales estimulantes que son fundamentales para el desarrollo del cáncer. En consecuencia, la expresión génica por degradación de factores de transcripción , como p53 , c-jun , c-Fos , NF-κB , c-Myc , HIF-1α, MATα2, STAT3 , proteínas de unión a elementos regulados por esteroles y receptores de andrógenos, están todos controlados por el UPS y, por lo tanto, están involucrados en el desarrollo de varias neoplasias malignas. [136] Además, el UPS regula la degradación de productos de genes supresores de tumores como la poliposis adenomatosa coli (APC) en el cáncer colorrectal, el retinoblastoma (Rb) y el supresor de tumores de von Hippel–Lindau (VHL), así como una serie de protooncogenes ( Raf , Myc , Myb , Rel , Src , Mos , ABL ). El UPS también está involucrado en la regulación de las respuestas inflamatorias. Esta actividad se atribuye generalmente al papel de los proteasomas en la activación de NF-κB que regula además la expresión de citocinas proinflamatorias como TNF-α , IL-β, IL-8 , moléculas de adhesión ( ICAM-1 , VCAM-1 , P-selectina ) yprostaglandinas y óxido nítrico (NO). [125] Además, el UPS también juega un papel en las respuestas inflamatorias como reguladores de la proliferación de leucocitos, principalmente a través de la proteólisis de ciclinas y la degradación de inhibidores de CDK . [137] Por último, los pacientes con enfermedades autoinmunes como LES , síndrome de Sjögren y artritis reumatoide (AR) exhiben predominantemente proteasomas circulantes que pueden aplicarse como biomarcadores clínicos. [138]