El cloro es un elemento químico de símbolo Cl y número atómico 17. Es el segundo halógeno más ligero , aparece entre el flúor y el bromo en la tabla periódica y sus propiedades son en su mayoría intermedias entre ellas. El cloro es un gas de color amarillo verdoso a temperatura ambiente. Es un elemento extremadamente reactivo y un fuerte agente oxidante : entre los elementos, tiene la mayor afinidad electrónica y la tercera mayor electronegatividad en la escala de Pauling revisada , solo detrás del oxígeno y el flúor.
El cloro jugó un papel importante en los experimentos realizados por los alquimistas medievales , que comúnmente implicaban el calentamiento de sales de cloruro como el cloruro de amonio ( sal amoniacal ) y el cloruro de sodio ( sal común ), produciendo varias sustancias químicas que contenían cloro, como el cloruro de hidrógeno , el cloruro de mercurio (II) (sublimado corrosivo) y el agua regia . Sin embargo, la naturaleza del gas de cloro libre como una sustancia separada solo fue reconocida alrededor de 1630 por Jan Baptist van Helmont . Carl Wilhelm Scheele escribió una descripción del gas de cloro en 1774, suponiendo que era un óxido de un nuevo elemento. En 1809, los químicos sugirieron que el gas podría ser un elemento puro, y esto fue confirmado por Sir Humphry Davy en 1810, quien lo nombró en honor al griego antiguo χλωρός ( khlōrós , "verde pálido") debido a su color.
Debido a su gran reactividad, todo el cloro presente en la corteza terrestre se presenta en forma de compuestos iónicos de cloruro , entre los que se incluye la sal de mesa. Es el segundo halógeno más abundante (después del flúor) y el vigésimo elemento más abundante en la corteza terrestre. Sin embargo, estos depósitos de cristales son pequeños comparados con las enormes reservas de cloruro en el agua de mar.
El cloro elemental se produce comercialmente a partir de salmuera por electrólisis , predominantemente en el proceso cloro-álcali . El alto potencial oxidante del cloro elemental condujo al desarrollo de blanqueadores y desinfectantes comerciales , y un reactivo para muchos procesos en la industria química. El cloro se utiliza en la fabricación de una amplia gama de productos de consumo, alrededor de dos tercios de ellos productos químicos orgánicos como el cloruro de polivinilo (PVC), muchos intermediarios para la producción de plásticos y otros productos finales que no contienen el elemento. Como desinfectante común, el cloro elemental y los compuestos generadores de cloro se utilizan más directamente en las piscinas para mantenerlas higiénicas . El cloro elemental en alta concentración es extremadamente peligroso y venenoso para la mayoría de los organismos vivos. Como agente de guerra química , el cloro se utilizó por primera vez en la Primera Guerra Mundial como arma de gas venenoso .
El cloro, en forma de iones de cloruro , es necesario para todas las especies de vida conocidas. Otros tipos de compuestos de cloro son raros en los organismos vivos, y los compuestos orgánicos clorados producidos artificialmente varían de inertes a tóxicos. En la atmósfera superior , las moléculas orgánicas que contienen cloro, como los clorofluorocarbonos, se han visto implicadas en el agotamiento del ozono . Se generan pequeñas cantidades de cloro elemental por oxidación de iones de cloruro en los neutrófilos como parte de una respuesta del sistema inmunológico contra las bacterias.
El compuesto más común del cloro, el cloruro de sodio, se conoce desde la antigüedad; los arqueólogos han encontrado evidencia de que la sal de roca se utilizaba ya en el año 3000 a. C. y la salmuera ya en el año 6000 a. C. [10]
Alrededor de 900, los autores de los escritos árabes atribuidos a Jabir ibn Hayyan (latín: Geber) y el médico y alquimista persa Abu Bakr al-Razi ( c. 865-925, latín: Rhazes) estaban experimentando con sal amónica ( cloruro de amonio ), que cuando se destilaba junto con vitriolo ( sulfatos hidratados de varios metales) producía cloruro de hidrógeno . [11] Sin embargo, parece que en estos primeros experimentos con sales de cloruro , los productos gaseosos fueron descartados, y el cloruro de hidrógeno puede haber sido producido muchas veces antes de que se descubriera que se puede utilizar en usos químicos. [12] Uno de los primeros usos de este tipo fue la síntesis de cloruro de mercurio (II) (sublimado corrosivo), cuya producción a partir del calentamiento del mercurio ya sea con alumbre y cloruro de amonio o con vitriolo y cloruro de sodio se describió por primera vez en el De aluminibus et salibus ("Sobre alumbres y sales", un texto árabe del siglo XI o XII falsamente atribuido a Abu Bakr al-Razi y traducido al latín en la segunda mitad del siglo XII por Gerardo de Cremona , 1144-1187). [13] Otro desarrollo importante fue el descubrimiento de pseudo-Geber (en el De inventione veritatis , "Sobre el descubrimiento de la verdad", después de c. 1300) de que añadiendo cloruro de amonio al ácido nítrico , se podía producir un disolvente fuerte capaz de disolver el oro (es decir, agua regia ). [14] Aunque el agua regia es una mezcla inestable que continuamente emite vapores que contienen gas cloro libre, este gas cloro parece haber sido ignorado hasta alrededor de 1630, cuando su naturaleza como sustancia gaseosa separada fue reconocida por el químico y médico brabantiano Jan Baptist van Helmont . [15] [en 1]

El elemento fue estudiado en detalle por primera vez en 1774 por el químico sueco Carl Wilhelm Scheele , y se le atribuye el descubrimiento. [16] [17] Scheele produjo cloro al hacer reaccionar MnO 2 (como el mineral pirolusita ) con HCl: [15]
Scheele observó varias de las propiedades del cloro: el efecto blanqueador sobre el tornasol , el efecto mortal sobre los insectos, el color verde amarillento y el olor similar al agua regia . [18] Lo llamó " aire de ácido muriático desflogistizado " ya que es un gas (entonces llamado "aires") y provenía del ácido clorhídrico (entonces conocido como "ácido muriático"). [17] No logró establecer el cloro como un elemento. [17]
La teoría química común en ese momento sostenía que un ácido es un compuesto que contiene oxígeno (restos de esto sobreviven en los nombres alemanes y holandeses del oxígeno : sauerstoff o zuurstof , ambos traducidos al inglés como sustancia ácida ), por lo que varios químicos, incluido Claude Berthollet , sugirieron que el ácido muriático desflogistizado de Scheele, el aire, debe ser una combinación de oxígeno y el elemento aún no descubierto, muriaticum . [19] [20]
En 1809, Joseph Louis Gay-Lussac y Louis-Jacques Thénard intentaron descomponer el aire desflogistizado con ácido muriático haciéndolo reaccionar con carbón para liberar el elemento libre muriaticum (y dióxido de carbono). [17] No tuvieron éxito y publicaron un informe en el que consideraron la posibilidad de que el aire desflogistizado con ácido muriático fuera un elemento, pero no estaban convencidos. [21]
En 1810, Sir Humphry Davy intentó el mismo experimento nuevamente y concluyó que la sustancia era un elemento y no un compuesto. [17] Anunció sus resultados a la Royal Society el 15 de noviembre de ese año. [15] En ese momento, nombró a este nuevo elemento "cloro", de la palabra griega χλωρος ( chlōros , "verde-amarillo"), en referencia a su color. [22] El nombre " halógeno ", que significa "productor de sal", fue utilizado originalmente para el cloro en 1811 por Johann Salomo Christoph Schweigger . [23] Este término se utilizó más tarde como término genérico para describir todos los elementos de la familia del cloro (flúor, bromo, yodo), después de una sugerencia de Jöns Jakob Berzelius en 1826. [24] [25] En 1823, Michael Faraday licuó el cloro por primera vez, [26] [27] [28] y demostró que lo que entonces se conocía como "cloro sólido" tenía una estructura de hidrato de cloro (Cl 2 ·H 2 O). [15]
El químico francés Claude Berthollet fue el primero en utilizar gas cloro para blanquear textiles en 1785. [29] [30] Los blanqueadores modernos resultaron del trabajo posterior de Berthollet, quien produjo por primera vez hipoclorito de sodio en 1789 en su laboratorio en la ciudad de Javel (ahora parte de París , Francia), al pasar gas cloro a través de una solución de carbonato de sodio. El líquido resultante, conocido como " Eau de Javel " (" agua de Javel "), era una solución débil de hipoclorito de sodio . Este proceso no era muy eficiente y se buscaron métodos de producción alternativos. El químico e industrial escocés Charles Tennant produjo primero una solución de hipoclorito de calcio ("cal clorada"), luego hipoclorito de calcio sólido (polvo blanqueador). [29] Estos compuestos producían niveles bajos de cloro elemental y podían transportarse de manera más eficiente que el hipoclorito de sodio, que permanecía como soluciones diluidas porque cuando se purificaba para eliminar el agua, se convertía en un oxidante peligrosamente poderoso e inestable. A finales del siglo XIX, ES Smith patentó un método de producción de hipoclorito de sodio que implicaba la electrólisis de salmuera para producir hidróxido de sodio y gas cloro, que luego se mezclaban para formar hipoclorito de sodio. [31] Esto se conoce como el proceso clorálcali , introducido por primera vez a escala industrial en 1892, y ahora la fuente de la mayoría del cloro elemental y el hidróxido de sodio. [32] En 1884, Chemischen Fabrik Griesheim de Alemania desarrolló otro proceso clorálcali que entró en producción comercial en 1888. [33]
Las soluciones de cloro elemental disueltas en agua químicamente básica ( hipoclorito de sodio y calcio ) se utilizaron por primera vez como agentes antiputrefacción y desinfectantes en la década de 1820, en Francia, mucho antes del establecimiento de la teoría de los gérmenes como causa de las enfermedades . Esta práctica fue iniciada por Antoine-Germain Labarraque , quien adaptó el blanqueador "agua de Javel" de Berthollet y otras preparaciones de cloro. [34] Desde entonces, el cloro elemental ha cumplido una función continua en la antisepsia tópica (soluciones de irrigación de heridas y similares) y el saneamiento público, particularmente en la natación y el agua potable. [18]
El gas cloro fue utilizado por primera vez como arma el 22 de abril de 1915, en la Segunda Batalla de Ypres por el Ejército alemán . [35] [36] El efecto sobre los aliados fue devastador porque las máscaras de gas existentes eran difíciles de desplegar y no habían sido ampliamente distribuidas. [37] [38]



El cloro es el segundo halógeno , siendo un no metal en el grupo 17 de la tabla periódica. Sus propiedades son similares a las del flúor , bromo y yodo , y son en gran medida intermedias entre las de los dos primeros. El cloro tiene la configuración electrónica [Ne]3s23p5 , con los siete electrones en la tercera y más externa capa actuando como sus electrones de valencia . Como todos los halógenos, le falta un electrón para completar un octeto, y por lo tanto es un agente oxidante fuerte, que reacciona con muchos elementos para completar su capa externa. [39] En correspondencia con las tendencias periódicas , es intermedio en electronegatividad entre el flúor y el bromo (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66), y es menos reactivo que el flúor y más reactivo que el bromo. También es un agente oxidante más débil que el flúor, pero más fuerte que el bromo. Por el contrario, el ion cloruro es un agente reductor más débil que el bromuro, pero más fuerte que el fluoruro. [39] Es intermedio en radio atómico entre el flúor y el bromo, y esto lleva a que muchas de sus propiedades atómicas continúen de manera similar la tendencia del yodo al bromo hacia arriba, como la primera energía de ionización , la afinidad electrónica , la entalpía de disociación de la molécula X 2 (X = Cl, Br, I), el radio iónico y la longitud del enlace X–X. (El flúor es anómalo debido a su pequeño tamaño). [39]
Los cuatro halógenos estables experimentan fuerzas de atracción intermoleculares de van der Waals , y su fuerza aumenta junto con el número de electrones entre todas las moléculas de halógeno diatómico homonuclear. Por lo tanto, los puntos de fusión y ebullición del cloro son intermedios entre los del flúor y el bromo: el cloro se funde a -101,0 °C y hierve a -34,0 °C. Como resultado del aumento del peso molecular de los halógenos a lo largo del grupo, la densidad y los calores de fusión y vaporización del cloro son de nuevo intermedios entre los del bromo y el flúor, aunque todos sus calores de vaporización son bastante bajos (lo que conduce a una alta volatilidad) gracias a su estructura molecular diatómica. [39] Los halógenos se oscurecen a medida que se desciende en el grupo: así, mientras que el flúor es un gas amarillo pálido, el cloro es claramente verde amarillento. Esta tendencia se produce porque las longitudes de onda de la luz visible absorbida por los halógenos aumentan a lo largo del grupo. [39] En concreto, el color de un halógeno, como el cloro, resulta de la transición electrónica entre el orbital molecular antienlazante π g más alto ocupado y el orbital molecular antienlazante σ u más bajo vacante . [40] El color se desvanece a bajas temperaturas, de modo que el cloro sólido a -195 °C es casi incoloro. [39]
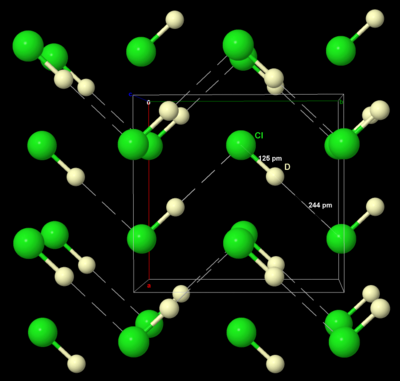
Al igual que el bromo y el yodo sólidos, el cloro sólido cristaliza en el sistema cristalino ortorrómbico , en una red estratificada de moléculas de Cl 2 . La distancia Cl–Cl es de 198 pm (cercana a la distancia Cl–Cl gaseoso de 199 pm) y la distancia Cl···Cl entre moléculas es de 332 pm dentro de una capa y de 382 pm entre capas (compárese con el radio de van der Waals del cloro, 180 pm). Esta estructura significa que el cloro es un muy mal conductor de electricidad y, de hecho, su conductividad es tan baja que es prácticamente inmensurable. [39]
El cloro tiene dos isótopos estables, 35 Cl y 37 Cl. Estos son sus únicos dos isótopos naturales que se encuentran en grandes cantidades, con 35 Cl constituyendo el 76% del cloro natural y 37 Cl constituyendo el 24% restante. Ambos se sintetizan en estrellas en los procesos de quema de oxígeno y de quema de silicio . [41] Ambos tienen un espín nuclear 3/2+ y por lo tanto pueden usarse para resonancia magnética nuclear , aunque la magnitud del espín es mayor que 1/2 da como resultado una distribución de carga nuclear no esférica y, por lo tanto, una ampliación de la resonancia como resultado de un momento cuadrupolar nuclear distinto de cero y la relajación cuadrupolar resultante. Los otros isótopos del cloro son todos radiactivos, con vidas medias demasiado cortas para ocurrir en la naturaleza de manera primordial . De estos, los más utilizados en el laboratorio son el 36 Cl ( t 1/2 = 3,0×10 5 y) y el 38 Cl ( t 1/2 = 37,2 min), que pueden producirse a partir de la activación neutrónica del cloro natural. [39]
El radioisótopo de cloro más estable es el 36 Cl. El modo de desintegración principal de los isótopos más ligeros que el 35 Cl es la captura de electrones a isótopos de azufre ; el de los isótopos más pesados que el 37 Cl es la desintegración beta a isótopos de argón ; y el 36 Cl puede desintegrarse por cualquier modo a 36 S o 36 Ar estables. [42] El 36 Cl se presenta en cantidades traza en la naturaleza como un nucleido cosmogénico en una proporción de aproximadamente (7–10) × 10 −13 a 1 con isótopos de cloro estables: se produce en la atmósfera por espalación de 36 Ar por interacciones con protones de rayos cósmicos . En el metro superior de la litosfera , el 36 Cl se genera principalmente por activación de neutrones térmicos de 35 Cl y espalación de 39 K y 40 Ca. En el entorno del subsuelo, la captura de muones por 40 Ca se vuelve más importante como una forma de generar 36 Cl. [43] [44]
El cloro es intermedio en reactividad entre el flúor y el bromo, y es uno de los elementos más reactivos. El cloro es un agente oxidante más débil que el flúor, pero más fuerte que el bromo o el yodo. Esto se puede ver a partir de los potenciales de electrodo estándar de las parejas X 2 /X − (F, +2,866 V; Cl, +1,395 V; Br, +1,087 V; I, +0,615 V; At , aproximadamente +0,3 V). Sin embargo, esta tendencia no se muestra en las energías de enlace porque el flúor es singular debido a su pequeño tamaño, baja polarizabilidad e incapacidad para mostrar hipervalencia . Como otra diferencia, el cloro tiene una química significativa en estados de oxidación positivos mientras que el flúor no. La cloración a menudo conduce a estados de oxidación más altos que la bromación o la yodación, pero a estados de oxidación más bajos que la fluoración. El cloro tiende a reaccionar con compuestos que incluyen enlaces M–M, M–H o M–C para formar enlaces M–Cl. [40]
Dado que E°( 1/2 O 2 /H 2 O) = +1,229 V, que es menor que +1,395 V, se esperaría que el cloro pudiera oxidar el agua a oxígeno y ácido clorhídrico. Sin embargo, la cinética de esta reacción es desfavorable, y también hay que considerar un efecto de sobrepotencial de burbuja , de modo que la electrólisis de soluciones acuosas de cloruro desprende gas cloro y no gas oxígeno, un hecho que resulta muy útil para la producción industrial de cloro. [45]
El compuesto de cloro más simple es el cloruro de hidrógeno , HCl, un químico importante en la industria y en el laboratorio, tanto en forma de gas como disuelto en agua como ácido clorhídrico . A menudo se produce quemando gas hidrógeno en gas de cloro, o como subproducto de la cloración de hidrocarburos . Otro enfoque es tratar el cloruro de sodio con ácido sulfúrico concentrado para producir ácido clorhídrico, también conocido como el proceso de "torta de sal": [46]
En el laboratorio, el cloruro de hidrógeno gaseoso se puede producir secando el ácido con ácido sulfúrico concentrado. El cloruro de deuterio, DCl, se puede producir haciendo reaccionar el cloruro de benzoilo con agua pesada (D 2 O). [46]
A temperatura ambiente, el cloruro de hidrógeno es un gas incoloro, como todos los haluros de hidrógeno excepto el fluoruro de hidrógeno , ya que el hidrógeno no puede formar fuertes enlaces de hidrógeno con el átomo de cloro electronegativo más grande; sin embargo, los enlaces de hidrógeno débiles están presentes en el cloruro de hidrógeno cristalino sólido a bajas temperaturas, similar a la estructura del fluoruro de hidrógeno, antes de que el desorden comience a prevalecer a medida que aumenta la temperatura. [46] El ácido clorhídrico es un ácido fuerte (p K a = −7) porque los enlaces de hidrógeno con el cloro son demasiado débiles para inhibir la disociación. El sistema HCl/H 2 O tiene muchos hidratos HCl· n H 2 O para n = 1, 2, 3, 4 y 6. Más allá de una mezcla 1:1 de HCl y H 2 O, el sistema se separa completamente en dos fases líquidas separadas. El ácido clorhídrico forma un azeótropo con un punto de ebullición de 108,58 °C a 20,22 g de HCl por 100 g de solución; Por lo tanto, el ácido clorhídrico no se puede concentrar más allá de este punto mediante destilación. [47]
A diferencia del fluoruro de hidrógeno, el cloruro de hidrógeno líquido anhidro es difícil de trabajar como disolvente, porque su punto de ebullición es bajo, tiene un rango líquido pequeño, su constante dieléctrica es baja y no se disocia apreciablemente en H 2 Cl + y HCl.−
2iones – estos últimos, en cualquier caso, son mucho menos estables que los iones bifluoruro ( HF−
2) debido al enlace de hidrógeno muy débil entre el hidrógeno y el cloro, aunque sus sales con cationes muy grandes y débilmente polarizantes como Cs + y NR+
4(R = Me , Et , Bu n ) todavía se puede aislar. El cloruro de hidrógeno anhidro es un disolvente deficiente, que solo puede disolver compuestos de pequeño peso molecular como el cloruro de nitrosilo y el fenol , o sales con energías reticulares muy bajas como los haluros de tetraalquilamonio. Protona fácilmente los electrófilos que contienen pares solitarios o enlaces π. La solvólisis , las reacciones de sustitución de ligandos y las oxidaciones están bien caracterizadas en la solución de cloruro de hidrógeno: [48]
-chloride-hexahydrate-sample.jpg/440px-Nickel(II)-chloride-hexahydrate-sample.jpg)
Casi todos los elementos de la tabla periódica forman cloruros binarios. Las excepciones son decididamente minoritarias y se deben en cada caso a una de tres causas: extrema inercia y renuencia a participar en reacciones químicas (los gases nobles , con la excepción del xenón en los altamente inestables XeCl 2 y XeCl 4 ); extrema inestabilidad nuclear que dificulta la investigación química antes de la desintegración y la transmutación (muchos de los elementos más pesados más allá del bismuto ); y tener una electronegatividad mayor que la del cloro ( oxígeno y flúor ) de modo que los compuestos binarios resultantes no son formalmente cloruros sino más bien óxidos o fluoruros de cloro. [49] Aunque el nitrógeno en NCl 3 tiene una carga negativa, el compuesto suele llamarse tricloruro de nitrógeno .
La cloración de metales con Cl 2 suele conducir a un estado de oxidación más alto que la bromación con Br 2 cuando hay varios estados de oxidación disponibles, como en MoCl 5 y MoBr 3 . Los cloruros se pueden formar por reacción de un elemento o su óxido, hidróxido o carbonato con ácido clorhídrico, y luego deshidratarse mediante temperaturas ligeramente altas combinadas con baja presión o gas de cloruro de hidrógeno anhidro. Estos métodos funcionan mejor cuando el producto de cloruro es estable a la hidrólisis; de lo contrario, las posibilidades incluyen la cloración oxidativa a alta temperatura del elemento con cloro o cloruro de hidrógeno, la cloración a alta temperatura de un óxido metálico u otro haluro con cloro, un cloruro metálico volátil, tetracloruro de carbono o un cloruro orgánico. Por ejemplo, el dióxido de circonio reacciona con cloro en condiciones estándar para producir tetracloruro de circonio , y el trióxido de uranio reacciona con hexacloropropeno cuando se calienta a reflujo para dar tetracloruro de uranio . El segundo ejemplo también implica una reducción del estado de oxidación , que también se puede lograr reduciendo un cloruro más alto utilizando hidrógeno o un metal como agente reductor. Esto también se puede lograr mediante descomposición térmica o desproporción de la siguiente manera: [49]
La mayoría de los cloruros metálicos con el metal en estados de oxidación bajos (+1 a +3) son iónicos. Los no metales tienden a formar cloruros moleculares covalentes, al igual que los metales en estados de oxidación altos de +3 y superiores. Se conocen cloruros iónicos y covalentes para metales en estado de oxidación +3 (por ejemplo, el cloruro de escandio es principalmente iónico, pero el cloruro de aluminio no lo es). El cloruro de plata es muy insoluble en agua y, por lo tanto, se utiliza a menudo como prueba cualitativa para el cloro. [49]
Aunque el dicloro es un agente oxidante fuerte con una alta energía de primera ionización, puede oxidarse en condiciones extremas para formar el catión [Cl 2 ] + . Este es muy inestable y solo se ha caracterizado por su espectro de banda electrónica cuando se produce en un tubo de descarga de baja presión. El catión amarillo [Cl 3 ] + es más estable y puede producirse de la siguiente manera: [50]
Esta reacción se lleva a cabo en el disolvente oxidante pentafluoruro de arsénico . También se ha caracterizado el anión tricloruro, [Cl 3 ] − , que es análogo al triyoduro . [51]
Los tres fluoruros de cloro forman un subconjunto de los compuestos interhalogenados , todos ellos diamagnéticos . [51] Se conocen algunos derivados catiónicos y aniónicos, como el ClF−
2, ClF−
4, ClF+
2, y Cl 2 F + . [52] También se conocen algunos pseudohaluros de cloro, como el cloruro de cianógeno (ClCN, lineal), el cianato de cloro (ClNCO), el tiocianato de cloro (ClSCN, a diferencia de su homólogo de oxígeno) y la azida de cloro (ClN 3 ). [51]
El monofluoruro de cloro (ClF) es extremadamente estable térmicamente y se vende comercialmente en botellas de acero de 500 gramos. Es un gas incoloro que se funde a -155,6 °C y hierve a -100,1 °C. Puede producirse por la reacción de sus elementos a 225 °C, aunque luego debe separarse y purificarse del trifluoruro de cloro y sus reactivos. Sus propiedades son en su mayoría intermedias entre las del cloro y el flúor. Reacciona con muchos metales y no metales a temperatura ambiente y superior, fluorándolos y liberando cloro. También actúa como agente clorofluorante, añadiendo cloro y flúor a través de un enlace múltiple o por oxidación: por ejemplo, ataca al monóxido de carbono para formar clorofluoruro de carbonilo, COFCl. Reaccionará de forma análoga con hexafluoroacetona , (CF 3 ) 2 CO, con un catalizador de fluoruro de potasio para producir hipoclorito de heptafluoroisopropilo, (CF 3 ) 2 CFOCl; con nitrilos RCN para producir RCF 2 NCl 2 ; y con los óxidos de azufre SO 2 y SO 3 para producir ClSO 2 F y ClOSO 2 F respectivamente. También reaccionará exotérmicamente con compuestos que contengan grupos –OH y –NH, como el agua: [51]
El trifluoruro de cloro (ClF 3 ) es un líquido molecular incoloro volátil que se funde a -76,3 °C y hierve a 11,8 °C. Puede formarse fluorando directamente el cloro gaseoso o el monofluoruro de cloro a 200–300 °C. Es uno de los compuestos químicos más reactivos conocidos, la lista de elementos que prende fuego es diversa, y contiene hidrógeno , potasio , fósforo , arsénico , antimonio , azufre , selenio , telurio , bromo , yodo y molibdeno en polvo , tungsteno , rodio , iridio y hierro . También enciende el agua, junto con muchas sustancias que en circunstancias normales se considerarían químicamente inertes, como el amianto , el hormigón, el vidrio y la arena. Cuando se calienta, corroe incluso metales nobles como el paladio , el platino y el oro , e incluso los gases nobles xenón y radón no escapan a la fluoración. Una capa impermeable de fluoruro está formada por sodio , magnesio , aluminio , zinc , estaño y plata , que puede eliminarse mediante calentamiento. Los contenedores de níquel , cobre y acero se utilizan habitualmente debido a su gran resistencia al ataque del trifluoruro de cloro, que se deriva de la formación de una capa no reactiva de fluoruro metálico. Su reacción con hidrazina para formar fluoruro de hidrógeno, nitrógeno y gases de cloro se utilizó en motores de cohetes experimentales, pero tiene problemas que se derivan principalmente de su extrema hipergolicidad que resulta en ignición sin ningún retraso mensurable. Hoy en día, se utiliza principalmente en el procesamiento de combustible nuclear, para oxidar uranio a hexafluoruro de uranio para su enriquecimiento y para separarlo del plutonio , así como en la industria de semiconductores, donde se utiliza para limpiar cámaras de deposición química de vapor . [53] Puede actuar como donador o aceptor de iones fluoruro (base o ácido de Lewis), aunque no se disocia apreciablemente en ClF+
2y ClF−
4iones. [54]
El pentafluoruro de cloro (ClF 5 ) se produce a gran escala mediante fluoración directa de cloro con exceso de gas flúor a 350 °C y 250 atm, y a pequeña escala mediante la reacción de cloruros metálicos con gas flúor a 100–300 °C. Se funde a -103 °C y hierve a -13,1 °C. Es un agente fluorante muy fuerte, aunque todavía no es tan eficaz como el trifluoruro de cloro. Sólo se han caracterizado unas pocas reacciones estequiométricas específicas. El pentafluoruro de arsénico y el pentafluoruro de antimonio forman aductos iónicos de la forma [ClF 4 ] + [MF 6 ] − (M = As, Sb) y el agua reacciona vigorosamente de la siguiente manera: [55]
El producto, fluoruro de clorilo , es uno de los cinco fluoruros de óxido de cloro conocidos. Estos van desde el térmicamente inestable FClO hasta el fluoruro de perclorilo químicamente no reactivo (FClO 3 ), siendo los otros tres FClO 2 , F 3 ClO y F 3 ClO 2 . Los cinco se comportan de manera similar a los fluoruros de cloro, tanto estructural como químicamente, y pueden actuar como ácidos o bases de Lewis ganando o perdiendo iones de fluoruro respectivamente o como agentes oxidantes y fluorantes muy fuertes. [56]


Los óxidos de cloro han sido bien estudiados a pesar de su inestabilidad (todos ellos son compuestos endotérmicos). Son importantes porque se producen cuando los clorofluorocarbonos sufren fotólisis en la atmósfera superior y causan la destrucción de la capa de ozono. Ninguno de ellos puede formarse a partir de la reacción directa de los elementos. [57]
El monóxido de dicloro (Cl2O ) es un gas de color amarillo parduzco (pardo rojizo cuando está sólido o líquido) que se puede obtener haciendo reaccionar el gas cloro con óxido de mercurio(II) amarillo . Es muy soluble en agua, en la que está en equilibrio con el ácido hipocloroso (HOCl), del que es el anhídrido. Por lo tanto, es un blanqueador eficaz y se utiliza principalmente para fabricar hipocloritos . Explota al calentarse o al producir chispas o en presencia de gas amoniaco. [57]
El dióxido de cloro (ClO 2 ) fue el primer óxido de cloro descubierto en 1811 por Humphry Davy . Es un gas paramagnético amarillo (rojo oscuro en estado sólido o líquido), como se esperaba por tener un número impar de electrones: es estable frente a la dimerización debido a la deslocalización del electrón desapareado. Explota por encima de los −40 °C como líquido y bajo presión como gas y, por lo tanto, debe producirse en bajas concentraciones para el blanqueo de pulpa de madera y el tratamiento del agua. Por lo general, se prepara reduciendo un clorato de la siguiente manera: [57]
Su producción está, por tanto, íntimamente ligada a las reacciones redox de los oxiácidos de cloro. Es un fuerte agente oxidante, que reacciona con azufre , fósforo , haluros de fósforo y borohidruro de potasio . Se disuelve exotérmicamente en agua para formar soluciones de color verde oscuro que se descomponen muy lentamente en la oscuridad. Los hidratos de clatrato cristalinos ClO 2 · n H 2 O ( n ≈ 6–10) se separan a bajas temperaturas. Sin embargo, en presencia de luz, estas soluciones se fotodescomponen rápidamente para formar una mezcla de ácidos clorhídrico y clorhídrico. La fotólisis de moléculas individuales de ClO 2 da como resultado los radicales ClO y ClOO, mientras que a temperatura ambiente se producen principalmente cloro, oxígeno y algo de ClO 3 y Cl 2 O 6. Cl 2 O 3 también se produce al fotolizar el sólido a −78 °C: es un sólido marrón oscuro que explota por debajo de 0 °C. El radical ClO provoca el agotamiento del ozono atmosférico y, por tanto, es importante desde el punto de vista medioambiental, como se indica a continuación: [57]
El perclorato de cloro (ClOClO 3 ) es un líquido amarillo pálido que es menos estable que el ClO 2 y se descompone a temperatura ambiente para formar cloro, oxígeno y hexóxido de dicloro (Cl 2 O 6 ). [57] El perclorato de cloro también puede considerarse un derivado de cloro del ácido perclórico (HOClO 3 ), similar a los derivados de cloro térmicamente inestables de otros oxoácidos: los ejemplos incluyen nitrato de cloro (ClONO 2 , vigorosamente reactivo y explosivo) y fluorosulfato de cloro (ClOSO 2 F, más estable pero aún sensible a la humedad y altamente reactivo). [58] El hexóxido de dicloro es un líquido rojo oscuro que se congela para formar un sólido que se vuelve amarillo a −180 °C: generalmente se produce por reacción de dióxido de cloro con oxígeno. A pesar de los intentos de racionalizarlo como el dímero de ClO 3 , reacciona más como si fuera perclorato de clorilo, [ClO 2 ] + [ClO 4 ] − , que se ha confirmado que es la estructura correcta del sólido. Se hidroliza en agua para dar una mezcla de ácidos clórico y perclórico: la reacción análoga con fluoruro de hidrógeno anhidro no se completa. [57]
El heptóxido de dicloro ( Cl2O7 ) es el anhídrido del ácido perclórico (HClO4 ) y se puede obtener fácilmente deshidratándolo con ácido fosfórico a -10 °C y luego destilando el producto a -35 °C y 1 mmHg. Es un líquido aceitoso incoloro y sensible a los golpes. Es el menos reactivo de los óxidos de cloro, siendo el único que no incendia materiales orgánicos a temperatura ambiente. Puede disolverse en agua para regenerar ácido perclórico o en álcalis acuosos para regenerar percloratos. Sin embargo, se descompone térmicamente de forma explosiva al romper uno de los enlaces centrales Cl–O, produciendo los radicales ClO3 y ClO4 que se descomponen inmediatamente en los elementos a través de óxidos intermedios. [57]
El cloro forma cuatro oxoácidos: ácido hipocloroso (HOCl), ácido cloroso (HOClO), ácido clórico (HOClO 2 ) y ácido perclórico (HOClO 3 ). Como se puede observar en los potenciales redox que se dan en la tabla adjunta, el cloro es mucho más estable a la desproporción en soluciones ácidas que en soluciones alcalinas: [45]
Los iones hipoclorito también se desproporcionan aún más para producir cloruro y clorato (3 ClO − ⇌ 2 Cl − + ClO−
3) pero esta reacción es bastante lenta a temperaturas inferiores a 70 °C a pesar de la constante de equilibrio muy favorable de 10 27 . Los iones clorato pueden desproporcionarse para formar cloruro y perclorato (4 ClO−
3⇌Cl − + 3 ClO−
4) pero esto sigue siendo muy lento incluso a 100 °C a pesar de la constante de equilibrio muy favorable de 10 20 . Las velocidades de reacción de los oxianiones de cloro aumentan a medida que disminuye el estado de oxidación del cloro. Las fortalezas de los oxiácidos de cloro aumentan muy rápidamente a medida que aumenta el estado de oxidación del cloro debido a la creciente deslocalización de la carga sobre más y más átomos de oxígeno en sus bases conjugadas. [45]
La mayoría de los oxiácidos de cloro se pueden producir mediante la explotación de estas reacciones de desproporción. El ácido hipocloroso (HOCl) es muy reactivo y bastante inestable; sus sales se utilizan principalmente por sus propiedades blanqueadoras y esterilizantes. Son agentes oxidantes muy fuertes, que transfieren un átomo de oxígeno a la mayoría de las especies inorgánicas. El ácido cloroso (HOClO) es aún más inestable y no se puede aislar ni concentrar sin descomposición: se conoce a partir de la descomposición del dióxido de cloro acuoso. Sin embargo, el clorito de sodio es una sal estable y es útil para blanquear y decapar textiles, como agente oxidante y como fuente de dióxido de cloro. El ácido clórico (HOClO 2 ) es un ácido fuerte que es bastante estable en agua fría hasta una concentración del 30%, pero al calentarlo produce cloro y dióxido de cloro. La evaporación a presión reducida permite concentrarlo aún más hasta aproximadamente el 40%, pero luego se descompone en ácido perclórico, cloro, oxígeno, agua y dióxido de cloro. Su sal más importante es el clorato de sodio , que se utiliza principalmente para fabricar dióxido de cloro para blanquear la pulpa de papel. La descomposición del clorato en cloruro y oxígeno es una forma habitual de producir oxígeno en el laboratorio a pequeña escala. El cloruro y el clorato pueden combinarse para formar cloro de la siguiente manera: [59]
Los percloratos y el ácido perclórico (HOClO 3 ) son los oxocompuestos más estables del cloro, de acuerdo con el hecho de que los compuestos de cloro son más estables cuando el átomo de cloro está en sus estados de oxidación más bajos (−1) o más altos (+7) posibles. El ácido perclórico y los percloratos acuosos son agentes oxidantes vigorosos y a veces violentos cuando se calientan, en marcado contraste con su naturaleza mayormente inactiva a temperatura ambiente debido a las altas energías de activación para estas reacciones por razones cinéticas. Los percloratos se obtienen oxidando electrolíticamente el clorato de sodio, y el ácido perclórico se obtiene haciendo reaccionar perclorato de sodio anhidro o perclorato de bario con ácido clorhídrico concentrado, filtrando el cloruro precipitado y destilando el filtrado para concentrarlo. El ácido perclórico anhidro es un líquido móvil incoloro que es sensible al choque y explota al contacto con la mayoría de los compuestos orgánicos, prende fuego al yoduro de hidrógeno y al cloruro de tionilo e incluso oxida la plata y el oro. Aunque es un ligando débil, más débil que el agua, existen pocos compuestos que impliquen ClO coordinado.−
4son conocidos. [59] La siguiente tabla presenta los estados de oxidación típicos del elemento cloro tal como se dan en las escuelas secundarias o universidades. Hay compuestos químicos más complejos, cuya estructura solo se puede explicar utilizando métodos químicos cuánticos modernos, por ejemplo, el cloruro de tecnecio en racimo [(CH 3 ) 4 N] 3 [Tc 6 Cl 14 ], en el que 6 de los 14 átomos de cloro son formalmente divalentes y los estados de oxidación son fraccionarios. [60] [61] Además, todas las regularidades químicas anteriores son válidas para condiciones "normales" o cercanas a las normales, mientras que a presiones ultra altas (por ejemplo, en los núcleos de grandes planetas), el cloro puede exhibir un estado de oxidación de -3, formando un compuesto Na3Cl con sodio, que no encaja en los conceptos tradicionales de la química. [62]

Al igual que los demás enlaces carbono-halógeno, el enlace C-Cl es un grupo funcional común que forma parte de la química orgánica básica . Formalmente, los compuestos con este grupo funcional pueden considerarse derivados orgánicos del anión cloruro. Debido a la diferencia de electronegatividad entre el cloro (3,16) y el carbono (2,55), el carbono en un enlace C-Cl es deficiente en electrones y, por lo tanto, electrofílico . La cloración modifica las propiedades físicas de los hidrocarburos de varias maneras: los clorocarbonos suelen ser más densos que el agua debido al mayor peso atómico del cloro frente al hidrógeno, y los organocloruros alifáticos son agentes alquilantes porque el cloruro es un grupo saliente . [63]
Los alcanos y arilalcanos pueden clorarse en condiciones de radicales libres , con luz ultravioleta. Sin embargo, el grado de cloración es difícil de controlar: la reacción no es regioselectiva y a menudo da como resultado una mezcla de varios isómeros con diferentes grados de cloración, aunque esto puede ser permisible si los productos se separan fácilmente. Los cloruros de arilo pueden prepararse mediante la halogenación de Friedel-Crafts , utilizando cloro y un catalizador de ácido de Lewis . [63] La reacción de haloformo , utilizando cloro e hidróxido de sodio , también puede generar haluros de alquilo a partir de metilcetonas y compuestos relacionados. El cloro también se suma a los enlaces múltiples en alquenos y alquinos , dando compuestos di- o tetracloro. Sin embargo, debido al costo y la reactividad del cloro, los compuestos organoclorados se producen más comúnmente utilizando cloruro de hidrógeno o con agentes clorantes como pentacloruro de fósforo (PCl 5 ) o cloruro de tionilo (SOCl 2 ). Esto último es muy conveniente en el laboratorio porque todos los productos secundarios son gaseosos y no es necesario destilarlos. [63]
Muchos compuestos organoclorados han sido aislados de fuentes naturales que van desde bacterias hasta humanos. [64] [65] Los compuestos orgánicos clorados se encuentran en casi todas las clases de biomoléculas, incluyendo alcaloides , terpenos , aminoácidos , flavonoides , esteroides y ácidos grasos . [64] [66] Los organoclorados, incluyendo dioxinas , se producen en el ambiente de alta temperatura de los incendios forestales, y se han encontrado dioxinas en las cenizas preservadas de incendios iniciados por rayos que son anteriores a las dioxinas sintéticas. [67] Además, una variedad de hidrocarburos clorados simples incluyendo diclorometano, cloroformo y tetracloruro de carbono han sido aislados de algas marinas. [68] La mayoría del clorometano en el ambiente es producido naturalmente por descomposición biológica, incendios forestales y volcanes. [69]
Algunos tipos de organoclorados, aunque no todos, tienen una toxicidad significativa para las plantas o los animales, incluidos los seres humanos. Las dioxinas, que se producen cuando se quema materia orgánica en presencia de cloro, y algunos insecticidas, como el DDT , son contaminantes orgánicos persistentes que plantean peligros cuando se liberan al medio ambiente. Por ejemplo, el DDT, que se utilizó ampliamente para controlar los insectos a mediados del siglo XX, también se acumula en las cadenas alimentarias y causa problemas reproductivos (por ejemplo, adelgazamiento de la cáscara de los huevos) en ciertas especies de aves. [70] Debido a la fácil fisión homolítica del enlace C-Cl para crear radicales de cloro en la atmósfera superior, los clorofluorocarbonos se han eliminado gradualmente debido al daño que causan a la capa de ozono. [57]

El cloro es demasiado reactivo para existir como elemento libre en la naturaleza, pero es muy abundante en forma de sales de cloruro. Es el vigésimo elemento más abundante [71] en la corteza terrestre y constituye 126 partes por millón de la misma, a través de los grandes depósitos de minerales de cloruro, especialmente cloruro de sodio , que se han evaporado de los cuerpos de agua. Todos estos son insignificantes en comparación con las reservas de iones de cloruro en el agua de mar: se encuentran cantidades más pequeñas en concentraciones más altas en algunos mares interiores y pozos de salmuera subterráneos , como el Gran Lago Salado en Utah y el Mar Muerto en Israel. [72]
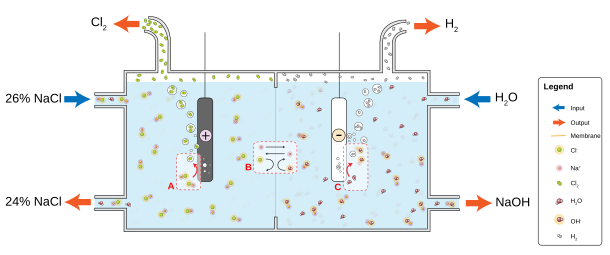
En el laboratorio se preparan pequeñas cantidades de gas cloro combinando ácido clorhídrico y dióxido de manganeso , pero rara vez surge la necesidad debido a su fácil disponibilidad. En la industria, el cloro elemental se produce generalmente por electrólisis del cloruro de sodio disuelto en agua. Este método, el proceso cloro-álcali industrializado en 1892, proporciona ahora la mayor parte del gas cloro industrial. [32] Junto con el cloro, el método produce gas hidrógeno e hidróxido de sodio , que es el producto más valioso. El proceso procede de acuerdo con la siguiente ecuación química : [73]
El cloro se produce principalmente mediante el proceso cloro-álcali , aunque existen procesos no cloro-álcali. La producción mundial de 2006 se estimó en 65 millones de toneladas cortas. [74] El uso más visible del cloro es en la desinfección del agua . Entre el 35 y el 40 % del cloro producido se utiliza para fabricar poli(cloruro de vinilo) a través del dicloruro de etileno y el cloruro de vinilo . [75] El cloro producido está disponible en cilindros de tamaños que van desde 450 g hasta 70 kg, así como en tambores (865 kg), vagones cisterna (15 toneladas en carreteras; 27-90 toneladas por ferrocarril) y barcazas (600-1200 toneladas). [76] Debido a la dificultad de transportar cloro elemental, la producción suele estar ubicada cerca de donde se consume. Como ejemplos, los productores de cloruro de vinilo como Westlake Chemical [77] y Formosa Plastics [78] han integrado activos cloro-álcali.
La electrólisis de soluciones de cloruro se realiza según las siguientes ecuaciones:
En el caso convencional donde se electroliza el cloruro de sodio, el hidróxido de sodio y el cloro son coproductos.
Industrialmente existen tres procesos cloro-álcali:
El proceso Castner-Kellner fue el primer método utilizado a finales del siglo XIX para producir cloro a escala industrial. [79] [80] Se utilizó mercurio (que es tóxico) como electrodo para amalgamar el producto de sodio, evitando reacciones secundarias indeseables.
En la electrólisis de celdas de diafragma, un diafragma de amianto (o fibra de polímero) separa un cátodo y un ánodo , evitando que el cloro que se forma en el ánodo se vuelva a mezclar con el hidróxido de sodio y el hidrógeno formado en el cátodo. [81] La solución de sal (salmuera) se alimenta continuamente al compartimento del ánodo y fluye a través del diafragma hasta el compartimento del cátodo, donde se produce el álcali cáustico y la salmuera se agota parcialmente. Los métodos de diafragma producen álcali diluido y ligeramente impuro, pero no tienen el problema de la eliminación del mercurio y son más eficientes energéticamente. [32]
La electrólisis de células de membrana emplea una membrana permeable como intercambiador de iones . La solución saturada de cloruro de sodio (o potasio) pasa a través del compartimento del ánodo, saliendo a una concentración más baja . Este método también produce hidróxido de sodio (o potasio) muy puro, pero tiene la desventaja de requerir salmuera muy pura a altas concentraciones. [82]
En el proceso Deacon , el cloruro de hidrógeno recuperado de la producción de compuestos organoclorados se recupera como cloro. El proceso se basa en la oxidación con oxígeno:
La reacción requiere un catalizador. Como lo introdujo Deacon, los primeros catalizadores se basaban en cobre. Los procesos comerciales, como el proceso Mitsui MT-Chlorine, han pasado a utilizar catalizadores basados en cromo y rutenio. [83]
.jpg/440px-Tank_car_with_placard_1017_(chlorine).jpg)
El cloruro de sodio es el compuesto de cloro más común y es la principal fuente de cloro para la demanda de la industria química. Se comercializan alrededor de 15 000 compuestos que contienen cloro, incluidos compuestos tan diversos como el metano clorado , los etanos , el cloruro de vinilo , el cloruro de polivinilo (PVC), el tricloruro de aluminio para catálisis , los cloruros de magnesio , titanio , circonio y hafnio , que son los precursores para producir la forma pura de esos elementos. [18]
Cuantitativamente, de todo el cloro elemental producido, alrededor del 63% se utiliza en la fabricación de compuestos orgánicos y el 18% en la fabricación de compuestos de cloro inorgánico. [85] Alrededor de 15.000 compuestos de cloro se utilizan comercialmente. [86] El 19% restante del cloro producido se utiliza para blanqueadores y productos desinfectantes. [76] Los compuestos orgánicos más significativos en términos de volumen de producción son el 1,2-dicloroetano y el cloruro de vinilo , intermediarios en la producción de PVC . Otros organoclorados particularmente importantes son el cloruro de metilo , el cloruro de metileno , el cloroformo , el cloruro de vinilideno , el tricloroetileno , el percloroetileno , el cloruro de alilo , la epiclorhidrina , el clorobenceno , los diclorobencenos y los triclorobencenos . Los principales compuestos inorgánicos incluyen HCl, Cl 2 O, HOCl, NaClO 3 , AlCl 3 , SiCl 4 , SnCl 4 , PCl 3 , PCl 5 , POCl 3 , AsCl 3 , SbCl 3 , SbCl 5 , BiCl 3 y ZnCl 2 . [76]
En Francia (como en otros lugares), los intestinos de los animales se procesaban para fabricar cuerdas de instrumentos musicales, piel de Goldbeater y otros productos. Esto se hacía en "fábricas de tripas" ( boyauderies ), y era un proceso maloliente y poco saludable. En 1820 aproximadamente, la Société d'encouragement pour l'industrie nationale ofreció un premio al descubrimiento de un método, químico o mecánico, para separar la membrana peritoneal de los intestinos de los animales sin putrefacción . [87] [88] El premio lo ganó Antoine-Germain Labarraque , un químico y farmacéutico francés de 44 años que había descubierto que las soluciones blanqueadoras cloradas de Berthollet (" Eau de Javel ") no solo destruían el olor a putrefacción de la descomposición del tejido animal, sino que también retardaban la descomposición. [88] [34]
Las investigaciones de Labarraque dieron como resultado el uso de cloruros e hipocloritos de cal ( hipoclorito de calcio ) y de sodio ( hipoclorito de sodio ) en las boyauderías. Se descubrió que los mismos productos químicos eran útiles en la desinfección y desodorización rutinaria de letrinas , alcantarillas , mercados, mataderos , quirófanos anatómicos y morgues. [89] Tuvieron éxito en hospitales , lazaretos , prisiones , enfermerías (tanto en tierra como en el mar), magnanerías , establos , cobertizos de ganado, etc.; y fueron beneficiosos durante las exhumaciones , [90] embalsamamientos , brotes de enfermedades epidémicas, fiebre y carbunco negro en el ganado. [87]
Las soluciones de cal clorada y soda de Labarraque han sido recomendadas desde 1828 para prevenir infecciones (llamadas "infecciones contagiosas", que se presume que se transmiten por " miasmas ") y para tratar la putrefacción de heridas existentes, incluidas las heridas sépticas. [91] En su trabajo de 1828, Labarraque recomendó que los médicos respiraran cloro, se lavaran las manos con cal clorada e incluso espolvorearan cal clorada sobre las camas de los pacientes en casos de "infección contagiosa". En 1828, el contagio de infecciones era bien conocido, aunque la agencia del microbio no se descubrió hasta más de medio siglo después.
Durante el brote de cólera de París de 1832, se utilizaron grandes cantidades del llamado cloruro de cal para desinfectar la capital. No se trataba simplemente del moderno cloruro de calcio , sino de gas cloro disuelto en agua de cal ( hidróxido de calcio diluido ) para formar hipoclorito de calcio (cal clorada). El descubrimiento de Labarraque ayudó a eliminar el terrible hedor a descomposición de los hospitales y las salas de disección y, al hacerlo, desodorizó eficazmente el Barrio Latino de París. [92] Muchos pensaban que estos "miasmas pútridos" causaban la propagación del "contagio" y la "infección", ambas palabras utilizadas antes de la teoría de los gérmenes de la infección. El cloruro de cal se utilizaba para destruir los olores y la "materia pútrida". Una fuente afirma que el Dr. John Snow utilizó cloruro de cal para desinfectar el agua del pozo contaminado con cólera que alimentaba la bomba de Broad Street en Londres en 1854, [93] aunque otras tres fuentes confiables que describen esa famosa epidemia de cólera no mencionan el incidente. [94] [95] [96] Una referencia deja claro que se utilizaba cloruro de cal para desinfectar los despojos y la suciedad de las calles que rodeaban la bomba de Broad Street, una práctica común en la Inglaterra de mediados del siglo XIX. [94] : 296

Tal vez la aplicación más famosa de las soluciones de cloro y bases químicas de Labarraque fue en 1847, cuando Ignaz Semmelweis utilizó agua clorada (cloro disuelto en agua pura, que era más barata que las soluciones de cal clorada) para desinfectar las manos de los médicos austríacos, que, como observó Semmelweis, todavía transmitían el hedor de la descomposición de las salas de disección a las salas de examen de los pacientes. Mucho antes de la teoría de los gérmenes como causa de las enfermedades, Semmelweis teorizó que las "partículas cadavéricas" transmitían la descomposición de los cadáveres médicos frescos a los pacientes vivos, y utilizó las conocidas "soluciones de Labarraque" como el único método conocido para eliminar el olor a descomposición y a descomposición de los tejidos (que descubrió que el jabón no hacía). Las soluciones demostraron ser antisépticos mucho más eficaces que el jabón (Semmelweis también era consciente de su mayor eficacia, pero no del motivo), y esto dio como resultado el célebre éxito de Semmelweis al detener la transmisión de la fiebre puerperal en las salas de maternidad del Hospital General de Viena en Austria en 1847. [97]
Mucho más tarde, durante la Primera Guerra Mundial en 1916, Henry Drysdale Dakin (quien le dio todo el crédito al trabajo previo de Labarraque en esta área) desarrolló una modificación estandarizada y diluida de la solución de Labarraque que contenía hipoclorito (0,5%) y ácido bórico como estabilizador ácido. Llamado solución de Dakin , el método de irrigación de heridas con soluciones cloradas permitió el tratamiento antiséptico de una amplia variedad de heridas abiertas, mucho antes de la era moderna de los antibióticos. Una versión modificada de esta solución continúa empleándose en la irrigación de heridas en los tiempos modernos, donde sigue siendo eficaz contra las bacterias que son resistentes a múltiples antibióticos (ver Century Pharmaceuticals ). [98]


La primera aplicación continua de cloración al agua potable de los Estados Unidos se instaló en Jersey City , Nueva Jersey, en 1908. [99] En 1918, el Departamento del Tesoro de los Estados Unidos exigió que toda el agua potable se desinfectara con cloro. En la actualidad, el cloro es un producto químico importante para la purificación del agua (por ejemplo, en las plantas de tratamiento de agua), en los desinfectantes y en la lejía . Incluso los suministros de agua pequeños se cloran ahora de forma rutinaria. [100]
El cloro se utiliza habitualmente (en forma de ácido hipocloroso ) para matar bacterias y otros microbios en los suministros de agua potable y piscinas públicas. En la mayoría de las piscinas privadas, no se utiliza cloro en sí, sino hipoclorito de sodio , formado a partir de cloro e hidróxido de sodio , o tabletas sólidas de isocianuratos clorados. El inconveniente de utilizar cloro en piscinas es que el cloro reacciona con los aminoácidos de las proteínas del cabello y la piel humanos. Contrariamente a la creencia popular, el distintivo "aroma a cloro" asociado a las piscinas no es el resultado del cloro elemental en sí, sino de la cloramina , un compuesto químico producido por la reacción del cloro libre disuelto con aminas en sustancias orgánicas, incluidas las de la orina y el sudor. [101] Como desinfectante en el agua, el cloro es más de tres veces más eficaz contra Escherichia coli que el bromo , y más de seis veces más eficaz que el yodo . [102] Cada vez más, la monocloramina se añade directamente al agua potable con fines de desinfección, un proceso conocido como cloraminación . [103]
A menudo resulta poco práctico almacenar y utilizar gas de cloro venenoso para el tratamiento del agua, por lo que se utilizan métodos alternativos para añadir cloro. Estos incluyen soluciones de hipoclorito , que liberan gradualmente cloro en el agua, y compuestos como dicloro-s-triazinetriona de sodio (dihidrato o anhidro), a veces denominado "diclor", y tricloro-s-triazinetriona , a veces denominado "triclor". Estos compuestos son estables mientras están sólidos y se pueden utilizar en forma de polvo, gránulos o tabletas. Cuando se añaden en pequeñas cantidades al agua de piscinas o sistemas de agua industriales, los átomos de cloro se hidrolizan del resto de la molécula, formando ácido hipocloroso (HOCl), que actúa como un biocida general , matando gérmenes, microorganismos, algas, etc. [104] [105]
El gas cloro, también conocido como bertholita, fue utilizado por primera vez como arma en la Primera Guerra Mundial por Alemania el 22 de abril de 1915, en la Segunda Batalla de Ypres . [106] [107] Según lo descrito por los soldados, tenía el olor distintivo de una mezcla de pimienta y piña. [108] También tenía un sabor metálico y picaba la parte posterior de la garganta y el pecho. El cloro reacciona con el agua en la mucosa de los pulmones para formar ácido clorhídrico , destructivo para el tejido vivo y potencialmente letal. Los sistemas respiratorios humanos pueden protegerse del gas cloro mediante máscaras de gas con carbón activado u otros filtros, lo que hace que el gas cloro sea mucho menos letal que otras armas químicas. Fue desarrollado por un científico alemán que luego sería premio Nobel, Fritz Haber del Instituto Kaiser Wilhelm en Berlín, en colaboración con el conglomerado químico alemán IG Farben , que desarrolló métodos para descargar gas cloro contra un enemigo atrincherado . [109] Después de su primer uso, ambos bandos en el conflicto emplearon cloro como arma química, pero pronto fue reemplazado por el fosgeno y el gas mostaza , que son más letales . [110]
En 2007, durante la guerra de Irak en la provincia de Anbar , los insurgentes también utilizaron gas cloro, que cargaron camiones bomba con granadas de mortero y tanques de cloro. Los ataques mataron a dos personas a causa de los explosivos y enfermaron a más de 350. La mayoría de las muertes se debieron a la fuerza de las explosiones, más que a los efectos del cloro, ya que el gas tóxico se dispersa y diluye fácilmente en la atmósfera por la explosión. En algunos atentados, más de cien civiles fueron hospitalizados debido a dificultades respiratorias. Las autoridades iraquíes reforzaron la seguridad del cloro elemental, que es esencial para proporcionar agua potable a la población. [111] [112]
El 23 de octubre de 2014, se informó de que el Estado Islámico del Iraq y el Levante había utilizado gas cloro en la ciudad de Duluiyah ( Irak) . [113] Los análisis de laboratorio de muestras de ropa y suelo confirmaron el uso de gas cloro contra las fuerzas peshmerga kurdas en un ataque con un dispositivo explosivo improvisado transportado por un vehículo el 23 de enero de 2015 en la intersección de la carretera 47 en Kiske, cerca de Mosul. [114]
Otro país del Medio Oriente, Siria , ha utilizado cloro como arma química [115] mediante bombas de barril y cohetes. [116] [117] En 2016, el Mecanismo de Investigación Conjunto de la OPAQ y la ONU concluyó que el gobierno sirio utilizó cloro como arma química en tres ataques separados. [118] Investigaciones posteriores del Equipo de Investigación e Identificación de la OPAQ concluyeron que la Fuerza Aérea Siria fue responsable de los ataques con cloro en 2017 y 2018. [119]
El anión cloruro es un nutriente esencial para el metabolismo. El cloro es necesario para la producción de ácido clorhídrico en el estómago y en las funciones de bombeo celular. [120] La principal fuente dietética es la sal de mesa o cloruro de sodio. Las concentraciones demasiado bajas o demasiado altas de cloruro en la sangre son ejemplos de alteraciones electrolíticas . La hipocloremia (tener muy poco cloruro) rara vez ocurre en ausencia de otras anomalías. A veces se asocia con hipoventilación . [121] Puede estar asociada con acidosis respiratoria crónica . [122] La hipercloremia (tener demasiado cloruro) generalmente no produce síntomas. Cuando aparecen, tienden a parecerse a los de la hipernatremia (tener demasiado sodio ). La reducción del cloruro en sangre conduce a la deshidratación cerebral; los síntomas son causados con mayor frecuencia por una rehidratación rápida que resulta en edema cerebral . La hipercloremia puede afectar el transporte de oxígeno. [123]
El cloro es un gas tóxico que ataca el sistema respiratorio, los ojos y la piel. [126] Debido a que es más denso que el aire, tiende a acumularse en el fondo de espacios mal ventilados. El gas de cloro es un oxidante fuerte, que puede reaccionar con materiales inflamables. [127] [128]
El cloro se puede detectar con dispositivos de medición en concentraciones tan bajas como 0,2 partes por millón (ppm), y por el olfato a 3 ppm. Puede producirse tos y vómitos a 30 ppm y daño pulmonar a 60 ppm. Unas 1000 ppm pueden ser fatales después de unas cuantas respiraciones profundas del gas. [18] La concentración IDLH (inmediatamente peligrosa para la vida y la salud) es de 10 ppm. [129] Respirar concentraciones más bajas puede agravar el sistema respiratorio y la exposición al gas puede irritar los ojos. [130] Cuando se inhala cloro en concentraciones superiores a 30 ppm, reacciona con el agua dentro de los pulmones, produciendo ácido clorhídrico (HCl) y ácido hipocloroso (HOCl).
Cuando se utiliza en niveles específicos para la desinfección del agua, la reacción del cloro con el agua no supone un problema importante para la salud humana. Otros materiales presentes en el agua pueden generar subproductos de desinfección que están asociados a efectos negativos para la salud humana. [131] [132]
En los Estados Unidos, la Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite de exposición permisible para el cloro elemental en 1 ppm, o 3 mg/m3 . El Instituto Nacional de Seguridad y Salud Ocupacional ha designado un límite de exposición recomendado de 0,5 ppm durante 15 minutos. [129]
En el hogar, se producen accidentes cuando las soluciones de lejía a base de hipoclorito entran en contacto con ciertos limpiadores de desagües ácidos y producen gas de cloro. [133] La lejía a base de hipoclorito (un aditivo popular para el lavado de ropa ) combinada con amoníaco (otro aditivo popular para el lavado de ropa) produce cloraminas , otro grupo tóxico de sustancias químicas. [134]

El cloro se utiliza ampliamente para purificar el agua, especialmente el agua potable y el agua que se utiliza en las piscinas. Se han producido varios derrumbes catastróficos de techos de piscinas debido a la corrosión bajo tensión inducida por el cloro en las varillas de suspensión de acero inoxidable . [135] Algunos polímeros también son sensibles al ataque, incluida la resina de acetal y el polibuteno . Ambos materiales se utilizaron en tuberías domésticas de agua fría y caliente, y la corrosión bajo tensión provocó fallos generalizados en los EE. UU. en los años 1980 y 1990. [136]
El elemento hierro puede combinarse con cloro a altas temperaturas en una fuerte reacción exotérmica, creando un incendio de cloro-hierro . [137] [138] Los incendios de cloro-hierro son un riesgo en las plantas de procesos químicos, donde gran parte de las tuberías que transportan gas cloro están hechas de acero. [137] [138]
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ){{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace )