El cloruro de sodio / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , [8] comúnmente conocido como sal de mesa , es un compuesto iónico con la fórmula química NaCl , que representa una proporción de 1:1 de iones de sodio y cloruro . El cloruro de sodio es la sal más responsable de la salinidad del agua de mar y del líquido extracelular de muchos organismos multicelulares . En su forma comestible, se utiliza comúnmente como condimento y conservante de alimentos . En muchos procesos industriales se utilizan grandes cantidades de cloruro de sodio y es una fuente importante de compuestos de sodio y cloro que se utilizan como materia prima para futuras síntesis químicas . Otra aplicación importante del cloruro de sodio es el deshielo de carreteras en climas bajo cero.
Además de los usos domésticos familiares de la sal, las aplicaciones más dominantes de la producción de aproximadamente 250 millones de toneladas por año (datos de 2008) incluyen productos químicos y deshielo. [9]
La sal se utiliza, directa o indirectamente, en la producción de muchas sustancias químicas que consumen la mayor parte de la producción mundial. [10]
Es el punto de partida del proceso cloro-álcali , proceso industrial para producir cloro e hidróxido de sodio , según la ecuación química
Esta electrólisis se lleva a cabo en una celda de mercurio, una celda de diafragma o una celda de membrana. Cada uno de ellos utiliza un método diferente para separar el cloro del hidróxido de sodio. Se están desarrollando otras tecnologías debido al alto consumo de energía de la electrólisis, por lo que pequeñas mejoras en la eficiencia pueden tener grandes beneficios económicos. Algunas aplicaciones del cloro incluyen la producción de termoplásticos de PVC , desinfectantes y disolventes.
El hidróxido de sodio se utiliza ampliamente en muchas industrias diferentes, lo que permite la producción de papel, jabón y aluminio, etc.
El cloruro de sodio se utiliza en el proceso Solvay para producir carbonato de sodio y cloruro de calcio . El carbonato de sodio, a su vez, se utiliza para producir vidrio , bicarbonato de sodio y tintes , así como una infinidad de otras sustancias químicas. En el proceso de Mannheim se utiliza cloruro de sodio para la producción de sulfato de sodio y ácido clorhídrico .
El cloruro de sodio se utiliza mucho, por lo que incluso aplicaciones relativamente menores pueden consumir cantidades masivas. En la exploración de petróleo y gas , la sal es un componente importante de los fluidos de perforación en la perforación de pozos. Se utiliza para flocular y aumentar la densidad del fluido de perforación para superar las altas presiones del gas en el pozo. Cada vez que una perforadora golpea una formación de sal, se agrega sal al fluido de perforación para saturar la solución y minimizar la disolución dentro del estrato de sal. [9] La sal también se utiliza para aumentar el curado del hormigón en revestimientos cementados. [10]
En los textiles y el teñido, la sal se utiliza como enjuague de salmuera para separar los contaminantes orgánicos, promover la "salación" de los precipitados de colorantes y mezclarlos con tintes concentrados para estandarizarlos [ se necesita clarificación ] . Una de sus funciones principales es proporcionar la carga de iones positivos para promover la absorción de iones de tintes cargados negativamente. [10]
Para su uso en la industria de la pulpa y el papel , se utiliza para fabricar clorato de sodio , que luego se hace reaccionar con ácido sulfúrico y un agente reductor como el metanol para fabricar dióxido de cloro , un químico blanqueador que se usa ampliamente para blanquear la pulpa de madera .
En el curtido y tratamiento del cuero, se agrega sal a las pieles de animales para inhibir la actividad microbiana en la parte inferior de las pieles y atraer la humedad nuevamente hacia las pieles. [10]
En la fabricación de caucho, la sal se utiliza para fabricar tipos de caucho buna , neopreno y blanco. Se utilizan salmuera y ácido sulfúrico para coagular un látex emulsionado elaborado a partir de butadieno clorado . [10] [9]
También se añade sal para asegurar el suelo y dar firmeza a los cimientos sobre los que se construyen las carreteras. La sal actúa para minimizar los efectos de los cambios causados en el subsuelo por los cambios de humedad y carga de tráfico. [10]
El agua dura contiene iones de calcio y magnesio que interfieren con la acción del jabón y contribuyen a la acumulación de incrustaciones o películas de depósitos minerales alcalinos en equipos y tuberías domésticos e industriales. Las unidades de ablandamiento de agua comerciales y residenciales utilizan resinas de intercambio iónico para eliminar los iones que causan la dureza. Estas resinas se generan y regeneran utilizando cloruro de sodio. [10] [9]
La segunda aplicación importante de la sal es para deshielo y antihielo de carreteras, tanto en contenedores de arena como esparcidos por vehículos de servicio invernal . En previsión de las nevadas, lo mejor es "anticongelar" las carreteras con salmuera ( solución concentrada de sal en agua), que evita la adherencia entre el hielo y la nieve y la superficie de la carretera. Este procedimiento evita el uso excesivo de sal después de las nevadas. Para descongelar se utilizan mezclas de salmuera y sal, a veces con agentes adicionales como cloruro de calcio y/o cloruro de magnesio . El uso de sal o salmuera deja de ser efectivo por debajo de -10 °C (14 °F).

La sal para descongelar en el Reino Unido proviene principalmente de una sola mina en Winsford , Cheshire . Antes de su distribución, se mezcla con <100 ppm de ferrocianuro de sodio como agente antiaglomerante , lo que permite que la sal gema fluya libremente fuera de los vehículos de arena a pesar de estar almacenada antes de su uso. En los últimos años este aditivo también se ha utilizado en la sal de mesa. Se habían utilizado otros aditivos en la sal para carreteras para reducir los costos totales. Por ejemplo, en Estados Unidos, una solución de carbohidratos derivados del procesamiento de remolacha azucarera se mezcló con sal gema y se adhirió a las superficies de las carreteras aproximadamente un 40% mejor que la sal gema suelta sola. Debido a que permaneció en el camino por más tiempo, el tratamiento no tuvo que repetirse varias veces, ahorrando tiempo y dinero. [10]
En términos técnicos de química física, el punto de congelación mínimo de una mezcla de agua y sal es −21,12 °C (−6,02 °F) para 23,31% en peso de sal. Sin embargo, la congelación cerca de esta concentración es tan lenta que se puede alcanzar el punto eutéctico de -22,4 °C (-8,3 °F) con aproximadamente un 25% en peso de sal. [11]
La sal de los caminos termina en cuerpos de agua dulce y podría dañar las plantas y animales acuáticos al alterar su capacidad de osmorregulación . [12] La omnipresencia de sal en las zonas costeras plantea un problema en cualquier aplicación de recubrimiento , porque las sales atrapadas causan grandes problemas en la adhesión. Las autoridades navales y los constructores navales controlan las concentraciones de sal en las superficies durante la construcción. Las concentraciones máximas de sal en las superficies dependen de la autoridad y la aplicación. La normativa de la OMI es la más utilizada y fija los niveles de sal en un máximo de 50 mg/m 2 de sales solubles medidas como cloruro de sodio. Estas mediciones se realizan mediante una prueba de Bresle . La salinización (aumento de la salinidad, también conocido como síndrome de salinización del agua dulce ) y el consiguiente aumento de la lixiviación de metales es un problema constante en América del Norte y las vías fluviales europeas. [13]
En el deshielo de carreteras, la sal se ha asociado con la corrosión de plataformas de puentes, vehículos de motor, barras y alambres de refuerzo y estructuras de acero desprotegidas utilizadas en la construcción de carreteras. La escorrentía superficial , las fumigaciones de vehículos y la sal arrastrada por el viento también afectan el suelo, la vegetación al borde de las carreteras y los suministros locales de agua superficial y subterránea. Aunque se ha encontrado evidencia de carga ambiental de sal durante el uso pico, las lluvias y deshielos de primavera generalmente diluyen las concentraciones de sodio en el área donde se aplicó la sal. [10] Un estudio de 2009 encontró que aproximadamente el 70% de la sal para carreteras que se aplica en el área metropolitana de Minneapolis-St Paul se retiene en la cuenca local. [14]
Algunas agencias están sustituyendo la sal para carreteras por cerveza , melaza y jugo de remolacha . [15] Las aerolíneas utilizan más glicol y azúcar en lugar de soluciones a base de sal para descongelar . [dieciséis]
La sal es agregada a los alimentos, ya sea por el productor de alimentos o por el consumidor, como potenciador del sabor, conservante, aglutinante, aditivo de control de la fermentación , agente de control de la textura y revelador del color. El consumo de sal en la industria alimentaria se subdivide, en orden descendente de consumo, en otros productos de procesamiento de alimentos, empacadores de carne, enlatados , panificación, lácteos y molinería. Se agrega sal para promover el desarrollo del color en el tocino, el jamón y otros productos cárnicos procesados. Como conservante, la sal inhibe el crecimiento de bacterias. La sal actúa como aglutinante en las salchichas para formar un gel aglutinante compuesto de carne, grasa y humedad. La sal también actúa como potenciador del sabor y como ablandador . [10]
Se utiliza como desecante barato y seguro debido a sus propiedades higroscópicas , lo que hace que la salazón sea históricamente un método eficaz de conservación de alimentos ; la sal extrae agua de las bacterias a través de la presión osmótica , impidiendo que se reproduzcan, una fuente importante de deterioro de los alimentos. Aunque hay desecantes más eficaces disponibles, pocos son seguros para que los humanos los ingieran. Muchos microorganismos no pueden vivir en un ambiente salado: el agua sale de sus células por ósmosis . Por este motivo la sal se utiliza para conservar algunos alimentos, como el tocino, el pescado o la col.
En muchas industrias lácteas, se agrega sal al queso como agente de control del color, la fermentación y la textura. El subsector lácteo incluye empresas que fabrican mantequilla cremosa, leche condensada y evaporada, postres helados, helados, quesos naturales y procesados, y productos lácteos especiales. En el envasado, la sal se agrega principalmente como potenciador del sabor y conservante . También se utiliza como portador de otros ingredientes, agente deshidratante, inhibidor de enzimas y ablandador. Al hornear, se agrega sal para controlar la velocidad de fermentación de la masa de pan. También se utiliza para fortalecer el gluten (el complejo elástico de proteína y agua en ciertas masas) y como potenciador del sabor, como aderezo en productos horneados. La categoría de procesamiento de alimentos también incluye productos de molinería. Estos productos consisten en la molienda de harina y arroz y en la fabricación de cereales para el desayuno y harinas mezcladas o preparadas. La sal también se utiliza como condimento, por ejemplo, en patatas fritas, pretzels y comida para perros y gatos. [10]
El cloruro de sodio se utiliza en medicina veterinaria como agente causante de la emesis . Se administra como una solución saturada tibia. La emesis también puede ser causada por la colocación en la faringe de una pequeña cantidad de sal simple o cristales de sal.
El cloruro de sodio se utiliza junto con agua como una de las principales soluciones para la terapia intravenosa . El aerosol nasal suele contener una solución salina .

El cloruro de sodio es el principal agente extintor de los extintores (Met-LX, Super D) utilizados en incendios de metales combustibles como magnesio, potasio, sodio y aleaciones NaK (Clase D). A la mezcla se le añade polvo termoplástico , junto con impermeabilizantes (estearatos metálicos) y antiaglomerantes (fosfato tricálcico) para formar el agente extintor. Cuando se aplica al fuego, la sal actúa como un disipador de calor, disipando el calor del fuego y también forma una costra que excluye el oxígeno para sofocar el fuego. El aditivo plástico se derrite y ayuda a que la corteza mantenga su integridad hasta que el metal en llamas se enfríe por debajo de su temperatura de ignición. Este tipo de extintor se inventó a finales de la década de 1940 como una unidad operada por cartucho, aunque ahora son populares las versiones con presión almacenada. Los tamaños comunes son portátiles de 30 libras (14 kg) y 350 libras (160 kg) con ruedas. [ cita necesaria ]
Al menos desde la época medieval , la gente ha utilizado la sal como agente limpiador para frotar las superficies del hogar. También se utiliza en muchas marcas de champú , pasta de dientes y, popularmente, para descongelar las entradas de vehículos y las zonas de hielo.
Los cristales de NaCl sin defectos tienen una transmitancia óptica de aproximadamente el 90% para la luz infrarroja, concretamente entre 200 nm y 20 µm . Por lo tanto, se utilizaron en componentes ópticos (ventanas y prismas) que operan en ese rango espectral, donde existen pocas alternativas no absorbentes y donde los requisitos de ausencia de heterogeneidades microscópicas son menos estrictos que en el rango visible. Aunque son económicos, los cristales de NaCl son suaves e higroscópicos : cuando se exponen al aire ambiente, se cubren gradualmente de "escarcha". Esto limita la aplicación de NaCl a ambientes secos, áreas de ensamblaje selladas al vacío o para usos a corto plazo, como la creación de prototipos. Hoy en día, para el rango espectral infrarrojo se utilizan materiales como el seleniuro de zinc (ZnSe), que son mecánicamente más resistentes y menos sensibles a la humedad, en lugar del NaCl.

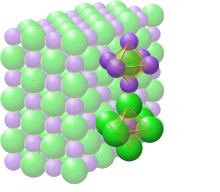
En el cloruro de sodio sólido, cada ion está rodeado por seis iones de carga opuesta, como se espera en términos electrostáticos. Los iones circundantes se encuentran en los vértices de un octaedro regular . En el lenguaje del empaquetamiento cerrado , los iones de cloruro más grandes (167 pm de tamaño [17] ) están dispuestos en una matriz cúbica mientras que los iones de sodio más pequeños (116 pm [17] ) llenan todos los espacios cúbicos (huecos octaédricos) entre ellos. . Esta misma estructura básica se encuentra en muchos otros compuestos y se conoce comúnmente como estructura de NaCl o estructura cristalina de sal de roca. Se puede representar como una red cúbica centrada en las caras (fcc) con una base de dos átomos o como dos redes cúbicas centradas en las caras interpenetrantes. El primer átomo está ubicado en cada punto de la red y el segundo átomo está ubicado a mitad de camino entre los puntos de la red a lo largo del borde de la celda unitaria fcc.
El cloruro de sodio sólido tiene un punto de fusión de 801 °C y el cloruro de sodio líquido hierve a 1465 °C. Las imágenes de vídeo en tiempo real con resolución atómica permiten la visualización de la etapa inicial de nucleación de cristales de cloruro de sodio. [18]
La conductividad térmica del cloruro de sodio en función de la temperatura tiene un máximo de 2,03 W/(cm K) a 8 K (−265,15 °C; −445,27 °F) y disminuye a 0,069 a 314 K (41 °C; 106 ° F). También disminuye con el dopaje . [19]

A partir de soluciones frías (subcongeladas), la sal cristaliza con agua de hidratación como hidrohalita (el dihidrato NaCl·2 H 2 O ). [21]
En 2023, se descubrió que bajo presión, el cloruro de sodio puede formar los hidratos NaCl·8,5H 2 O y NaCl·13H 2 O. [22]

La atracción entre los iones Na + y Cl − en el sólido es tan fuerte que sólo los disolventes altamente polares como el agua disuelven bien el NaCl.
Cuando se disuelve en agua, la estructura de cloruro de sodio se desintegra a medida que los iones Na + y Cl − quedan rodeados por moléculas de agua polares. Estas soluciones consisten en un complejo acuoso metálico con la fórmula [Na(H 2 O) 8 ] + , con una distancia Na-O de 250 pm . Los iones cloruro también están fuertemente solvatados y cada uno está rodeado por un promedio de seis moléculas de agua. [23] Las soluciones de cloruro de sodio tienen propiedades muy diferentes a las del agua pura. El punto eutéctico es −21,12 °C (−6,02 °F) para una fracción en masa de sal del 23,31%, y el punto de ebullición de la solución salina saturada es cercano a 108,7 °C (227,7 °F). [11]
El pH de una solución de cloruro de sodio permanece ≈7 debido a la basicidad extremadamente débil del ion Cl − , que es la base conjugada del ácido fuerte HCl. En otras palabras, el NaCl no tiene ningún efecto sobre el pH del sistema [24] en soluciones diluidas donde los efectos de la fuerza iónica y los coeficientes de actividad son insignificantes.
La sal común tiene una proporción molar de sodio y cloro de 1:1. En 2013 se descubrieron compuestos de sodio y cloruro de diferentes estequiometrías ; Se predijeron cinco nuevos compuestos (p. ej., Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 y NaCl 7 ). La existencia de algunos de ellos ha sido confirmada experimentalmente a altas presiones y otras condiciones: NaCl 3 cúbico y ortorrómbico, Na 3 Cl tetragonal metálico bidimensional y NaCl exótico hexagonal. [26] Esto indica que los compuestos que violan la intuición química son posibles, en sistemas simples en condiciones no ambientales. [27]
La mayor parte de la sal del mundo se disuelve en el océano [ cita necesaria ] . Una cantidad menor se encuentra en la corteza terrestre como halita mineral soluble en agua (sal de roca), y una pequeña cantidad existe como partículas de sal marina suspendidas en la atmósfera [ cita requerida ] . Estas partículas son los núcleos de condensación de nubes dominantes en el mar, lo que permite la formación de nubes en aire que de otro modo no estaría contaminado . [28]
Actualmente, la sal se produce en masa mediante la evaporación del agua de mar o de la salmuera de pozos de salmuera y lagos salados . La extracción de sal gema también es una fuente importante. China es el principal proveedor mundial de sal. [10] En 2017, la producción mundial se estimó en 280 millones de toneladas , siendo los cinco principales productores (en millones de toneladas) China (68,0), Estados Unidos (43,0), India (26,0), Alemania (13,0) y Canadá (13,0). ). [29] La sal también es un subproducto de la extracción de potasio .
La neutralización de un ácido fuerte y una base fuerte da una sal neutra.