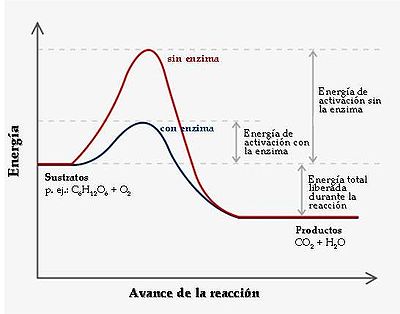
Cinética enzimática
La cinética enzimática estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas.
Algunas enzimas pueden unir varios sustratos diferentes y/o liberar diversos productos, como es el caso de las proteasas al romper una proteína en dos polipéptidos.
Por ejemplo, la estructura puede sugerir cómo permanecen unidos sustrato y producto durante la catálisis, qué cambios conformacionales ocurren durante la reacción, o incluso el papel en particular de determinados residuos aminoácidos en el mecanismo catalítico.
Algunas enzimas modifican su conformación significativamente durante la reacción, en cuyo caso, puede ser crucial saber la estructura molecular de la enzima con y sin sustrato unido (se suelen usar análogos que se unen pero no permiten llevar a cabo la reacción y mantienen a la enzima permanentemente en la conformación de sustrato unido).
Sin embargo, no todas las catálisis biológicas son llevadas a cabo por enzimas proteicas.
[2] La eficiencia de la reacción, hasta el momento en que todos los sitios posibles estén ocupados.
Sin embargo, estos ensayos son extremadamente sensibles y permiten detectar niveles muy bajos de actividad enzimática.
Actualmente existen métodos sencillos que se pueden emplear con alumnos de bachillerato como el propuesto por Johnson R.J.
Los ensayos enzimáticos más sensibles utilizan láseres dirigidos a través de un microscopio para observar los cambios producidos en enzimas individuales cuando catalizan una reacción.
Sin embargo, también es posible medir toda la curva de la reacción y ajustar estos datos a una ecuación no lineal.
Las enzimas que presentan un mecanismo de único sustrato incluyen isomerasas, tales como la triosafosfato isomerasa o la bisfosfoglicerato mutasa, y liasas intramoleculares, tales como la adenilato ciclasa o la ribozima ARN-liasa.
A bajas concentraciones de sustrato, la enzima permanece en un equilibrio constante entre la forma libre
Durante el período inicial, la velocidad de la reacción es más o menos constante, indicando que la
Sin embargo, llevar a cabo estas predicciones no es trivial, incluso en los sistemas más simples.
Entre las enzimas que presentan este mecanismo podemos encontrar la glutatión S-transferasa,[15] la dihidrofolato reductasa[16] y la ADN polimerasa.
En las serin-proteasas, el estado intermedio E* es una especie acilada en una serina del centro catalítico de la enzima.
El siguiente enlace muestra una animación del mecanismo catalítico de la quimiotripsina δ.
Algunas reacciones enzimáticas dan lugar a curvas sigmoideas, al ser representadas en una curva de saturación, lo que suele indicar una unión cooperativa del sustrato al centro catalítico de la enzima.
Este comportamiento es el más común en las enzimas multiméricas, que presentan varias zonas de interacción con el sustrato.
Por el contrario, la cooperatividad negativa hace que la enzima sea insensible a pequeños cambios en la concentración de sustrato.
La primera enzima en la que se estudió este proceso, durante la reacción de hidrólisis, fue la quimiotripsina.
[26] La detección de intermediarios suele ser la principal evidencia necesaria para saber bajo qué mecanismo actúa la enzima.
Por lo tanto, la cantidad de producto liberado durante esta fase (que puede obtenerse prolongando la recta correspondiente al estado estacionario hasta cortar el eje y) también da la cantidad de enzima funcional presente en el ensayo.
Con el fin de determinar la etapa limitante de la reacción o los intermediarios que se forman durante la misma, se pueden llevar a cabo ensayos enzimáticos en diversas condiciones con enzimas o sustratos ligeramente modificados, que aporten datos al respecto.
Este efecto dependerá de que el inhibidor se una a la enzima E, al complejo enzima-sustrato ES o a ambos, como se puede observar en la figura de la derecha y en la tabla inferior.
En presencia de un inhibidor reversible, los valores aparentes de la Km y la Vmax pasan a ser (α/α')Km y (1/α')Vmax, respectivamente, como se puede apreciar en la tabla inferior para los casos más comunes.
Estas reacciones decaen de forma exponencial y suelen ser saturables.
[33] Este modelo propone que las interacciones iniciales entre la enzima y el sustrato son relativamente débiles, pero suficientes para producir ciertos cambios conformacionales en la enzima, que estabilizan e incrementan la fuerza de la interacción.
Estos cambios conformacionales implican a una serie de aminoácidos catalíticos del centro activo, en los cuales se producen los enlaces químicos correspondientes entre la enzima y el sustrato.
A continuación se describen brevemente algunos de estos mecanismos:[34] • Catálisis ácido-base.