Sal (química)
En química, una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más líquida, lo que se denomina neutralización.
En general, las sales son compuestos iónicos que forman cristales.
Son generalmente solubles en agua, donde se separan los dos iones.
Las sales están formadas por una reacción química entre: Las sales también pueden formarse si se mezclan soluciones de diferentes sales, sus iones se recombinan, y la nueva sal es insoluble y precipita (ver: equilibrio de solubilidad), por ejemplo: Pb (NO3) 2 + Na2SO4 → PbSO4 ↓ + 2 NaNO3 Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión.
Hay que distinguir entre distintos casos: Las sales se pueden clasificar de diversas formas.
Los zwitteriones contienen un centro aniónico y catiónico en la misma molécula, pero no se consideran sales.
Los ejemplos de zwitteriones incluyen aminoácidos, muchos metabolitos, péptidos y proteínas.
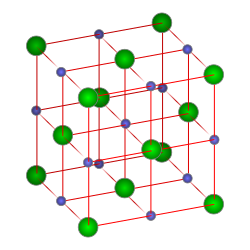
[6] En general, las sales son materiales cristalinos con estructura iónica.
Por ejemplo, los cristales de haluros de los metales alcalinos y alcalinotérreos (NaCl, CsCl, CaF2) formados por aniones, situados al principio del empaquetamiento esférico más denso, y cationes que ocupan huecos dentro del paquete.
Esta estructura se refleja apropiadamente en sus propiedades físicas: tienen altos puntos de fusión y en estado sólido son dieléctricos.
Las propiedades especiales de estas sales se explican por la baja simetría del catión, la interacción débil entre los iones y una buena distribución de la carga del catión.
Por ejemplo, el cloruro de sodio se funde a 801 °C.
Algunas sales con energías reticulares bajas son líquidas a temperatura ambiente o cerca de ella.
Estos incluyen sales fundidas, que suelen ser mezclas de sales, y líquidos iónicos, que normalmente contienen cationes orgánicos.
Muchos compuestos iónicos exhiben una solubilidad significativa en agua u otros disolventes polares.
A diferencia de los compuestos moleculares, las sales se disocian en solución en componentes aniónicos y catiónicos.
Por ejemplo, las sales de sodio, potasio y amonio suelen ser solubles en agua.
La mayoría de los nitratos y muchos sulfatos son solubles en agua.
Por razones similares, la mayoría de los carbonatos metálicos no son solubles en agua.
Al diluirse en agua se disocian por completo, en una reacción llamada hidrólisis.
[13] Las disoluciones de sales provenientes de una base fuerte y un ácido débil son básicas, lo que significa que tienen un pH mayor a siete.
Por el contrario, las disoluciones de sales de una base débil y un ácido fuerte son ácidas, y el pH resultante es menor a siete.
Generalmente, todos los iones metálicos producen disoluciones ácidas.
[13] Si la disolución se produce con una sal proveniente de una base y un ácido débiles, entonces el resultado dependerá de las fuerzas relativas que primen en la reacción.
Este comportamiento puede predecirse mediante la constante de disociación.
Estos compuestos iónicos se disocian completamente en agua.
Las sales fuertes son especialmente útiles cuando se crean compuestos conductores, ya que sus iones constituyentes permiten una mayor conductividad.
Pueden tener un olor similar al ácido o la base de los que se derivan.
Por ejemplo, el acetato de sodio, NaCH3COO, huele similar al ácido acético CH3COOH.