El virus del herpes simple 1 (herpes labial) y 2 (herpes genital) ( HSV-1 y HSV-2 ), también conocidos por sus nombres taxonómicos alfaherpesvirus humano 1 y alfaherpesvirus humano 2 , son dos miembros de la familia humana Herpesviridae , un conjunto de virus que producen infecciones virales en la mayoría de los humanos . [1] [2] Tanto el HSV-1 como el HSV-2 son muy comunes y contagiosos . Pueden transmitirse cuando una persona infectada comienza a eliminar el virus .
En 2016, aproximadamente el 67 % de la población mundial menor de 50 años tenía HSV-1. [3] En los Estados Unidos, se estima que aproximadamente el 47,8 % y el 11,9 % tienen HSV-1 y HSV-2, respectivamente, aunque la prevalencia real puede ser mucho mayor. [4] Debido a que se puede transmitir a través de cualquier contacto íntimo, es una de las infecciones de transmisión sexual más comunes . [5]
Muchos de los infectados nunca desarrollan síntomas. [6] Los síntomas, cuando aparecen, pueden incluir ampollas acuosas en la piel de cualquier parte del cuerpo o en las mucosas de la boca, los labios, la nariz, los genitales [1] o los ojos ( queratitis por herpes simple ). [7] Las lesiones se curan con una costra característica de la enfermedad herpética. A veces, los virus causan síntomas leves o atípicos durante los brotes. Sin embargo, también pueden causar formas más problemáticas de herpes simple . Como virus neurotrópicos y neuroinvasivos , HSV-1 y -2 persisten en el cuerpo ocultándose del sistema inmunológico en los cuerpos celulares de las neuronas , particularmente en los ganglios sensoriales. Después de la infección inicial o primaria, algunas personas infectadas experimentan episodios esporádicos de reactivación viral o brotes. En un brote, el virus en una célula nerviosa se activa y se transporta a través del axón de la neurona a la piel, donde se produce la replicación y el desprendimiento del virus y puede causar nuevas llagas. [8]
El HSV-1 y el HSV-2 se transmiten por contacto con una persona infectada que presenta reactivaciones del virus. El HSV-1 y el HSV-2 se excretan periódicamente, la mayoría de las veces de forma asintomática. [ cita requerida ]
En un estudio de personas con un primer episodio de infección genital por HSV-1 en 2022, se detectó la diseminación genital del HSV-1 en el 12 % de los días a los 2 meses y disminuyó significativamente al 7 % de los días a los 11 meses. La mayor parte de la diseminación genital fue asintomática; las lesiones genitales y orales y la diseminación oral fueron poco frecuentes. [9]
La mayoría de las transmisiones sexuales del VHS-2 ocurren durante períodos de diseminación asintomática . [10] La reactivación asintomática significa que el virus causa síntomas atípicos, sutiles o difíciles de notar que no se identifican como una infección activa por herpes, por lo que es posible contraer el virus incluso si no hay ampollas o llagas activas de VHS. En un estudio, las muestras de hisopado genital diarias detectaron HSV-2 en una mediana de 12 a 28 % de los días entre aquellos que tuvieron un brote, y 10 % de los días entre aquellos con infección asintomática (sin brotes previos), y muchos de estos episodios ocurrieron sin un brote visible ("diseminación subclínica"). [11]
En otro estudio, 73 sujetos fueron asignados aleatoriamente para recibir valaciclovir 1 g diario o placebo durante 60 días cada uno en un diseño cruzado de dos vías . Se recogió una muestra diaria del área genital para la detección de HSV-2 mediante reacción en cadena de la polimerasa, para comparar el efecto de valaciclovir versus placebo en la eliminación viral asintomática en sujetos inmunocompetentes, seropositivos a HSV-2 sin antecedentes de infección genital sintomática por herpes. El estudio encontró que valaciclovir redujo significativamente la eliminación durante los días subclínicos en comparación con placebo, mostrando una reducción del 71%; el 84% de los sujetos no tuvieron eliminación mientras recibieron valaciclovir frente al 54% de los sujetos con placebo. Alrededor del 88% de los pacientes tratados con valaciclovir no tuvieron signos o síntomas reconocidos frente al 77% de los que recibieron placebo. [12]
En el caso del HSV-2, la diseminación subclínica puede explicar la mayor parte de la transmisión. [11] Los estudios sobre parejas discordantes (una infectada con HSV-2 y otra no) muestran que la tasa de transmisión es de aproximadamente 5 a 8,9 por cada 10 000 contactos sexuales, y el uso del preservativo reduce en gran medida el riesgo de adquisición. [13] Los síntomas atípicos suelen atribuirse a otras causas, como una infección por levaduras . [14] [15] El HSV-1 suele adquirirse por vía oral durante la infancia. También puede transmitirse sexualmente, incluido el contacto con la saliva, como los besos y el sexo oral . [16] Históricamente, el HSV-2 era principalmente una infección de transmisión sexual, pero las tasas de infecciones genitales por HSV-1 han ido aumentando en las últimas décadas. [14]
Ambos virus también pueden transmitirse verticalmente durante el parto. [17] [18] Sin embargo, el riesgo de transmisión es mínimo si la madre no presenta síntomas ni ampollas expuestas durante el parto. El riesgo es considerable cuando la madre se infecta con el virus por primera vez durante la última etapa del embarazo, lo que refleja una alta carga viral. [19] Si bien la mayoría de las ETS virales no se pueden transmitir a través de objetos, ya que el virus muere rápidamente fuera del cuerpo, el VHS puede sobrevivir hasta 4,5 horas en superficies y puede transmitirse a través del uso de toallas, cepillos de dientes, tazas, cubiertos, etc. [20] [21] [22] [23]
Los virus del herpes simple pueden afectar las zonas de la piel expuestas al contacto con una persona infectada. Un ejemplo de esto es el panadizo herpético , que es una infección por herpes en los dedos; se encontraba comúnmente en las manos de los cirujanos dentales antes del uso rutinario de guantes al tratar a los pacientes. Estrechar la mano a una persona infectada no transmite esta enfermedad. [24] La infección genital por HSV-2 aumenta el riesgo de contraer el VIH . [25]
El HSV ha sido un virus modelo para muchos estudios de biología molecular. Por ejemplo, uno de los primeros promotores funcionales en eucariotas fue descubierto en el HSV (del gen de la timidina quinasa ) y la proteína virión VP16 es uno de los activadores transcripcionales más estudiados . [26]

Todos los virus del herpes animal comparten algunas propiedades comunes. La estructura de los virus del herpes consiste en un genoma de ADN lineal, bicatenario y relativamente grande encerrado dentro de una jaula proteica icosaédrica llamada cápside , que está envuelta en una bicapa lipídica llamada envoltura . La envoltura está unida a la cápside por medio de un tegumento . Esta partícula completa se conoce como virión . [27] HSV-1 y HSV-2 contienen cada uno al menos 74 genes (o marcos de lectura abiertos , ORF) dentro de sus genomas, [28] aunque la especulación sobre el hacinamiento de genes permite hasta 84 genes codificadores de proteínas únicos por 94 ORF putativos. [29] Estos genes codifican una variedad de proteínas involucradas en la formación de la cápside, el tegumento y la envoltura del virus, así como en el control de la replicación e infectividad del virus. Estos genes y sus funciones se resumen en la siguiente tabla. [ cita requerida ]
Los genomas de HSV-1 y HSV-2 son complejos y contienen dos regiones únicas llamadas región única larga (UL ) y región única corta (US ) . De los 74 ORF conocidos, UL contiene 56 genes virales, mientras que US contiene solo 12. [28] La transcripción de los genes de HSV es catalizada por la ARN polimerasa II del huésped infectado. [28] Los genes tempranos inmediatos , que codifican proteínas, por ejemplo ICP22 [30] que regulan la expresión de genes virales tempranos y tardíos, son los primeros en expresarse después de la infección. La expresión génica temprana sigue, para permitir la síntesis de enzimas involucradas en la replicación del ADN y la producción de ciertas glicoproteínas de la envoltura . La expresión de genes tardíos ocurre al final; este grupo de genes codifica predominantemente proteínas que forman la partícula del virión. [28]
Cinco proteínas de (U L ) forman la cápside viral: UL6 , UL18, UL35, UL38 y la proteína principal de la cápside UL19. [27]
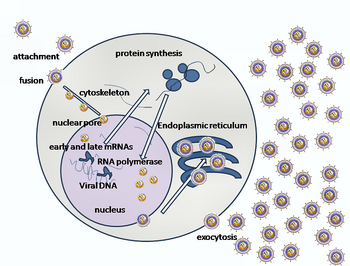
La entrada del HSV en una célula huésped implica la unión de varias glicoproteínas en la superficie del virus envuelto a sus receptores transmembrana en la superficie celular. Muchos de estos receptores son luego atraídos hacia el interior de la célula, lo que se cree que abre un anillo de tres heterodímeros gHgL que estabilizan una conformación compacta de la glicoproteína gB, de modo que salta y perfora la membrana celular. [31] La envoltura que cubre la partícula del virus luego se fusiona con la membrana celular, creando un poro a través del cual el contenido de la envoltura viral ingresa a la célula huésped. [ cita requerida ]
Las etapas secuenciales de la entrada del HSV son análogas a las de otros virus . Al principio, los receptores complementarios en el virus y la superficie celular acercan las membranas viral y celular. Las interacciones de estas moléculas forman entonces un poro de entrada estable a través del cual se introduce el contenido de la envoltura viral en la célula huésped. El virus también puede ser endocitado después de unirse a los receptores, y la fusión podría ocurrir en el endosoma . En las micrografías electrónicas, se han visto fusionadas las láminas externas de las bicapas lipídicas viral y celular; [32] esta hemifusión puede estar en la ruta habitual de entrada o puede ser generalmente un estado detenido con más probabilidades de ser capturado que un mecanismo de entrada transitorio. [ cita requerida ]
En el caso de un virus del herpes, las interacciones iniciales ocurren cuando dos glicoproteínas de la envoltura viral llamadas glicoproteína C (gC) y glicoproteína B (gB) se unen a un polisacárido de la superficie celular llamado heparán sulfato . A continuación, la principal proteína de unión al receptor, la glicoproteína D (gD), se une específicamente a al menos uno de los tres receptores de entrada conocidos. [33] Estos receptores celulares incluyen el mediador de entrada del virus del herpes ( HVEM ), la nectina -1 y el heparán sulfato sulfatado 3-O. Los receptores de nectina suelen producir adhesión célula-célula, para proporcionar un fuerte punto de unión para el virus a la célula huésped. [31] Estas interacciones acercan mutuamente las superficies de la membrana y permiten que otras glicoproteínas incrustadas en la envoltura viral interactúen con otras moléculas de la superficie celular. Una vez unida al HVEM, la gD cambia su conformación e interactúa con las glicoproteínas virales H (gH) y L (gL), que forman un complejo. La interacción de estas proteínas de membrana puede dar lugar a un estado de hemifusión. La interacción de gB con el complejo gH/gL crea un poro de entrada para la cápside viral. [32] gB interactúa con los glicosaminoglicanos en la superficie de la célula huésped. [ cita requerida ]
Después de que la cápside viral ingresa al citoplasma celular , comienza a expresar la proteína viral ICP27. ICP27 es una proteína reguladora que causa la interrupción en la síntesis de proteínas del huésped y la utiliza para la replicación viral. ICP27 se une con una enzima celular Serine-Arginine Protein Kinase 1, SRPK1 . La formación de este complejo hace que SRPK1 se desplace del citoplasma al núcleo, y el genoma viral se transporta al núcleo celular . [34] Una vez unida al núcleo en un poro de entrada nuclear, la cápside expulsa su contenido de ADN a través del portal de la cápside. El portal de la cápside está formado por 12 copias de la proteína portal, UL6, dispuestas como un anillo; las proteínas contienen una secuencia de aminoácidos de cremallera de leucina , que les permite adherirse entre sí. [35] Cada cápside icosaédrica contiene un solo portal, ubicado en un vértice . [36] [37] El ADN sale de la cápside en un solo segmento lineal. [38]
El HSV evade el sistema inmunológico a través de la interferencia con la presentación de antígenos MHC clase I en la superficie celular, al bloquear el transportador asociado con el procesamiento de antígenos (TAP) inducido por la secreción de ICP-47 por HSV. En la célula huésped, TAP transporta péptidos del epítopo del antígeno viral digerido desde el citosol hasta el retículo endoplasmático, lo que permite que estos epítopos se combinen con moléculas MHC clase I y se presenten en la superficie de la célula. La presentación del epítopo viral con MHC clase I es un requisito para la activación de los linfocitos T citotóxicos (CTL), los principales efectores de la respuesta inmune mediada por células contra las células infectadas por virus. ICP-47 previene el inicio de una respuesta CTL contra HSV, lo que permite que el virus sobreviva durante un período prolongado en el huésped. [39] HSV generalmente produce efecto citopático (CPE) dentro de las 24 a 72 horas posteriores a la infección en líneas celulares permisivas que se observa por la formación clásica de placa. Sin embargo, también se ha informado de aislados clínicos de HSV-1 que no mostraron ningún ECP en cultivos de células Vero y A549 en varios pases con un bajo nivel de expresión de la proteína del virus. Probablemente, estos aislados de HSV-1 están evolucionando hacia una forma más "críptica" para establecer una infección crónica, desenmascarando así otra estrategia para evadir el sistema inmunológico del huésped, además de la latencia neuronal. [40]

Tras la infección de una célula, se produce una cascada de proteínas del virus del herpes, denominadas inmediata-temprana, temprana y tardía. Las investigaciones realizadas con citometría de flujo en otro miembro de la familia del virus del herpes, el herpesvirus asociado al sarcoma de Kaposi , indican la posibilidad de una etapa lítica adicional , tardía-retardada. [41] Estas etapas de la infección lítica, en particular la tardía, son distintas de la etapa de latencia. En el caso del HSV-1, no se detectan productos proteicos durante la latencia, mientras que sí se detectan durante el ciclo lítico. [ cita requerida ]
Las primeras proteínas transcritas se utilizan en la regulación de la replicación genética del virus. Al entrar en la célula, una proteína α-TIF se une a la partícula viral y ayuda en la transcripción temprana inmediata . La proteína de apagado del huésped del virión (VHS o UL41) es muy importante para la replicación viral. [42] Esta enzima apaga la síntesis de proteínas en el huésped, degrada el ARNm del huésped , ayuda en la replicación viral y regula la expresión génica de las proteínas virales. El genoma viral viaja inmediatamente al núcleo, pero la proteína VHS permanece en el citoplasma. [43] [44]
Las proteínas tardías forman la cápside y los receptores en la superficie del virus. El empaquetamiento de las partículas virales, incluido el genoma , el núcleo y la cápside, ocurre en el núcleo de la célula. Aquí, los concatémeros del genoma viral se separan por escisión y se colocan en las cápsides formadas. HSV-1 experimenta un proceso de envoltura primaria y secundaria. La envoltura primaria se adquiere mediante gemación en la membrana nuclear interna de la célula. Esta luego se fusiona con la membrana nuclear externa. El virus adquiere su envoltura final mediante gemación en vesículas citoplasmáticas . [45]
Los HSV pueden persistir en una forma quiescente pero persistente conocida como infección latente, en particular en los ganglios neurales . [1] El ADN circular del genoma del HSV reside en el núcleo celular como un episoma . [46] El HSV-1 tiende a residir en los ganglios trigéminos , mientras que el HSV-2 tiende a residir en los ganglios sacros , pero estas son solo tendencias históricas. Durante la infección latente de una célula, los HSV expresan ARN transcrito asociado a latencia (LAT) . El LAT regula el genoma de la célula huésped e interfiere con los mecanismos naturales de muerte celular. Al mantener las células huésped, la expresión de LAT preserva un reservorio del virus, lo que permite recurrencias periódicas posteriores, generalmente sintomáticas, o "brotes" característicos de la no latencia. Independientemente de si las recurrencias son sintomáticas o no, se produce la diseminación viral para infectar a un nuevo huésped. [ cita requerida ]
Una proteína que se encuentra en las neuronas puede unirse al ADN del virus del herpes y regular la latencia . El ADN del virus del herpes contiene un gen para una proteína llamada ICP4, que es un transactivador importante de genes asociados con la infección lítica en HSV-1. [47] Los elementos que rodean al gen para ICP4 se unen a una proteína conocida como factor de silenciamiento restrictivo neuronal de la proteína neuronal humana (NRSF) o factor de transcripción silenciador del elemento represor humano (REST) . Cuando se une a los elementos del ADN viral, la desacetilación de histonas ocurre sobre la secuencia del gen ICP4 para prevenir el inicio de la transcripción de este gen, previniendo así la transcripción de otros genes virales involucrados en el ciclo lítico. [47] [48] Otra proteína del HSV revierte la inhibición de la síntesis de la proteína ICP4. ICP0 disocia NRSF del gen ICP4 y así previene el silenciamiento del ADN viral. [49]
El genoma del HSV abarca unos 150.000 pb y consta de dos segmentos únicos, denominados unique long (UL) y unique short (US), así como repeticiones terminales invertidas que se encuentran en los dos extremos de ellos, denominadas repeat long (RL) y repeat short (RS). También hay elementos menores de "redundancia terminal" (α) que se encuentran en los extremos posteriores de RS. La disposición general es RL-UL-RL-α-RS-US-RS-α con cada par de repeticiones invirtiéndose entre sí. La secuencia completa se encapsula entonces en una repetición directa terminal. Las partes larga y corta tienen cada una sus propios orígenes de replicación , con OriL ubicado entre UL28 y UL30 y OriS ubicado en un par cerca de RS. [50] Como los segmentos L y S se pueden ensamblar en cualquier dirección, se pueden invertir libremente entre sí, formando varios isómeros lineales. [51]
Los genes del VHS se expresan en tres clases temporales: genes tempranos inmediatos (IE o α), tempranos (E o ß) y tardíos (γ). Sin embargo, la progresión de la expresión génica viral es más bien gradual que en etapas claramente diferenciadas. Los genes tempranos inmediatos se transcriben justo después de la infección y sus productos genéticos activan la transcripción de los genes tempranos. Los productos génicos tempranos ayudan a replicar el ADN viral. La replicación del ADN viral , a su vez, estimula la expresión de los genes tardíos, que codifican las proteínas estructurales. [26]
La transcripción de los genes tempranos inmediatos (IE) comienza justo después de que el ADN del virus entra en el núcleo. Todos los genes del virus son transcritos por la ARN polimerasa II del huésped . Aunque las proteínas del huésped son suficientes para la transcripción del virus, las proteínas virales son necesarias para la transcripción de ciertos genes. [26] Por ejemplo, VP16 juega un papel importante en la transcripción de IE y la partícula del virus aparentemente la lleva a la célula huésped, de modo que no necesita ser producida primero. De manera similar, las proteínas IE RS1 (ICP4), UL54 (ICP27) e ICP0 promueven la transcripción de los genes tempranos (E). Al igual que los genes IE, los promotores de genes tempranos contienen sitios de unión para factores de transcripción celular. Una proteína temprana, ICP8, es necesaria tanto para la transcripción de genes tardíos como para la replicación del ADN. [26]
Más adelante en el ciclo de vida del VHS, se detiene la expresión de los genes tempranos e inmediatos. Esto está mediado por proteínas virales específicas, por ejemplo, ICP4, que se reprime a sí misma uniéndose a elementos de su propio promotor. Como consecuencia, la regulación negativa de los niveles de ICP4 conduce a una reducción de la expresión de genes tempranos y tardíos, ya que ICP4 es importante para ambos. [26]
Es importante destacar que el HSV detiene la síntesis de ARN, ADN y proteínas de la célula huésped para dirigir los recursos celulares a la producción del virus. En primer lugar, la proteína del virus vhs induce la degradación de los ARNm existentes al principio de la infección. Otros genes virales impiden la transcripción y la traducción celular. Por ejemplo, ICP27 inhibe el empalme del ARN , de modo que los ARNm del virus (que normalmente no se empalman) obtienen una ventaja sobre los ARNm del huésped. Finalmente, las proteínas del virus desestabilizan ciertas proteínas celulares implicadas en el ciclo celular del huésped , de modo que tanto la división celular como la replicación del ADN de la célula huésped se alteran a favor de la replicación del virus. [26]
Los genomas del virus del herpes simple 1 se pueden clasificar en seis clados . [57] Cuatro de ellos se encuentran en África oriental , uno en Asia oriental y uno en Europa y América del Norte . Esto sugiere que el virus puede haberse originado en África oriental. El ancestro común más reciente de las cepas euroasiáticas parece haber evolucionado hace unos 60.000 años. [58] Los aislamientos del virus del herpes simple 1 del este de Asia tienen un patrón inusual que actualmente se explica mejor por las dos olas de migración responsables del poblamiento de Japón . [58]
Los genomas del virus del herpes simple tipo 2 se pueden dividir en dos grupos: uno se distribuye globalmente y el otro se limita principalmente al África subsahariana . [59] El genotipo distribuido globalmente ha experimentado cuatro recombinaciones antiguas con el virus del herpes simple tipo 1. También se ha informado que el HSV-1 y el HSV-2 pueden tener eventos de recombinación contemporáneos y estables en huéspedes infectados simultáneamente con ambos patógenos. Todos los casos son HSV-2 que adquiere partes del genoma del HSV-1, a veces cambiando partes de su epítopo antigénico en el proceso. [60]
Se ha estimado que la tasa de mutación es de ~1,38×10 −7 sustituciones/sitio/año. [57] En el ámbito clínico, las mutaciones en el gen de la timidina quinasa o en el gen de la ADN polimerasa han causado resistencia al aciclovir . Sin embargo, la mayoría de las mutaciones se producen en el gen de la timidina quinasa en lugar del gen de la ADN polimerasa. [61]
Otro análisis ha estimado que la tasa de mutación en el genoma del virus del herpes simple 1 es de 1,82×10 −8 sustituciones de nucleótidos por sitio por año. Este análisis situó al ancestro común más reciente de este virus hace unos 710.000 años. [62]
Los virus del herpes simple 1 y 2 divergieron hace unos 6 millones de años . [60]
Al igual que otros herpesvirus , los virus del herpes simple establecen una infección latente de por vida y, por lo tanto, no pueden erradicarse del cuerpo con los tratamientos actuales. [63]
El tratamiento generalmente implica medicamentos antivirales de uso general que interfieren con la replicación viral, reducen la gravedad física de las lesiones asociadas al brote y disminuyen la posibilidad de transmisión a otras personas. Los estudios de poblaciones de pacientes vulnerables han indicado que el uso diario de antivirales como aciclovir [64] y valaciclovir puede reducir las tasas de reactivación. [15] El uso extensivo de medicamentos antiherpéticos ha llevado al desarrollo de cierta resistencia a los medicamentos , [ cita requerida ] que a su vez puede conducir al fracaso del tratamiento. Por lo tanto, se investigan ampliamente nuevas fuentes de medicamentos para abordar el problema. En enero de 2020, se publicó un artículo de revisión integral que demostró la eficacia de los productos naturales como prometedores medicamentos contra el VHS. [65] La piritiona , un ionóforo de zinc , ha demostrado actividad antiviral contra el herpes simple. [66]
En 1979, se informó que existe un posible vínculo entre HSV-1 y la enfermedad de Alzheimer , en personas con el alelo épsilon4 del gen APOE . [67] HSV-1 parece ser particularmente dañino para el sistema nervioso y aumenta el riesgo de desarrollar la enfermedad de Alzheimer. El virus interactúa con los componentes y receptores de las lipoproteínas , lo que puede conducir al desarrollo de la enfermedad de Alzheimer. [68] Esta investigación identifica a HSV como el patógeno más claramente vinculado al establecimiento de Alzheimer. [69] Según un estudio realizado en 1997, sin la presencia del alelo del gen , HSV-1 no parece causar ningún daño neurológico o aumentar el riesgo de Alzheimer. [70] Sin embargo, un estudio prospectivo más reciente publicado en 2008 con una cohorte de 591 personas mostró una diferencia estadísticamente significativa entre pacientes con anticuerpos que indicaban una reactivación reciente de HSV y aquellos sin estos anticuerpos en la incidencia de la enfermedad de Alzheimer, sin correlación directa con el alelo APOE-epsilon4. [71]
El ensayo contó con una muestra pequeña de pacientes que no tenían el anticuerpo al inicio del estudio, por lo que los resultados deben considerarse altamente inciertos . En 2011, los científicos de la Universidad de Manchester demostraron que el tratamiento de células infectadas con HSV1 con agentes antivirales disminuyó la acumulación de proteína β-amiloide y tau y también disminuyó la replicación de HSV-1. [72]
Un estudio retrospectivo de 2018 de Taiwán sobre 33.000 pacientes encontró que estar infectado con el virus del herpes simple aumentó el riesgo de demencia 2,56 veces (IC del 95 %: 2,3-2,8) en pacientes que no recibían medicamentos antiherpéticos (2,6 veces para infecciones por HSV-1 y 2,0 veces para infecciones por HSV-2). Sin embargo, los pacientes infectados con HSV que recibían medicamentos antiherpéticos (p. ej., aciclovir , famciclovir , ganciclovir , idoxuridina , penciclovir , tromantadina , valaciclovir o valganciclovir ) no mostraron un riesgo elevado de demencia en comparación con los pacientes no infectados con HSV. [73]
La reactivación por multiplicidad (MR) es el proceso por el cual los genomas virales que contienen daño inactivante interactúan dentro de una célula infectada para formar un genoma viral viable. La MR se descubrió originalmente con el virus bacteriano bacteriófago T4, pero posteriormente también se encontró en virus patógenos, incluidos el virus de la influenza, el VIH-1, el virus adenovirus simio 40, el virus vaccinia, el reovirus, el poliovirus y el virus del herpes simple. [74]
Cuando las partículas de HSV se exponen a dosis de un agente que daña el ADN que sería letal en infecciones únicas, pero luego se les permite sufrir infecciones múltiples (es decir, dos o más virus por célula huésped), se observa MR. La supervivencia mejorada de HSV-1 debido a MR ocurre tras la exposición a diferentes agentes que dañan el ADN, incluyendo metil metanosulfonato , [75] trimetilpsoraleno (que causa enlaces cruzados de ADN entre cadenas), [76] [77] y luz UV. [78] Después del tratamiento de HSV genéticamente marcado con trimetilpsoraleno, la recombinación entre los virus marcados aumenta, lo que sugiere que el daño del trimetilpsoraleno estimula la recombinación. [76] La MR de HSV parece depender parcialmente de la maquinaria de reparación recombinatoria de la célula huésped ya que las células de fibroblastos de la piel defectuosas en un componente de esta maquinaria (es decir, células de pacientes con síndrome de Bloom) son deficientes en MR. [78]
Estas observaciones sugieren que la MR en las infecciones por HSV implica una recombinación genética entre genomas virales dañados que da como resultado la producción de virus de progenie viables. El HSV-1, al infectar las células huésped, induce inflamación y estrés oxidativo. [79] Por lo tanto, parece que el genoma del HSV puede estar sujeto a daño oxidativo del ADN durante la infección, y que la MR puede mejorar la supervivencia y la virulencia viral en estas condiciones. [ cita requerida ]
El virus del herpes simple modificado se considera una posible terapia contra el cáncer y se ha probado clínicamente de forma exhaustiva para evaluar su capacidad oncolítica (para matar el cáncer). [80] Los datos provisionales de supervivencia general del ensayo de fase 3 de Amgen de un virus del herpes genéticamente atenuado sugieren eficacia contra el melanoma . [81]
El virus del herpes simple también se utiliza como trazador transneuronal que define conexiones entre neuronas en virtud de atravesar sinapsis. [82]
El HSV-2 es la causa más común de meningitis de Mollaret . [83] El HSV-1 puede provocar casos potencialmente fatales de encefalitis por herpes simple . [84] Los virus del herpes simple también se han estudiado en trastornos del sistema nervioso central como la esclerosis múltiple , pero las investigaciones han sido contradictorias y no concluyentes. [85]
Tras el diagnóstico de infección por herpes simple genital, los pacientes pueden sufrir un episodio de depresión profunda . Además de ofrecer medicación antiviral para aliviar los síntomas y acortar su duración, los médicos también deben abordar el impacto en la salud mental de un nuevo diagnóstico. Proporcionar información sobre la altísima prevalencia de estas infecciones, sus tratamientos eficaces y las futuras terapias en desarrollo puede brindar esperanza a los pacientes que, de otro modo, se sentirían desmoralizados. [ cita requerida ]
Existen vacunas de uso común para algunos herpesvirus, como la vacuna veterinaria HVT/LT (vacuna contra la laringotraqueítis por vector del herpesvirus de pavo). Sin embargo, previene la aterosclerosis (que refleja histológicamente la aterosclerosis en humanos) en los animales de destino vacunados. [86] [87] Las únicas vacunas humanas disponibles para los herpesvirus son la del virus varicela zóster , que se administra a los niños alrededor de su primer cumpleaños para prevenir la varicela , o a los adultos para prevenir un brote de herpes zóster . Sin embargo, no existe una vacuna humana para los virus del herpes simple. A partir de 2022, hay estudios preclínicos y clínicos activos en curso sobre el herpes simple en humanos; se están desarrollando vacunas tanto para el tratamiento como para la prevención. [ cita requerida ]