La entrada del virus es la etapa más temprana de la infección en el ciclo de vida del virus , ya que el virus entra en contacto con la célula huésped e introduce material viral en la célula. Los principales pasos involucrados en la entrada del virus se muestran a continuación. [1] A pesar de la variación entre los virus, existen varias generalidades compartidas con respecto a la entrada del virus. [2]
La forma en que un virus ingresa a una célula varía según el tipo de virus. Un virus con una cápside sin envoltura ingresa a la célula uniéndose al factor de unión ubicado en una célula huésped. Luego ingresa a la célula por endocitosis o haciendo un orificio en la membrana de la célula huésped e insertando su genoma viral. [2]


La entrada de los virus envueltos en la célula es más complicada. Los virus envueltos entran en la célula uniéndose a un factor de unión situado en la superficie de la célula huésped. A continuación, entran por endocitosis o un evento de fusión directa de la membrana. El evento de fusión se produce cuando la membrana del virus y la membrana de la célula huésped se fusionan permitiendo la entrada del virus. Esto se produce mediante la unión (o adsorción) a una célula susceptible; una célula que contiene un receptor al que el virus puede unirse, de forma similar a dos piezas de un rompecabezas que encajan entre sí. Los receptores de la envoltura viral se conectan de forma efectiva a receptores complementarios en la membrana celular . Esta unión hace que las dos membranas permanezcan en proximidad mutua, lo que favorece más interacciones entre las proteínas de superficie. Este es también el primer requisito que debe cumplirse antes de que una célula pueda infectarse. La satisfacción de este requisito hace que la célula sea susceptible. Los virus que muestran este comportamiento incluyen muchos virus envueltos, como el VIH y el virus del herpes simple . [2]
Estas ideas básicas se aplican a los virus que infectan a las bacterias, conocidos como bacteriófagos (o simplemente fagos). Los fagos típicos tienen colas largas que utilizan para adherirse a receptores en la superficie bacteriana e inyectar su genoma viral.
Antes de entrar, un virus debe unirse a una célula huésped. La unión se logra cuando proteínas específicas de la cápside viral o envoltura viral se unen a proteínas específicas llamadas proteínas receptoras en la membrana celular de la célula diana. El virus debe entrar en la célula, que está cubierta por una bicapa de fosfolípidos , la barrera natural de la célula hacia el mundo exterior. El proceso por el cual se rompe esta barrera depende del virus. Los tipos de entrada son:
Mediante el uso de la proteína fluorescente verde (GFP), la entrada del virus y la infección se pueden visualizar en tiempo real. Una vez que un virus entra en una célula, la replicación no es inmediata y, de hecho, lleva algún tiempo (desde segundos hasta horas). [3] [4]
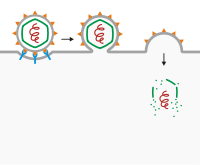
El ejemplo más conocido es la fusión de membranas. En varios virus con una envoltura viral , los receptores virales se unen a los receptores en la superficie de la célula y pueden estar presentes receptores secundarios para iniciar la perforación de la membrana o la fusión con la célula huésped. Después de la unión, la envoltura viral se fusiona con la membrana de la célula huésped, lo que hace que el virus entre. Los virus que entran en una célula de esta manera incluyen el VIH , el KSHV [5] [6] [7] [8] y el virus del herpes simple . [9]
En el SARS-CoV-2 y otros virus similares, la entrada se produce a través de la fusión de membranas mediada por la proteína de la espícula , ya sea en la superficie celular o en vesículas. Los esfuerzos de investigación se han centrado en la interacción de la proteína de la espícula con su receptor de superficie celular, la enzima convertidora de angiotensina 2 (ACE2). El alto nivel de actividad evolucionado para mediar la fusión de célula a célula ha dado como resultado una capacidad de fusión mejorada. [10] La profilaxis actual contra la infección por SARS-2 se dirige a las proteínas de la espícula (S) que albergan la capacidad de fusión de membranas. [11] Las vacunas se basan en el bloqueo de la glicoproteína S viral con la célula, deteniendo así la fusión del virus y las membranas de su célula huésped. [12] El mecanismo de fusión también se estudia como un objetivo potencial para el desarrollo de antivirales. [13]

Los virus sin envoltura viral entran en la célula generalmente a través de endocitosis ; “engañan” a la célula huésped para que ingiera los viriones a través de la membrana celular. Las células pueden absorber recursos del entorno exterior a la célula, y estos mecanismos pueden ser explotados por los virus para entrar en una célula de la misma manera que los recursos ordinarios. Una vez dentro de la célula, el virus abandona la vesícula huésped por la que fue absorbido y así obtiene acceso al citoplasma. Algunos ejemplos de virus que entran de esta manera incluyen el virus de la polio , el virus de la hepatitis C [14] y el virus de la fiebre aftosa [15] .
Muchos virus envueltos, como el SARS-CoV-2 , también ingresan a la célula a través de la endocitosis. La entrada a través del endosoma garantiza un pH bajo y la exposición a las proteasas que son necesarias para abrir la cápside viral y liberar el material genético dentro del citoplasma del huésped. Además, los endosomas transportan el virus a través de la célula y garantizan que no quede ningún rastro del virus en la superficie, lo que de lo contrario podría desencadenar el reconocimiento inmunológico por parte del huésped. [16]
Un tercer método consiste en unirse simplemente a la superficie de la célula huésped a través de receptores en la célula, con el virus inyectando sólo su genoma en la célula, dejando el resto del virus en la superficie. Esto se limita a los virus en los que sólo se requiere el genoma para la infección de una célula (por ejemplo, los virus de ARN de cadena positiva porque pueden traducirse inmediatamente) y se limita aún más a los virus que realmente muestran este comportamiento. El ejemplo mejor estudiado incluye a los bacteriófagos ; por ejemplo, cuando las fibras de la cola del fago T2 aterrizan en una célula, su vaina central perfora la membrana celular y el fago inyecta ADN de la cápside de la cabeza directamente en la célula. [17]
Una vez que un virus se encuentra en una célula, activará la formación de proteínas (ya sea por sí mismo o utilizando la maquinaria del huésped) para obtener el control total de la célula huésped, si es posible. Los mecanismos de control incluyen la supresión de las defensas celulares intrínsecas, la supresión de la señalización celular y la supresión de la transcripción y traducción celular del huésped . A menudo, estos efectos citotóxicos conducen a la muerte y el deterioro de una célula infectada por un virus.
Una célula se clasifica como susceptible a un virus si el virus es capaz de entrar en la célula. Después de la introducción de la partícula viral, se produce la descompresión del contenido ( proteínas virales en el tegumento y el genoma viral a través de alguna forma de ácido nucleico ) como preparación para la siguiente etapa de la infección viral: la replicación viral .