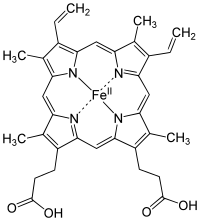
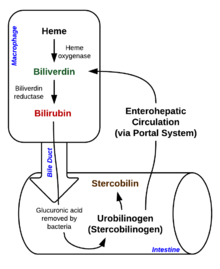
Hemo
No todas las porfirinas contienen hierro, pero una fracción sustancial de las metaloproteínas que contienen el núcleo porfirina, poseen el grupo hemo como grupo prostético; estas proteínas se conocen como hemoproteínas.
[1] Las hemoproteínas han alcanzado su remarcable diversidad funcional modificando el ambiente inmediato del macrociclo hemo dentro de la matriz proteica.
Por ejemplo, la capacidad de la hemoglobina para entregar en forma efectiva el oxígeno a los tejidos se debe a unos residuos aminoacídicos específicos localizados cerca del grupo hemo de la molécula.
El proceso enzimático que lleva a la producción del grupo hemo, se llama apropiadamente porfirinosíntesis, ya que todos los intermediarios son tetrapirroles se clasifican químicamente como porfirinas.
En humanos, esta vía metabólica sirve casi exclusivamente para la síntesis del hemo.
El monóxido de carbono actúa como mensajero celular y tiene alguna función en la vasodilatación.
Adicionalmente, la degradación del heme parece ser una respuesta evolutivamente muy conservada al estrés oxidativo.
La razón por la cual las células podrían aumentar exponencialmente su capacidad de degradar el grupo hemo en respuesta al estrés oxidativo todavía permanece poco clara, pero parece formar parte de una respuesta citoprotectora que limita los efectos deletéreos del hemo libre.
Este se oxida a estercobilina, la cual es la responsable del color oscuro de las heces.
Sin embargo, bajo condiciones de estrés oxidativo, algunas hemoproteínas, tales como por ejemplo la hemoglobina, pueden liberar sus grupos prostéticos.
[cita requerida] Esta propiedad del hemo libre puede sensibilizar a una variedad de células para entrar en muerte celular programada en respuesta a agonistas proinflamatorios, un efecto deletéreo que juega un importante rol en la patogénesis de ciertas enfermedades inflamatorias tales como la malaria[9] y sepsis.

) en el centro de la protoporfirina IX.