El dietilestilbestrol ( DES ), también conocido como stilbestrol o stilboestrol , es un medicamento de estrógeno no esteroide , que actualmente se usa raramente. [5] [6] [7] En el pasado, se usaba ampliamente para una variedad de indicaciones, incluido el apoyo durante el embarazo para aquellas con antecedentes de abortos espontáneos recurrentes , la terapia hormonal para los síntomas de la menopausia y la deficiencia de estrógenos , el tratamiento del cáncer de próstata y el cáncer de mama , y otros usos. [5] Para 2007, solo se usaba en el tratamiento del cáncer de próstata y el cáncer de mama. [8] En 2011, Hoover y sus colegas informaron sobre los resultados de salud adversos relacionados con el DES, incluida la infertilidad , el aborto espontáneo , el embarazo ectópico , la preeclampsia , el parto prematuro , la muerte fetal , la muerte infantil , la menopausia antes de los 45 años, el cáncer de mama, el cáncer de cuello uterino y el cáncer vaginal . [9] Aunque lo más común es tomarlo por vía oral , el DES también estaba disponible para usarse por otras vías , por ejemplo, vaginal , tópica y por inyección .
El DES es un estrógeno o un agonista de los receptores de estrógeno , el objetivo biológico de los estrógenos como el estradiol . [7] Es un estrógeno sintético y no esteroide del grupo del estilbestrol , y se diferencia del estrógeno natural estradiol en varias formas. [7] En comparación con el estradiol, el DES tiene una biodisponibilidad mucho mejor cuando se toma por vía oral, es más resistente al metabolismo y muestra efectos relativamente mayores en ciertas partes del cuerpo como el hígado y el útero . [7] Estas diferencias dan como resultado que el DES tenga un mayor riesgo de coágulos sanguíneos , problemas cardiovasculares y ciertos otros efectos adversos. [7]
El DES se descubrió en 1938 y se introdujo para uso médico en 1939. [10] [11] Desde aproximadamente 1940 hasta 1971, el medicamento se administró a mujeres embarazadas con la creencia incorrecta de que reduciría el riesgo de complicaciones y pérdidas del embarazo. [10] En 1971, se demostró que el DES causaba carcinoma de células claras , un tumor vaginal poco común , en aquellas que habían estado expuestas a este medicamento en el útero . [10] [5] Posteriormente, la Administración de Alimentos y Medicamentos de los Estados Unidos retiró la aprobación del DES como tratamiento para mujeres embarazadas. [10] [5] Los estudios de seguimiento han indicado que el DES también tiene el potencial de causar una variedad de complicaciones médicas adversas significativas durante la vida de las personas expuestas (por ejemplo, infertilidad). [10] [12]
El Instituto Nacional del Cáncer de los Estados Unidos recomienda [13] que los niños nacidos de madres que tomaron DES se sometan a exámenes médicos especiales de forma periódica para detectar complicaciones como resultado de la medicación. A las personas que estuvieron expuestas al DES durante los embarazos de sus madres se las suele denominar "hijas del DES" e "hijos del DES". [10] [14] Desde que se descubrieron los efectos tóxicos del DES, se ha dejado de utilizar en gran medida y ahora prácticamente ya no se comercializa. [10] [15]
El DES se ha utilizado en el pasado para las siguientes indicaciones: [5] [ cita(s) adicional(es) necesaria(s) ]
El DES se utilizó en dosis de 0,2 a 0,5 mg/día en la terapia hormonal menopáusica . [27] [5]
El interés en el uso de DES para tratar el cáncer de próstata continúa hoy en día. [28] [29] [30] [31] [32] [33] [34] [ citas excesivas ] Sin embargo, el uso de estrógenos parenterales bioidénticos como el fosfato de poliestradiol se ha defendido en favor de estrógenos sintéticos orales como el DES debido a su riesgo mucho menor de toxicidad cardiovascular. [35] [32] [34] Además del cáncer de próstata, cierto interés en el uso de DES para tratar el cáncer de mama continúa hoy en día también. [36] [37] Sin embargo, de manera similar al caso del cáncer de próstata, se han presentado argumentos [38] para el uso de estrógenos bioidénticos como el estradiol en lugar de DES para el cáncer de mama. [36] [38]
El DES oral a razón de 0,25 a 0,5 mg/día es eficaz en el tratamiento de los sofocos en hombres sometidos a terapia de privación de andrógenos para el cáncer de próstata. [39]
Aunque se utilizó DES para apoyar el embarazo, más tarde se descubrió que no era eficaz para este uso y que, en realidad, era perjudicial. [40] [41] [42] [43]
A dosis superiores a 1 mg/día, el DES se asocia con altas tasas de efectos secundarios, entre ellos náuseas , vómitos , malestar abdominal , dolor de cabeza y distensión abdominal (incidencia del 15 al 50%). [44]
La pigmentación de las areolas mamarias suele ser muy oscura y casi negra con la terapia con DES. [5] [45] [46] [47] [48] [49] [50] [51] La pigmentación que se produce con estrógenos sintéticos como el DES es mucho mayor que con estrógenos naturales como el estradiol . [5] [45] Se desconoce el mecanismo de la diferencia. [5] Se ha informado que los progestágenos como el caproato de hidroxiprogesterona reducen la hiperpigmentación del pezón inducida por la terapia con estrógenos en dosis altas. [52]
En hombres tratados con él para el cáncer de próstata, se ha descubierto que el DES produce altas tasas de ginecomastia (desarrollo mamario), del 41 al 77 %. [53]
En estudios de DES como una forma de terapia de estrógeno en dosis altas para aquellos con cáncer de próstata , se ha asociado con una morbilidad y mortalidad cardiovascular considerables . [29] [5] El riesgo depende de la dosis. [29] Una dosis de 5 mg/día de DES se ha asociado con un aumento del 36% en muertes no relacionadas con el cáncer (principalmente cardiovasculares). [29] Además, hay una incidencia de hasta el 15% de tromboembolia venosa . [54] Una dosis de 3 mg/día de DES se ha asociado con una incidencia de tromboembolia del 9,6 al 17%, con una incidencia de complicaciones cardiovasculares del 33,3%. [29] Una dosis menor de 1 mg/día de DES se ha asociado con una tasa de muerte debido a eventos cardiovasculares del 14,8% (en relación con el 8,3% para la orquiectomía sola). [29]
El DES se ha relacionado con una variedad de efectos adversos a largo plazo en mujeres que fueron tratadas con él durante el embarazo y/o en su descendencia, incluido un mayor riesgo de lo siguiente: [40]
Un estudio exhaustivo realizado en animales en 1993 encontró una gran cantidad de efectos adversos del DES, como (entre otros):
Los estudios en roedores revelan cánceres y anomalías del tracto reproductivo femenino que llegan hasta la generación F2 , y hay evidencia de efectos adversos como ciclos menstruales irregulares intersexuales en nietos de madres DES. [57] Además, la evidencia también apunta a efectos transgeneracionales en hijos F2, como hipospadias . [58] Sin embargo, en este momento, el alcance de los efectos transgeneracionales del DES en humanos no se comprende completamente. [ cita requerida ]
El DES se ha evaluado en el pasado en estudios clínicos en dosis extremadamente altas de hasta 1.500 a 5.000 mg/día. [36] [59] [60]
El DES es un estrógeno ; específicamente, es un agonista completo altamente potente de ambos receptores de estrógeno (RE). [61] [62] Tiene aproximadamente el 468% y el 295% de la afinidad del estradiol en el ERα y el ERβ, respectivamente. [63] Sin embargo, se han reportado valores de CE50 de 0,18 nM y 0,06 nM de DES para el ERα y el ERβ, respectivamente, lo que sugiere, a pesar de su afinidad de unión para los dos receptores, una preferencia varias veces mayor por la activación del ERβ sobre el ERα. [64] Además de los RE nucleares, el DES es un agonista del receptor de estrógeno acoplado a proteína G (GPER), aunque con una afinidad relativamente baja (~1000 nM). [65] El DES produce todos los mismos efectos biológicos atribuidos a los estrógenos naturales como el estradiol. [66] [67] Esto incluye efectos en el útero , la vagina , las glándulas mamarias , la glándula pituitaria y otros tejidos . [66] [67] [68] [69]
Una dosis de 1 mg/día de DES es aproximadamente equivalente a una dosis de 50 μg/día de etinilestradiol en términos de potencia estrogénica sistémica. [1] [4] De manera similar al etinilestradiol , el DES muestra un efecto marcado y desproporcionadamente fuerte en la síntesis de proteínas hepáticas . [7] Mientras que su potencia estrogénica sistémica fue aproximadamente 3,8 veces la del estropipato (sulfato de piperazina estrona), que tiene una potencia similar al estradiol micronizado , la potencia estrogénica hepática del DES fue 28 veces la del estropipato (o aproximadamente 7,5 veces más fuerte para una dosis con efecto estrogénico sistémico equivalente). [1]
El DES tiene al menos tres mecanismos de acción en el tratamiento del cáncer de próstata. [70] Suprime la producción de andrógenos gonadales y, por lo tanto, los niveles circulantes de andrógenos debido a sus efectos antigonadotrópicos ; estimula la producción hepática de globulina transportadora de hormonas sexuales (SHBG), aumentando así los niveles circulantes de SHBG y disminuyendo la fracción libre de testosterona y dihidrotestosterona (DHT) en la circulación ; y puede tener efectos citotóxicos directos en los testículos y la glándula prostática . [70] También se ha descubierto que el DES disminuye la síntesis de ADN en dosis altas. [70]
El DES es un estrógeno de acción prolongada, con una retención nuclear de alrededor de 24 horas. [71] [72]
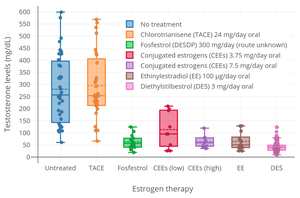

Debido a su actividad estrogénica, el DES tiene efectos antigonadotrópicos . [83] [70] [94] [95] Es decir, ejerce una retroalimentación negativa sobre el eje hipotálamo-hipofisario-gonadal (eje HPG), suprime la secreción de gonadotropinas , hormona luteinizante (LH) y hormona folículo estimulante (FSH), y suprime la producción de hormonas sexuales , así como la producción o maduración de gametos en las gónadas . [83] [70] [94] [95] Un estudio de inhibición de la ovulación encontró que 5 mg/día de DES oral fue 92% efectivo, y la ovulación ocurrió en un solo ciclo. [96] [90] El DES suprime consistentemente los niveles de testosterona en hombres en el rango de castración (<50 ng/dL) dentro de 1 a 2 semanas en dosis de 3 mg/día y superiores. [83] [95] [97] Por el contrario, una dosis de 1 mg/día de DES no puede suprimir completamente los niveles de testosterona en el rango de castración en los hombres, que en cambio a menudo se estabilizan justo por encima de los niveles de castración (>50 ng/dL). [29] [70] [94] Sin embargo, también se ha informado que 1 mg/día de DES da como resultado aproximadamente un 50% de supresión de los niveles de testosterona, aunque con una amplia variabilidad interindividual . [83] [98] Se ha dicho que dosis de DES de menos de 1 mg/día no tienen efecto sobre los niveles de testosterona. [83] Sin embargo, se ha descubierto que la adición de una dosis "extremadamente baja" de 0,1 mg/día de DES al acetato de ciproterona da como resultado un efecto antigonadotrópico sinérgico y suprime los niveles de testosterona en el rango de castración en los hombres. [99] [100] [101] El DES a 3 mg/día tiene una supresión de testosterona similar a una dosis de 300 mg/día, lo que sugiere que la supresión de los niveles de testosterona es máxima a 3 mg/día. [102]
Además de los ER, un estudio in vitro encontró que el DES también posee actividad, aunque relativamente débil, en una variedad de otros receptores de hormonas esteroides . [64] Mientras que el estudio encontró valores de CE 50 de 0,18 nM y 0,06 nM de DES para el ERα y el ERβ, respectivamente, el medicamento mostró una actividad glucocorticoide significativa a una concentración de 1 μM que superó la de 0,1 nM de dexametasona , así como un antagonismo significativo de los receptores de andrógenos , progesterona y mineralocorticoides (75%, 85% y 50% de inhibición de la estimulación de control positivo, respectivamente, todo a una concentración de 1 μM). [64] También mostró aproximadamente un 25% de inhibición de la activación de PPARγ y LXRα a una concentración de 10 μM. [64] Los investigadores afirmaron que, hasta donde tenían conocimiento, eran los primeros en informar sobre dichas acciones del DES y plantearon la hipótesis de que dichas acciones podrían estar implicadas en los efectos clínicos del DES, por ejemplo, en el cáncer de próstata (en particular, en el que se emplean dosis particularmente altas de DES). [64] Sin embargo, también señalaron que la importancia de las actividades requiere más estudios en modelos animales en dosis farmacológicamente relevantes. [64]
Se ha identificado al DES como un antagonista de los tres isotipos de los receptores relacionados con el estrógeno (ERR), el ERRα , el ERRβ y el ERRγ . [103] [104] La inhibición semimáxima ocurre a una concentración de aproximadamente 1 μM. [104]
El DES se absorbe bien con la administración oral . [1] Con una dosis oral de 1 mg/día de DES, los niveles plasmáticos de DES a las 20 horas posteriores a la última dosis oscilaron entre 0,9 y 1,9 ng/mL (3,4 a 7,1 nmol/L). [1] La administración sublingual de DES parece tener aproximadamente la misma potencia estrogénica que el DES oral en mujeres. [105] El DES intrauterino se ha estudiado para el tratamiento de la hipoplasia uterina . [106] Se cree que el DES oral tiene aproximadamente entre el 17 y el 50 % de la potencia estrogénica clínica del DES inyectable. [107]
La vida media de distribución del DES es de 80 minutos. [1] No tiene afinidad por la SHBG ni por la globulina transportadora de corticosteroides y, por lo tanto, no se une a estas proteínas en la circulación. [108] La unión del DES a las proteínas plasmáticas es superior al 95 %. [2]
La hidroxilación de los anillos aromáticos del DES y la conjugación posterior de las cadenas laterales etílicos representan entre el 80 y el 90% del metabolismo del DES , mientras que la oxidación representa el 10 a 20% restante y está dominada por reacciones de conjugación. [2] [3] La conjugación del DES consiste en la glucuronidación , mientras que la oxidación incluye la deshidrogenación en ( Z , Z )-dienestrol . [1] [2] [3] También se sabe que el medicamento produce paroxipropiona como metabolito . [109] El DES produce intermediarios reactivos transitorios similares a las quinonas que causan daño celular y genético , lo que puede ayudar a explicar los efectos cancerígenos conocidos del DES en los seres humanos. [1] Sin embargo, otras investigaciones indican que los efectos tóxicos del DES pueden deberse simplemente a la sobreactivación de los ER. [110] A diferencia del estradiol , los grupos hidroxilo del DES no sufren oxidación en un equivalente similar a la estrona . [111]
La vida media de eliminación del DES es de 24 horas. [1] Los metabolitos del DES se excretan en la orina y las heces . [2] [3]

El DES pertenece al grupo de compuestos del estilbestrol (4,4'-dihidroxiestilbeno ) . [115] Es un análogo de anillo abierto no esteroide del estrógeno esteroide estradiol . [ 112] El DES se puede preparar a partir de anetol , que también es débilmente estrogénico. [115] [116] [114] [113] El anetol se desmetiló para formar anol y luego anol se dimerizó espontáneamente en dianol y hexestrol , y posteriormente se sintetizó el DES mediante la modificación estructural del hexestrol. [115] [116] [114] [113] Como se muestra mediante cristalografía de rayos X , las dimensiones moleculares del DES son casi idénticas a las del estradiol, particularmente en lo que respecta a la distancia entre los grupos hidroxilo terminales . [113]
El DES fue sintetizado por primera vez a principios de 1938 por Leon Golberg, entonces estudiante de posgrado de Sir Robert Robinson en el Laboratorio Dyson Perrins de la Universidad de Oxford . La investigación de Golberg se basó en el trabajo de Wilfrid Lawson en el Instituto Courtauld de Bioquímica (dirigido por Sir Edward Charles Dodds en la Escuela de Medicina del Hospital Middlesex, ahora parte del University College de Londres ). Un informe de su síntesis se publicó en Nature el 5 de febrero de 1938. [117] [118] [119]
La investigación sobre el DES fue financiada por el Consejo de Investigación Médica (MRC) del Reino Unido , que tenía una política contraria a las patentes de medicamentos descubiertos con fondos públicos. Como no estaba patentado, el DES fue producido por más de 200 empresas farmacéuticas y químicas de todo el mundo. [ cita requerida ]
El DES se comercializó por primera vez para uso médico en 1939. [11] Fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) el 19 de septiembre de 1941, en tabletas de hasta 5 mg para cuatro indicaciones: vaginitis gonorreica , vaginitis atrófica , síntomas menopáusicos y supresión de la lactancia posparto para prevenir la congestión mamaria. [119] La indicación de vaginitis gonorreica se abandonó cuando el antibiótico penicilina estuvo disponible. Desde su inicio, el fármaco fue muy controvertido. [120] [121]
En 1941, Charles Huggins y Clarence Hodges de la Universidad de Chicago descubrieron que el benzoato de estradiol y el DES eran los primeros fármacos eficaces para el tratamiento del cáncer de próstata metastásico . [122] [123] El DES fue el primer fármaco contra el cáncer. [124]
La orquiectomía o el DES o ambos fueron el tratamiento inicial estándar para el cáncer de próstata avanzado sintomático durante más de 40 años, hasta que se descubrió que el agonista de GnRH leuprorelina tenía una eficacia similar al DES sin efectos estrogénicos y fue aprobado en 1985. [97]
Desde la década de 1940 hasta fines de la década de 1980, el DES fue aprobado por la FDA como terapia de reemplazo de estrógeno para estados de deficiencia de estrógeno, como disgenesia ovárica , insuficiencia ovárica prematura y después de una ooforectomía . [ cita requerida ]
En la década de 1940, el DES se utilizó fuera de etiqueta para prevenir resultados adversos del embarazo en mujeres con antecedentes de aborto espontáneo. El 1 de julio de 1947, la FDA aprobó el uso de DES para esta indicación. La primera aprobación de este tipo se otorgó a Bristol-Myers Squibb , permitiendo el uso de tabletas de 25 mg (y luego 100 mg) de DES durante el embarazo. Se otorgaron aprobaciones a otras compañías farmacéuticas más tarde en el mismo año. [125] El régimen recomendado comenzó con 5 mg por día en la séptima y octava semanas de embarazo (desde el primer día del último período menstrual), aumentó cada dos semanas en 5 mg por día hasta la semana 14, y luego aumentó cada semana en 5 mg por día de 25 mg por día en la semana 15 a 125 mg por día en la semana 35 de embarazo. [126] El DES originalmente se consideró efectivo y seguro tanto para la mujer embarazada como para el bebé en desarrollo. Se comercializó agresivamente y se recetó de manera rutinaria. Las ventas alcanzaron su punto máximo en 1953. [ cita requerida ]
A principios de los años 1950, un ensayo clínico doble ciego en la Universidad de Chicago evaluó los resultados del embarazo en mujeres que recibieron o no DES. [127] El estudio no mostró ningún beneficio de tomar DES durante el embarazo; los resultados adversos del embarazo no se redujeron en las mujeres que recibieron DES. A fines de los años 1960, seis de los siete libros de texto principales de obstetricia decían que el DES era ineficaz para prevenir el aborto espontáneo. [125] [128]
A pesar de la ausencia de evidencia que apoye el uso de DES para prevenir resultados adversos del embarazo, DES continuó administrándose a mujeres embarazadas durante la década de 1960. En 1971, un informe publicado en el New England Journal of Medicine mostró un vínculo probable entre DES y adenocarcinoma de células claras vaginal en niñas y mujeres jóvenes que habían estado expuestas a este fármaco en el útero . Más tarde en el mismo año, la FDA envió un Boletín de Medicamentos de la FDA a todos los médicos de EE. UU. desaconsejando el uso de DES en mujeres embarazadas. La FDA también eliminó la prevención del aborto espontáneo como indicación para el uso de DES y agregó el embarazo como contraindicación para el uso de DES. [129] El 5 de febrero de 1975, la FDA ordenó que se retiraran los comprimidos de DES de 25 mg y 100 mg, con vigencia a partir del 18 de febrero de 1975. [130] Se desconoce el número de personas expuestas al DES durante el embarazo o en el útero durante el período de 1940 a 1971, pero puede ser tan alto como 2 millones en los Estados Unidos. El DES también se utilizó en otros países, especialmente en Francia, los Países Bajos y Gran Bretaña.
Desde la década de 1950 hasta principios de la de 1970, se prescribía DES a niñas prepúberes para iniciar la pubertad y, de ese modo, detener el crecimiento cerrando las placas de crecimiento de los huesos. A pesar de su clara relación con el cáncer, los médicos siguieron recomendando la hormona para el "exceso de altura". [131]
En 1960, se descubrió que el DES era más eficaz que los andrógenos en el tratamiento del cáncer de mama avanzado en mujeres posmenopáusicas. [132] El DES fue el tratamiento hormonal de elección para el cáncer de mama avanzado en mujeres posmenopáusicas hasta 1977, cuando la FDA aprobó el tamoxifeno , un modulador selectivo del receptor de estrógeno con una eficacia similar al DES pero con menos efectos secundarios. [133]
Varias fuentes de la literatura médica de los años 1970 y 1980 indican que el DES se utilizó como un componente de la terapia hormonal para mujeres transgénero . [134] [135] [136]
En 1973, en un intento de restringir el uso no indicado en la etiqueta de DES como anticonceptivo postcoital (que se había vuelto frecuente en muchos servicios de salud universitarios luego de la publicación de un influyente estudio en 1971 en JAMA ) a situaciones de emergencia como la violación, se envió un Boletín de Medicamentos de la FDA a todos los médicos y farmacéuticos de los EE. UU. que decía que la FDA había aprobado, bajo condiciones restringidas, el uso anticonceptivo postcoital de DES. [137]
En 1975, la FDA dijo que en realidad no había dado (y nunca dio) aprobación a ningún fabricante para comercializar DES como anticonceptivo postcoital, pero aprobaría esa indicación para situaciones de emergencia como violación o incesto si un fabricante proporcionaba etiquetado para el paciente y empaque especial como se establece en una regla final de la FDA publicada en 1975. [138] Para desalentar el uso no indicado en la etiqueta de DES como anticonceptivo postcoital, la FDA en 1975 retiró del mercado los comprimidos de DES de 25 mg y ordenó que se cambiara el etiquetado de las dosis más bajas (5 mg y menos) de DES aún aprobadas para otras indicaciones para que estableciera: "Este medicamento no debe usarse como anticonceptivo postcoital" en letras mayúsculas en la primera línea del prospecto de información de prescripción del médico y en un lugar prominente y visible de la etiqueta del envase y la caja. [130] [139] En la década de 1980, el uso no indicado en la etiqueta del régimen Yuzpe de ciertas píldoras anticonceptivas orales combinadas regulares reemplazó el uso no indicado en la etiqueta del DES como anticonceptivo postcoital. [140]
En 1978, la FDA eliminó la supresión de la lactancia posparto para prevenir la congestión mamaria de sus indicaciones aprobadas para DES y otros estrógenos. [141] En la década de 1990, las únicas indicaciones aprobadas para DES eran el tratamiento del cáncer de próstata avanzado y el tratamiento del cáncer de mama avanzado en mujeres posmenopáusicas. El último fabricante estadounidense restante de DES, Eli Lilly , dejó de fabricarlo y comercializarlo en 1997. [ cita requerida ]
El dietilestilbestrol se ha utilizado en innumerables ocasiones en estudios con ratas. Una vez que se descubrió que el DES causaba cáncer vaginal, se iniciaron experimentos tanto en ratas macho como hembra. [142] A muchas de estas ratas macho se les inyectó DES, mientras que a otras ratas macho se les inyectó aceite de oliva, y se las consideró el grupo de control. [142] Cada grupo recibió la misma dosis en los mismos días, y los investigadores realizaron microscopía óptica, microscopía electrónica y microscopía láser confocal. Con la microscopía electrónica y la microscopía láser confocal, fue frecuente que las células de Sertoli, que son células somáticas donde se desarrollan las espermátidas en los testículos, se formaran 35 días después en las ratas a las que se les inyectó dietilestilbestrol en comparación con las ratas del grupo de control. [142] Una vez finalizado el ensayo, se descubrió que las ratas de mayor edad a las que se les inyectó DES experimentaron un retraso en la maduración de las células de Sertoli, epidídimos subdesarrollados y una disminución drástica del peso en comparación con sus contrapartes. [142]
Las ratas hembras utilizadas eran endogámicas y a la mayoría de ellas se les administró DES combinado con su comida. Estas ratas se dividieron en tres grupos, un grupo que no recibió dietilestilbestrol, un grupo que recibió DES mezclado con su dieta y el tercer grupo al que se le administró DES en su dieta después del día 13 de gestación. [143] Algunas ratas a las que se les administró DES, lamentablemente, murieron antes de dar a luz a sus crías. [143] El grupo que recibió DES en su comida durante 13 días mientras estaba embarazada resultó en abortos tempranos y parto fallido. [143] Estos resultados mostraron que el DES tuvo un efecto perjudicial sobre el embarazo cuando se administró con tanta frecuencia. Proporcionar la dosis de dietilestilbestrol más tarde en el término del embarazo también hizo visible la ocurrencia de abortos entre las ratas. [143] En general, cualquier interacción con DES en ratas hembra concluyó en que las ratas experimentaron abortos, crecimiento fetal inadecuado y aumento de la esterilidad. [143]
Se realizó una revisión de personas que habían sido tratadas o expuestas al DES para averiguar qué efectos a largo plazo se manifestarían. [144] Las personas habían sido tratadas durante mucho tiempo con DES durante su embarazo, y se sabía que había efectos tóxicos y adversos a la terapia hormonal. "La exposición al DES se ha asociado con un mayor riesgo de cáncer de mama en madres que recibieron DES (riesgo relativo, <2,0) y con un riesgo de cáncer cervicovaginal de células claras en hijas que recibieron DES durante la vida de 1/1000 a 1/10 000". [144] Se está demostrando que los efectos secundarios del DES son a largo plazo, ya que puede causar un mayor riesgo de cáncer después de su uso. [144] Se seguirá investigando para ver hasta qué punto se extienden los efectos adversos del DES después de una terapia previa y cómo afectará a la descendencia y a las madres a largo plazo. [144]
En 1938, la FDA obtuvo por primera vez la capacidad de probar la seguridad del DES en animales. Los resultados de las pruebas preliminares mostraron que el DES dañaba los sistemas reproductivos de los animales. No se pudo determinar la aplicación de estos resultados a los seres humanos, por lo que la FDA no pudo actuar de manera regulatoria. [145]
En 1940, la FDA retiró las solicitudes de aprobación de DES como medicamento nuevo, debido a la incertidumbre científica. Sin embargo, esta decisión generó una presión política importante, por lo que la FDA llegó a un compromiso. El compromiso implicaba que el DES solo estaría disponible con receta médica y que tendría que tener advertencias sobre sus efectos en el frasco, pero la advertencia se eliminó en 1945. En 1947, la FDA finalmente aprobó el DES para su prescripción a mujeres embarazadas que tenían diabetes como método para prevenir abortos espontáneos. Esto llevó a la prescripción generalizada de DES a todas las mujeres embarazadas. [145]
En 1971, la FDA recomendó no prescribir DES a mujeres embarazadas. [146] Como resultado, el DES comenzó a retirarse del mercado estadounidense a partir de 1972 y del mercado europeo a partir de 1978, pero la FDA todavía no retiró su aprobación para el uso de DES en humanos. [147]
La Agencia Internacional para la Investigación sobre el Cáncer clasificó al DES como un carcinógeno del Grupo 1. Después de clasificarlo como carcinógeno, la FDA retiró su aprobación al DES en 2000. [146] Actualmente, el DES solo se utiliza en prácticas veterinarias y en ensayos de investigación según lo permita la FDA. [148]
La ética médica en relación con la aprobación y el uso del dietilestilbestrol ha sido desestimada debido a las acciones de la FDA y de las compañías farmacéuticas que fabricaban el DES en el momento de su uso. El vicepresidente de la Asociación Estadounidense de Fabricantes de Medicamentos, Carson Frailey, fue contratado por las compañías farmacéuticas que creaban el DES para ayudar a que la Administración de Alimentos y Medicamentos (FDA) lo aprobara. Nancy Langston, autora de The Retreat from Precaution: Regulating Diethylstilbestrol (DES), Endocrine Disruptors, and Environmental Health, afirma que "Frailey convenció a cincuenta y cuatro médicos de todo el país para que escribieran a la FDA, describiendo sus experiencias clínicas con un total de más de cinco mil pacientes. Sólo cuatro de estos cincuenta y cuatro médicos opinaron que el DES no debía aprobarse, y el resultado fue que, en contra de las preocupaciones de muchos miembros del personal médico de la FDA, el jefe de medicamentos de la FDA, Theodore Klumpp, recomendó que la FDA aprobara el DES". [149] Este extracto describe cómo se aprobó el DES de manera poco ética y muestra que la motivación detrás de su aprobación fue para el beneficio de las compañías farmacéuticas en lugar de las personas que iban a usar el medicamento. Esta aprobación del DES viola los valores de la ética médica, la autonomía , la no maleficencia , la beneficencia y la justicia, ya que se pensó poco en cómo afectaría el DES a sus usuarios. [150] Las decisiones tomadas por los líderes de la FDA para aprobar el DES sin más estudios y convencer a los médicos de que disimularan sus opiniones sobre el uso del DES son poco éticas. Una vez que el DES fue aprobado para el consumo público, las "advertencias [para el DES] se pusieron a disposición solo en una circular separada que los pacientes no verían. Los médicos podían obtener esta circular de advertencia solo escribiendo a las compañías farmacéuticas y solicitándola. Las cartas entre las compañías y los reguladores de la FDA revelan que ambos grupos temían que si una mujer alguna vez viera cuántos riesgos potenciales podría presentar el DES, podría negarse a tomar el medicamento, o bien podría demandar a la compañía y a los médicos que le recetaban si contraía cáncer o daño hepático después de tomar el medicamento". [149] Las mujeres no fueron informadas sobre los posibles efectos del DES porque los médicos y los reguladores de la FDA temían que el DES fracasara y nunca fuera aprobado, lo que costaría millones de dólares a las compañías farmacéuticas. El acto de distribuir medicamentos potencialmente peligrosos a los pacientes sin importar el efecto y el daño que puedan causar, solo por una ganancia monetaria, es poco ético. [ cita requerida ]
En la década de 1970, la publicidad negativa que rodeó el descubrimiento de los efectos a largo plazo del DES dio lugar a una enorme ola de demandas en los Estados Unidos contra sus fabricantes. Estas culminaron en una decisión histórica de 1980 de la Corte Suprema de California , Sindell v. Abbott Laboratories , en la que el tribunal impuso una presunción refutable de responsabilidad por participación en el mercado a todos los fabricantes de DES, proporcional a su participación en el mercado en el momento en que el fármaco fue consumido por la madre de un demandante en particular. [ cita requerida ]
Eli Lilly, una empresa farmacéutica que fabrica DES, y la Universidad de Chicago, fueron demandadas por ensayos clínicos realizados en la década de 1950. Tres mujeres presentaron una demanda alegando que sus hijas habían desarrollado formaciones celulares cervicales anormales, así como anomalías reproductivas en ellas mismas y en sus hijos. [151] Las demandantes habían pedido a los tribunales que certificaran su caso como demanda colectiva, pero los tribunales se lo denegaron. Sin embargo, los tribunales emitieron una opinión en la que se afirmaba que su caso tenía mérito. El tribunal sostuvo que Eli Lilly tenía el deber de notificar los riesgos del DES una vez que se enteraran de ellos o deberían haberlos conocido. [151] Según la ley de responsabilidad civil de Illinois, para que las demandantes pudieran obtener una indemnización en virtud de las teorías de incumplimiento del deber de advertir y responsabilidad estricta, debían haber alegado daños a sí mismas. Finalmente, en virtud de sus reclamaciones de incumplimiento del deber de advertir y responsabilidad estricta debido a que las demandantes citaron el riesgo de daños físicos a otras personas, no a sí mismas, el caso fue desestimado por los tribunales. [151] Aunque el caso no fue certificado como demanda colectiva y sus reclamos de incumplimiento del deber de advertir y responsabilidad estricta fueron desestimados, los tribunales no desestimaron las acusaciones de agresión. [151] La cuestión era entonces determinar si la Universidad de Chicago había cometido agresión contra estas mujeres, pero el caso se resolvió antes del juicio. [151] Como parte del acuerdo de conciliación para este caso, Mink v. University of Chicago, los abogados de los demandantes negociaron para que la universidad proporcionara exámenes médicos gratuitos para todos los hijos expuestos al DES en el útero durante los experimentos de 1950, así como para tratar a las hijas de cualquier mujer involucrada que desarrollara cáncer vaginal o cervical asociado al DES. [151]
En febrero de 1991, había más de mil acciones legales pendientes contra los fabricantes de DES. [151] Hay más de 300 empresas que fabricaron DES según la misma fórmula y la mayor barrera para la recuperación es determinar qué fabricante suministró el fármaco en cada caso particular. [151] Muchos de los casos exitosos se han basado en la responsabilidad conjunta o de varias partes.
Cincuenta y tres hijas de pacientes con DES presentaron una demanda en el Tribunal Federal de Boston, alegando que sus cánceres de mama fueron consecuencia de que se les recetó DES a sus madres durante el embarazo. Sus casos sobrevivieron a una audiencia de Daubert . En 2013, las hermanas Fecho que iniciaron el litigio sobre el vínculo entre el cáncer de mama y el DES aceptaron un monto de acuerdo no revelado el segundo día del juicio. Los demás litigantes han recibido varios acuerdos. [152]
El grupo de defensa DES Action USA ayudó a proporcionar información y apoyo a las personas expuestas al DES que participaron en demandas judiciales. [153]
A Alan Turing , el criptógrafo innovador , fundador de la ciencia informática y de las computadoras programables, quien también propuso el modelo teórico actual de la morfogénesis biológica , le administraron esta droga a la fuerza para inducir la castración química como un "tratamiento" punitivo y desacreditado para la conducta homosexual, poco antes de morir en circunstancias ambiguas. [154]
Al menos en una ocasión en Nueva Zelanda a principios de la década de 1960, se prescribió dietilestilbestrol para el "tratamiento" de la homosexualidad. [155]
James Herriot describe un caso relacionado con el tratamiento de un tumor de células de Sertoli en los testículos de un perro pequeño en su libro All Things Bright and Beautiful (Todo es brillante y hermoso ) de 1974. Herriot decidió recetar una dosis alta de estilbestrol para el tumor recurrente, con el divertido efecto secundario de que el perro macho se volvió "atractivo para otros perros machos", que siguieron al terrier por el pueblo durante unas semanas. Herriot comenta en la historia que sabía que "se decía que el nuevo fármaco tenía un efecto feminizante, pero seguramente no en esa medida". [ cita requerida ]
El DES ha tenido mucho éxito en el tratamiento de la incontinencia canina femenina causada por un control deficiente del esfínter. Todavía se puede conseguir en farmacias especializadas y, en dosis bajas (1 mg), no tiene las propiedades cancerígenas que eran tan problemáticas en los seres humanos. [156] Generalmente se administra una vez al día durante siete a diez días y luego una vez por semana según sea necesario. [ cita requerida ]
El mayor uso del DES fue en la industria ganadera, para mejorar la conversión alimenticia en carne de res y aves de corral. Durante la década de 1960, el DES se utilizó como hormona de crecimiento en las industrias de carne de res y aves de corral. Más tarde, en 1971, se descubrió que causaba cáncer, pero no se eliminó gradualmente hasta 1979. [157] [158] Aunque se descubrió que el DES era dañino para los humanos, su uso veterinario no se detuvo de inmediato. En 2011, el DES todavía se usaba como promotor del crecimiento en ganado terrestre o peces en algunas partes del mundo, incluida China. [159]
El sulfato de estrona de piperazina y el estradiol micronizado fueron equipotentes con respecto a los aumentos de SHBG, mientras que [...] El DES fue 28,4 veces más potente [...]. Con respecto a la disminución de FSH, [...] El DES fue 3,8 veces y el etinilestradiol fue de 80 a 200 veces más potente que el sulfato de estrona de piperazina. Los equivalentes de dosis para el etinilestradiol (50 μg) y el DES (1 mg) reflejan estas potencias relativas.220 [...] El DES, un potente estrógeno sintético (fig. 6-12), se absorbe bien después de una dosis oral. Los pacientes que recibieron 1 mg de DES diariamente tuvieron concentraciones plasmáticas a las 20 horas que oscilaron entre 0,9 y 1,9 ng por ml. La semivida inicial del DES es de 80 minutos, con una semivida secundaria de 24 horas.223 Las principales vías metabólicas son la conversión al glucurónido y la oxidación. Las vías oxidativas incluyen la hidroxilación aromática de las cadenas laterales etílicos y la deshidrogenación a (Z,Z)-dienestrol, produciendo intermediarios transitorios similares a las quinonas que reaccionan con macromoléculas celulares y causan daño genético en las células eucariotas.223 La activación metabólica del DES puede explicar sus propiedades carcinógenas bien establecidas.224
Desde principios de la década de 1940 hasta la de 1970, se administró DES a mujeres embarazadas para prevenir el aborto espontáneo, que a menudo es precedido por una disminución en los niveles de estrógeno. Más tarde se hizo evidente que el tratamiento con DES era en su mayoría ineficaz para prevenir el aborto espontáneo [66], pero, sin embargo, los médicos continuaron prescribiendo DES a mujeres embarazadas. Un artículo reciente resume los efectos de la exposición materna al DES durante el embarazo y sus efectos adversos sobre el embarazo y el desarrollo fetal en las mujeres [67], y muestra que esta exposición aumentó los abortos espontáneos en el segundo trimestre en 3,8 veces.
Hace varias décadas, se consideró que el dietilestilbestrol (DES) era eficaz para mejorar los resultados del embarazo. Los datos posteriores no respaldaron esta afirmación y las madres y los hijos expuestos sufrieron diversos problemas atribuidos al fármaco.
[El dietilestilbestrol] sufre el serio inconveniente de que en dosis superiores a 1 mg al día es probable que produzca náuseas, vómitos, malestar abdominal, dolor de cabeza y distensión abdominal en una proporción de pacientes estimada de forma variable entre el 15 y el 50%.
[Diethylstilbestrol], differing distinctly in chemical structure from the previously known estrogens, has been shown to produce all the biologic effects attributed to them, such as suppression of the antuitary (2), inhibition of body growth (2), proliferation of the ductile system of the breast (3), suppression of engorgement incident to lactation (4), hyperemia, edema, and distention of the uterus (5), proliferation of the endometrium (6), vaginal cornification (7), and swelling of the sexual skin (8). It likewise presumably has the supposed carcinogenic propensities of the true estrogens (9).
Después de que Dodds, Goldberg, Lawson y Robinson demostraran que el estilbestrol (4,4' dioxi-α-β-dietilestilbeno) tenía los mismos efectos que las estronas naturales sobre la mucosa vaginal de ratas hembras castradas, han aparecido numerosos trabajos que demuestran que esta sustancia, a pesar de su gran diferencia química con las hormonas sexuales femeninas naturales, tiene prácticamente el mismo efecto que éstas en todos los aspectos. Las investigaciones más importantes las han hecho Dodds, Lawson y Noble, Noble, Bishop, Boycott y Zuckermann, Erik Guldberg, Engelhardt, Winterton y MacGregor, Erik Jacobsen y, más recientemente, Kreitmair y Sickman, Buschbeck y Hausknecht, Cobet, Ratschow y Stechner. Los experimentos anteriores se han realizado en gallinas, ratones, ratas, cobayas, conejos, monos y seres humanos.
No hay duda de que la conversión del endometrio con inyecciones de preparaciones de hormonas estrogénicas tanto sintéticas como nativas tiene éxito, pero la opinión sobre si las preparaciones nativas administradas por vía oral pueden producir una proliferación de la mucosa varía según los autores. PEDERSEN-BJERGAARD (1939) pudo demostrar que el 90% de la foliculina captada en la sangre de la vena portae se inactiva en el hígado. Ni KAUFMANN (1933, 1935), ni RAUSCHER (1939, 1942) ni HERRNBERGER (1941) lograron que un endometrio de castración proliferara utilizando grandes dosis de preparaciones de estrona o estradiol administradas por vía oral. NEUSTAEDTER (1939), LAUTERWEIN (1940) y FERIN (1941) informaron sobre otros resultados; lograron convertir un endometrio de castración atrófico en una mucosa proliferante inequívoca con 120-300 de estradiol o con 380 de estrona.