
La herencia epigenética transgeneracional es la transmisión de marcadores epigenéticos y modificaciones de una generación a múltiples generaciones posteriores sin alterar la estructura primaria del ADN . [1] Por lo tanto, la regulación de los genes a través de mecanismos epigenéticos puede ser hereditaria; la cantidad de transcripciones y proteínas producidas puede alterarse por cambios epigenéticos heredados. Sin embargo, para que las marcas epigenéticas sean hereditarias, deben ocurrir en los gametos de los animales, pero como las plantas carecen de una línea germinal definitiva y pueden propagarse, las marcas epigenéticas en cualquier tejido pueden ser hereditarias. [2]
La herencia de las marcas epigenéticas en la generación inmediata se denomina herencia intergeneracional. [3] En ratones machos, la señal epigenética se mantiene a través de la generación F1. [4] En ratones hembra, la señal epigenética se mantiene a través de la generación F2 como resultado de la exposición de la línea germinal en el útero. [4] Muchas señales epigenéticas se pierden más allá de la generación F2/F3 y ya no se heredan, porque las generaciones posteriores no estuvieron expuestas al mismo entorno que las generaciones parentales. [3] Las señales que se mantienen más allá de la generación F2/F3 se denominan herencia epigenética transgeneracional (TEI), porque los estímulos ambientales iniciales dieron como resultado la herencia de modificaciones epigenéticas. [5] Hay varios mecanismos de TEI que han demostrado afectar la reprogramación de la línea germinal, como los aumentos transgeneracionales en la susceptibilidad a enfermedades, mutaciones y herencia del estrés. Durante la reprogramación de la línea germinal y la embriogénesis temprana en ratones, las marcas de metilación se eliminan para permitir que comience el desarrollo, pero la marca de metilación se convierte en hidroximetilcitosina para que sea reconocida y metilada una vez que esa área del genoma ya no se utiliza, [6] que sirve como memoria para esa marca de TEI. Por lo tanto, en condiciones de laboratorio, las marcas de metilo heredadas se eliminan y se restauran para garantizar que la TEI aún se produzca. Sin embargo, la observación de TEI en poblaciones silvestres todavía está en sus inicios, ya que los estudios de laboratorio permiten sistemas más manejables. [7]
Los factores ambientales pueden inducir las marcas epigenéticas (etiquetas epigenéticas) para algunos rasgos influidos epigenéticamente. [1] Estos pueden incluir, entre otros, cambios en la temperatura, disponibilidad de recursos, exposición a contaminantes, sustancias químicas y disruptores endocrinos. [8] La dosis y los niveles de exposición pueden afectar el grado de influencia de los factores ambientales sobre el epigenoma y su efecto en generaciones posteriores. Las marcas epigenéticas pueden dar lugar a una amplia gama de efectos, desde cambios fenotípicos menores hasta enfermedades y trastornos complejos. [8] Las complejas vías de señalización celular de organismos multicelulares como las plantas y los seres humanos pueden dificultar mucho la comprensión de los mecanismos de este proceso hereditario. [9]
Existen mecanismos por los cuales las exposiciones ambientales inducen cambios epigenéticos al afectar la regulación y la expresión génica. Se conocen cuatro categorías generales de modificación epigenética.
Aunque existen diversas formas de herencia de marcadores epigenéticos, la herencia de marcadores epigenéticos puede resumirse como la diseminación de información epigenética por medio de la línea germinal. [19] Además, la variación epigenética típicamente toma una de cuatro formas generales, aunque hay otras formas que aún no se han dilucidado. Actualmente, los bucles de retroalimentación autosostenidos, la formación de plantillas espaciales, el marcado de cromatina y las vías mediadas por ARN modifican los epígenes de las células individuales. La variación epigenética dentro de los organismos multicelulares es endógena o exógena. [20] La endógena se genera por la señalización entre células (por ejemplo, durante la diferenciación celular al principio del desarrollo), mientras que la exógena es una respuesta celular a señales ambientales. [ cita requerida ]
En los organismos que se reproducen sexualmente, gran parte de la modificación epigenética dentro de las células se restablece durante la meiosis (por ejemplo, las marcas en el locus FLC que controlan la vernalización de la planta [21] ), aunque se ha demostrado que algunas respuestas epigenéticas se conservan (por ejemplo, la metilación de transposones en plantas [21] ). La herencia diferencial de las marcas epigenéticas debido a sesgos maternos o paternos subyacentes en los mecanismos de eliminación o retención puede conducir a la asignación de la causalidad epigenética a algunos efectos de origen parental en animales [22] y plantas. [23]
En los mamíferos, las marcas epigenéticas se borran durante dos fases del ciclo de vida. En primer lugar, justo después de la fertilización y, en segundo lugar, en las células germinales primordiales en desarrollo, los precursores de los futuros gametos. [24] Durante la fertilización, los gametos masculinos y femeninos se unen en diferentes estados del ciclo celular y con diferente configuración del genoma. Las marcas epigenéticas del macho se diluyen rápidamente. En primer lugar, las protaminas asociadas con el ADN masculino se reemplazan con histonas del citoplasma de la hembra , la mayoría de las cuales están acetiladas debido a una mayor abundancia de histonas acetiladas en el citoplasma de la hembra o mediante la unión preferencial del ADN masculino a las histonas acetiladas. [25] [26] En segundo lugar, el ADN masculino se desmetila sistemáticamente en muchos organismos, [27] [28] posiblemente a través de 5-hidroximetilcitosina . Sin embargo, algunas marcas epigenéticas, en particular la metilación del ADN materno, pueden escapar a esta reprogramación; lo que lleva a la impronta parental.
En las células germinales primordiales (PGC) hay un borrado más extenso de la información epigenética. Sin embargo, algunos sitios raros también pueden evadir el borrado de la metilación del ADN. [29] Si las marcas epigenéticas evaden el borrado durante los eventos de reprogramación tanto cigótico como de PGC, esto podría permitir la herencia epigenética transgeneracional. [ cita requerida ]
El reconocimiento de la importancia de la programación epigenética para el establecimiento y fijación de la identidad de la línea celular durante la embriogénesis temprana ha estimulado recientemente el interés en la eliminación artificial de la programación epigenética. [30] Las manipulaciones epigenéticas pueden permitir la restauración de la totipotencia en células madre o células en general, generalizando así la medicina regenerativa [ cita requerida ] .
Los mecanismos celulares pueden permitir la cotransmisión de algunas marcas epigenéticas. Durante la replicación, las polimerasas de ADN que trabajan en las cadenas líder y rezagada están acopladas por el factor de procesividad del ADN, el antígeno nuclear de células proliferantes (PCNA), que también ha estado implicado en la formación de patrones y la diafonía de cadenas que permite la fidelidad de copia de las marcas epigenéticas. [31] [32] El trabajo sobre la fidelidad de copia de la modificación de histonas ha permanecido en la fase de modelo, pero los primeros esfuerzos sugieren que las modificaciones de las nuevas histonas siguen el patrón de las de las histonas antiguas y que las histonas nuevas y antiguas se distribuyen aleatoriamente entre las dos cadenas de ADN hijas. [33] Con respecto a la transferencia a la siguiente generación, muchas marcas se eliminan como se describió anteriormente. Los estudios emergentes están encontrando patrones de conservación epigenética a lo largo de las generaciones. Por ejemplo, los satélites centroméricos resisten la desmetilación. [34] El mecanismo responsable de esta conservación no se conoce, aunque algunas evidencias sugieren que la metilación de las histonas puede contribuir. [34] [35] También se identificó una desregulación del tiempo de metilación del promotor asociada con la desregulación de la expresión genética en el embrión. [36]
Mientras que la tasa de mutación en un gen de 100 bases puede ser de 10 −7 por generación, los epigenes pueden "mutar" varias veces por generación o pueden permanecer fijos durante muchas generaciones. [37] Esto plantea la pregunta: ¿los cambios en las frecuencias de los epigenes constituyen evolución? Los efectos epigenéticos que se desintegran rápidamente en los fenotipos (es decir, que duran menos de tres generaciones) pueden explicar parte de la variación residual en los fenotipos después de que se tienen en cuenta el genotipo y el entorno. Sin embargo, distinguir estos efectos a corto plazo de los efectos del entorno materno en la ontogenia temprana sigue siendo un desafío. [ cita requerida ]
La importancia relativa de la herencia genética y epigenética es objeto de debate. Aunque se han publicado cientos de ejemplos de modificación epigenética de fenotipos, se han realizado pocos estudios fuera del ámbito del laboratorio. Por lo tanto, no se pueden inferir las interacciones de los genes con el medio ambiente a pesar del papel central del medio ambiente en la selección natural. Múltiples factores epigenéticos pueden influir en el estado de los genes y alterar el estado epigenético. Debido a la naturaleza multivariable de los factores ambientales, es difícil para los investigadores determinar la causa exacta de los cambios epigenéticos fuera del ámbito del laboratorio. [38]
Estudios sobre la herencia epigenética transgeneracional en plantas han sido reportados ya en la década de 1950. [39] Uno de los primeros y mejor caracterizados ejemplos de esto es la paramutación b1 en el maíz. [39] [40] [41] [42 ] [43] [44] [45] [46] El gen b1 codifica un factor de transcripción básico hélice-bucle-hélice que está involucrado en la vía de producción de antocianina . Cuando se expresa el gen b1, la planta acumula antocianina dentro de sus tejidos, lo que lleva a una coloración púrpura de esos tejidos. El alelo BI (para B-Intense) tiene alta expresión de b1 resultando en la pigmentación oscura de los tejidos de la vaina y la cáscara mientras que el alelo B' (pronunciado B-prime) tiene baja expresión de b1 resultando en baja pigmentación en esos tejidos. [47] Cuando los padres homocigotos BI se cruzan con homocigotos B', la descendencia F1 resultante muestra una pigmentación baja que se debe al silenciamiento del gen b1. [39] [47] Inesperadamente, cuando las plantas F1 se cruzan entre sí, la generación F2 resultante muestra una pigmentación baja y tiene niveles bajos de expresión de b1. Además, cuando cualquier planta F2 (incluidas las que son genéticamente homocigotas para BI) se cruza con homocigotos BI, la descendencia mostrará una pigmentación baja y expresión de b1. [39] [47] La falta de individuos con pigmentación oscura en la progenie F2 es un ejemplo de herencia no mendeliana y otras investigaciones han sugerido que el alelo BI se convierte en B' a través de mecanismos epigenéticos. [41] [42] Los alelos B' y BI se consideran epialelos porque son idénticos a nivel de secuencia de ADN pero difieren en el nivel de metilación del ADN , producción de ARNi e interacciones cromosómicas dentro del núcleo. [45] [48] [ 44] [43] Además, las plantas defectuosas en componentes de la vía de metilación del ADN dirigida por ARN muestran una mayor expresión de b1 en individuos B' similar a la de BI, sin embargo, una vez que se restauran estos componentes, la planta vuelve al estado de baja expresión. [46] [49] [50] [51] Aunque se ha observado la conversión espontánea de BI a B', nunca se ha observado una reversión de B' a BI (de verde a morado) en más de 50 años y miles de plantas en experimentos de invernadero y de campo. [52]
También se han descrito ejemplos de herencia epigenética transgeneracional inducida por el medio ambiente en plantas. En un caso, las plantas de arroz que estuvieron expuestas a tratamientos de simulación de sequía mostraron una mayor tolerancia a la sequía después de 11 generaciones de exposición y propagación por descendencia de una sola semilla en comparación con las plantas no tratadas con sequía. Las diferencias en la tolerancia a la sequía se relacionaron con cambios direccionales en los niveles de metilación del ADN en todo el genoma, lo que sugiere que los cambios hereditarios inducidos por el estrés en los patrones de metilación del ADN pueden ser importantes en la adaptación a estreses recurrentes. En otro estudio, las plantas que estuvieron expuestas a una herbivoría moderada por parte de las orugas durante varias generaciones mostraron una mayor resistencia a la herbivoría en las generaciones posteriores (medida por la masa seca de las orugas) en comparación con las plantas que carecían de presión herbívora. Este aumento de la resistencia a los herbívoros persistió después de una generación de crecimiento sin ninguna exposición a herbívoros, lo que sugiere que la respuesta se transmitió a través de las generaciones. El informe concluyó que los componentes de la vía de metilación del ADN dirigida por el ARN están involucrados en el aumento de la resistencia a lo largo de las generaciones. También se ha observado una herencia epigenética transgeneracional en plantas poliploides. Se ha demostrado que los híbridos triploides F1 recíprocos genéticamente idénticos muestran efectos epigenéticos transgeneracionales en el desarrollo de semillas F2 viables. [ cita requerida ]
Se ha demostrado en plantas de rábano silvestre ( Raphanus raphanistrum ) que la TEI puede inducirse cuando las plantas están expuestas a depredadores como Pieris rapae , la oruga blanca de la col. Las plantas de rábano aumentarán la producción de pelos erizados en las hojas y aceite de mostaza tóxico en respuesta a la depredación de las orugas. Los niveles aumentados también se verán en la próxima generación. Los niveles reducidos de depredación también dan como resultado una disminución de los pelos de las hojas y las toxinas producidas en la generación actual y las posteriores. [53]
Es difícil rastrear la TEI en animales debido a la reprogramación de genes durante la meiosis y la embriogénesis, especialmente en poblaciones silvestres que no se crían en un entorno de laboratorio. Se deben realizar más estudios para fortalecer la documentación de la TEI en animales. Sin embargo, existen algunos ejemplos. [ cita requerida ]
Se ha demostrado la herencia epigenética transgeneracional inducida en animales, como Daphnia cucullata . Estos diminutos crustáceos desarrollarán cascos protectores cuando sean jóvenes si se exponen a kairomonas , un tipo de hormona secretada por los depredadores mientras están en el útero. El casco actúa como un método de defensa al disminuir la capacidad de los depredadores para capturar a Daphnia , por lo que la inducción de la presencia de casco reducirá las tasas de mortalidad. D. cucullata desarrollará un casco pequeño si no hay kairomonas presentes. Sin embargo, dependiendo del nivel de kairomonas del depredador, la longitud del casco casi se duplicará. La siguiente generación de Daphnia mostrará un tamaño de casco similar. Si los niveles de kairomonas disminuyen o desaparecen, entonces la tercera generación volverá al tamaño de casco original. Estos organismos muestran fenotipos adaptativos que afectarán el fenotipo en las generaciones posteriores. [54]
El análisis genético de los peces de arrecife de coral, Acanthochromis polyacanthus , ha propuesto la TEI como respuesta al cambio climático. A medida que se produce el cambio climático, la temperatura del agua del océano aumenta. Cuando A. polyacanthus se expone a temperaturas del agua más altas de hasta +3 °C con respecto a las temperaturas normales del océano, los peces expresan mayores niveles de metilación del ADN en 193 genes, lo que resulta en cambios fenotípicos en la función del consumo de oxígeno, el metabolismo, la respuesta a la insulina, la producción de energía y la angiogénesis. El aumento de la metilación del ADN y sus efectos fenotípicos se transmitieron a múltiples generaciones posteriores. [55]
Se ha estudiado la posible TEI en cobayas ( Cavia aperea ) exponiendo a los machos a una temperatura ambiente más elevada durante dos meses. En el laboratorio, se permitió a los machos aparearse con la misma hembra antes y después de la exposición al calor para determinar si las altas temperaturas afectaban a la descendencia. Dado que sirve como órgano termorregulador, se estudiaron muestras del hígado en los cobayas padres (generación F0) y el hígado y los testículos de la descendencia macho (generación F1). Los machos F0 experimentaron una respuesta epigenética inmediata al aumento de temperatura; los niveles de hormonas en el hígado responsables de la termorregulación aumentaron. La generación F1 también mostró la diferente respuesta epigenética metilada en su hígado y testículos, lo que indica que potencialmente podrían transmitir las marcas epigenéticas a la generación F2. [56]
Aunque la herencia genética es importante para describir los resultados fenotípicos , no puede explicar por completo por qué los hijos se parecen a sus padres. Además de los genes, los hijos heredan condiciones ambientales similares establecidas por generaciones anteriores. Un entorno que los hijos humanos suelen compartir con su progenitora materna durante nueve meses es el útero. Teniendo en cuenta la duración de las etapas fetales del desarrollo , el entorno del útero de la madre puede tener efectos duraderos en la salud de los hijos. [ cita requerida ]
Un ejemplo de cómo el ambiente dentro del útero puede afectar la salud de una descendencia es el invierno de hambruna holandés de 1944-45 y su efecto causal en las enfermedades hereditarias epigenéticas transgeneracionales inducidas. Durante el invierno de hambruna holandés, la descendencia expuesta a condiciones de hambruna durante el tercer trimestre de desarrollo fue más pequeña que la nacida el año anterior a la hambruna. Además, se encontró que la descendencia nacida durante la hambruna y su descendencia posterior tenían un mayor riesgo de enfermedades metabólicas , enfermedades cardiovasculares , intolerancia a la glucosa , diabetes y obesidad en la edad adulta. Los efectos de esta hambruna en el desarrollo duraron hasta dos generaciones. [9] [57] El aumento de los factores de riesgo para la salud de las generaciones F1 y F2 durante el invierno de hambruna holandés es un fenómeno conocido llamado " programación fetal ", que es causado por la exposición a factores ambientales dañinos en el útero. [57]
En algunos casos se ha descubierto que la pérdida de expresión genética que da lugar al síndrome de Prader-Willi o al síndrome de Angelman está causada por cambios epigenéticos (o "epimutaciones") en ambos alelos , en lugar de implicar una mutación genética . En los 19 casos informativos, las epimutaciones que, junto con la impronta fisiológica y, por tanto, el silenciamiento del otro alelo , estaban causando estos síndromes se localizaban en un cromosoma con un origen parental y de abuelos específico. Específicamente, el cromosoma de origen paterno tenía una marca materna anormal en el SNURF-SNRPN , y esta marca anormal se heredó de la abuela paterna. [58]
Se ha descubierto que varios tipos de cáncer están influenciados por la epigenética transgeneracional. Se han encontrado epimutaciones en el gen MLH1 en dos individuos con un fenotipo de cáncer colorrectal hereditario sin poliposis y sin ninguna mutación franca de MLH1 que de otra manera cause la enfermedad. Las mismas epimutaciones también se encontraron en los espermatozoides de uno de los individuos, lo que indica el potencial de ser transmitidos a la descendencia. [58] Además de las epimutaciones en el gen MLH1 , se ha determinado que ciertos tipos de cáncer, como el cáncer de mama , pueden originarse durante las etapas fetales dentro del útero . [59] Además, la evidencia recopilada en varios estudios que utilizan sistemas modelo (es decir, animales) ha encontrado que la exposición durante las generaciones parentales puede resultar en la herencia multigeneracional y transgeneracional del cáncer de mama. [59] Más recientemente, los estudios han descubierto una conexión entre la adaptación de las células germinales masculinas a través de las dietas paternas previas a la concepción y la regulación del cáncer de mama en la descendencia en desarrollo. [59] Más específicamente, los estudios han comenzado a descubrir nuevos datos que subrayan una relación entre la herencia epigenética transgeneracional del cáncer de mama y los componentes alimentarios ancestrales o marcadores asociados , como el peso al nacer. [59] Al utilizar sistemas modelo, como ratones, los estudios han demostrado que la obesidad paterna estimulada en el momento de la concepción puede alterar epigenéticamente la línea germinal paterna. La línea germinal paterna es responsable de regular el peso de sus hijas al nacer y el potencial de que su hija desarrolle cáncer de mama. [60] Además, se encontró que las modificaciones en el perfil de expresión de miRNA de la línea germinal masculina están acopladas con un peso corporal elevado. [60] Además, la obesidad paterna resultó en un aumento en el porcentaje de descendencia femenina que desarrolla tumores mamarios inducidos por carcinógenos , lo que es causado por cambios en la expresión de miRNA mamario. [60]
Aparte de las afecciones relacionadas con el cáncer asociadas con los efectos de la herencia epigenética transgeneracional, la herencia epigenética transgeneracional se ha implicado recientemente en la progresión de la hipertensión arterial pulmonar (HAP). [61] Estudios recientes han encontrado que es probable que la herencia epigenética transgeneracional esté involucrada en la progresión de la HAP porque las terapias actuales para la HAP no reparan los fenotipos irregulares asociados con esta enfermedad. [61] Los tratamientos actuales para la HAP han intentado corregir los síntomas de la HAP con vasodilatadores y protectores antitrombóticos , pero ninguno ha aliviado eficazmente las complicaciones relacionadas con los fenotipos deteriorados asociados con la HAP. [61] La incapacidad de los vasodilatadores y protectores antitrombóticos para corregir la HAP sugiere que la progresión de la HAP depende de múltiples variables, lo que probablemente sea consecuente de la herencia epigenética transgeneracional. [61] Específicamente, se cree que la epigenética transgeneracional está vinculada a los cambios fenotípicos asociados con la remodelación vascular . [61] Por ejemplo, la hipoxia durante la gestación puede inducir alteraciones epigenéticas transgeneracionales que podrían resultar perjudiciales durante las primeras fases del desarrollo fetal y aumentar la posibilidad de desarrollar HAP en la edad adulta. [61] Aunque los estados hipóxicos podrían inducir la variación epigenética transgeneracional asociada con la HAP, hay pruebas sólidas que respaldan que una variedad de factores de riesgo maternos están vinculados con la progresión final de la HAP. [61] Dichos factores de riesgo maternos vinculados con la HAP de aparición tardía incluyen disfunción placentaria, hipertensión, obesidad y preeclampsia. [61] Estos factores de riesgo maternos y estresores ambientales junto con cambios epigenéticos transgeneracionales pueden resultar en un daño prolongado a las vías de señalización asociadas con el desarrollo vascular durante las etapas fetales, lo que aumenta la probabilidad de tener HAP. [61]
Un estudio ha demostrado que el abuso infantil, que se define como "contacto sexual, abuso físico grave y/o negligencia grave", conduce a modificaciones epigenéticas de la expresión del receptor de glucocorticoides. [62] [63] La expresión del receptor de glucocorticoides desempeña un papel vital en la actividad hipotálamo-hipofisario-adrenal (HPA). Además, los experimentos con animales han demostrado que los cambios epigenéticos pueden depender de las interacciones madre-bebé después del nacimiento. [64] Además, un estudio reciente que investigó las correlaciones entre el estrés materno en el embarazo y la metilación en adolescentes/sus madres ha descubierto que los hijos de mujeres que fueron abusadas durante el embarazo tenían más probabilidades de tener genes metilados del receptor de glucocorticoides. [65] Por lo tanto, los niños con genes metilados del receptor de glucocorticoides experimentan una respuesta alterada al estrés, lo que en última instancia conduce a una mayor susceptibilidad a experimentar ansiedad. [65]
Estudios adicionales que examinaron los efectos del dietilestilbestrol (DES), que es un disruptor endocrino , han encontrado que los nietos (tercera generación) de mujeres expuestas al DES aumentaron significativamente la probabilidad de que sus nietos desarrollaran trastorno por déficit de atención e hiperactividad (TDAH). [66] Esto se debe a que las mujeres expuestas a disruptores endocrinos , como el DES, durante la gestación pueden estar vinculadas a déficits multigeneracionales del desarrollo neurológico . [66] Además, estudios en animales indican que los disruptores endocrinos tienen un profundo impacto en las células de la línea germinal y el desarrollo neurológico. [66] Se postula que la causa del impacto multigeneracional del DES es el resultado de procesos biológicos asociados con la reprogramación epigenética de la línea germinal , aunque esto aún está por determinar. [66]
La herencia epigenética sólo puede afectar la aptitud si altera predeciblemente un rasgo bajo selección. Se han presentado evidencias de que los estímulos ambientales son agentes importantes en la alteración de los epigenes. Irónicamente, la evolución darwiniana puede actuar sobre estas características adquiridas neolamarckianas, así como sobre los mecanismos celulares que las producen (por ejemplo, los genes de la metiltransferasa). La herencia epigenética puede conferir un beneficio de aptitud a los organismos que se enfrentan a cambios ambientales en escalas de tiempo intermedias. [67] Es probable que los cambios de ciclo corto tengan procesos reguladores codificados por el ADN, ya que la probabilidad de que la descendencia necesite responder a los cambios varias veces durante su vida es alta. Por otro lado, la selección natural actuará sobre las poblaciones que experimentan cambios en cambios ambientales de ciclo más largo. En estos casos, si la preparación epigenética de la siguiente generación es perjudicial para la aptitud durante la mayor parte del intervalo (por ejemplo, información errónea sobre el medio ambiente), estos genotipos y epigenotipos se perderán. En el caso de los ciclos temporales intermedios, la probabilidad de que la descendencia se encuentre con un entorno similar es suficientemente alta sin que se ejerza una presión selectiva sustancial sobre los individuos que carecen de una arquitectura genética capaz de responder al entorno. Naturalmente, las duraciones absolutas de los ciclos ambientales cortos, intermedios y largos dependerán del rasgo, la duración de la memoria epigenética y el tiempo de generación del organismo. Gran parte de la interpretación de los efectos de la aptitud epigenética se centra en la hipótesis de que los epigenes son contribuyentes importantes a los fenotipos, que aún está por resolver. [ cita requerida ]
Las marcas epigenéticas heredadas pueden ser importantes para regular componentes importantes de la aptitud. En las plantas, por ejemplo, el gen Lcyc en Linaria vulgaris controla la simetría de la flor. Linnaeus describió por primera vez mutantes radialmente simétricos, que surgen cuando Lcyc está muy metilado. [68] Dada la importancia de la forma floral para los polinizadores, [69] la metilación de los homólogos de Lcyc (por ejemplo, CYCLOIDEA ) puede tener efectos nocivos sobre la aptitud de las plantas. En animales, numerosos estudios han demostrado que las marcas epigenéticas heredadas pueden aumentar la susceptibilidad a las enfermedades. También se sugiere que las influencias epigenéticas transgeneracionales contribuyen a la enfermedad, especialmente el cáncer, en humanos. [70] Se ha demostrado que los patrones de metilación tumoral en los promotores de genes se correlacionan positivamente con la historia familiar de cáncer. [71] Además, la metilación del gen MSH2 se correlaciona con cánceres colorrectales y de endometrio de aparición temprana. [72]
Las semillas desmetiladas experimentalmente del organismo modelo Arabidopsis thaliana tienen una mortalidad significativamente mayor, un crecimiento atrofiado, una floración retrasada y un cuajado de frutos más bajo, [73] lo que indica que los epigenes pueden aumentar la aptitud. Además, se ha demostrado que las respuestas epigenéticas inducidas por el medio ambiente al estrés son hereditarias y se correlacionan positivamente con la aptitud. [74] En los animales, la anidación comunitaria cambia el comportamiento de los ratones aumentando los regímenes de cuidado parental [75] y las habilidades sociales [76] que se plantea la hipótesis de que aumentan la supervivencia de las crías y el acceso a los recursos (como comida y parejas), respectivamente.
La epigenética juega un papel crucial en la regulación y el desarrollo del sistema inmunológico. [77] En 2021, se proporcionó evidencia de la herencia de la inmunidad entrenada a lo largo de generaciones a la progenie de ratones con una infección sistémica de Candida albicans . [78] La progenie de ratones sobrevivió a la infección por Candida albicans a través de cambios funcionales, transcripcionales y epigenéticos vinculados a los loci de genes inmunes. [78] La capacidad de respuesta de las células mieloides a la infección por Candida albicans aumentó en las vías inflamatorias y la resistencia aumentó a las infecciones en las siguientes generaciones. [78] La inmunidad en los vertebrados también puede transferirse de la madre a través del paso de hormonas, nutrientes y anticuerpos. [79] En los mamíferos, los factores maternos pueden transferirse a través de la lactancia o la placenta. [79] La transmisión transgeneracional de rasgos relacionados con la inmunidad también se describe en plantas e invertebrados. Las plantas tienen un sistema de preparación de defensa que les permite tener una respuesta de defensa alternativa que puede acelerarse ante la exposición a acciones de estrés o patógenos. [80] Después del evento de cebado, la información clave del estrés de cebado se almacena, y la memoria puede heredarse en la descendencia (intergeneracional o transgeneracional). [80] En estudios, la progenie de Arabidopsis infectada con Pseudomonas syringae fue preparada durante la expresión de resistencia sistémica adquirida (SAR). [81] La progenie mostró tener resistencia contra patógenos (hemi)-biotróficos que está asociada con genes dependientes de salicílico y el gen regulador de defensa, no expresivo de genes PR (NPR1). [81] La SAR transgeneracional en la progenie se asoció con una mayor acetilación de la histona 3 en la lisina 9, hipometilación de genes y marcas de cromatina en regiones promotoras de genes dependientes de salicílico. [81] De manera similar en los insectos, el escarabajo rojo de la harina Tribolium castaneum es preparado a través de la exposición al patógeno Bacillus thuringiensis . [79] Los experimentos de apareamiento doble con el escarabajo rojo de la harina demostraron que la preparación inmunitaria transgeneracional paterna está mediada por el esperma o el líquido seminal, que mejora la supervivencia tras la exposición a patógenos y contribuye a los cambios epigenéticos. [79]
Los bucles de retroalimentación positivos y negativos se observan comúnmente en los mecanismos moleculares y la regulación de los procesos homeostáticos. Hay evidencia de que los bucles de retroalimentación interactúan para mantener las modificaciones epigenéticas dentro de una generación, así como para contribuir a la TEI en varios organismos, y estos bucles de retroalimentación pueden mostrar posibles adaptaciones a las perturbaciones ambientales. Los bucles de retroalimentación son realmente una repercusión de cualquier modificación epigenética, ya que resultan en cambios en la expresión. Más aún, los bucles de retroalimentación observados a lo largo de múltiples generaciones debido a la TEI muestran una dinámica espacio-temporal que está asociada solo con la TEI. Por ejemplo, las temperaturas elevadas durante la embriogénesis y el establecimiento del ARN PIWI (piRNA) son directamente proporcionales, lo que proporciona un resultado hereditario para reprimir elementos transponibles a través de grupos de piRNA. [82] Además, las generaciones posteriores conservan un locus activo para continuar estableciendo piRNA, cuya formación era previamente enigmática. [82] En otro caso, se sugirió que la disrupción endocrina tenía una interacción de bucle de retroalimentación con la metilación de varios sitios genómicos en Menidia beryllina , que puede haber sido una función de TEI. [83] Cuando se eliminó la exposición, y la descendencia F2 de M. beryllina todavía retuvo estas marcas de metilación, lo que causó un bucle de retroalimentación negativo en la expresión de varios genes. [83] En otro ejemplo, la hibridación de anguilas puede conducir a bucles de retroalimentación que contribuyen a la desmetilación de transposones y la activación de elementos transponibles. [84] Debido a que los TE generalmente están silenciados en el genoma, su presencia y expresión potencial crea un bucle de retroalimentación para evitar que los híbridos se reproduzcan con otros híbridos o especies no híbridas, lo que elimina la proliferación de la expresión de TE y previene TEI en este contexto. Este fenómeno se conoce como una forma de aislamiento reproductivo postcigótico.
Los efectos epigenéticos heredados sobre los fenotipos han sido bien documentados en bacterias, protistas, hongos, plantas, nematodos y moscas de la fruta. [85] [19] Aunque no se ha realizado ningún estudio sistemático de la herencia epigenética (la mayoría se centra en organismos modelo), hay evidencia preliminar de que este modo de herencia es más importante en plantas que en animales. [85] Es probable que la diferenciación temprana de las líneas germinales animales impida que el marcado epigenético ocurra más tarde en el desarrollo, mientras que en plantas y hongos las células somáticas pueden incorporarse a la línea germinal. [86] [87]
Se cree que la herencia epigenética transgeneracional puede permitir que ciertas poblaciones se adapten fácilmente a entornos variables. [19] Aunque hay casos bien documentados de herencia epigenética transgeneracional en ciertas poblaciones, hay dudas sobre si esta misma forma de adaptabilidad es aplicable a los mamíferos. [19] Más específicamente, se cuestiona si se aplica a los humanos. [19] Últimamente, la mayoría de los modelos experimentales que utilizan ratones y observaciones limitadas en humanos solo han encontrado rasgos heredados epigenéticamente que son perjudiciales para la salud de ambos organismos. [19] Estos rasgos dañinos van desde un mayor riesgo de enfermedad, como la enfermedad cardiovascular , hasta la muerte prematura. [19] Sin embargo, esto puede basarse en la premisa de un sesgo de informe limitado porque es más fácil detectar efectos experimentales negativos, opuestos a efectos experimentales positivos. [19] Además, la considerable reprogramación epigenética necesaria para el éxito evolutivo de las líneas germinales y las fases iniciales de la embriogénesis en mamíferos puede ser la causa potencial que limita la herencia transgeneracional de las marcas de cromatina en mamíferos. [19]
Los patrones de historia de vida también pueden contribuir a la ocurrencia de la herencia epigenética. Los organismos sésiles , aquellos con baja capacidad de dispersión y aquellos con un comportamiento simple pueden beneficiarse más de la transmisión de información a su descendencia a través de vías epigenéticas. También pueden surgir patrones geográficos, donde los entornos altamente variables y altamente conservados pueden albergar menos especies con una herencia epigenética importante. [ cita requerida ]
Los seres humanos han reconocido desde hace mucho tiempo que los rasgos de los padres suelen verse en la descendencia. Esta idea condujo a la aplicación práctica de la cría selectiva de plantas y animales, pero no abordó la cuestión central de la herencia: ¿cómo se conservan estos rasgos entre generaciones y qué causa la variación? En la historia del pensamiento evolutivo se han mantenido varias posiciones. [ cita requerida ]
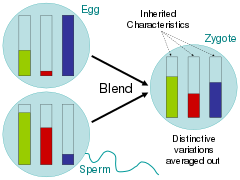
Al abordar estas preguntas relacionadas, los científicos durante la época de la Ilustración defendieron en gran medida la hipótesis de la mezcla, en la que los rasgos parentales se homogeneizaban en la descendencia de manera muy similar a la mezcla de baldes de pintura de diferentes colores. [88] Los críticos de El origen de las especies de Charles Darwin señalaron que bajo este esquema de herencia, la variación se vería rápidamente inundada por el fenotipo mayoritario. [89] En la analogía del balde de pintura, esto se vería mezclando dos colores juntos y luego mezclando el color resultante con solo uno de los colores parentales 20 veces; el color de la variante rara se desvanecería rápidamente.
Sin que la mayoría de la comunidad científica europea lo supiera, el monje Gregor Mendel había resuelto la cuestión de cómo se conservan los caracteres entre generaciones mediante experimentos de reproducción con plantas de guisantes. [90] Por tanto, Charles Darwin no conocía la propuesta de Mendel de "herencia particulada" en la que los caracteres no se mezclaban sino que se transmitían a la descendencia en unidades discretas que ahora llamamos genes. Darwin llegó a rechazar la hipótesis de la mezcla a pesar de que sus ideas y las de Mendel no se unificaron hasta la década de 1930, un período conocido como la síntesis moderna .
En su libro de 1809, Philosophie Zoologique , [91] Jean-Baptiste Lamarck reconoció que cada especie experimenta un conjunto único de desafíos debido a su forma y entorno. Por lo tanto, propuso que los caracteres utilizados con más frecuencia acumularían un "fluido nervioso". Dichas acumulaciones adquiridas luego se transmitirían a la descendencia del individuo. En términos modernos, un fluido nervioso transmitido a la descendencia sería una forma de herencia epigenética. [ cita requerida ]
El lamarckismo , como se conoció a esta corriente de pensamiento, era la explicación estándar para el cambio en las especies a lo largo del tiempo cuando Charles Darwin y Alfred Russel Wallace propusieron conjuntamente una teoría de la evolución por selección natural en 1859. En respuesta a la teoría de Darwin y Wallace, un neolamarckismo revisado atrajo a un pequeño grupo de biólogos, [92] aunque el celo lamarckiano se apagó en gran parte debido al famoso experimento de Weismann [93] en el que cortó las colas de ratones a lo largo de varias generaciones sucesivas sin tener ningún efecto en la longitud de la cola. Así, el consenso emergente de que las características adquiridas no podían heredarse se convirtió en canon. [24]
Sin embargo, la variación y la herencia no genéticas resultaron ser bastante comunes. Simultáneamente con el desarrollo en el siglo XX de la síntesis evolutiva moderna (que unificó la genética mendeliana y la selección natural), CH Waddington (1905-1975) estaba trabajando para unificar la biología del desarrollo y la genética. Al hacerlo, adoptó la palabra "epigenética" [94] para representar la diferenciación ordenada de las células embrionarias en tipos celulares funcionalmente distintos a pesar de tener una estructura primaria idéntica de su ADN. [95] Los investigadores discutieron la epigenética de Waddington esporádicamente: se convirtió más en un comodín para caracteres hereditarios no genéticos desconcertantes en lugar de un concepto que hiciera avanzar el cuerpo de investigación. [96] [97] En consecuencia, la definición de la palabra de Waddington ha evolucionado, ampliándose más allá del subconjunto de la especialización celular hereditaria señalizada por el desarrollo.
Algunos científicos han cuestionado si la herencia epigenética compromete la base de la síntesis moderna. Al describir el dogma central de la biología molecular , Francis Crick [98] afirmó sucintamente que "el ADN se mantiene en una configuración por medio de histonas de modo que pueda actuar como una plantilla pasiva para la síntesis simultánea de ARN y proteínas. Ninguna de la 'información' detallada está en la histona". Sin embargo, cierra el artículo afirmando que "¡este esquema explica la mayoría de los resultados experimentales actuales!". De hecho, la aparición de la herencia epigenética (además de los avances en el estudio del desarrollo evolutivo, la plasticidad fenotípica , la capacidad de evolución y la biología de sistemas) ha puesto a prueba el marco actual de la síntesis evolutiva moderna y ha impulsado la reexaminación de mecanismos evolutivos previamente descartados. [99]
Además, los patrones en la herencia epigenética y las implicaciones evolutivas de los códigos epigenéticos en los organismos vivos están conectados con las teorías de la evolución de Lamarck y Darwin . [100] Por ejemplo, Lamarck postuló que los factores ambientales eran responsables de modificar los fenotipos hereditariamente , lo que apoya los constructos de que la exposición a factores ambientales durante etapas críticas del desarrollo puede resultar en epimutaciones en líneas germinales , aumentando así la varianza fenotípica. [100] En contraste, la teoría de Darwin afirmó que la selección natural fortaleció la capacidad de una población para sobrevivir y permanecer reproductivamente apta al favorecer a las poblaciones que pueden adaptarse fácilmente. [100] Esta teoría es consistente con la plasticidad intergeneracional y la varianza fenotípica resultante de la adaptabilidad hereditaria. [100]
Además, cierta variabilidad epigenética puede proporcionar una plasticidad beneficiosa , de modo que ciertos organismos pueden adaptarse a condiciones ambientales fluctuantes. Sin embargo, el intercambio de información epigenética entre generaciones puede dar lugar a aberraciones epigenéticas, que son rasgos epigenéticos que se desvían de la norma. Por lo tanto, la descendencia de las generaciones parentales puede estar predispuesta a enfermedades específicas y a una plasticidad reducida debido a las aberraciones epigenéticas. Aunque la capacidad de adaptarse fácilmente cuando se enfrentan a un nuevo entorno puede ser beneficiosa para ciertas poblaciones de especies que pueden reproducirse rápidamente, las especies con grandes brechas generacionales pueden no beneficiarse de dicha capacidad. Si una especie con una brecha generacional más larga no se adapta adecuadamente al entorno previsto, entonces la aptitud reproductiva de la descendencia de esa especie se verá disminuida.
Ha habido una discusión crítica de la teoría evolutiva dominante por parte de Edward J Steele , Robyn A Lindley y colegas, [101] [102] [103] [104] [105] Fred Hoyle y N. Chandra Wickramasinghe , [106] [107] [108] Yongsheng Liu [109] [110] Denis Noble , [111] [112] John Mattick [113] y otros que las inconsistencias lógicas, así como los efectos de la herencia lamarckiana que involucran modificaciones directas del ADN, así como las transmisiones indirectas recién descritas, a saber, las epigenéticas, desafían el pensamiento convencional en biología evolutiva y campos adyacentes.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )Una de las controversias clásicas en embriología fue la que se produjo entre los preformacionistas y los epigenistas[sic]. [...] la interacción de estos constituyentes da lugar a nuevos tipos de tejidos y órganos que no estaban presentes originalmente, y en esa medida el desarrollo debe considerarse como 'epigenético'.