El dietilestilbestrol ( DES ), también conocido como estilbestrol o estilboestrol , es un medicamento de estrógeno no esteroideo , que actualmente rara vez se usa. [5] [6] [7] En el pasado, se usaba ampliamente para una variedad de indicaciones, incluido el apoyo al embarazo para aquellas con antecedentes de abortos espontáneos recurrentes , la terapia hormonal para los síntomas de la menopausia y la deficiencia de estrógenos , el tratamiento del cáncer de próstata y de mama. cáncer y otros usos. [5] En 2007, sólo se utilizaba en el tratamiento del cáncer de próstata y de mama. [8] En 2011, Hoover y sus colegas informaron sobre resultados de salud adversos relacionados con DES, incluyendo infertilidad , aborto espontáneo , embarazo ectópico , preeclampsia , parto prematuro , muerte fetal , muerte infantil , menopausia antes de los 45 años, cáncer de mama, cáncer de cuello uterino y cáncer vaginal. . [9] Si bien se toma más comúnmente por vía oral , el DES también estaba disponible para su uso por otras vías , por ejemplo, vaginal , tópica y por inyección .
El DES es un estrógeno o un agonista de los receptores de estrógeno , el objetivo biológico de los estrógenos como el estradiol . [7] Es un estrógeno sintético y no esteroideo del grupo del estilbestrol y se diferencia del estrógeno natural estradiol en varios aspectos. [7] En comparación con el estradiol, el DES ha mejorado enormemente su biodisponibilidad cuando se toma por vía oral, es más resistente al metabolismo y muestra efectos relativamente mayores en ciertas partes del cuerpo como el hígado y el útero . [7] Estas diferencias dan como resultado que el DES tenga un mayor riesgo de coágulos sanguíneos , problemas cardiovasculares y otros efectos adversos. [7]
El DES se descubrió en 1938 y se introdujo para uso médico en 1939. [10] [11] Aproximadamente entre 1940 y 1971, el medicamento se administraba a mujeres embarazadas con la creencia incorrecta de que reduciría el riesgo de complicaciones y pérdidas del embarazo. [10] En 1971, se demostró que el DES causaba carcinoma de células claras , un tumor vaginal poco común , en aquellas que habían estado expuestas a este medicamento en el útero . [10] [5] Posteriormente, la Administración de Alimentos y Medicamentos de los Estados Unidos retiró la aprobación del DES como tratamiento para mujeres embarazadas. [10] [5] Los estudios de seguimiento han indicado que el DES también tiene el potencial de causar una variedad de complicaciones médicas adversas importantes durante la vida de las personas expuestas, incluida la submasculinización genital XY . [10] [12]
El Instituto Nacional del Cáncer de Estados Unidos recomienda [13] que los niños nacidos de madres que tomaron DES se sometan a exámenes médicos especiales de forma regular para detectar complicaciones como resultado del medicamento. Las personas que estuvieron expuestas al DES durante el embarazo de sus madres se denominan comúnmente "hijas de DES" e "hijos de DES". [10] [14] Desde el descubrimiento de los efectos tóxicos del DES, se ha descontinuado en gran medida y actualmente ya no se comercializa. [10] [15]
DES se ha utilizado en el pasado para las siguientes indicaciones: [5] [ se necesitan citas adicionales ]
El DES se utilizó en dosis de 0,2 a 0,5 mg/día en la terapia hormonal menopáusica . [27] [5]
El interés en el uso de DES para tratar el cáncer de próstata continúa en la actualidad. [28] [29] [30] [31] [32] [33] [34] Sin embargo, se ha recomendado el uso de estrógenos parenterales bioidénticos como el fosfato de poliestradiol en favor de los estrógenos sintéticos orales como el DES debido a su riesgo mucho menor de enfermedad cardiovascular. toxicidad. [35] [32] [34] Además del cáncer de próstata, hoy en día también continúa cierto interés en el uso de DES para tratar el cáncer de mama. [36] [37] Sin embargo, al igual que en el caso del cáncer de próstata, se han presentado argumentos [38] a favor del uso de estrógenos bioidénticos como el estradiol en lugar de DES para el cáncer de mama. [36] [38]
El DES oral en dosis de 0,25 a 0,5 mg/día es eficaz en el tratamiento de los sofocos en hombres sometidos a terapia de privación de andrógenos para el cáncer de próstata. [39]
Aunque el DES se utilizaba para favorecer el embarazo, más tarde se descubrió que no era eficaz para este uso y que, en realidad, era perjudicial. [40] [41] [42] [43]
En dosis de más de 1 mg/día, el DES se asocia con tasas altas de efectos secundarios que incluyen náuseas , vómitos , malestar abdominal , dolor de cabeza e hinchazón (incidencia del 15 al 50%). [44]
La pigmentación de las areolas mamarias suele ser muy oscura y casi negra con la terapia DES. [5] [45] [46] [47] [48] [49] [50] [51] La pigmentación que se produce con estrógenos sintéticos como el DES es mucho mayor que con estrógenos naturales como el estradiol . [5] [45] Se desconoce el mecanismo de la diferencia. [5] Se ha informado que los progestágenos como el caproato de hidroxiprogesterona reducen la hiperpigmentación del pezón inducida por la terapia con altas dosis de estrógeno. [52]
En hombres tratados con él por cáncer de próstata, se ha descubierto que el DES produce altas tasas de ginecomastia (desarrollo de los senos) del 41 al 77%. [53]
En estudios sobre el DES como forma de terapia con estrógenos en dosis altas para personas con cáncer de próstata , se ha asociado con una considerable morbilidad y mortalidad cardiovascular . [29] [5] El riesgo depende de la dosis. [29] Una dosis de 5 mg/día de DES se ha asociado con un aumento del 36 % en las muertes no relacionadas con el cáncer (principalmente cardiovasculares). [29] Además, existe una incidencia de hasta el 15% de tromboembolismo venoso . [54] Una dosis de 3 mg/día de DES se ha asociado con una incidencia de tromboembolismo del 9,6 al 17 %, con una incidencia de complicaciones cardiovasculares del 33,3 %. [29] Una dosis más baja de 1 mg/día de DES se ha asociado con una tasa de muerte por eventos cardiovasculares del 14,8 % (en comparación con el 8,3 % para la orquiectomía sola). [29]
El DES se ha relacionado con una variedad de efectos adversos a largo plazo en mujeres que fueron tratadas con él durante el embarazo y/o en su descendencia, incluido un mayor riesgo de lo siguiente: [40]
Un estudio exhaustivo en animales realizado en 1993 encontró una gran cantidad de efectos adversos del DES, tales como (pero no limitados a)
Estudios en roedores revelan cánceres y anomalías del tracto reproductivo femenino que llegan hasta la generación F2 , y hay evidencia de efectos adversos como ciclos menstruales irregulares intersexuales en nietos de madres DES. [57] Además, la evidencia también apunta a efectos transgeneracionales en los hijos F2, como el hipospadias . [58] Sin embargo, en este momento, el alcance de los efectos transgeneracionales del DES en humanos no se comprende completamente. [ cita necesaria ]
El DES se ha evaluado en el pasado en estudios clínicos en dosis extremadamente altas de hasta 1500 a 5000 mg/día. [36] [59] [60]
DES es un estrógeno ; específicamente, es un agonista completo muy potente de ambos receptores de estrógeno (ER). [61] [62] Tiene aproximadamente 468% y 295% de la afinidad del estradiol en el ERα y ERβ , respectivamente. [63] Sin embargo, se han informado valores de CE 50 de 0,18 nM y 0,06 nM de DES para ERα y ERβ, respectivamente, lo que sugiere, a pesar de su afinidad de unión por los dos receptores, una preferencia varias veces mayor por la activación del ERβ. sobre el ERα. [64] Además de los RE nucleares, el DES es un agonista del receptor de estrógeno acoplado a proteína G (GPER), aunque con una afinidad relativamente baja (~1000 nM). [65] DES produce todos los mismos efectos biológicos atribuidos a los estrógenos naturales como el estradiol. [66] [67] Esto incluye efectos en el útero , la vagina , las glándulas mamarias , la glándula pituitaria y otros tejidos . [66] [67] [68] [69]
Una dosis de 1 mg/día de DES es aproximadamente equivalente a una dosis de 50 µg/día de etinilestradiol en términos de potencia estrogénica sistémica. [1] [4] De manera similar al etinilestradiol , el DES muestra un efecto marcado y desproporcionadamente fuerte sobre la síntesis de proteínas hepáticas . [7] Mientras que su potencia estrogénica sistémica fue aproximadamente 3,8 veces mayor que la del estropipato (sulfato de estrona y piperazina), que tiene una potencia similar al estradiol micronizado , la potencia estrogénica hepática del DES fue 28 veces mayor que la del estropipato (o aproximadamente 7,5 veces). potencia más fuerte para una dosis con efecto estrogénico sistémico equivalente). [1]
DES tiene al menos tres mecanismos de acción en el tratamiento del cáncer de próstata. [70] Suprime la producción de andrógenos gonadales y, por tanto, los niveles circulantes de andrógenos debido a sus efectos antigonadotrópicos ; estimula la producción hepática de globulina transportadora de hormonas sexuales (SHBG), aumentando así los niveles circulantes de SHBG y disminuyendo la fracción libre de testosterona y dihidrotestosterona (DHT) en la circulación ; y puede tener efectos citotóxicos directos en los testículos y la próstata . [70] También se ha descubierto que el DES disminuye la síntesis de ADN en dosis altas. [70]
El DES es un estrógeno de acción prolongada, con una retención nuclear de unas 24 horas. [71] [72]


Debido a su actividad estrogénica, el DES tiene efectos antigonadotrópicos . [83] [70] [94] [95] Es decir, ejerce retroalimentación negativa sobre el eje hipotalámico-pituitario-gonadal (eje HPG), suprime la secreción de gonadotropinas , hormona luteinizante (LH) y hormona folículo estimulante ( FSH), y suprime la producción de hormonas sexuales , así como la producción o maduración de gametos en las gónadas . [83] [70] [94] [95] Un estudio sobre la inhibición de la ovulación encontró que 5 mg/día de DES oral tenía una eficacia del 92 % y la ovulación se producía en un solo ciclo. [96] [90] El DES suprime consistentemente los niveles de testosterona en hombres en el rango de castración (<50 ng/dL) dentro de 1 a 2 semanas en dosis de 3 mg/día y superiores. [83] [95] [97] Por el contrario, una dosis de 1 mg/día de DES no puede suprimir completamente los niveles de testosterona en el rango de castración en los hombres, que en cambio a menudo se estabilizan justo por encima de los niveles de castración (>50 ng/dL). [29] [70] [94] Sin embargo, también se ha informado que 1 mg/día de DES produce aproximadamente un 50% de supresión de los niveles de testosterona, aunque con una amplia variabilidad interindividual . [83] [98] Se ha dicho que dosis de DES de menos de 1 mg/día no tienen ningún efecto sobre los niveles de testosterona. [83] Sin embargo, se ha descubierto que la adición de una dosis "extremadamente baja" de 0,1 mg/día de DES al acetato de ciproterona produce un efecto antigonadotrópico sinérgico y suprime los niveles de testosterona en el rango de castración en los hombres. [99] [100] [101] DES a 3 mg/día tiene una supresión de testosterona similar a una dosis de 300 mg/día, lo que sugiere que la supresión de los niveles de testosterona es máxima con 3 mg/día. [102]
Además de las salas de emergencia, un estudio in vitro encontró que el DES también posee actividad, aunque relativamente débil, en una variedad de otros receptores de hormonas esteroides . [64] Mientras que el estudio encontró valores de CE 50 de 0,18 nM y 0,06 nM de DES para el ERα y ERβ, respectivamente, el medicamento mostró una actividad glucocorticoide significativa a una concentración de 1 μM que superó la de la dexametasona 0,1 nM , así como una actividad glucocorticoide significativa. antagonismo de los receptores de andrógenos , progesterona y mineralocorticoides (75%, 85% y 50% de inhibición de la estimulación del control positivo, respectivamente, todos a una concentración de 1 μM). [64] También mostró aproximadamente un 25% de inhibición de la activación de PPARγ y LXRα a una concentración de 10 μM. [64] Los investigadores afirmaron que, hasta donde sabían, fueron los primeros en informar tales acciones del DES, y plantearon la hipótesis de que estas acciones podrían estar involucradas en los efectos clínicos del DES, por ejemplo, en el cáncer de próstata (especialmente en en los que se emplean dosis especialmente altas de DES). [64] Sin embargo, también señalaron que la importancia de las actividades requiere más estudios en modelos animales en dosis farmacológicamente relevantes. [64]
El DES ha sido identificado como un antagonista de los tres isotipos de los receptores relacionados con estrógenos (ERR), ERRα , ERRβ y ERRγ . [103] [104] La inhibición media máxima se produce a una concentración de aproximadamente 1 μM. [104]
El DES se absorbe bien con la administración oral . [1] Con una dosis oral de 1 mg/día de DES, los niveles plasmáticos de DES a las 20 horas después de la última dosis oscilaron entre 0,9 y 1,9 ng/ml (3,4 a 7,1 nmol/L). [1] La administración sublingual de DES parece tener aproximadamente la misma potencia estrogénica que la del DES oral en las mujeres. [105] El DES intrauterino se ha estudiado para el tratamiento de la hipoplasia uterina . [106] Se cree que el DES oral tiene alrededor del 17 al 50% de la potencia estrogénica clínica del DES inyectado. [107]
La vida media de distribución del DES es de 80 minutos. [1] No tiene afinidad por la SHBG ni por la globulina transportadora de corticosteroides y, por lo tanto, no está unida a estas proteínas en la circulación. [108] La unión del DES a las proteínas plasmáticas es superior al 95%. [2]
La hidroxilación de los anillos aromáticos del DES y la posterior conjugación de las cadenas laterales de etilo representan del 80 al 90% del metabolismo del DES , mientras que la oxidación representa del 10 al 20% restante y está dominada por reacciones de conjugación. [2] [3] La conjugación de DES consiste en glucuronidación , mientras que la oxidación incluye la deshidrogenación en ( Z , Z )-dienestrol . [1] [2] [3] También se sabe que el medicamento produce paroxipropiona como metabolito . [109] El DES produce intermediarios reactivos transitorios similares a las quinonas que causan daño celular y genético , lo que puede ayudar a explicar los efectos cancerígenos conocidos del DES en humanos. [1] Sin embargo, otras investigaciones indican que los efectos tóxicos del DES pueden deberse simplemente a la sobreactivación de los RE. [110] A diferencia del estradiol , los grupos hidroxilo del DES no se oxidan en un equivalente similar a la estrona . [111]
La vida media de eliminación del DES es de 24 horas. [1] Los metabolitos del DES se excretan en la orina y las heces . [2] [3]
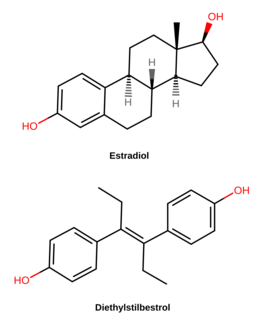
DES pertenece al grupo de compuestos estilbestrol (4,4'-dihidroxiestilbeno ) . [115] Es un análogo de anillo abierto no esteroide del estrógeno esteroide estradiol . [112] El DES se puede preparar a partir de anetol , que también resulta ser débilmente estrogénico. [115] [116] [114] [113] El anetol se desmetiló para formar anol y luego el anol se dimerizó espontáneamente en dianol y hexestrol , y posteriormente se sintetizó DES mediante modificación estructural del hexestrol. [115] [116] [114] [113] Como lo muestra la cristalografía de rayos X , las dimensiones moleculares del DES son casi idénticas a las del estradiol, particularmente en lo que respecta a la distancia entre los grupos hidroxilo terminales . [113]
El DES fue sintetizado por primera vez a principios de 1938 por Leon Golberg, entonces estudiante de posgrado de Sir Robert Robinson en el Laboratorio Dyson Perrins de la Universidad de Oxford . La investigación de Golberg se basó en el trabajo de Wilfrid Lawson en el Instituto Courtauld de Bioquímica (dirigido por Sir Edward Charles Dodds en la Facultad de Medicina del Hospital Middlesex, ahora parte del University College de Londres ). Un informe de su síntesis se publicó en Nature el 5 de febrero de 1938. [117] [118] [119]
La investigación del DES fue financiada por el Consejo de Investigación Médica del Reino Unido (MRC) , que tenía una política contra el patentamiento de medicamentos descubiertos con fondos públicos. Como no estaba patentado, el DES fue producido por más de 200 empresas farmacéuticas y químicas en todo el mundo. [ cita necesaria ]
El DES se comercializó por primera vez para uso médico en 1939. [11] Fue aprobado por la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) el 19 de septiembre de 1941, en comprimidos de hasta 5 mg para cuatro indicaciones: vaginitis gonorreica , vaginitis atrófica , menopausia. síntomas y supresión de la lactancia posparto para prevenir la congestión mamaria. [119] La indicación de vaginitis gonorreica se abandonó cuando estuvo disponible el antibiótico penicilina . Desde sus inicios, el fármaco fue muy controvertido. [120] [121]
En 1941, Charles Huggins y Clarence Hodges de la Universidad de Chicago descubrieron que el benzoato de estradiol y el DES eran los primeros fármacos eficaces para el tratamiento del cáncer de próstata metastásico . [122] [123] DES fue el primer fármaco contra el cáncer. [124]
La orquiectomía , el DES o ambos fueron el tratamiento inicial estándar para el cáncer de próstata avanzado sintomático durante más de 40 años, hasta que se descubrió que el agonista de GnRH leuprorelina tenía una eficacia similar al DES sin efectos estrogénicos y se aprobó en 1985. [97]
Desde la década de 1940 hasta finales de la década de 1980, el DES fue aprobado por la FDA como terapia de reemplazo de estrógenos para estados de deficiencia de estrógenos como la disgenesia ovárica , la insuficiencia ovárica prematura y después de la ooforectomía . [ cita necesaria ]
En la década de 1940, el DES se utilizaba de forma no autorizada para prevenir resultados adversos del embarazo en mujeres con antecedentes de aborto espontáneo. El 1 de julio de 1947, la FDA aprobó el uso de DES para esta indicación. La primera aprobación de este tipo se concedió a Bristol-Myers Squibb , permitiendo el uso de comprimidos de 25 mg (y posteriormente de 100 mg) de DES durante el embarazo. Más tarde ese mismo año se concedieron aprobaciones a otras empresas farmacéuticas. [125] El régimen recomendado comenzó con 5 mg por día en la séptima y octava semana de embarazo (desde el primer día del último período menstrual), aumentó cada dos semanas en 5 mg por día hasta la semana 14 y luego aumentó cada semana en 5 mg por día de 25 mg por día en la semana 15 a 125 mg por día en la semana 35 de embarazo. [126] Originalmente, el DES se consideraba eficaz y seguro tanto para la mujer embarazada como para el bebé en desarrollo. Se comercializó agresivamente y se prescribió de forma rutinaria. Las ventas alcanzaron su punto máximo en 1953.
A principios de la década de 1950, un ensayo clínico doble ciego en la Universidad de Chicago evaluó los resultados del embarazo en mujeres a las que se les asignó recibir o no DES. [127] El estudio no mostró ningún beneficio de tomar DES durante el embarazo; Los resultados adversos del embarazo no se redujeron en las mujeres que recibieron DES. A finales de la década de 1960, seis de los siete principales libros de texto de obstetricia decían que el DES era ineficaz para prevenir el aborto espontáneo. [125] [128]
A pesar de la ausencia de evidencia que respalde el uso de DES para prevenir resultados adversos del embarazo, se siguió administrando DES a mujeres embarazadas durante la década de 1960. En 1971, un informe publicado en el New England Journal of Medicine mostró un vínculo probable entre el DES y el adenocarcinoma vaginal de células claras en niñas y mujeres jóvenes que habían estado expuestas a este fármaco en el útero . Más tarde, ese mismo año, la FDA envió un Boletín de Medicamentos de la FDA a todos los médicos estadounidenses advirtiendo contra el uso de DES en mujeres embarazadas. La FDA también eliminó la prevención del aborto espontáneo como indicación para el uso de DES y agregó el embarazo como contraindicación para el uso de DES. [129] El 5 de febrero de 1975, la FDA ordenó que se retiraran las tabletas de DES de 25 mg y 100 mg, a partir del 18 de febrero de 1975. [130] El número de personas expuestas al DES durante el embarazo o en el útero durante el período de 1940 a 1971 Se desconoce, pero puede llegar a los 2 millones en los Estados Unidos. DES también se utilizó en otros países, sobre todo en Francia, los Países Bajos y Gran Bretaña.
Desde la década de 1950 hasta principios de la de 1970, se prescribía DES a niñas prepúberes para comenzar la pubertad y así detener el crecimiento cerrando las placas de crecimiento en los huesos. A pesar de su claro vínculo con el cáncer, los médicos siguieron recomendando la hormona para el "exceso de altura". [131]
En 1960, se descubrió que el DES era más eficaz que los andrógenos en el tratamiento del cáncer de mama avanzado en mujeres posmenopáusicas. [132] El DES fue el tratamiento hormonal de elección para el cáncer de mama avanzado en mujeres posmenopáusicas hasta 1977, cuando la FDA aprobó el tamoxifeno , un modulador selectivo del receptor de estrógeno con eficacia similar al DES pero con menos efectos secundarios. [133]
Varias fuentes de la literatura médica de las décadas de 1970 y 1980 indican que el DES se utilizaba como componente de la terapia hormonal para mujeres transgénero . [134] [135] [136]
En 1973, en un intento de restringir el uso no autorizado del DES como anticonceptivo poscoital (que se había vuelto frecuente en muchos servicios de salud universitarios tras la publicación de un influyente estudio en 1971 en JAMA ) a situaciones de emergencia como la violación, un Boletín de Medicamentos de la FDA Se envió a todos los médicos y farmacéuticos de EE. UU. que decían que la FDA había aprobado, bajo condiciones restringidas, el uso de anticonceptivos poscoitales de DES. [137]
En 1975, la FDA dijo que en realidad no había dado (y nunca dio) aprobación a ningún fabricante para comercializar DES como anticonceptivo poscoital, pero aprobaría esa indicación para situaciones de emergencia como violación o incesto si un fabricante proporcionaba etiquetas al paciente y etiquetas especiales. empaquetado como se establece en una norma final de la FDA publicada en 1975. [138] Para desalentar el uso no autorizado del DES como anticonceptivo poscoital, en 1975 la FDA retiró del mercado las tabletas de DES de 25 mg y ordenó el etiquetado de dosis más bajas (5 mg y menos) de DES todavía aprobado para otras indicaciones cambiado para decir: "Este medicamento no debe usarse como anticonceptivo poscoital" en letras mayúsculas en la primera línea del prospecto de información de prescripción del médico y en un lugar prominente y visible del envase y de la etiqueta del cartón. [130] [139] En la década de 1980, el uso no autorizado del régimen Yuzpe de ciertas píldoras anticonceptivas orales combinadas regulares reemplazó el uso no autorizado del DES como anticonceptivo poscoital. [140]
En 1978, la FDA eliminó la supresión de la lactancia posparto para prevenir la ingurgitación mamaria de sus indicaciones aprobadas para DES y otros estrógenos. [141] En la década de 1990, las únicas indicaciones aprobadas para DES eran el tratamiento del cáncer de próstata avanzado y el tratamiento del cáncer de mama avanzado en mujeres posmenopáusicas. El último fabricante estadounidense de DES que queda, Eli Lilly , dejó de fabricarlo y comercializarlo en 1997. [ cita necesaria ]
El dietilestilbestrol se ha utilizado innumerables veces en estudios con ratas. Una vez que se descubrió que el DES estaba causando cáncer vaginal, comenzaron los experimentos con ratas macho y hembra. [142] A muchas de estas ratas machos se les inyectó DES mientras que a otras ratas machos se les inyectó aceite de oliva, y se las consideró el grupo de control. [142] Cada grupo recibió la misma dosis los mismos días y los investigadores realizaron microscopía óptica, microscopía electrónica y microscopía láser confocal. Tanto con la microscopía electrónica como con la microscopía láser confocal, prevaleció que las células de Sertoli, que son células somáticas donde se desarrollan las espermátidas en los testículos, se formaron 35 días después en las ratas a las que se les inyectó dietilestilbestrol en comparación con las ratas del grupo de control. [142] Al finalizar el ensayo, se entendió que las ratas de mayor edad a las que se les inyectó DES experimentaron un retraso en la maduración de las células de Sertoli, epidídimos subdesarrollados y una disminución drástica de peso en comparación con sus contrapartes. [142]
Las ratas hembra utilizadas eran endogámicas y a la mayoría de ellas se les administró DES combinado en su comida. Estas ratas se dividieron en tres grupos, un grupo que no recibió dietilestilbestrol, un grupo al que se le mezcló DES en su dieta y al tercer grupo al que se le administró DES en su dieta después del día 13 de embarazo. [143] Desafortunadamente, algunas ratas que recibieron DES murieron antes de dar a luz a sus crías. [143] El grupo que recibió DES en su comida durante 13 días mientras estaba embarazada resultó en un aborto prematuro y fracaso en el parto. [143] Estos resultados mostraron que el DES tenía un efecto perjudicial sobre el embarazo cuando se administraba con tanta frecuencia. Proporcionar la dosis de dietilestilbestrol más adelante en el embarazo también hizo visible la aparición de abortos entre las ratas. [143] En general, cualquier interacción con DES en ratas hembras concluyó en que las ratas experimentaran abortos, crecimiento fetal inadecuado y aumento de la esterilidad. [143]
Se realizó una revisión de las personas que habían sido tratadas o expuestas al DES para determinar qué efectos a largo plazo mostrarían. [144] Las personas durante mucho tiempo habían sido tratadas durante el embarazo con DES, y se sabe que la terapia hormonal tiene efectos tóxicos y adversos. "La exposición al DES se ha asociado con un mayor riesgo de cáncer de mama en madres DES (riesgo relativo, <2,0) y con un riesgo de por vida de cáncer cervicovaginal de células claras en hijas DES de 1/1000 a 1/10000". [144] Los efectos secundarios del DES están demostrando ser a largo plazo, ya que puede causar mayores riesgos de cáncer después de su uso. [144] Se seguirá trabajando para ver hasta qué punto llegan los efectos adversos del DES después de una terapia previa y cómo afectará a los hijos y a las madres a largo plazo. [144]
En 1938, la FDA obtuvo por primera vez la capacidad de probar la seguridad del DES en animales. Los resultados de las pruebas preliminares mostraron que el DES daña el sistema reproductivo de los animales. No se pudo determinar la aplicación de estos resultados a humanos, por lo que la FDA no pudo actuar de manera regulatoria. [145]
Las solicitudes de nuevos medicamentos para la aprobación del DES fueron retiradas en 1940 en una decisión tomada por la FDA basada en la incertidumbre científica. Sin embargo, esta decisión generó una importante presión política, por lo que la FDA llegó a un compromiso. El compromiso significó que el DES estaría disponible sólo con receta médica y tendría que tener advertencias sobre sus efectos en el frasco, pero la advertencia se abandonó en 1945. En 1947, el DES finalmente obtuvo la aprobación de la FDA para su prescripción a mujeres embarazadas que tenían diabetes como medicamento. Método para prevenir abortos espontáneos. Esto llevó a la prescripción generalizada de DES a todas las mujeres embarazadas. [145]
En 1971, la FDA desaconsejó la prescripción de DES a mujeres embarazadas. [146] Como resultado, el DES comenzó a retirarse del mercado estadounidense a partir de 1972 y del mercado europeo a partir de 1978, pero la FDA aún no retiró su aprobación para el uso de DES en humanos. [147]
El DES fue clasificado como carcinógeno del Grupo 1 por la Agencia Internacional para la Investigación del Cáncer. Después de clasificarlo como carcinógeno, al DES se le retiró la aprobación de la FDA en 2000. [146] Actualmente, el DES sólo se utiliza en prácticas veterinarias y en ensayos de investigación según lo permitido por la FDA. [148]
La ética médica con respecto a la aprobación y el uso del dietilestilbestrol ha sido descartada debido a las acciones de la FDA y las compañías farmacéuticas que fabricaban DES en el momento de su uso. El vicepresidente de la Asociación Estadounidense de Fabricantes de Medicamentos, Carson Frailey, fue contratado por compañías farmacéuticas que crearon DES para ayudar a que fuera aprobado por la Administración de Alimentos y Medicamentos (FDA). Nancy Langston, autora de The Retreat from Precaution: Regulating Dietilestilbestrol (DES), Endocrine Disruptors, and Environmental Health, afirma que "Frailey convenció a cincuenta y cuatro médicos de todo el país para que escribieran a la FDA, describiendo sus experiencias clínicas con un total de más de cinco mil pacientes, sólo cuatro de estos cincuenta y cuatro médicos consideraron que el DES no debería aprobarse, y el resultado fue que, contra las preocupaciones de muchos miembros del personal médico de la FDA, el jefe de medicamentos de la FDA, Theodore Klumpp, recomendó que la FDA. aprobar DES." [149] Este extracto describe cómo el DES fue aprobado de manera poco ética y muestra que la motivación detrás de su aprobación fue para el beneficio de las compañías farmacéuticas y no para las personas que iban a usar el medicamento. Esta aprobación del DES viola los valores de ética médica, autonomía , no maleficencia , beneficencia y justicia , ya que se pensó poco en cómo afectaría el DES a sus usuarios. [150] Las decisiones tomadas por los líderes de la FDA de aprobar DES sin más estudios y convencer a los médicos de disimular sus opiniones sobre el uso de DES no son éticas. Una vez que se aprobó el DES para el consumo público, las "advertencias [para el DES] estuvieron disponibles sólo en una circular separada que los pacientes no podían ver. Los médicos sólo podían obtener esta circular de advertencia escribiendo a las compañías farmacéuticas y solicitándola. Cartas entre las compañías y la FDA Los reguladores revelan que ambos grupos temían que si una mujer alguna vez viera cuántos riesgos potenciales podría presentar DES, podría negarse a tomar el medicamento, o podría demandar a la compañía y a los médicos que lo recetaron si padecía cáncer o daño hepático después de tomar el medicamento. droga." [149] Las mujeres no fueron informadas sobre los posibles efectos del DES porque los médicos y los reguladores de la FDA temían que el DES fracasara y nunca fuera aprobado, lo que le costaría a las compañías farmacéuticas millones de dólares. El acto de distribuir medicamentos potencialmente peligrosos a los pacientes, independientemente del efecto y daño que pueda causar, únicamente para obtener ganancias monetarias no es ético. [ cita necesaria ]
En la década de 1970, la publicidad negativa que rodeó el descubrimiento de los efectos a largo plazo del DES resultó en una enorme ola de demandas en los Estados Unidos contra sus fabricantes. Estos culminaron en una decisión histórica de 1980 de la Corte Suprema de California , Sindell v. Abbott Laboratories , en la que el tribunal impuso una presunción refutable de responsabilidad por participación de mercado a todos los fabricantes de DES, proporcional a su participación en el mercado en el momento en que se lanzó el medicamento. consumido por la madre de un demandante en particular. [ cita necesaria ]
Eli Lilly, una empresa farmacéutica que fabrica DES, y la Universidad de Chicago, presentaron una demanda contra ellos con respecto a ensayos clínicos de la década de 1950. Tres mujeres presentaron la reclamación de que sus hijas tenían desarrollos de formaciones celulares cervicales anormales, así como anomalías reproductivas en ellas y en sus hijos. [151] Los demandantes habían pedido a los tribunales que certificaran su caso como una demanda colectiva, pero los tribunales los rechazaron. Sin embargo, los tribunales dictaminaron que su caso tenía mérito. El tribunal sostuvo que Eli Lilly tenía el deber de notificar los riesgos del DES una vez que tuvo conocimiento de ellos o debería haberlo conocido. [151] Según la ley de daños de Illinois, para que los demandantes obtengan una recuperación bajo las teorías de incumplimiento del deber de advertir y responsabilidad estricta, los demandantes deben haber alegado daño a sí mismos. En última instancia, bajo sus reclamos de incumplimiento del deber de advertir y responsabilidad estricta debido a que los demandantes citaron riesgo de daño físico a otros, no daño físico a ellos mismos, el caso fue desestimado por los tribunales. [151] Aunque el caso no fue certificado como demanda colectiva y sus reclamos de incumplimiento del deber de advertir y responsabilidad objetiva fueron desestimados, los tribunales no desestimaron las acusaciones de agresión. [151] La cuestión entonces era determinar si la Universidad de Chicago había cometido agresión contra estas mujeres, pero el caso se resolvió antes del juicio. [151] Como parte del acuerdo de conciliación para este caso, Mink v. University of Chicago, los abogados de los demandantes negociaron para que la universidad proporcionara exámenes médicos gratuitos a todos los descendientes expuestos al DES en el útero durante los experimentos de 1950, así como para tratar a las hijas. de cualquier mujer involucrada que desarrolle cáncer vaginal o cervical asociado al DES. [151]
En febrero de 1991, había más de mil acciones legales pendientes contra los fabricantes de DES. [151] Hay más de 300 empresas que fabrican DES según la misma fórmula y la mayor barrera para la recuperación es determinar qué fabricante suministró el medicamento en cada caso particular. [151] Muchos de los casos exitosos se han basado en la responsabilidad conjunta o varias de las partes.
Una demanda fue presentada en el Tribunal Federal de Boston por 53 hijas de DES que dicen que sus cánceres de mama fueron el resultado de que se les recetara DES a sus madres mientras estaban embarazadas de ellas. Sus casos sobrevivieron a una audiencia de Daubert . En 2013, las hermanas Fecho que iniciaron el litigio sobre el vínculo cáncer de mama/DES acordaron un monto de acuerdo no revelado en el segundo día del juicio. Los litigantes restantes han recibido varios acuerdos. [152]
El grupo de defensa DES Action USA ayudó a brindar información y apoyo a las personas expuestas al DES involucradas en demandas. [153]
Alan Turing , el criptógrafo pionero , fundador de la informática y de los ordenadores programables, que también propuso el actual modelo teórico de la morfogénesis biológica , recibió a la fuerza este fármaco para inducir la castración química como "tratamiento" punitivo y desacreditado para el comportamiento homosexual, poco después antes de morir en circunstancias ambiguas. [154]
Al menos en una ocasión en Nueva Zelanda a principios de los años 1960, se prescribió dietilestilbestrol para el "tratamiento" de la homosexualidad. [155]
James Herriot describe un caso relacionado con el tratamiento del tumor testicular de células de Sertoli de un perro pequeño en su libro de 1974 All Things Bright and Beautiful . Herriot decidió prescribir una dosis alta de estilboestrol para el tumor recurrente, con el divertido efecto secundario de que el perro macho se volvió "atractivo para otros perros machos", que siguieron al terrier por el pueblo durante algunas semanas. Herriot comenta en el artículo que sabía que "se decía que el nuevo medicamento tenía un efecto feminizante, pero seguramente no hasta ese punto".
DES ha tenido mucho éxito en el tratamiento de la incontinencia canina femenina derivada del control deficiente de los esfínteres. Todavía está disponible en farmacias de compuestos y, en dosis bajas (1 mg), no tiene las propiedades cancerígenas que eran tan problemáticas en los humanos. [156] Generalmente se administra una vez al día durante siete a diez días y luego una vez por semana según sea necesario. [ cita necesaria ]
El mayor uso del DES fue en la industria ganadera, utilizado para mejorar la conversión alimenticia en carne de vacuno y aves de corral. Durante la década de 1960, el DES se utilizó como hormona del crecimiento en las industrias de la carne vacuna y avícola. Más tarde se descubrió que causaba cáncer en 1971, pero no se eliminó gradualmente hasta 1979. [157] [158] Aunque se descubrió que el DES era dañino para los humanos, su uso veterinario no se detuvo de inmediato. En 2011, el DES todavía se utilizaba como promotor del crecimiento del ganado terrestre o de los peces en algunas partes del mundo, incluida China. [159]
El sulfato de piperazina estrona y el estradiol micronizado fueron equipotentes con respecto a los aumentos de SHBG, mientras que [...] el DES fue 28,4 veces más potente [...]. Con respecto a la disminución de FSH, [...] el DES fue 3,8 veces y el etinilestradiol fue entre 80 y 200 veces más potente que el sulfato de piperazina y estrona. Las dosis equivalentes de etinilestradiol (50 µg) y DES (1 mg) reflejan estas potencias relativas.220 [...] El DES, un potente estrógeno sintético (fig. 6-12), se absorbe bien después de una dosis oral. Los pacientes que recibieron 1 mg de DES al día tuvieron concentraciones plasmáticas a las 20 horas que oscilaron entre 0,9 y 1,9 ng por ml. La vida media inicial del DES es de 80 minutos, con una vida media secundaria de 24 horas.223 Las principales vías del metabolismo son la conversión al glucurónido y la oxidación. Las vías oxidativas incluyen la hidroxilación aromática de las cadenas laterales de etilo y la deshidrogenación a (Z,Z)-dienestrol, produciendo intermediarios transitorios similares a las quinonas que reaccionan con macromoléculas celulares y causan daño genético en las células eucariotas.223 La activación metabólica del DES puede explicar bien su -propiedades cancerígenas establecidas.224
Desde principios de la década de 1940 hasta la de 1970, se administraba DES a mujeres embarazadas para prevenir el aborto espontáneo, que a menudo va precedido de una disminución de los niveles de estrógeno. Más tarde se hizo evidente que el tratamiento con DES era en su mayor parte ineficaz para prevenir el aborto espontáneo [66], pero, aun así, los médicos continuaron prescribiendo DES a las mujeres embarazadas. Un artículo reciente resume los efectos de la exposición materna al DES durante el embarazo y sus efectos adversos sobre el embarazo y el desarrollo fetal en las mujeres [67], y muestra que esta exposición aumentó 3,8 veces el aborto espontáneo en el segundo trimestre.
Hace varias décadas, el dietilestilbestrol (DES) se consideraba eficaz para mejorar los resultados del embarazo. Los datos posteriores no respaldaron esto, y las madres y los hijos expuestos han sufrido una variedad de problemas atribuidos a la droga.
[Dietilestilbestrol] sufre el grave inconveniente de que en dosis superiores a 1 mg. al día es probable que produzca náuseas, vómitos, malestar abdominal, dolor de cabeza y distensión abdominal en una proporción de pacientes que se estima de forma variable entre el 15 y el 50%.
Se ha demostrado que el [dietilestilbestrol], que difiere claramente en su estructura química de los estrógenos conocidos anteriormente, produce todos los efectos biológicos que se les atribuyen, como la supresión del antuitario (2), la inhibición del crecimiento corporal (2), la proliferación del tejido dúctil. sistema mamario (3), supresión de la ingurgitación relacionada con la lactancia (4), hiperemia, edema y distensión del útero (5), proliferación del endometrio (6), cornificación vaginal (7) e hinchazón del sistema sexual. piel (8). También es de suponer que tiene las supuestas propiedades cancerígenas de los estrógenos verdaderos (9).
Después de que Dodds, Goldberg, Lawson y Robinson demostraran que el estilboestrol (4,4' dioxi-α-β-dietilestilbeno tenía los mismos efectos que las estronas naturales en la mucosa vaginal de ratas hembra castradas, han aparecido un gran número de trabajos, que demuestran que esta sustancia, a pesar de su gran diferencia química con las hormonas sexuales femeninas naturales, tiene prácticamente el mismo efecto que éstas en todos los aspectos. Las más importantes de estas investigaciones han sido realizadas por Dodds, Lawson y Noble, por Noble, por Bishop. , Boycott y Zuckermann, de Erik Guldberg, de Engelhardt, de Winterton y MacGregor, de Erik Jacobsen y más recientemente de Kreitmair y Sickman, de Buschbeck y Hausknecht, de Cobet, Ratschow y Stechner. Los experimentos anteriores se realizaron con gallinas y ratones. , ratas, cobayas, conejos, monos y sujetos humanos.
No hay duda de que la transformación del endometrio con inyecciones de preparados de hormonas estrogénicas tanto sintéticas como nativas tiene éxito, pero la opinión sobre si los preparados nativos administrados por vía oral pueden provocar una proliferación mucosa varía entre los diferentes autores. PEDERSEN-BJERGAARD (1939) pudo demostrar que el 90% de la foliculina absorbida en la sangre por la vena porta está inactivada en el hígado. Ni KAUFMANN (1933, 1935), RAUSCHER (1939, 1942) ni HERRNBERGER (1941) lograron que el endometrio de castración proliferara utilizando grandes dosis de preparaciones de estrona o estradiol administradas por vía oral. NEUSTAEDTER (1939), LAUTERWEIN (1940) y FERIN (1941) informan de otros resultados; Con 120-300 estradiol o 380 estrona lograron convertir un endometrio de castración atrófico en una mucosa de proliferación inequívoca.