En los organismos multicelulares , las células madre son células indiferenciadas o parcialmente diferenciadas que pueden transformarse en varios tipos de células y proliferar indefinidamente para producir más de la misma célula madre. Son el tipo de célula más antiguo de un linaje celular . [1] Se encuentran tanto en organismos embrionarios como adultos, pero tienen propiedades ligeramente diferentes en cada uno. Suelen distinguirse de las células progenitoras , que no pueden dividirse indefinidamente, y de las células precursoras o blásticas, que suelen estar comprometidas a diferenciarse en un tipo celular.
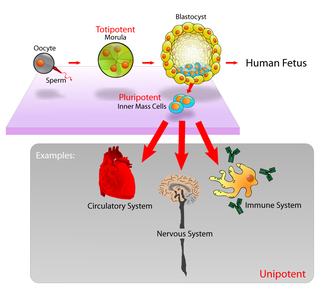
En los mamíferos , aproximadamente entre 50 y 150 células constituyen la masa celular interna durante la etapa de blastocisto del desarrollo embrionario , alrededor de los días 5 a 14. Estos tienen capacidad de células madre. In vivo , eventualmente se diferencian en todos los tipos de células del cuerpo (lo que las convierte en pluripotentes ). Este proceso comienza con la diferenciación en las tres capas germinales ( ectodermo , mesodermo y endodermo ) en la etapa de gastrulación . Sin embargo, cuando se aíslan y se cultivan in vitro , se pueden mantener en la etapa de células madre y se conocen como células madre embrionarias (ESC).
Las células madre adultas se encuentran en algunos lugares selectos del cuerpo, conocidos como nichos , como los de la médula ósea o las gónadas . Existen para reponer los tipos de células que se pierden rápidamente y son multipotentes o unipotentes, lo que significa que sólo se diferencian en unos pocos tipos de células o en un tipo de célula. En los mamíferos, incluyen, entre otras, las células madre hematopoyéticas , que reponen la sangre y las células inmunitarias, las células basales , que mantienen el epitelio de la piel , y las células madre mesenquimales , que mantienen las células óseas, cartilaginosas , musculares y grasas. Las células madre adultas son una pequeña minoría de células; son ampliamente superados en número por las células progenitoras y las células terminalmente diferenciadas en las que se diferencian. [1]
La investigación sobre células madre surgió a partir de los hallazgos de los biólogos canadienses Ernest McCulloch , James Till y Andrew J. Becker en la Universidad de Toronto y el Instituto del Cáncer de Ontario en la década de 1960. [2] [3] A partir de 2016 [actualizar], la única terapia médica establecida que utiliza células madre es el trasplante de células madre hematopoyéticas , [4] realizado por primera vez en 1958 por el oncólogo francés Georges Mathé . Sin embargo, desde 1998 es posible cultivar y diferenciar células madre embrionarias humanas (en líneas de células madre ). El proceso de aislamiento de estas células ha sido controvertido porque normalmente resulta en la destrucción del embrión. Las fuentes para aislar CME han sido restringidas en algunos países europeos y Canadá, pero otros, como el Reino Unido y China, han promovido la investigación. [5] La transferencia nuclear de células somáticas es un método de clonación que se puede utilizar para crear un embrión clonado para el uso de sus células madre embrionarias en la terapia con células madre. [6] En 2006, un equipo japonés dirigido por Shinya Yamanaka descubrió un método para convertir células corporales maduras nuevamente en células madre. Estas se denominaron células madre pluripotentes inducidas (iPSC). [7]
El término célula madre fue acuñado por Theodor Boveri y Valentin Haecker a finales del siglo XIX. [8] Artur Pappenheim , Alexander Maximow y Franz Ernst Christian Neumann realizaron trabajos pioneros sobre la teoría de las células madre sanguíneas a principios del siglo XX . [8]
Las propiedades clave de una célula madre fueron definidas por primera vez por Ernest McCulloch y James Till en la Universidad de Toronto y el Instituto del Cáncer de Ontario a principios de los años 1960. Descubrieron la célula madre formadora de sangre, la célula madre hematopoyética (HSC), gracias a su trabajo pionero en ratones. McCulloch y Till comenzaron una serie de experimentos en los que se inyectaban células de la médula ósea en ratones irradiados. Observaron bultos en el bazo de los ratones que eran linealmente proporcionales al número de células de la médula ósea inyectadas. Plantearon la hipótesis de que cada bulto (colonia) era un clon que surgía de una única célula de la médula (célula madre). En trabajos posteriores, McCulloch y Till, junto con el estudiante graduado Andrew John Becker y el científico Louis Siminovitch , confirmaron que cada bulto surgió de una sola célula. Sus resultados se publicaron en Nature en 1963. Ese mismo año, Siminovitch fue el investigador principal de estudios que encontraron que las células formadoras de colonias eran capaces de autorrenovarse, que es una propiedad clave que define las células madre y que Till y McCulloch habían teorizado. [9]
La primera terapia con células madre fue un trasplante de médula ósea realizado por el oncólogo francés Georges Mathé en 1958 a cinco trabajadores del Instituto Nuclear de Vinča, en Yugoslavia , afectados por un accidente de criticidad . Todos los trabajadores sobrevivieron. [10]
En 1981, los biólogos británicos Martin Evans y Matthew Kaufman aislaron por primera vez células madre embrionarias (ES) y las cultivaron con éxito utilizando blastocistos de ratón . Esto permitió la formación de modelos genéticos murinos, un sistema en el que se eliminan o alteran genes de ratones para estudiar su función en patología. En 1998, las células madre embrionarias humanas fueron aisladas por primera vez por el biólogo estadounidense James Thomson , lo que permitió disponer de nuevos métodos de trasplante o diversos tipos de células para probar nuevos tratamientos. En 2006, el equipo de Shinya Yamanaka en Kioto, Japón, convirtió fibroblastos en células madre pluripotentes modificando la expresión de sólo cuatro genes. La hazaña representa el origen de las células madre pluripotentes inducidas, conocidas como células iPS. [7]
En 2011, una loba de crin , atropellada por un camión, se sometió a un tratamiento con células madre en el Zoológico de Brasilia, siendo este el primer caso registrado del uso de células madre para curar heridas en un animal salvaje. [11] [12]
La definición clásica de célula madre requiere que posea dos propiedades:
Dos mecanismos garantizan que se mantenga una población de células madre (que no disminuya de tamaño):
1. División celular asimétrica : una célula madre se divide en una célula madre, que es idéntica a la célula madre original, y otra célula hija, que se diferencia.
Cuando una célula madre se renueva, se divide y no altera el estado indiferenciado. Esta autorrenovación exige el control del ciclo celular, así como el mantenimiento de la multipotencia o pluripotencia, todo lo cual depende de la célula madre. [13]
2. Diferenciación estocástica: cuando una célula madre crece y se divide en dos células hijas diferenciadas, otra célula madre sufre mitosis y produce dos células madre idénticas a la original.
Las células madre utilizan la telomerasa , una proteína que restaura los telómeros , para proteger su ADN y ampliar su límite de división celular (el límite de Hayflick ). [14]

La potencia especifica el potencial de diferenciación (el potencial de diferenciarse en diferentes tipos de células) de la célula madre. [15]
En la práctica, las células madre se identifican por si pueden regenerar tejido. Por ejemplo, la prueba definitoria para la médula ósea o las células madre hematopoyéticas (HSC) es la capacidad de trasplantar las células y salvar a un individuo sin HSC. Esto demuestra que las células pueden producir nuevas células sanguíneas a largo plazo. También debería ser posible aislar células madre del individuo trasplantado, que a su vez puedan trasplantarse a otro individuo sin HSC, lo que demuestra que la célula madre fue capaz de autorrenovarse.
Las propiedades de las células madre se pueden ilustrar in vitro , utilizando métodos como los ensayos clonogénicos , en los que se evalúa la capacidad de las células individuales para diferenciarse y autorrenovarse. [18] [19] Las células madre también se pueden aislar por la posesión de un conjunto distintivo de marcadores de superficie celular. Sin embargo, las condiciones de cultivo in vitro pueden alterar el comportamiento de las células, lo que no deja claro si las células se comportarán de manera similar in vivo . Existe un debate considerable sobre si algunas poblaciones de células adultas propuestas son verdaderamente células madre. [20]
Las células madre embrionarias (ESC) son las células de la masa celular interna de un blastocisto , formadas antes de su implantación en el útero. [21] En el desarrollo embrionario humano, la etapa de blastocisto se alcanza entre 4 y 5 días después de la fertilización , momento en el que consta de 50 a 150 células. Las CME son pluripotentes y dan origen durante el desarrollo a todos los derivados de las tres capas germinales : ectodermo , endodermo y mesodermo . En otras palabras, pueden convertirse en cada uno de los más de 200 tipos de células del cuerpo adulto cuando se les proporciona la estimulación suficiente y necesaria para un tipo de célula específico. No contribuyen a las membranas extraembrionarias ni a la placenta .
Durante el desarrollo embrionario, las células de la masa celular interna se dividen continuamente y se vuelven más especializadas. Por ejemplo, una porción del ectodermo en la parte dorsal del embrión se especializa como ' neurectodermo ', que se convertirá en el futuro sistema nervioso central . [22] Más adelante en el desarrollo, la neurulación hace que el neurectodermo forme el tubo neural . En la etapa del tubo neural, la porción anterior se somete a encefalización para generar o "modelar" la forma básica del cerebro. En esta etapa de desarrollo, el principal tipo de célula del SNC se considera una célula madre neural .
Las células madre neurales se autorenuevan y, en algún momento, se convierten en células progenitoras gliales radiales (RGP). "Las RGP formadas tempranamente se renuevan por división simétrica para formar un grupo reservorio de células progenitoras ". Estas células pasan a un estado neurogénico y comienzan a dividirse asimétricamente para producir una gran diversidad de muchos tipos diferentes de neuronas, cada una con características de expresión genética, morfológicas y funcionales únicas. El proceso de generación de neuronas a partir de células gliales radiales se llama neurogénesis . La célula glial radial tiene una morfología bipolar distintiva con procesos muy alargados que abarcan todo el espesor de la pared del tubo neural. Comparte algunas características gliales , en particular la expresión de la proteína ácida fibrilar glial (GFAP). [23] [24] La célula glial radial es la célula madre neural primaria del SNC de los vertebrados en desarrollo , y su cuerpo celular reside en la zona ventricular , adyacente al sistema ventricular en desarrollo . Las células madre neurales están comprometidas con los linajes neuronales ( neuronas , astrocitos y oligodendrocitos ) y, por tanto, su potencia está restringida. [22]
Casi todas las investigaciones hasta la fecha han utilizado células madre embrionarias de ratón (mES) o células madre embrionarias humanas (hES) derivadas de la masa celular interna temprana. Ambas tienen las características esenciales de las células madre, pero requieren ambientes muy diferentes para mantener un estado indiferenciado. Las células ES de ratón se cultivan sobre una capa de gelatina como matriz extracelular (como soporte) y requieren la presencia de factor inhibidor de la leucemia (LIF) en el medio sérico. También se ha demostrado que un cóctel de fármacos que contiene inhibidores de GSK3B y de la vía MAPK/ERK , llamado 2i, mantiene la pluripotencia en cultivos de células madre. [25] Las CME humanas se cultivan en una capa alimentadora de fibroblastos embrionarios de ratón y requieren la presencia de un factor de crecimiento de fibroblastos básico (bFGF o FGF-2). [26] Sin condiciones de cultivo óptimas o manipulación genética, [27] las células madre embrionarias se diferenciarán rápidamente.
Una célula madre embrionaria humana también se define por la expresión de varios factores de transcripción y proteínas de la superficie celular. Los factores de transcripción Oct-4 , Nanog y Sox2 forman la red reguladora central que garantiza la supresión de genes que conducen a la diferenciación y el mantenimiento de la pluripotencia. [28] Los antígenos de superficie celular más comúnmente utilizados para identificar las células hES son los antígenos embrionarios 3 y 4 específicos de la etapa de glicolípidos, y los antígenos de sulfato de queratán Tra-1-60 y Tra-1-81. La definición molecular de célula madre incluye muchas más proteínas y sigue siendo un tema de investigación. [29]
Al utilizar células madre embrionarias humanas para producir células especializadas como células nerviosas o cardíacas en el laboratorio, los científicos pueden obtener acceso a células humanas adultas sin tomar tejido de los pacientes. Luego podrán estudiar en detalle estas células adultas especializadas para intentar discernir las complicaciones de las enfermedades o estudiar las reacciones celulares a los nuevos fármacos propuestos.
Debido a sus capacidades combinadas de expansión ilimitada y pluripotencia, las células madre embrionarias siguen siendo una fuente teóricamente potencial para la medicina regenerativa y el reemplazo de tejidos después de una lesión o enfermedad. [30] Sin embargo, actualmente no existen tratamientos aprobados que utilicen células ES. El primer ensayo en humanos fue aprobado por la Administración de Alimentos y Medicamentos de EE. UU. en enero de 2009. [31] Sin embargo, el ensayo en humanos no se inició hasta el 13 de octubre de 2010 en Atlanta para la investigación de lesiones de la médula espinal . El 14 de noviembre de 2011, la empresa que realizaba el ensayo ( Geron Corporation ) anunció que interrumpiría el desarrollo de sus programas de células madre. [32] Diferenciar las células madre embrionarias en células utilizables y al mismo tiempo evitar el rechazo del trasplante son sólo algunos de los obstáculos que aún enfrentan los investigadores de células madre embrionarias. [33] Las células madre embrionarias, al ser pluripotentes, requieren señales específicas para una diferenciación correcta: si se inyectan directamente en otro cuerpo, las células ES se diferenciarán en muchos tipos diferentes de células, causando un teratoma . Las consideraciones éticas relativas al uso de tejido humano no nacido son otra razón de la falta de tratamientos aprobados que utilicen células madre embrionarias. Muchas naciones actualmente tienen moratorias o limitaciones sobre la investigación de células ES humanas o la producción de nuevas líneas de células ES humanas.

Se sabe que las células madre mesenquimales (MSC) o células estromales mesenquimales, también conocidas como células de señalización medicinal, son multipotentes y se pueden encontrar en tejidos adultos, por ejemplo, en el músculo, el hígado, la médula ósea y el tejido adiposo. Las células madre mesenquimales suelen funcionar como soporte estructural en varios órganos como se mencionó anteriormente y controlan el movimiento de sustancias. Las MSC pueden diferenciarse en numerosas categorías celulares, por ejemplo, adipocitos, osteocitos y condrocitos, derivados de la capa mesodérmica. [34] Donde la capa de mesodermo proporciona un aumento a los elementos esqueléticos del cuerpo, como los relacionados con el cartílago o el hueso. El término "meso" significa medio, infusión se originó en el griego y significa que las células mesenquimales pueden moverse y viajar durante el crecimiento embrionario temprano entre las capas ectodérmica y endodérmica. Este mecanismo ayuda a llenar el espacio, por lo que es clave para reparar heridas en organismos adultos que tienen que ver con células mesenquimales en la dermis (piel), hueso o músculo. [35]
Se sabe que las células madre mesenquimales son esenciales para la medicina regenerativa. Se estudian ampliamente en ensayos clínicos . Ya que se aíslan fácilmente y obtienen alto rendimiento, alta plasticidad, lo que los hace capaces de facilitar la inflamación y favorecer el crecimiento celular, la diferenciación celular y la restauración del tejido derivado de la inmunomodulación y la inmunosupresión. Las MSC provienen de la médula ósea, lo que requiere un procedimiento agresivo a la hora de aislar la cantidad y calidad de la célula aislada, y varía según la edad del donante. Al comparar las tasas de MSC en los aspirados de médula ósea y el estroma de la médula ósea, los aspirados tienden a tener tasas más bajas de MSC que el estroma. Se sabe que las MSC son heterogéneas y expresan un alto nivel de marcadores pluripotentes en comparación con otros tipos de células madre, como las células madre embrionarias. [34] La inyección de MSC conduce a la curación de heridas principalmente mediante la estimulación de la angiogénesis. [36]
Las células madre embrionarias (ESC) tienen la capacidad de dividirse indefinidamente manteniendo su pluripotencia , lo que es posible gracias a mecanismos especializados de control del ciclo celular . [37] En comparación con las células somáticas en proliferación , las CME tienen características únicas del ciclo celular, como una rápida división celular causada por una fase G1 acortada, una fase G0 ausente y modificaciones en los puntos de control del ciclo celular , lo que deja a las células principalmente en la fase S en un momento dado. . [37] [38] La rápida división de las CME se demuestra por su corto tiempo de duplicación, que oscila entre 8 y 10 horas, mientras que las células somáticas tienen un tiempo de duplicación de aproximadamente 20 horas o más. [39] A medida que las células se diferencian, estas propiedades cambian: las fases G1 y G2 se alargan, lo que lleva a ciclos de división celular más largos. Esto sugiere que una estructura específica del ciclo celular puede contribuir al establecimiento de la pluripotencia. [37]
Particularmente porque la fase G1 es la fase en la que las células tienen una mayor sensibilidad a la diferenciación, la G1 acortada es una de las características clave de las ESC y juega un papel importante en el mantenimiento del fenotipo indiferenciado . Aunque el mecanismo molecular exacto aún se comprende solo parcialmente, varios estudios han mostrado información sobre cómo las CME progresan a través de G1 (y potencialmente otras fases) con tanta rapidez. [38]
El ciclo celular está regulado por una red compleja de ciclinas , quinasas dependientes de ciclina (Cdk), inhibidores de quinasa dependientes de ciclina (Cdkn), proteínas de bolsillo de la familia del retinoblastoma (Rb) y otros factores accesorios. [39] Se obtuvo información fundamental sobre la regulación distintiva del ciclo celular de las ESC mediante estudios en ESC de ratón (mESC). [38] Las mESC mostraron un ciclo celular con una fase G1 muy abreviada, lo que permitió a las células alternar rápidamente entre la fase M y la fase S. En un ciclo celular somático, la actividad oscilatoria de los complejos Ciclina-Cdk se observa en acción secuencial, que controla reguladores cruciales del ciclo celular para inducir transiciones unidireccionales entre fases: la Ciclina D y Cdk4/6 están activas en la fase G1, mientras que la Ciclina E y Cdk2 están activos durante la fase G1 tardía y la fase S; y la ciclina A y Cdk2 están activas en la fase S y G2, mientras que la ciclina B y Cdk1 están activas en la fase G2 y M. [39] Sin embargo, en las mESC, esta actividad típicamente ordenada y oscilatoria de los complejos ciclina-Cdk está ausente. Más bien, el complejo Ciclina E/Cdk2 es constitutivamente activo durante todo el ciclo, manteniendo la proteína del retinoblastoma (pRb) hiperfosforilada y, por tanto, inactiva. Esto permite una transición directa de la fase M a la fase G1 tardía, lo que lleva a la ausencia de ciclinas de tipo D y, por lo tanto, a una fase G1 más corta. [38] La actividad de Cdk2 es crucial tanto para la regulación del ciclo celular como para las decisiones sobre el destino celular en las mESC; La regulación negativa de la actividad de Cdk2 prolonga la progresión de la fase G1, establece un ciclo celular similar a las células somáticas e induce la expresión de marcadores de diferenciación. [40]
En las ESC humanas (hESC), la duración de G1 se acorta drásticamente. Esto se ha atribuido a los altos niveles de ARNm de los genes ciclina D2 y Cdk4 relacionados con G1 y a los bajos niveles de proteínas reguladoras del ciclo celular que inhiben la progresión del ciclo celular en G1, como p21 CipP1 , p27 Kip1 y p57 Kip2 . [37] [41] Además, los reguladores de la actividad de Cdk4 y Cdk6, como los miembros de la familia de inhibidores Ink (p15, p16, p18 y p19), se expresan en niveles bajos o no se expresan en absoluto. Por lo tanto, al igual que las mESC, las hESC muestran una alta actividad de Cdk, y Cdk2 exhibe la mayor actividad quinasa. También de manera similar a las mESC, las hESC demuestran la importancia de Cdk2 en la regulación de la fase G1 al mostrar que la transición de G1 a S se retrasa cuando se inhibe la actividad de Cdk2 y G1 se detiene cuando se derriba Cdk2. [37] Sin embargo, a diferencia de las mESC, las hESC tienen una fase G1 funcional. Las hESC muestran que las actividades de los complejos Ciclina E/Cdk2 y Ciclina A/Cdk2 dependen del ciclo celular y que el punto de control Rb en G1 es funcional. [39]
Los ESC también se caracterizan por la falta de funcionalidad del punto de control G1, aunque el punto de control G1 es crucial para mantener la estabilidad genómica. En respuesta al daño del ADN , las ESC no se detienen en G1 para reparar los daños del ADN, sino que dependen de los puntos de control S y G2/M o sufren apoptosis. La ausencia del punto de control G1 en las ESC permite la eliminación de células con ADN dañado, evitando así posibles mutaciones debidas a una reparación inexacta del ADN. [37] De acuerdo con esta idea, las ESC son hipersensibles al daño del ADN para minimizar las mutaciones transmitidas a la siguiente generación. [39]
Las células madre primitivas ubicadas en los órganos del feto se denominan células madre fetales. [42]
Hay dos tipos de células madre fetales:
Las células madre adultas, también llamadas células madre somáticas (del griego σωματικóς, "del cuerpo"), son células madre que mantienen y reparan el tejido en el que se encuentran. [44] Se pueden encontrar tanto en niños como en adultos. [45]
Hay tres fuentes accesibles conocidas de células madre adultas autólogas en humanos:
Las células madre también se pueden extraer de la sangre del cordón umbilical justo después del nacimiento. De todos los tipos de células madre, la recolección autóloga implica el menor riesgo. Por definición, las células autólogas se obtienen del propio cuerpo, del mismo modo que uno puede almacenar su propia sangre para procedimientos quirúrgicos electivos. [ cita necesaria ]
Las células madre adultas pluripotentes son raras y generalmente pequeñas en número, pero se pueden encontrar en la sangre del cordón umbilical y otros tejidos. [49] La médula ósea es una rica fuente de células madre adultas, [50] que se han utilizado en el tratamiento de varias afecciones, incluida la cirrosis hepática, [51] la isquemia crónica de las extremidades [52] y la insuficiencia cardíaca terminal. [53] La cantidad de células madre de la médula ósea disminuye con la edad y es mayor en los hombres que en las mujeres durante los años reproductivos. [54] Gran parte de la investigación sobre células madre adultas hasta la fecha ha tenido como objetivo caracterizar su potencia y capacidades de autorrenovación. [55] El daño al ADN se acumula con la edad tanto en las células madre como en las células que componen el entorno de las células madre. Se considera que esta acumulación es responsable, al menos en parte, del aumento de la disfunción de las células madre con el envejecimiento (ver Teoría del envejecimiento del daño al ADN ). [56]
La mayoría de las células madre adultas son de linaje restringido ( multipotentes ) y generalmente se las denomina por su origen tisular ( células madre mesenquimales , células madre derivadas del tejido adiposo, células madre endoteliales , células madre de la pulpa dental , etc.). [57] [58] Las células Muse (células multilinaje que diferencian el estrés y soportan el estrés) son un tipo de células madre pluripotentes recientemente descubiertas que se encuentran en múltiples tejidos adultos, incluidos los fibroblastos adiposos, dérmicos y la médula ósea. Si bien son raras, las células musa son identificables por su expresión de SSEA-3 , un marcador de células madre indiferenciadas, y marcadores generales de células madre mesenquimales como CD90, CD105 . Cuando se someten a un cultivo en suspensión de células individuales, las células generarán grupos que son similares a los cuerpos embrioides en morfología y expresión genética, incluidos los marcadores canónicos de pluripotencia Oct4 , Sox2 y Nanog . [59]
Los tratamientos con células madre adultas se han utilizado con éxito durante muchos años para tratar la leucemia y los cánceres de huesos y sangre relacionados mediante trasplantes de médula ósea. [60] Las células madre adultas también se utilizan en medicina veterinaria para tratar lesiones de tendones y ligamentos en caballos. [61]
El uso de células madre adultas en investigación y terapia no es tan controvertido como el uso de células madre embrionarias , porque la producción de células madre adultas no requiere la destrucción de un embrión . Además, en los casos en que se obtienen células madre adultas del receptor previsto (un autoinjerto ), el riesgo de rechazo es prácticamente inexistente. En consecuencia, el gobierno estadounidense está proporcionando más fondos para la investigación con células madre adultas. [62]
Con la creciente demanda de células madre humanas adultas para fines clínicos y de investigación (normalmente se requieren entre 1 y 5 millones de células por kg de peso corporal por tratamiento), resulta de suma importancia cerrar la brecha entre la necesidad de expandir las células in vitro y y la capacidad de aprovechar los factores que subyacen a la senescencia replicativa. Se sabe que las células madre adultas tienen una vida útil limitada in vitro y entran en senescencia replicativa de manera casi indetectable al comenzar el cultivo in vitro. [63]
Las células madre hematopoyéticas (HSC) son vulnerables a daños y mutaciones en el ADN que aumentan con la edad. [64] Esta vulnerabilidad puede explicar el mayor riesgo de cánceres sanguíneos de crecimiento lento (malignidades mieloides) en los ancianos. [64] Varios factores parecen influir en el envejecimiento de las HSC, incluidas las respuestas a la producción de especies reactivas de oxígeno que pueden causar daños en el ADN y mutaciones genéticas, así como perfiles epigenéticos alterados . [sesenta y cinco]
También llamadas células madre perinatales, estas células madre multipotentes se encuentran en el líquido amniótico y en la sangre del cordón umbilical. Estas células madre son muy activas, se expanden ampliamente sin alimentarse y no son tumorigénicas. Las células madre amnióticas son multipotentes y pueden diferenciarse en células de líneas adipogénicas, osteogénicas, miogénicas, endoteliales, hepáticas y también neuronales. [66] Las células madre amnióticas son un tema de investigación activa.
El uso de células madre del líquido amniótico supera las objeciones éticas al uso de embriones humanos como fuente de células. La enseñanza católica romana prohíbe el uso de células madre embrionarias en experimentación; Por ello, el periódico vaticano " Osservatore Romano " calificó las células madre amnióticas como "el futuro de la medicina". [67]
Es posible recolectar células madre amnióticas para donantes o para uso autólogo: el primer banco de células madre amnióticas de EE. UU. [68] [69] fue inaugurado en 2009 en Medford, MA, por Biocell Center Corporation [70] [71] [72] y colabora con varios hospitales y universidades de todo el mundo. [73]
Las células madre adultas tienen limitaciones en cuanto a su potencia; a diferencia de las células madre embrionarias (ESC), no pueden diferenciarse en células de las tres capas germinales . Como tales, se consideran multipotentes .
Sin embargo, la reprogramación permite la creación de células pluripotentes, células madre pluripotentes inducidas (iPSC), a partir de células adultas. No se trata de células madre adultas, sino de células somáticas (por ejemplo, células epiteliales) reprogramadas para dar lugar a células con capacidades pluripotentes. Utilizando reprogramación genética con factores de transcripción de proteínas , se han derivado células madre pluripotentes con capacidades similares a las ESC. [74] [75] [76] La primera demostración de células madre pluripotentes inducidas fue realizada por Shinya Yamanaka y sus colegas de la Universidad de Kyoto . [77] Utilizaron los factores de transcripción Oct3/4 , Sox2 , c-Myc y Klf4 para reprogramar células de fibroblastos de ratón en células pluripotentes. [74] [78] Trabajos posteriores utilizaron estos factores para inducir pluripotencia en células de fibroblastos humanos. [79] Junying Yu , James Thomson y sus colegas de la Universidad de Wisconsin-Madison utilizaron un conjunto diferente de factores, Oct4, Sox2, Nanog y Lin28, y llevaron a cabo sus experimentos utilizando células del prepucio humano . [74] [80] Sin embargo, pudieron replicar el hallazgo de Yamanaka de que era posible inducir pluripotencia en células humanas.
Las células madre pluripotentes inducidas se diferencian de las células madre embrionarias. Comparten muchas propiedades similares, como la pluripotencia y el potencial de diferenciación, la expresión de genes de pluripotencia , los patrones epigenéticos , la formación de cuerpos embrioides y teratomas , y la formación de quimeras viables , [77] [78] pero existen muchas diferencias dentro de estas propiedades. La cromatina de las iPSC parece estar más "cerrada" o metilada que la de las ESC. [77] [78] De manera similar, el patrón de expresión genética entre ESC e iPSC, o incluso iPSC, proviene de diferentes orígenes. [77] Por lo tanto, existen dudas sobre la "integridad" de la reprogramación y la memoria somática de las células madre pluripotentes inducidas. A pesar de esto, inducir que las células somáticas sean pluripotentes parece viable.
Como resultado del éxito de estos experimentos, Ian Wilmut , que ayudó a crear el primer animal clonado, la oveja Dolly , ha anunciado que abandonará la transferencia nuclear de células somáticas como vía de investigación. [81]
Las IPSC han ayudado significativamente al campo de la medicina al encontrar numerosas formas de curar enfermedades. Desde el IPSCc humano se ha dado la ventaja de realizar modelos in vitro para estudiar toxinas y patogénesis. [82]
Además, las células madre pluripotentes inducidas proporcionan varias ventajas terapéuticas. Al igual que los ESC, son pluripotentes . Tienen, por tanto, un gran potencial de diferenciación; En teoría, podrían producir cualquier célula del cuerpo humano (si la reprogramación a la pluripotencia fuera "completa"). [77] Además, a diferencia de las ESC, potencialmente podrían permitir a los médicos crear una línea de células madre pluripotentes para cada paciente individual. [83] Las muestras de sangre congeladas se pueden utilizar como una fuente valiosa de células madre pluripotentes inducidas. [84] Las células madre específicas de cada paciente permiten detectar efectos secundarios antes del tratamiento farmacológico, así como reducir el riesgo de rechazo del trasplante. [83] A pesar de su uso terapéutico limitado actual, las iPSC tienen un gran potencial para su uso futuro en tratamientos e investigaciones médicas.
Los factores clave que controlan el ciclo celular también regulan la pluripotencia . Por tanto, la manipulación de genes relevantes puede mantener la pluripotencia y reprogramar células somáticas a un estado pluripotente inducido. [39] Sin embargo, la reprogramación de células somáticas suele tener una eficiencia baja y se considera estocástica . [85]
Con la idea de que un ciclo celular más rápido es un componente clave de la pluripotencia, se puede mejorar la eficiencia de la reprogramación. Los métodos para mejorar la pluripotencia mediante la manipulación de reguladores del ciclo celular incluyen: sobreexpresión de ciclina D/Cdk4, fosforilación de Sox2 en S39 y S253, sobreexpresión de ciclina A y ciclina E, eliminación de Rb y eliminación de miembros de la familia Cip/Kip o la familia Tinta. [39] Además, la eficiencia de la reprogramación se correlaciona con el número de divisiones celulares que se produjeron durante la fase estocástica, lo que se sugiere por la creciente ineficiencia de la reprogramación de células más viejas o de buceo lento. [86]
El linaje es un procedimiento importante para analizar embriones en desarrollo. Dado que los linajes celulares muestran la relación entre las células en cada división. Esto ayuda a analizar los linajes de células madre a lo largo del camino, lo que ayuda a reconocer la eficacia, la esperanza de vida y otros factores de las células madre. Con la técnica del linaje celular se pueden analizar genes mutantes en clones de células madre que pueden ayudar en rutas genéticas. Estas vías pueden regular el funcionamiento de las células madre. [87]
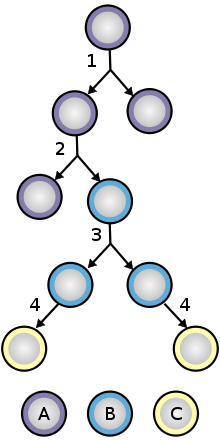
Para garantizar la autorrenovación, las células madre se someten a dos tipos de división celular (consulte el diagrama de división y diferenciación de las células madre ). La división simétrica da lugar a dos células hijas idénticas, ambas dotadas de propiedades de células madre. La división asimétrica, por otro lado, produce sólo una célula madre y una célula progenitora con un potencial de autorrenovación limitado. Los progenitores pueden pasar por varias rondas de división celular antes de diferenciarse terminalmente en una célula madura. Es posible que la distinción molecular entre divisiones simétricas y asimétricas radique en la segregación diferencial de proteínas de la membrana celular (como los receptores ) entre las células hijas. [88]
Una teoría alternativa es que las células madre permanecen indiferenciadas debido a señales ambientales en su nicho particular . Las células madre se diferencian cuando abandonan ese nicho o ya no reciben esas señales. Los estudios en Drosophila germarium han identificado las señales decapentapléjicas y uniones adherentes que impiden que las células madre del germarium se diferencien. [89] [90]
En Estados Unidos, la Orden Ejecutiva 13505 estableció que el dinero federal se puede utilizar para investigaciones en las que se utilicen líneas aprobadas de células madre embrionarias humanas (hESC), pero no se puede utilizar para derivar nuevas líneas. [91] Las Directrices de los Institutos Nacionales de Salud (NIH) sobre investigación de células madre humanas, vigentes a partir del 7 de julio de 2009, implementaron la Orden Ejecutiva 13505 al establecer criterios que las líneas de hESC deben cumplir para ser aprobadas para financiamiento. [92] Se puede acceder en línea al Registro de células madre embrionarias humanas de los NIH, que contiene información actualizada sobre líneas celulares elegibles para recibir financiación de los NIH. [93] Hay 486 líneas aprobadas a enero de 2022. [94]
La terapia con células madre es el uso de células madre para tratar o prevenir una enfermedad o afección. El trasplante de médula ósea es una forma de terapia con células madre que se ha utilizado durante muchos años porque ha demostrado ser eficaz en ensayos clínicos. [95] [96] La implantación de células madre puede ayudar a fortalecer el ventrículo izquierdo del corazón, así como a retener el tejido cardíaco en pacientes que han sufrido ataques cardíacos en el pasado. [97]
Durante más de 90 años, el trasplante de células madre hematopoyéticas (TCMH) se ha utilizado para tratar a personas con afecciones como leucemia y linfoma ; ésta es la única forma ampliamente practicada de terapia con células madre. [95] [98] [99] A partir de 2016 [actualizar], la única terapia establecida que utiliza células madre es el trasplante de células madre hematopoyéticas . [100] Esto generalmente toma la forma de un trasplante de médula ósea , pero las células también pueden derivarse de sangre del cordón umbilical . Se están realizando investigaciones para desarrollar diversas fuentes de células madre, así como para aplicar tratamientos con células madre para enfermedades neurodegenerativas [101] [102] [103] y afecciones como la diabetes y las enfermedades cardíacas .
Los tratamientos con células madre pueden reducir los síntomas de la enfermedad o afección que se está tratando. La reducción de los síntomas puede permitir a los pacientes reducir la ingesta de fármacos para la enfermedad o afección. El tratamiento con células madre también puede proporcionar conocimientos a la sociedad para mejorar la comprensión de las células madre y los tratamientos futuros. [104] El credo de los médicos sería no causar daño, y las células madre lo hacen más simple que nunca. Los procesos quirúrgicos por su carácter son perjudiciales. Es necesario eliminar el tejido para lograr un resultado exitoso. Se pueden prevenir los peligros de las intervenciones quirúrgicas utilizando células madre. Además, existe la posibilidad de que se produzca una enfermedad y, si el procedimiento falla, es posible que se requiera otra cirugía. Los riesgos asociados a la anestesia también pueden eliminarse con células madre. [105] Además de eso, se recolectaron células madre del cuerpo del paciente y se las redistribuyó donde se necesitan. Dado que provienen del propio cuerpo del paciente, a esto se le llama tratamiento autólogo. Se cree que los remedios autólogos son los más seguros porque es probable que la probabilidad de rechazo de la sustancia del donante sea nula.
Los tratamientos con células madre pueden requerir inmunosupresión debido a la necesidad de radiación antes del trasplante para eliminar las células anteriores de la persona, o porque el sistema inmunológico del paciente puede atacar las células madre. Una forma de evitar la segunda posibilidad es utilizar células madre del mismo paciente que está siendo tratado.
La pluripotencia de determinadas células madre también podría dificultar la obtención de un tipo de célula específico. También es difícil obtener el tipo de célula exacto necesario, porque no todas las células de una población se diferencian de manera uniforme. Las células indiferenciadas pueden crear tejidos distintos de los tipos deseados. [106]
Algunas células madre forman tumores después del trasplante; [107] la pluripotencia está relacionada con la formación de tumores, especialmente en células madre embrionarias, células madre fetales propias y células madre pluripotentes inducidas. Las células madre fetales propias forman tumores a pesar de su multipotencia. [108]
También surgen preocupaciones éticas sobre la práctica de utilizar o investigar células madre embrionarias. La recolección de células del blastocisto provoca la muerte del blastocisto. La preocupación es si el blastocisto debe considerarse como una vida humana. [109] El debate sobre esta cuestión es principalmente filosófico, no científico.
El turismo con células madre es la parte de la industria del turismo médico en la que los pacientes viajan para obtener procedimientos con células madre. [110]
Estados Unidos ha tenido una explosión de "clínicas de células madre". [111] Los procedimientos con células madre son muy rentables para las clínicas. La publicidad parece autoritaria, pero la eficacia y seguridad de los procedimientos no está probada. En ocasiones, los pacientes experimentan complicaciones, como tumores espinales [112] y la muerte. El elevado gasto también puede provocar problemas económicos. [112] Según los investigadores, es necesario educar al público, a los pacientes y a los médicos sobre este tema. [113]
Según la Sociedad Internacional para la Investigación de Células Madre , la organización académica más grande que aboga por la investigación con células madre, las terapias con células madre están en desarrollo y aún no se puede decir que estén probadas. [114] [115] Los médicos deben informar a los pacientes que los ensayos clínicos continúan investigando si estas terapias son seguras y efectivas, pero que las clínicas poco éticas las presentan como probadas. [116]
Algunas de las patentes fundamentales que cubren células madre embrionarias humanas son propiedad de la Wisconsin Alumni Research Foundation (WARF): son las patentes 5.843.780, 6.200.806 y 7.029.913 inventadas por James A. Thomson . WARF no aplica estas patentes a los científicos académicos, pero sí a las empresas. [117]
En 2006, la Public Patent Foundation presentó una solicitud a la Oficina de Patentes y Marcas de Estados Unidos (USPTO) para que volviera a examinar las tres patentes en nombre de su cliente, el grupo sin fines de lucro de vigilancia de patentes Consumer Watchdog (anteriormente Foundation for Derechos del Contribuyente y del Consumidor). [117] En el proceso de reexamen, que implica varias rondas de discusión entre la USPTO y las partes, la USPTO inicialmente estuvo de acuerdo con Consumer Watchdog y rechazó todas las reclamaciones en las tres patentes, [118] sin embargo, en respuesta, WARF modificó el reivindicaciones de las tres patentes para hacerlas más limitadas, y en 2008 la USPTO encontró que las reivindicaciones modificadas en las tres patentes eran patentables. La decisión sobre una de las patentes (7.029.913) era apelable, mientras que las decisiones sobre las otras dos no lo eran. [119] [120] Consumer Watchdog apeló la concesión de la patente '913 ante la Junta de Apelaciones e Interferencias de Patentes (BPAI) de la USPTO, que concedió la apelación, y en 2010 la BPAI decidió que las reivindicaciones modificadas de la patente '913 no eran patentable. [121] Sin embargo, WARF pudo reabrir el procesamiento del caso y lo hizo, modificando nuevamente las reivindicaciones de la patente '913 para hacerlas más limitadas, y en enero de 2013 se permitieron las reivindicaciones enmendadas. [122]
En julio de 2013, Consumer Watchdog anunció que apelaría la decisión de permitir las reclamaciones de la patente '913 ante el Tribunal de Apelaciones del Circuito Federal de EE. UU . (CAFC), el tribunal federal de apelaciones que conoce los casos de patentes. [123] En una audiencia celebrada en diciembre de 2013, la CAFC planteó la cuestión de si Consumer Watchdog tenía capacidad legal para apelar; el caso no podría continuar hasta que se resolviera esa cuestión. [124]

Las enfermedades y afecciones en las que se está investigando el tratamiento con células madre incluyen:
Se están realizando investigaciones para desarrollar diversas fuentes de células madre y aplicar tratamientos con células madre para enfermedades y afecciones neurodegenerativas , diabetes , enfermedades cardíacas y otras afecciones. [145] También se están realizando investigaciones para generar organoides utilizando células madre, lo que permitiría una mayor comprensión del desarrollo humano, la organogénesis y el modelado de enfermedades humanas. [146]
En años más recientes, con la capacidad de los científicos para aislar y cultivar células madre embrionarias , y con la creciente capacidad de los científicos para crear células madre utilizando transferencia nuclear de células somáticas y técnicas para crear células madre pluripotentes inducidas , ha surgido controversia , ambas relacionadas con la política del aborto y la clonación humana .
La hepatotoxicidad y la lesión hepática inducida por fármacos representan un número sustancial de fracasos de nuevos fármacos en desarrollo y retirada del mercado, lo que destaca la necesidad de ensayos de detección, como células similares a hepatocitos derivadas de células madre, que sean capaces de detectar la toxicidad en las primeras etapas del fármaco. proceso de desarrollo . [147]
En agosto de 2021, investigadores del Centro Oncológico Princess Margaret de University Health Network publicaron su descubrimiento de un mecanismo de inactividad en células madre clave que podría ayudar a desarrollar tratamientos contra el cáncer en el futuro. [148]