La epigenética del cáncer es el estudio de modificaciones epigenéticas en el ADN de las células cancerosas que no implican un cambio en la secuencia de nucleótidos, sino que implican un cambio en la forma en que se expresa el código genético. Los mecanismos epigenéticos son necesarios para mantener secuencias normales de expresión genética específica de tejido y son cruciales para el desarrollo normal. [1] Pueden ser tan importantes, si no más, que las mutaciones genéticas en la transformación de una célula en cáncer. La alteración de los procesos epigenéticos en los cánceres puede provocar una pérdida de expresión de genes que se produce aproximadamente 10 veces más frecuentemente por silenciamiento de la transcripción (causado por la hipermetilación del promotor epigenético de las islas CpG ) que por mutaciones. Como señalan Vogelstein et al. Como señala, en un cáncer colorrectal generalmente hay alrededor de 3 a 6 mutaciones de conductor y de 33 a 66 mutaciones de autoestopista o pasajero. [2] Sin embargo, en los tumores de colon en comparación con la mucosa colónica adyacente de apariencia normal, hay alrededor de 600 a 800 islas CpG fuertemente metiladas en los promotores de genes en los tumores, mientras que estas islas CpG no están metiladas en la mucosa adyacente. [3] [4] [5] La manipulación de las alteraciones epigenéticas es muy prometedora para la prevención, detección y terapia del cáncer. [6] [7] En diferentes tipos de cáncer, se pueden alterar una variedad de mecanismos epigenéticos, como el silenciamiento de genes supresores de tumores y la activación de oncogenes mediante patrones alterados de metilación de islas CpG , modificaciones de histonas y desregulación de las proteínas de unión al ADN . Hay varios medicamentos que tienen un impacto epigenético y que ahora se utilizan en varias de estas enfermedades.


En las células somáticas, los patrones de metilación del ADN generalmente se transmiten a las células hijas con alta fidelidad. [8] Normalmente, esta metilación sólo se produce en las citosinas que se encuentran en 5' con respecto a la guanosina en los dinucleótidos CpG de eucariotas de orden superior. [9] Sin embargo, la metilación epigenética del ADN difiere entre las células normales y las células tumorales en humanos. El perfil de metilación de CpG "normal" a menudo se invierte en células que se vuelven tumorigénicas. [10] En las células normales, las islas CpG que preceden a los promotores de genes generalmente no están metiladas y tienden a ser transcripcionalmente activas, mientras que otros dinucleótidos CpG individuales en todo el genoma tienden a estar metilados. Sin embargo, en las células cancerosas, las islas CpG que preceden a los promotores de genes supresores de tumores a menudo están hipermetiladas, mientras que la metilación de CpG de las regiones promotoras de oncogenes y las secuencias repetidas parasitarias a menudo está disminuida. [11]
La hipermetilación de las regiones promotoras de genes supresores de tumores puede provocar el silenciamiento de esos genes. Este tipo de mutación epigenética permite que las células crezcan y se reproduzcan sin control, lo que lleva a la tumorigénesis. [10] La adición de grupos metilo a las citosinas hace que el ADN se enrolle firmemente alrededor de las proteínas histonas, lo que da como resultado un ADN que no puede someterse a transcripción (ADN transcripcionalmente silenciado). Los genes que comúnmente se encuentran silenciados transcripcionalmente debido a la hipermetilación del promotor incluyen: inhibidor de la quinasa p16 dependiente de ciclina , un inhibidor del ciclo celular; MGMT , un gen reparador del ADN ; APC , un regulador del ciclo celular; MLH1 , un gen de reparación del ADN; y BRCA1 , otro gen de reparación del ADN. [10] [12] De hecho, las células cancerosas pueden volverse adictas al silenciamiento transcripcional, debido a la hipermetilación del promotor, de algunos genes supresores de tumores clave, un proceso conocido como adicción epigenética. [13]
La hipometilación de dinucleótidos CpG en otras partes del genoma conduce a la inestabilidad cromosómica debido a mecanismos como la pérdida de impronta y la reactivación de elementos transponibles . [14] [15] [16] [17] La pérdida de impronta del gen del factor de crecimiento similar a la insulina (IGF2) aumenta el riesgo de cáncer colorrectal y se asocia con el síndrome de Beckwith-Wiedemann, que aumenta significativamente el riesgo de cáncer en los recién nacidos. [18] En las células sanas, los dinucleótidos CpG de densidades más bajas se encuentran dentro de regiones intergénicas codificantes y no codificantes . La expresión de algunas secuencias repetitivas y la recombinación meiótica en los centrómeros se reprimen mediante la metilación [19]
El genoma completo de una célula cancerosa contiene significativamente menos metilcitosina que el genoma de una célula sana. De hecho, los genomas de las células cancerosas tienen entre un 20% y un 50% menos de metilación en los dinucleótidos CpG individuales en todo el genoma. [14] [15] [16] [17] Las islas CpG que se encuentran en las regiones promotoras generalmente están protegidas de la metilación del ADN. En las células cancerosas, las islas CpG están hipometiladas [20] Las regiones que flanquean las islas CpG llamadas costas de islas CpG son donde ocurre la mayor parte de la metilación del ADN en el contexto del dinucleótido CpG. Las células cancerosas se metilan con deferencia en las costas de las islas CpG. En las células cancerosas, la hipermetilación en las costas de las islas CpG se mueve hacia las islas CpG, o la hipometilación de las islas CpG se mueve hacia las costas de las islas CpG, eliminando límites epigenéticos definidos entre estos elementos genéticos. [21] En las células cancerosas, la "hipometilación global" debido a la alteración de las metiltransferasas del ADN (DNMT) puede promover la recombinación mitótica y el reordenamiento cromosómico , lo que en última instancia resulta en aneuploidía cuando los cromosomas no se separan adecuadamente durante la mitosis . [14] [15] [16] [17]
La metilación de la isla CpG es importante en la regulación de la expresión genética, pero la metilación de la citosina puede conducir directamente a mutaciones genéticas desestabilizadoras y a un estado celular precanceroso. Las citosinas metiladas favorecen la hidrólisis del grupo amina y la conversión espontánea a timina . Pueden provocar un reclutamiento aberrante de proteínas de la cromatina . Las metilaciones de citosina cambian la cantidad de absorción de luz ultravioleta de la base de nucleótidos, creando dímeros de pirimidina . Cuando la mutación produce una pérdida de heterocigosidad en los sitios de los genes supresores de tumores, estos genes pueden volverse inactivos. Las mutaciones de un solo par de bases durante la replicación también pueden tener efectos perjudiciales. [12]
El ADN eucariota tiene una estructura compleja. Generalmente se envuelve alrededor de proteínas especiales llamadas histonas para formar una estructura llamada nucleosoma . Un nucleosoma consta de 2 conjuntos de 4 histonas: H2A , H2B , H3 y H4 . Además, la histona H1 contribuye al empaquetamiento del ADN fuera del nucleosoma. Ciertas enzimas modificadoras de histonas pueden agregar o eliminar grupos funcionales de las histonas, y estas modificaciones influyen en el nivel de transcripción de los genes que rodean esas histonas y en el nivel de replicación del ADN. Los perfiles de modificación de histonas de células sanas y cancerosas tienden a diferir.
En comparación con las células sanas, las células cancerosas presentan una disminución de las formas monoacetiladas y trimetiladas de histona H4 (disminución de H4ac y H4me3). [22] Además, los modelos de ratón han demostrado que una disminución en la dimetilación asimétrica de la histona H4R3 (H4R3me2a) del promotor p19ARF se correlaciona con casos más avanzados de tumorigénesis y metástasis. [23] En modelos de ratón, la pérdida de acetilación y trimetilación de la histona H4 aumenta a medida que continúa el crecimiento del tumor. [22] Pérdida de acetilación de la histona H4 Lisina 16 ( H4K16ac ), que es una marca de envejecimiento en los telómeros , específicamente pierde su acetilación. Algunos científicos esperan que esta pérdida particular de acetilación de histonas pueda combatirse con un inhibidor de histona desacetilasa (HDAC) específico para SIRT1 , un HDAC específico para H4K16. [10] [24]
Otras marcas de histonas asociadas con la tumorigénesis incluyen un aumento de la desacetilación (disminución de la acetilación) de las histonas H3 y H4, una disminución de la trimetilación de la histona H3 lisina 4 ( H3K4me3 ) y una mayor monometilación de la histona H3 lisina 9 (H3K9me1) y trimetilación de la histona H3 lisina 27 ( H3K27me3 ). ). Estas modificaciones de las histonas pueden silenciar los genes supresores de tumores a pesar de la caída en la metilación de la isla CpG del gen (un evento que normalmente activa los genes). [25] [26]
Algunas investigaciones se han centrado en bloquear la acción de BRD4 sobre las histonas acetiladas, lo que ha demostrado aumentar la expresión de la proteína Myc , implicada en varios cánceres. El proceso de desarrollo del fármaco que se une a BRD4 es digno de mención por el enfoque colaborativo y abierto que está adoptando el equipo. [27]
El gen supresor de tumores p53 regula la reparación del ADN y puede inducir la apoptosis en células desreguladas. E Soto-Reyes y F Recillas-Targa dilucidaron la importancia de la proteína CTCF en la regulación de la expresión de p53. [28] CTCF, o factor de unión CCCTC, es una proteína con dedos de zinc que aísla al promotor p53 de la acumulación de marcas de histonas represivas. En ciertos tipos de células cancerosas, la proteína CTCF no se une normalmente y el promotor p53 acumula marcas de histonas represivas, lo que hace que la expresión de p53 disminuya. [28]
También pueden ocurrir mutaciones en la propia maquinaria epigenética, potencialmente responsables de los cambios en los perfiles epigenéticos de las células cancerosas. Las variantes de histonas de la familia H2A están altamente conservadas en los mamíferos y desempeñan funciones críticas en la regulación de muchos procesos nucleares mediante la alteración de la estructura de la cromatina . Una de las variantes clave de H2A, H2A.X, marca el daño del ADN, facilitando el reclutamiento de proteínas reparadoras del ADN para restaurar la integridad genómica. Otra variante, H2A.Z, juega un papel importante tanto en la activación como en la represión genética. En muchos cánceres se detecta un alto nivel de expresión de H2A.Z y se asocia significativamente con la proliferación celular y la inestabilidad genómica. [11] La variante de histona macroH2A1 es importante en la patogénesis de muchos tipos de cánceres, por ejemplo en el carcinoma hepatocelular. [29] Otros mecanismos incluyen una disminución en H4K16ac que puede ser causada por una disminución en la actividad de una histona acetiltransferasa (HAT) o un aumento en la desacetilación por SIRT1. [10] Asimismo, una mutación inactivadora del marco de lectura en HDAC2 , una histona desacetilasa que actúa sobre muchas lisinas de cola de histonas , se ha asociado con cánceres que muestran patrones alterados de acetilación de histonas. [30] Estos hallazgos indican un mecanismo prometedor para alterar los perfiles epigenéticos mediante inhibición o mejora enzimática. Un nuevo campo emergente que captura los cambios epigenéticos toxicológicos como resultado de la exposición a diferentes compuestos (fármacos, alimentos y medio ambiente) es la toxicoepigenética. En este campo, existe un interés creciente en mapear los cambios en las modificaciones de las histonas y sus posibles consecuencias. [31]
El daño al ADN , causado por la luz ultravioleta, la radiación ionizante , las toxinas ambientales y las sustancias químicas metabólicas, también puede provocar inestabilidad genómica y cáncer. La respuesta al daño del ADN a las roturas del ADN de doble cadena (DSB) está mediada en parte por modificaciones de las histonas. En un DSB, el complejo proteico MRE11 - RAD50 - NBS1 (MRN) recluta la quinasa mutada de ataxia telangiectasia (ATM) que fosforila la serina 129 de la histona 2A. MDC1, mediador del punto de control 1 del daño del ADN, se une al fosfopéptido y la fosforilación de H2AX puede propagarse mediante un circuito de retroalimentación positiva del reclutamiento y la fosforilación de MRN-ATM. TIP60 acetila el γH2AX, que luego se poliubiquitila. RAP80, una subunidad del complejo proteico de susceptibilidad al cáncer de mama tipo 1 de reparación del ADN ( BRCA1 -A), se une a la ubiquitina unida a las histonas. La actividad de BRCA1-A detiene el ciclo celular en el punto de control G2/M , dando tiempo para la reparación del ADN o se puede iniciar la apoptosis . [32]
En los mamíferos, los microARN (miARN) regulan aproximadamente el 60% de la actividad transcripcional de los genes que codifican proteínas. [33] Algunos miARN también sufren silenciamiento asociado a la metilación en las células cancerosas. [34] [35] Let-7 y miR15/16 desempeñan funciones importantes en la regulación negativa de los oncogenes RAS y BCL2 , y su silenciamiento se produce en las células cancerosas. [18] Se observó una disminución de la expresión de miR-125b1, un miARN que funciona como supresor de tumores , en cánceres de próstata, ovario , mama y células gliales . Los experimentos in vitro han demostrado que miR-125b1 se dirige a dos genes, HER2/neu y ESR1 , que están relacionados con el cáncer de mama. La metilación del ADN, específicamente la hipermetilación, es una de las principales formas en que se silencia epigenéticamente el miR-125b1. En pacientes con cáncer de mama, se observó hipermetilación de las islas CpG ubicadas proximales al sitio de inicio de la transcripción. La pérdida de unión a CTCF y un aumento en las marcas de histonas represivas, H3K9me3 y H3K27me3, se correlacionan con la metilación del ADN y el silenciamiento de miR-125b1. Mecánicamente, CTCF puede funcionar como un elemento límite para detener la propagación de la metilación del ADN. Los resultados de los experimentos realizados por Soto-Reyes et al. [36] indican un efecto negativo de la metilación en la función y expresión de miR-125b1. Por lo tanto, concluyeron que la metilación del ADN contribuye al silenciamiento del gen. Además, algunos miARN se silencian epigenéticamente en las primeras etapas del cáncer de mama y, por lo tanto, estos miARN podrían ser útiles como marcadores tumorales. [36] El silenciamiento epigenético de genes de miARN por metilación aberrante del ADN es un evento frecuente en las células cancerosas; Casi un tercio de los promotores de miARN activos en células mamarias normales se encontraron hipermetilados en células de cáncer de mama, es decir, una proporción varias veces mayor que la que normalmente se observa en los genes que codifican proteínas. [37]
La desregulación del metabolismo permite que las células tumorales generen los componentes básicos necesarios, así como que modulen las marcas epigenéticas para respaldar el inicio y la progresión del cáncer. Los cambios metabólicos inducidos por el cáncer alteran el paisaje epigenético, especialmente las modificaciones en las histonas y el ADN, promoviendo así la transformación maligna, la adaptación a una nutrición inadecuada y la metástasis. Para satisfacer las demandas biosintéticas de las células cancerosas, las vías metabólicas se alteran mediante la manipulación simultánea de oncogenes y genes supresores de tumores. [38] La acumulación de ciertos metabolitos en el cáncer puede apuntar a enzimas epigenéticas para alterar globalmente el panorama epigenético. Los cambios metabólicos relacionados con el cáncer conducen a una recodificación de marcas epigenéticas específicas del locus. La epigenética del cáncer puede reprogramarse con precisión mediante el metabolismo celular a través de 1) modulación de la epigenética del cáncer en respuesta a la dosis mediante metabolitos; 2) reclutamiento de enzimas metabólicas específico de secuencia; y 3) dirección de enzimas epigenéticas mediante señales nutricionales. [38] Además de modular la programación metabólica a nivel molecular, existen factores microambientales que pueden influir y afectar la recodificación metabólica. Estas influencias incluyen la respuesta nutricional, inflamatoria e inmune de los tejidos malignos.
El daño al ADN parece ser la principal causa subyacente del cáncer. [39] [40] Si la reparación del ADN es deficiente, el daño del ADN tiende a acumularse. Tal daño excesivo en el ADN puede aumentar los errores mutacionales durante la replicación del ADN debido a la síntesis de translesiones propensa a errores . El exceso de daño en el ADN también puede aumentar las alteraciones epigenéticas debido a errores durante la reparación del ADN. [41] [42] Tales mutaciones y alteraciones epigenéticas pueden dar lugar a cáncer (ver neoplasias malignas ).
Las mutaciones de la línea germinal en los genes reparadores del ADN causan sólo del 2 al 5% de los casos de cáncer de colon . [43] Sin embargo, la expresión alterada de microARN, que causa deficiencias en la reparación del ADN, se asocia frecuentemente con cánceres y puede ser un factor causal importante para estos cánceres.
La sobreexpresión de ciertos miARN puede reducir directamente la expresión de proteínas reparadoras del ADN específicas. Wan et al. [44] se refirió a 6 genes de reparación del ADN a los que se dirigen directamente los miARN indicados entre paréntesis: ATM (miR-421), RAD52 (miR-210, miR-373), RAD23B (miR-373), MSH2 (miR-21 ), BRCA1 (miR-182) y P53 (miR-504, miR-125b). Más recientemente, Tessitore et al. [45] enumeraron otros genes de reparación del ADN a los que se dirigen directamente miARN adicionales, incluidos ATM (miR-18a, miR-101), DNA-PK (miR-101), ATR (miR-185), Wip1 (miR-16). , MLH1, MSH2 y MSH6 (miR-155), ERCC3 y ERCC4 (miR-192) y UNG2 (mir-16, miR-34c y miR-199a). De estos miARN, miR-16, miR-18a, miR-21, miR-34c, miR-125b, miR-101, miR-155, miR-182, miR-185 y miR-192 se encuentran entre los identificados por Schnekenburger y Diederich [46] está sobreexpresado en el cáncer de colon mediante hipometilación epigenética. La sobreexpresión de cualquiera de estos miARN puede provocar una expresión reducida de su gen de reparación del ADN diana.
Hasta el 15% de las deficiencias de MLH1 en cánceres de colon esporádicos parecían deberse a la sobreexpresión del microARN miR-155 , que reprime la expresión de MLH1. [47] Sin embargo, se encontró que la mayoría de los 68 cánceres de colon esporádicos con expresión reducida de la proteína de reparación de errores de coincidencia de ADN MLH1 eran deficientes debido a la metilación epigenética de la isla CpG del gen MLH1 . [48]
En el 28% de los glioblastomas, la proteína reparadora del ADN MGMT es deficiente pero el promotor MGMT no está metilado. [49] En los glioblastomas sin promotores MGMT metilados , el nivel de microARN miR-181d se correlaciona inversamente con la expresión de proteínas de MGMT y el objetivo directo de miR-181d es el ARNm 3'UTR de MGMT (las tres principales regiones no traducidas del ARNm de MGMT). ). [49] Por lo tanto, en 28 % de los glioblastomas, el aumento de la expresión de miR-181d y la reducción de la expresión de la enzima reparadora del ADN MGMT pueden ser un factor causal. En 29 a 66% [49] [50] de los glioblastomas , la reparación del ADN es deficiente debido a la metilación epigenética del gen MGMT , que reduce la expresión proteica de MGMT.
Las proteínas del grupo A de alta movilidad ( HMGA ), caracterizadas por un gancho AT , son proteínas pequeñas, no histonas, asociadas a la cromatina que pueden modular la transcripción. Los microARN controlan la expresión de las proteínas HMGA , y estas proteínas ( HMGA1 y HMGA2 ) son elementos arquitectónicos que controlan la transcripción de la cromatina. Palmieri et al. [51] demostraron que, en tejidos normales, los genes HGMA1 y HMGA2 son atacados (y por lo tanto su expresión está fuertemente reducida) por miR-15 , miR-16 , miR-26a , miR-196a2 y Let-7a .
La expresión de HMGA es casi indetectable en tejidos adultos diferenciados, pero está elevada en muchos cánceres. Las proteínas HGMA son polipéptidos de ~100 residuos de aminoácidos caracterizados por una organización de secuencia modular. Estas proteínas tienen tres regiones altamente cargadas positivamente, denominadas ganchos AT , que se unen al surco menor de tramos de ADN ricos en AT en regiones específicas del ADN. Las neoplasias humanas, incluidos el carcinoma de tiroides, próstata, cuello uterino, colorrectal, páncreas y ovario, muestran un fuerte aumento de las proteínas HMGA1a y HMGA1b. [52] Los ratones transgénicos con HMGA1 dirigido a células linfoides desarrollan un linfoma agresivo, lo que demuestra que la expresión alta de HMGA1 no solo está asociada con cánceres, sino que el gen HMGA1 puede actuar como un oncogén para causar cáncer. [53] Baldassarre et al., [54] demostraron que la proteína HMGA1 se une a la región promotora del gen de reparación del ADN BRCA1 e inhibe la actividad del promotor BRCA1 . También demostraron que, si bien solo el 11 % de los tumores de mama tenían hipermetilación del gen BRCA1 , el 82 % de los cánceres de mama agresivos tienen una expresión baja de la proteína BRCA1, y la mayoría de estas reducciones se debieron a la remodelación de la cromatina por altos niveles de proteína HMGA1.
La proteína HMGA2 se dirige específicamente al promotor de ERCC1 , reduciendo así la expresión de este gen reparador del ADN. [55] La expresión de la proteína ERCC1 fue deficiente en el 100 % de los 47 cánceres de colon evaluados (aunque se desconoce hasta qué punto estuvo involucrado HGMA2). [56]
Palmieri et al. [51] demostraron que cada uno de los miARN que se dirigen a los genes HMGA se reduce drásticamente en casi todos los adenomas hipofisarios humanos estudiados, en comparación con la glándula pituitaria normal. De acuerdo con la regulación negativa de estos miARN dirigidos a HMGA, se observó un aumento en los ARNm específicos de HMGA1 y HMGA2. Tres de estos microARN (miR-16, miR-196a y Let-7a) [46] [57] tienen promotores metilados y, por tanto, baja expresión en el cáncer de colon. Para dos de ellos, miR-15 y miR-16, las regiones codificantes están silenciadas epigenéticamente en el cáncer debido a la actividad de la histona desacetilasa . [58] Cuando estos microARN se expresan en un nivel bajo, las proteínas HMGA1 y HMGA2 se expresan en un nivel alto. HMGA1 y HMGA2 se dirigen (reducen la expresión de) los genes de reparación del ADN BRCA1 y ERCC1 . Por tanto, la reparación del ADN puede reducirse, lo que probablemente contribuya a la progresión del cáncer. [40]
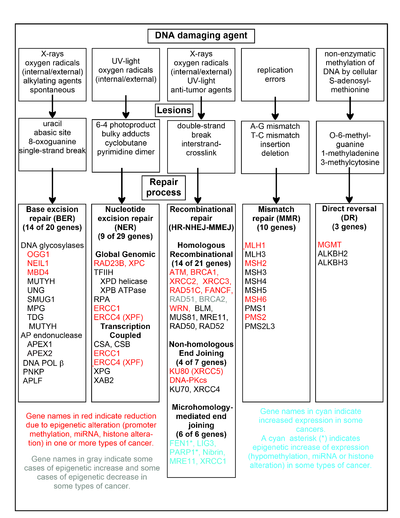
El cuadro de esta sección muestra algunos agentes que dañan el ADN con frecuencia, ejemplos de lesiones del ADN que causan y las vías que se ocupan de estos daños en el ADN. Al menos 169 enzimas se emplean directamente en la reparación del ADN o influyen en los procesos de reparación del ADN. [59] De estos, 83 se emplean directamente en la reparación de los cinco tipos de daños en el ADN ilustrados en el cuadro.
En el cuadro se muestran algunos de los genes mejor estudiados y fundamentales para estos procesos de reparación. Las designaciones de genes que se muestran en rojo, gris o cian indican genes frecuentemente alterados epigenéticamente en varios tipos de cáncer. Los artículos de Wikipedia sobre cada uno de los genes resaltados en rojo, gris o cian describen las alteraciones epigenéticas y los cánceres en los que se encuentran estas epimutaciones. Dos amplios artículos de encuestas experimentales [60] [61] también documentan la mayoría de estas deficiencias epigenéticas en la reparación del ADN en los cánceres.
Los genes resaltados en rojo con frecuencia se reducen o silencian mediante mecanismos epigenéticos en varios tipos de cáncer. Cuando estos genes tienen una expresión baja o nula, se pueden acumular daños en el ADN. Los errores de replicación más allá de estos daños (ver síntesis de translesión ) pueden provocar un aumento de mutaciones y, en última instancia, cáncer. La represión epigenética de los genes de reparación del ADN en vías precisas de reparación del ADN parece ser fundamental para la carcinogénesis .
Los dos genes resaltados en gris, RAD51 y BRCA2 , son necesarios para la reparación recombinacional homóloga . A veces se sobreexpresan epigenéticamente y a veces se subexpresan en ciertos cánceres. Como se indica en los artículos de Wikipedia sobre RAD51 y BRCA2 , estos cánceres normalmente tienen deficiencias epigenéticas en otros genes de reparación del ADN. Estas deficiencias en la reparación probablemente provocarían un aumento de los daños no reparados en el ADN. La sobreexpresión de RAD51 y BRCA2 observada en estos cánceres puede reflejar presiones selectivas para la sobreexpresión compensatoria de RAD51 o BRCA2 y una mayor reparación recombinante homóloga para abordar al menos parcialmente dichos daños excesivos en el ADN. En aquellos casos en los que RAD51 o BRCA2 están subexpresados, esto conduciría a un aumento de los daños no reparados en el ADN. Los errores de replicación más allá de estos daños (ver síntesis de translesiones ) podrían causar un aumento de mutaciones y cáncer, por lo que la subexpresión de RAD51 o BRCA2 sería cancerígena en sí misma.
Los genes resaltados en cian se encuentran en la vía de unión de extremos mediada por microhomología (MMEJ) y están regulados positivamente en el cáncer. MMEJ es una vía de reparación imprecisa adicional propensa a errores para roturas de doble cadena. En la reparación MMEJ de una rotura de doble cadena, una homología de 5 a 25 pares de bases complementarias entre ambas cadenas emparejadas es suficiente para alinear las cadenas, pero generalmente hay extremos no coincidentes (flaps). MMEJ elimina los nucleótidos adicionales (flaps) donde se unen las hebras y luego liga las hebras para crear una doble hélice de ADN intacta. MMEJ casi siempre implica al menos una pequeña deleción, por lo que es una vía mutagénica. [62] FEN1 , la endonucleasa del colgajo en MMEJ, aumenta epigenéticamente mediante la hipometilación del promotor y se sobreexpresa en la mayoría de los cánceres de mama, [63] próstata, [64] estómago, [65] [66] neuroblastomas, [ 67] páncreas, [68] y pulmón. [69] PARP1 también se sobreexpresa cuando el sitio ETS de su región promotora está epigenéticamente hipometilado, y esto contribuye a la progresión a cáncer de endometrio, [70] cáncer de ovario con mutación BRCA, [71] y cáncer de ovario seroso con mutación BRCA. [72] Otros genes de la vía MMEJ también se sobreexpresan en varios tipos de cáncer (consulte MMEJ para obtener un resumen) y también se muestran en azul.
Las deficiencias en las proteínas reparadoras del ADN que funcionan en vías precisas de reparación del ADN aumentan el riesgo de mutación. Las tasas de mutación aumentan considerablemente en células con mutaciones en la reparación de errores de coincidencia del ADN [73] [74] o en la reparación recombinacional homóloga (HRR). [75] Las personas con mutaciones hereditarias en cualquiera de los 34 genes de reparación del ADN tienen un mayor riesgo de cáncer (consulte Defectos de reparación del ADN y mayor riesgo de cáncer ).
En los cánceres esporádicos, ocasionalmente se encuentra que una deficiencia en la reparación del ADN se debe a una mutación en un gen de reparación del ADN, pero con mucha más frecuencia la expresión reducida o ausente de los genes de reparación del ADN se debe a alteraciones epigenéticas que reducen o silencian la expresión génica. Por ejemplo, de 113 cánceres colorrectales examinados en secuencia, solo cuatro tenían una mutación sin sentido en el gen de reparación del ADN MGMT , mientras que la mayoría tenía una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética). [76] De manera similar, de 119 casos de cánceres colorrectales con reparación deficiente de coincidencias que carecían de expresión del gen de reparación del ADN PMS2 , la proteína PMS2 fue deficiente en 6 debido a mutaciones en el gen PMS2 , mientras que en 103 casos la expresión de PMS2 fue deficiente debido a que su pareja de emparejamiento MLH1 fue reprimido debido a la metilación del promotor (la proteína PMS2 es inestable en ausencia de MLH1). [48] En los otros 10 casos, la pérdida de expresión de PMS2 probablemente se debió a la sobreexpresión epigenética del microARN, miR-155, que regula negativamente MLH1. [47]
Los defectos epigenéticos en los genes de reparación del ADN son frecuentes en los cánceres. En la tabla, se evaluaron múltiples cánceres para determinar la expresión reducida o ausente del gen de reparación del ADN de interés, y la frecuencia que se muestra es la frecuencia con la que los cánceres tenían una deficiencia epigenética de la expresión genética. Es probable que tales deficiencias epigenéticas surjan temprano en la carcinogénesis , ya que también se encuentran con frecuencia (aunque con una frecuencia algo menor) en el defecto de campo que rodea al cáncer del cual probablemente surgió (ver Tabla).
Parece que los cánceres frecuentemente pueden iniciarse por una reducción epigenética en la expresión de una o más enzimas reparadoras del ADN. La reparación reducida del ADN probablemente permita la acumulación de daños en el ADN. La síntesis de translesiones propensa a errores más allá de algunos de estos daños en el ADN puede dar lugar a una mutación con una ventaja selectiva. "Un parche clonal con una ventaja selectiva puede crecer y competir con las células vecinas, formando un defecto de campo ". Si bien no existe una ventaja selectiva obvia para una célula que tenga una reparación reducida del ADN, la epimutación del gen de reparación del ADN puede llevarse como pasajero cuando las células con la mutación selectivamente ventajosa se replican. En las células que portan tanto la epimutación del gen reparador del ADN como la mutación con ventaja selectiva, se acumularán más daños en el ADN, que a su vez podrían dar lugar a nuevas mutaciones con ventajas selectivas aún mayores. Por tanto, los defectos epigenéticos en la reparación del ADN pueden contribuir a la alta frecuencia característica de mutaciones en los genomas de los cánceres y provocar su progresión cancerígena.
Los cánceres tienen altos niveles de inestabilidad genómica , asociados con una alta frecuencia de mutaciones . Una alta frecuencia de mutaciones genómicas aumenta la probabilidad de que se produzcan mutaciones particulares que activen oncogenes e inactiven genes supresores de tumores, lo que conduce a la carcinogénesis . Sobre la base de la secuenciación del genoma completo , se descubre que los cánceres tienen entre miles y cientos de miles de mutaciones en todo su genoma. [87] (Consulte también Frecuencias de mutación en cánceres ). En comparación, la frecuencia de mutación en todo el genoma entre generaciones de humanos (de padres a hijos) es de aproximadamente 70 nuevas mutaciones por generación. [88] [89] En las regiones codificantes de proteínas del genoma, hay solo alrededor de 0,35 mutaciones entre generaciones de padres e hijos (menos de una proteína mutada por generación). [90] La secuenciación del genoma completo en células sanguíneas de un par de gemelos idénticos centenarios de 100 años solo encontró 8 diferencias somáticas, aunque la variación somática que ocurre en menos del 20% de las células sanguíneas no se detectaría. [91]
Si bien los daños en el ADN pueden dar lugar a mutaciones a través de una síntesis de translesiones propensa a errores , los daños en el ADN también pueden dar lugar a alteraciones epigenéticas durante procesos defectuosos de reparación del ADN. [41] [42] [92] [93] Los daños en el ADN que se acumulan debido a defectos epigenéticos en la reparación del ADN pueden ser una fuente del aumento de las alteraciones epigenéticas que se encuentran en muchos genes de los cánceres. En un estudio inicial, que analizó un conjunto limitado de promotores transcripcionales, Fernández et al. [94] examinaron los perfiles de metilación del ADN de 855 tumores primarios. Al comparar cada tipo de tumor con su correspondiente tejido normal, 729 sitios de islas CpG (55% de los 1322 sitios CpG evaluados) mostraron metilación diferencial del ADN. De estos sitios, 496 estaban hipermetilados (reprimidos) y 233 hipometilados (activados). Por tanto, existe un alto nivel de alteraciones de la metilación del promotor epigenético en los tumores. Algunas de estas alteraciones epigenéticas pueden contribuir a la progresión del cáncer.
Una variedad de compuestos se consideran carcinógenos epigenéticos : dan como resultado una mayor incidencia de tumores, pero no muestran actividad mutágena (también deben excluirse los compuestos tóxicos o patógenos que causan tumores relacionados con una mayor regeneración). Los ejemplos incluyen dietilestilbestrol , arsenito , hexaclorobenceno y compuestos de níquel .
Muchos teratógenos ejercen efectos específicos sobre el feto mediante mecanismos epigenéticos. [95] [96] Si bien los efectos epigenéticos pueden preservar el efecto de un teratógeno como el dietilestilbestrol durante toda la vida de un niño afectado, la posibilidad de defectos congénitos resultantes de la exposición de los padres o en la segunda y siguientes generaciones de descendientes generalmente se ha rechazado en fundamentos teóricos y por falta de evidencia. [97] Sin embargo, se ha demostrado una variedad de anomalías mediadas por los hombres, y es probable que existan más. [98] La información de la etiqueta de la FDA para Vidaza, una formulación de 5-azacitidina (un análogo no metilable de la citidina que causa hipometilación cuando se incorpora al ADN) establece que "se debe advertir a los hombres que no engendren un hijo" mientras usan el medicamento, citando evidencia en ratones machos tratados con fertilidad reducida, mayor pérdida de embriones y desarrollo anormal de embriones. [99] En ratas, se observaron diferencias endocrinas en la descendencia de machos expuestos a la morfina. [100] En ratones, se han descrito efectos de segunda generación del dietilestilbesterol que se producen mediante mecanismos epigenéticos. [101]
El melanoma es un cáncer de piel mortal que se origina a partir de los melanocitos. Se sabe que varias alteraciones epigenéticas desempeñan un papel en la transición de los melanocitos a células de melanoma. Esto incluye la metilación del ADN que se puede heredar sin realizar cambios en la secuencia del ADN, así como el silenciamiento de los genes supresores de tumores en la epidermis que han estado expuestas a la radiación ultravioleta durante períodos de tiempo. [102] El silenciamiento de genes supresores de tumores conduce a la fotocarcinogénesis que se asocia con alteraciones epigenéticas en la metilación del ADN, las metiltransferasas del ADN y la acetilación de histonas. [102] Estas alteraciones son consecuencia de la desregulación de sus correspondientes enzimas. Entre estas enzimas se encuentran varias histonas metiltransferasas y desmetilasas. [103]
El cáncer de próstata mata a alrededor de 35.000 hombres cada año, y alrededor de 220.000 hombres son diagnosticados con cáncer de próstata cada año, sólo en América del Norte. [104] El cáncer de próstata es la segunda causa principal de muertes causadas por cáncer en los hombres, y durante la vida de un hombre, uno de cada seis tendrá la enfermedad. [104] Se producen alteraciones en la acetilación de histonas y la metilación del ADN en varios genes que influyen en el cáncer de próstata y se han observado en genes implicados en la respuesta hormonal. [105] Más del 90 % de los cánceres de próstata muestran silenciamiento genético mediante la hipermetilación de la isla CpG del promotor del gen GSTP1 , que protege las células de la próstata del daño genómico causado por diferentes oxidantes o carcinógenos . [106] La reacción en cadena de la polimerasa (PCR) específica de la metilación en tiempo real sugiere que muchos otros genes también están hipermetilados. [106] La expresión genética en la próstata puede estar modulada por cambios en la nutrición y el estilo de vida. [107]
El segundo tumor maligno más común en las mujeres es el cáncer de cuello uterino invasivo (CPI) y más del 50% de todos los cánceres de cuello uterino invasivo (CPI) son causados por el virus del papiloma humano oncongénico 16 ( VPH16 ). [108] Además, la neoplasia intraepitelial del cuello uterino (NIC) es causada principalmente por el VPH16 oncogénico. [108] Como en muchos casos, el factor causante del cáncer no siempre toma una ruta directa desde la infección hasta el desarrollo del cáncer. Los patrones de metilación genómica se han asociado con el cáncer de cuello uterino invasivo. Dentro de la región HPV16L1 , 14 sitios CpG probados tienen una metilación significativamente mayor en CIN3+ que en los genomas de HPV16 de mujeres sin CIN3 . [108] Se encontró que solo 2/16 sitios CpG analizados en la región reguladora aguas arriba del VPH16 tenían asociación con una mayor metilación en CIN3+. [108] Esto sugiere que la ruta directa de la infección al cáncer a veces se desvía hacia un estado precanceroso en la neoplasia intraepitelial del cuello uterino. Además, se encontró un aumento de la metilación del sitio CpG en niveles bajos en la mayoría de los cinco genes nucleares del huésped estudiados, incluidos 5/5 TERT , 1/4 DAPK1 , 2/5 RARB , MAL y CADM1 . [108] Además, 1/3 de los sitios CpG en el ADN mitocondrial se asociaron con una mayor metilación en CIN3+. [108] Por lo tanto, existe una correlación entre CIN3+ y una mayor metilación de sitios CpG en el marco de lectura abierto L1 de HPV16. [108] Este podría ser un biomarcador potencial para futuros exámenes de detección de enfermedades cervicales cancerosas y precancerosas. [108]
Estudios recientes han demostrado que el gen de la leucemia de linaje mixto (MLL) causa leucemia al reorganizarse y fusionarse con otros genes en diferentes cromosomas, lo cual es un proceso bajo control epigenético. [109] Las mutaciones en MLL bloquean las regiones reguladoras correctas en las translocaciones o inserciones asociadas a la leucemia que causan una transformación maligna controlada por genes HOX. [110] Esto es lo que conduce al aumento de glóbulos blancos. Los genes relacionados con la leucemia se gestionan por las mismas vías que controlan la epigenética, la transducción de señales, la regulación transcripcional y el metabolismo energético. Se indicó que las infecciones, los campos electromagnéticos y el aumento de peso al nacer pueden contribuir a ser las causas de la leucemia. [111]
Hay alrededor de 15 000 nuevos casos de sarcoma en los EE. UU. cada año, y se proyectó que alrededor de 6200 personas morirían a causa del sarcoma en los EE. UU. en 2014. [112] Los sarcomas comprenden una gran cantidad de tumores mesenquimales raros, histogenéticamente heterogéneos que, por ejemplo, incluyen condrosarcoma, sarcoma de Ewing, leiomiosarcoma, liposarcoma, osteosarcoma, sarcoma sinovial y rabdomiosarcoma (alveolar y embrionario). Varios oncogenes y genes supresores de tumores están alterados epigenéticamente en los sarcomas. Estos incluyen APC, CDKN1A, CDKN2A, CDKN2B, Ezrin, FGFR1, GADD45A, MGMT, STK3, STK4, PTEN, RASSF1A, WIF1, así como varios miARN. [113] La expresión de modificadores epigenéticos como la del componente BMI1 del complejo PRC1 está desregulada en el condrosarcoma, el sarcoma de Ewing y el osteosarcoma, y la expresión del componente EZH2 del complejo PRC2 está alterada en el sarcoma de Ewing y el rabdomiosarcoma. De manera similar, la expresión de otro modificador epigenético, la histona desmetilasa LSD1, aumenta en el condrosarcoma, el sarcoma de Ewing, el osteosarcoma y el rabdomiosarcoma. La dirección farmacológica y la inhibición de EZH2 en el sarcoma de Ewing, [114] o de LSD1 en varios sarcomas, [115] inhiben el crecimiento de células tumorales en estos sarcomas.
El cáncer de pulmón es el segundo tipo de cáncer más común y la principal causa de muerte en hombres y mujeres en los Estados Unidos, se estima que hay alrededor de 216.000 casos nuevos y 160.000 muertes debido al cáncer de pulmón. [116]
El inicio y la progresión del carcinoma de pulmón es el resultado de la interacción entre factores genéticos, epigenéticos y ambientales. La mayoría de los casos de cáncer de pulmón se deben a mutaciones genéticas en EGFR , KRAS , STK11 (también conocido como LKB1 ), TP53 (también conocido como p53 ) y CDKN2A (también conocido como p16 o INK4a ) [117] [118] [119] siendo el tipo más común de cáncer de pulmón una inactivación en p16. p16 es una proteína supresora de tumores que se produce principalmente en humanos. La importancia funcional de las mutaciones se probó en muchas otras especies, incluidos ratones, gatos, perros, monos y vacas. La identificación de estos múltiples clones no superpuestos no fue del todo sorprendente, ya que la hibridación es rigurosa. de una transferencia zoológica con la misma sonda también reveló entre 10 y 15 fragmentos EcoRI positivos en todas las especies analizadas. [120]
Anteriormente, los perfiles epigenéticos se limitaban a genes individuales examinados por un equipo de investigación concreto. Sin embargo, recientemente los científicos han avanzado hacia un enfoque más genómico para determinar un perfil genómico completo para las células cancerosas versus las sanas. [10]
Los enfoques populares para medir la metilación de CpG en células incluyen:
Dado que la secuenciación con bisulfito se considera el estándar de oro para medir la metilación de CpG, cuando se utiliza uno de los otros métodos, los resultados generalmente se confirman mediante la secuenciación con bisulfito[1]. Los enfoques populares para determinar los perfiles de modificación de histonas en células cancerosas versus células sanas incluyen: [10]
Los investigadores esperan identificar perfiles epigenéticos específicos de varios tipos y subtipos de cáncer con el objetivo de utilizar estos perfiles como herramientas para diagnosticar individuos de manera más específica y precisa. [10] Dado que los perfiles epigenéticos cambian, a los científicos les gustaría utilizar los diferentes perfiles epigenómicos para determinar la etapa de desarrollo o el nivel de agresividad de un cáncer en particular en los pacientes. Por ejemplo, la hipermetilación de los genes que codifican la proteína quinasa asociada a la muerte (DAPK), p16 y la proteína 3 de la membrana epitelial (EMP3) se han relacionado con formas más agresivas de cáncer de pulmón , colorrectal y cerebral . [17] Este tipo de conocimiento puede afectar la forma en que los médicos diagnosticarán y elegirán tratar a sus pacientes.
Otro factor que influirá en el tratamiento de los pacientes es saber qué tan bien responderán a determinados tratamientos. Los perfiles epigenómicos personalizados de células cancerosas pueden proporcionar información sobre este campo. Por ejemplo, MGMT es una enzima que revierte la adición de grupos alquilo al nucleótido guanina . [121] Sin embargo, la alquilación de guanina es el mecanismo por el cual actúan varios fármacos quimioterapéuticos para alterar el ADN y provocar la muerte celular . [122] [123] [124] [125] Por lo tanto, si el gen que codifica MGMT en las células cancerosas está hipermetilado y, de hecho, silenciado o reprimido, los fármacos quimioterapéuticos que actúan metilando la guanina serán más eficaces que en las células cancerosas que tienen una enzima MGMT funcional.
Los biomarcadores epigenéticos también se pueden utilizar como herramientas para el pronóstico molecular. En muestras de biopsia de tumor primario y ganglio linfático mediastínico , la hipermetilación de CDKN2A y CDH13 sirve como marcador de un mayor riesgo de una recaída más rápida del cáncer y una mayor tasa de mortalidad de los pacientes. [126]
El control epigenético de las regiones protoonco y las secuencias supresoras de tumores mediante cambios conformacionales en las histonas desempeña un papel en la formación y progresión del cáncer. [127] Los productos farmacéuticos que revierten los cambios epigenéticos podrían tener un papel en una variedad de cánceres. [105] [127] [128]
Recientemente, se sabe evidentemente que las asociaciones entre histotipos de cáncer específicos y cambios epigenéticos pueden facilitar el desarrollo de nuevos epifármacos. [129] El desarrollo de fármacos se ha centrado principalmente en la modificación de la ADN metiltransferasa , la histona acetiltransferasa (HAT) y la histona desacetilasa (HDAC). [130]
Los fármacos que se dirigen específicamente al patrón de metilación invertida de las células cancerosas incluyen los inhibidores de la ADN metiltransferasa azacitidina [131] [132] y decitabina . [133] [134] Estos agentes hipometilantes se usan para tratar el síndrome mielodisplásico , [135] un cáncer de la sangre producido por células madre anormales de la médula ósea . [12] Estos agentes inhiben los tres tipos de ADN metiltransferasas activas y se pensaba que eran altamente tóxicos, pero demostraron ser efectivos cuando se usan en dosis bajas, reduciendo la progresión del síndrome mielodisplásico a leucemia . [136]
"Los inhibidores de la histona desacetilasa (HDAC) muestran eficacia en el tratamiento del linfoma de células T" . La Administración de Alimentos y Medicamentos ha aprobado dos inhibidores de HDAC, vorinostat y romidepsina . [137] [138] Sin embargo, dado que estos inhibidores de HDAC alteran el estado de acetilación de muchas proteínas además de la histona de interés, se requiere conocimiento del mecanismo subyacente a nivel molecular de la respuesta del paciente para mejorar la eficiencia del uso de inhibidores como tratamiento. [18] Se ha descubierto que el tratamiento con inhibidores de HDAC promueve la reactivación genética después de que los inhibidores de las ADN metiltransferasas hayan reprimido la transcripción. [139] El panobinostat está aprobado para determinadas situaciones en el mieloma . [140]
Otros objetivos farmacéuticos en investigación son las histonas lisina metiltransferasas (KMT) y las proteínas arginina metiltransferasas (PRMT). [141] Un estudio preclínico ha sugerido que la lunasina puede tener efectos epigenéticos potencialmente beneficiosos. [142]
La terapia epigenética del cáncer ha demostrado ser un tratamiento prometedor y posible de las células cancerosas. La inactivación epigenética es un objetivo ideal para las células cancerosas porque se dirige a genes imprescindibles para controlar el crecimiento celular, específicamente el crecimiento de células cancerosas. Es crucial que estos genes se reactiven para suprimir el crecimiento tumoral y sensibilizar las células a las terapias que curan el cáncer. [143] La quimioterapia típica tiene como objetivo matar y eliminar las células cancerosas del cuerpo. El cáncer iniciado por alteraciones genéticas de las células suele ser permanente y casi imposible de revertir; esto se diferencia del cáncer epigenético porque el cáncer que causa las aberraciones epigenéticas tiene la capacidad de revertirse y las células regresan a su función normal. La capacidad de revertir los mecanismos epigenéticos se atribuye al hecho de que la codificación de los genes que se silencian mediante la modificación de histonas y el ADN no se altera. [144]
Hay dos tipos principales de alteraciones epigenéticas en las células cancerosas, que se conocen como metilación del ADN y modificación de histonas. El objetivo de las terapias epigenéticas es inhibir estas alteraciones. Las ADN metiltransferasas (DNMT) y las histonas desacetilasas (HDAC) son los principales catalizadores de las modificaciones epigenéticas de las células cancerosas. [145] El objetivo de las terapias epigenéticas es reprimir esta metilación y revertir estas modificaciones para crear un nuevo epigenoma donde las células cancerosas ya no prosperan y la supresión de tumores es la nueva función. Las drogas sintéticas se utilizan como herramientas en terapias epigenéticas debido a su capacidad para inhibir enzimas que causan modificaciones de histonas y metilaciones del ADN. La terapia combinada es un método de terapia epigenética que implica el uso de más de un fármaco sintético; estos fármacos incluyen un inhibidor de DNMT en dosis bajas y un inhibidor de HDAC. Juntos, estos medicamentos pueden atacar el vínculo entre la metilación del ADN y la modificación de las histonas. [146]
El objetivo de las terapias epigenéticas para el cáncer en relación con la metilación del ADN es disminuir la metilación del ADN y, a su vez, disminuir el silenciamiento de genes relacionados con la supresión de tumores. [147] El término asociado con la disminución de la metilación del ADN se conocerá como hipometilación. La Administración de Alimentos y Medicamentos (FDA) ha aprobado actualmente un agente hipometilante que, mediante la realización de ensayos clínicos, ha mostrado resultados prometedores cuando se utiliza para tratar pacientes con síndrome mielodisplásico (MDS). [148] Este agente hipometilante se conoce como el extraño análogo de la 5-azacitidina y actúa para promover la hipometilación al atacar todas las ADN metiltransferasas para su degradación. [147]
{{cite web}}: Falta o está vacío |title=( ayuda )