La plata es un elemento químico ; su símbolo es Ag (del latín argentum 'plata', derivado del protoindoeuropeo *h₂erǵ ' brillante, blanco ' ) y su número atómico es 47. Es un metal de transición blando, blanco y brillante , que exhibe la conductividad eléctrica , conductividad térmica y reflectividad más altas de todos los metales . [11] La plata se encuentra en la corteza terrestre en forma elemental pura y libre (" plata nativa "), como una aleación con oro y otros metales, y en minerales como la argentita y la clorargirita . La mayor parte de la plata se produce como subproducto del refinado de cobre , oro, plomo y zinc .
La plata ha sido valorada durante mucho tiempo como un metal precioso . El metal de plata se utiliza en muchas monedas de lingotes , a veces junto con el oro : [12] si bien es más abundante que el oro, es mucho menos abundante como metal nativo . [13] Su pureza se mide típicamente en base a mil ; una aleación con una pureza del 94% se describe como "0,940 fina". Como uno de los siete metales de la antigüedad , la plata ha tenido un papel duradero en la mayoría de las culturas humanas.
Además de en moneda y como medio de inversión ( monedas y lingotes ), la plata se utiliza en paneles solares , filtración de agua , joyería , adornos, vajillas y utensilios de alto valor (de ahí el término " plata "), en contactos y conductores eléctricos , en espejos especializados, revestimientos de ventanas, en la catálisis de reacciones químicas, como colorante en vidrieras y en confitería especializada. Sus compuestos se utilizan en películas fotográficas y de rayos X. Las soluciones diluidas de nitrato de plata y otros compuestos de plata se utilizan como desinfectantes y microbiocidas ( efecto oligodinámico ), se añaden a vendajes , apósitos para heridas, catéteres y otros instrumentos médicos .

La plata es similar en sus propiedades físicas y químicas a sus dos vecinos verticales del grupo 11 de la tabla periódica : el cobre y el oro . Sus 47 electrones están dispuestos en la configuración [Kr]4d 10 5s 1 , de manera similar al cobre ([Ar]3d 10 4s 1 ) y al oro ([Xe]4f 14 5d 10 6s 1 ); el grupo 11 es uno de los pocos grupos en el bloque d que tiene un conjunto completamente consistente de configuraciones electrónicas. [15] Esta configuración electrónica distintiva, con un solo electrón en la subcapa s más ocupada sobre una subcapa d llena, explica muchas de las propiedades singulares de la plata metálica. [16]
La plata es un metal de transición relativamente blando y extremadamente dúctil y maleable , aunque es ligeramente menos maleable que el oro. La plata cristaliza en una red cúbica centrada en las caras con un número de coordinación volumétrica de 12, donde solo el único electrón 5s está deslocalizado, de manera similar al cobre y al oro. [17] A diferencia de los metales con capas d incompletas, los enlaces metálicos en la plata carecen de un carácter covalente y son relativamente débiles. Esta observación explica la baja dureza y la alta ductilidad de los monocristales de plata. [18]
La plata tiene un brillo metálico blanco brillante que puede pulirse bien , [ 19] y que es tan característico que el nombre del metal en sí se ha convertido en un nombre de color . [16] La plata protegida tiene mayor reflectividad óptica que el aluminio en todas las longitudes de onda mayores a ~450 nm. [20] En longitudes de onda menores a 450 nm, la reflectividad de la plata es inferior a la del aluminio y cae a cero cerca de los 310 nm. [21]
Los elementos del grupo 11 tienen una conductividad eléctrica y térmica muy alta, porque su único electrón s está libre y no interactúa con la subcapa d llena, ya que tales interacciones (que ocurren en los metales de transición anteriores) reducen la movilidad de los electrones. [22] La conductividad térmica de la plata está entre las más altas de todos los materiales, aunque la conductividad térmica del carbono (en el alótropo del diamante ) y del helio-4 superfluido es mayor. [15] La conductividad eléctrica de la plata es la más alta de todos los metales, incluso mayor que la del cobre. La plata también tiene la resistencia de contacto más baja de todos los metales. [15] La plata rara vez se usa por su conductividad eléctrica, debido a su alto costo, aunque una excepción es en la ingeniería de radiofrecuencia , particularmente en VHF y frecuencias más altas donde el enchapado de plata mejora la conductividad eléctrica porque esas corrientes tienden a fluir en la superficie de los conductores en lugar de a través del interior. Durante la Segunda Guerra Mundial en los EE. UU., se utilizaron 13.540 toneladas de plata para los electroimanes de los calutrones para enriquecer uranio , principalmente debido a la escasez de cobre en tiempos de guerra. [23] [24] [25]
La plata forma fácilmente aleaciones con cobre, oro y cinc . Las aleaciones de cinc-plata con baja concentración de cinc pueden considerarse soluciones sólidas cúbicas centradas en las caras de cinc en plata, ya que la estructura de la plata permanece prácticamente inalterada mientras que la concentración de electrones aumenta a medida que se añade más cinc. El aumento de la concentración de electrones conduce a fases cúbicas centradas en el cuerpo (concentración de electrones 1,5), cúbicas complejas (1,615) y hexagonales compactas (1,75). [17]
La plata natural se compone de dos isótopos estables , 107 Ag y 109 Ag, siendo 107 Ag ligeramente más abundante (51,839% de abundancia natural ). Esta abundancia casi igual es rara en la tabla periódica. El peso atómico es 107,8682(2) u ; [26] [27] este valor es muy importante debido a la importancia de los compuestos de plata, particularmente los haluros, en el análisis gravimétrico . [26] Ambos isótopos de plata se producen en estrellas a través del proceso s (captura lenta de neutrones), así como en supernovas a través del proceso r (captura rápida de neutrones). [28]
Se han caracterizado veintiocho radioisótopos , siendo el más estable el 105 Ag con una vida media de 41,29 días, el 111 Ag con una vida media de 7,45 días y el 112 Ag con una vida media de 3,13 horas. La plata tiene numerosos isómeros nucleares , siendo los más estables el 108m Ag ( t 1/2 = 418 años), el 110m Ag ( t 1/2 = 249,79 días) y el 106m Ag ( t 1/2 = 8,28 días). Todos los isótopos radiactivos restantes tienen vidas medias de menos de una hora, y la mayoría de estos tienen vidas medias de menos de tres minutos. [29]
Los isótopos de plata varían en masa atómica relativa de 92,950 u ( 93 Ag) a 129,950 u ( 130 Ag); [30] el modo de desintegración primario antes del isótopo estable más abundante, 107 Ag, es la captura de electrones y el modo primario después es la desintegración beta . Los productos de desintegración primarios antes de 107 Ag son isótopos de paladio (elemento 46), y los productos primarios después son isótopos de cadmio (elemento 48). [29]
El isótopo de paladio 107 Pd se desintegra por emisión beta en 107 Ag con una vida media de 6,5 millones de años. Los meteoritos de hierro son los únicos objetos con una relación paladio-plata lo suficientemente alta como para producir variaciones mensurables en la abundancia de 107 Ag. El 107 Ag radiogénico se descubrió por primera vez en el meteorito de Santa Clara en 1978. [31] Las correlaciones 107 Pd– 107 Ag observadas en cuerpos que claramente se han fundido desde la acreción del Sistema Solar deben reflejar la presencia de nucleidos inestables en el Sistema Solar primitivo. [32]
La plata es un metal poco reactivo. Esto se debe a que su capa 4d llena no es muy eficaz para proteger las fuerzas electrostáticas de atracción del núcleo hacia el electrón 5s más externo, y por lo tanto la plata está cerca del final de la serie electroquímica ( E 0 (Ag + /Ag) = +0,799 V). [16] En el grupo 11, la plata tiene la primera energía de ionización más baja (lo que muestra la inestabilidad del orbital 5s), pero tiene segunda y tercera energías de ionización más altas que el cobre y el oro (lo que muestra la estabilidad de los orbitales 4d), de modo que la química de la plata es predominantemente la del estado de oxidación +1, lo que refleja el rango cada vez más limitado de estados de oxidación a lo largo de la serie de transición a medida que los orbitales d se llenan y se estabilizan. [34] A diferencia del cobre , para el cual la mayor energía de hidratación del Cu 2+ en comparación con el Cu + es la razón por la que el primero es más estable en solución acuosa y sólidos a pesar de carecer de la subcapa d llena estable del último, con la plata este efecto se ve eclipsado por su mayor segunda energía de ionización. Por lo tanto, Ag + es la especie estable en solución acuosa y sólidos, siendo Ag 2+ mucho menos estable ya que oxida el agua. [34]
La mayoría de los compuestos de plata tienen un carácter covalente significativo debido al pequeño tamaño y la alta energía de primera ionización (730,8 kJ/mol) de la plata. [16] Además, la electronegatividad de Pauling de la plata de 1,93 es mayor que la del plomo (1,87), y su afinidad electrónica de 125,6 kJ/mol es mucho mayor que la del hidrógeno (72,8 kJ/mol) y no mucho menor que la del oxígeno (141,0 kJ/mol). [35] Debido a su subcapa d completa, la plata en su estado de oxidación principal +1 exhibe relativamente pocas propiedades de los metales de transición propiamente dichos de los grupos 4 a 10, formando compuestos organometálicos bastante inestables , formando complejos lineales que muestran números de coordinación muy bajos como 2, y formando un óxido anfótero [36] así como fases de Zintl como los metales post-transición . [37] A diferencia de los metales de transición anteriores, el estado de oxidación +1 de la plata es estable incluso en ausencia de ligandos aceptores π . [34]
La plata no reacciona con el aire, ni siquiera al rojo vivo, y por ello los alquimistas la consideraban un metal noble , junto con el oro. Su reactividad es intermedia entre la del cobre (que forma óxido de cobre(I) cuando se calienta al rojo vivo en el aire) y la del oro. Al igual que el cobre, la plata reacciona con el azufre y sus compuestos; en su presencia, la plata se empaña en el aire para formar el sulfuro de plata negro (el cobre forma en cambio el sulfato verde , mientras que el oro no reacciona). Si bien la plata no es atacada por ácidos no oxidantes, el metal se disuelve fácilmente en ácido sulfúrico concentrado caliente , así como en ácido nítrico diluido o concentrado . En presencia de aire, y especialmente en presencia de peróxido de hidrógeno , la plata se disuelve fácilmente en soluciones acuosas de cianuro . [33]
Las tres formas principales de deterioro de los objetos históricos de plata son el deslustre, la formación de cloruro de plata debido a la inmersión prolongada en agua salada, así como la reacción con iones de nitrato u oxígeno. El cloruro de plata fresco es de color amarillo pálido y se vuelve violáceo al exponerse a la luz; sobresale ligeramente de la superficie del objeto o la moneda. La precipitación de cobre en plata antigua se puede utilizar para datar objetos, ya que el cobre es casi siempre un componente de las aleaciones de plata. [38]
El metal plata es atacado por oxidantes fuertes como el permanganato de potasio ( KMnO
4) y dicromato de potasio ( K
2Cr
2Oh
7), y en presencia de bromuro de potasio ( KBr ). Estos compuestos se utilizan en fotografía para blanquear imágenes de plata, convirtiéndolas en bromuro de plata que puede fijarse con tiosulfato o volverse a revelar para intensificar la imagen original. La plata forma complejos de cianuro ( cianuro de plata ) que son solubles en agua en presencia de un exceso de iones de cianuro. Las soluciones de cianuro de plata se utilizan en la galvanoplastia de plata. [39]
Los estados de oxidación más comunes de la plata son (en orden de frecuencia): +1 (el estado más estable; por ejemplo, nitrato de plata , AgNO 3 ); +2 (muy oxidante; por ejemplo, fluoruro de plata(II) , AgF 2 ); e incluso muy raramente +3 (oxidante extremo; por ejemplo, tetrafluoroargentato(III) de potasio, KAgF 4 ). [40] El estado +3 requiere agentes oxidantes muy fuertes para alcanzarlo, como el flúor o el peroxodisulfato , y algunos compuestos de plata(III) reaccionan con la humedad atmosférica y atacan el vidrio. [41] De hecho, el fluoruro de plata(III) se obtiene generalmente haciendo reaccionar plata o monofluoruro de plata con el agente oxidante más fuerte conocido, el difluoruro de criptón . [42]
La plata y el oro tienen afinidades químicas bastante bajas para el oxígeno, menores que el cobre, y por lo tanto se espera que los óxidos de plata sean térmicamente bastante inestables. Las sales solubles de plata (I) precipitan óxido de plata (I) marrón oscuro , Ag 2 O, tras la adición de álcali. (El hidróxido AgOH existe solo en solución; de lo contrario, se descompone espontáneamente en óxido). El óxido de plata (I) se reduce muy fácilmente a plata metálica y se descompone en plata y oxígeno por encima de los 160 °C. [43] Este y otros compuestos de plata (I) pueden oxidarse por el fuerte agente oxidante peroxodisulfato a AgO negro, un óxido de plata (I, III) mixto de fórmula Ag I Ag III O 2 . También se conocen algunos otros óxidos mixtos con plata en estados de oxidación no integrales, a saber, Ag 2 O 3 y Ag 3 O 4 , al igual que Ag 3 O que se comporta como un conductor metálico. [43]
El sulfuro de plata (I) , Ag 2 S, se forma muy fácilmente a partir de sus elementos constituyentes y es la causa del deslustre negro de algunos objetos de plata antiguos. También puede formarse a partir de la reacción del sulfuro de hidrógeno con el metal plata o iones Ag + acuosos. Se conocen muchos seleniuros y telururos no estequiométricos ; en particular, AgTe ~3 es un superconductor de baja temperatura . [43]

El único dihaluro de plata conocido es el difluoruro , AgF 2 , que se puede obtener a partir de los elementos bajo calor. El fluoruro de plata (II), un agente fluorante fuerte pero térmicamente estable y, por lo tanto, seguro, se utiliza a menudo para sintetizar hidrofluorocarbonos . [44]
En marcado contraste con esto, se conocen los cuatro haluros de plata (I). El fluoruro , el cloruro y el bromuro tienen la estructura del cloruro de sodio, pero el yoduro tiene tres formas estables conocidas a diferentes temperaturas; la que está a temperatura ambiente es la estructura de blenda de zinc cúbica . Todos ellos se pueden obtener por reacción directa de sus respectivos elementos. [44] A medida que desciende el grupo halógeno, el haluro de plata adquiere cada vez más carácter covalente, la solubilidad disminuye y el color cambia del cloruro blanco al yoduro amarillo a medida que disminuye la energía requerida para la transferencia de carga del ligando al metal (X − Ag + → XAg). [44] El fluoruro es anómalo, ya que el ion fluoruro es tan pequeño que tiene una energía de solvatación considerable y, por lo tanto, es altamente soluble en agua y forma dihidratos y tetrahidratos. [44] Los otros tres haluros de plata son altamente insolubles en soluciones acuosas y se utilizan muy comúnmente en métodos analíticos gravimétricos. [26] Los cuatro son fotosensibles (aunque el monofluoruro lo es sólo a la luz ultravioleta ), especialmente el bromuro y el yoduro que se fotodescomponen en metal plata, y por eso se usaban en la fotografía tradicional . [44] La reacción involucrada es: [45]
El proceso no es reversible porque el átomo de plata liberado se encuentra normalmente en un defecto del cristal o en un sitio de impureza, de modo que la energía del electrón se reduce lo suficiente como para que quede "atrapado". [45]

El nitrato de plata blanco , AgNO 3 , es un precursor versátil de muchos otros compuestos de plata, especialmente los haluros, y es mucho menos sensible a la luz. Alguna vez se lo llamó cáustico lunar porque los antiguos alquimistas llamaban a la plata luna , quienes creían que la plata estaba asociada con la Luna. [46] [47] A menudo se utiliza para el análisis gravimétrico, explotando la insolubilidad de los haluros de plata más pesados, de los que es un precursor común. [26] El nitrato de plata se utiliza de muchas maneras en la síntesis orgánica , por ejemplo, para la desprotección y las oxidaciones. Ag + se une a los alquenos de forma reversible, y el nitrato de plata se ha utilizado para separar mezclas de alquenos por absorción selectiva. El aducto resultante se puede descomponer con amoníaco para liberar el alqueno libre. [48]
El carbonato de plata amarillo , Ag2CO3 , se puede preparar fácilmente haciendo reaccionar soluciones acuosas de carbonato de sodio con una deficiencia de nitrato de plata. [49] Su uso principal es para la producción de polvo de plata para su uso en microelectrónica. Se reduce con formaldehído , produciendo plata libre de metales alcalinos: [50]
El carbonato de plata también se utiliza como reactivo en síntesis orgánica, como en la reacción de Koenigs-Knorr . En la oxidación de Fétizon , el carbonato de plata sobre celita actúa como agente oxidante para formar lactonas a partir de dioles . También se emplea para convertir bromuros de alquilo en alcoholes . [49]
El fulminato de plata , AgCNO, un explosivo potente y sensible al tacto que se utiliza en cápsulas fulminantes , se obtiene mediante la reacción del metal plata con ácido nítrico en presencia de etanol . Otros compuestos de plata peligrosamente explosivos son la azida de plata , AgN 3 , formada por la reacción del nitrato de plata con azida de sodio , [51] y el acetiluro de plata , Ag 2 C 2 , que se forma cuando la plata reacciona con gas acetileno en solución de amoníaco. [34] En su reacción más característica, la azida de plata se descompone de forma explosiva, liberando gas nitrógeno: dada la fotosensibilidad de las sales de plata, este comportamiento puede inducirse al iluminar sus cristales. [34]

Los complejos de plata tienden a ser similares a los de su homólogo más ligero, el cobre. Los complejos de plata(III) tienden a ser raros y se reducen muy fácilmente a estados de oxidación más bajos, aunque son ligeramente más estables que los del cobre(III). Por ejemplo, los complejos de peryodato [Ag(IO 5 OH) 2 ] 5− y telurato [Ag{TeO 4 (OH) 2 } 2 ] 5−, de estructura plana cuadrada , se pueden preparar oxidando plata(I) con peroxodisulfato alcalino . El diamagnético amarillo [AgF 4 ] − es mucho menos estable, humea en aire húmedo y reacciona con el vidrio. [41]
Los complejos de plata(II) son más comunes. Al igual que los complejos de cobre(II) isoelectrónicos de valencia, suelen ser planos cuadrados y paramagnéticos, lo que aumenta por la mayor división del campo para los electrones 4d que para los electrones 3d. El Ag 2+ acuoso , producido por oxidación de Ag + por ozono, es un agente oxidante muy fuerte, incluso en soluciones ácidas: se estabiliza en ácido fosfórico debido a la formación de complejos. La oxidación con peroxodisulfato generalmente es necesaria para dar los complejos más estables con aminas heterocíclicas , como [Ag(py) 4 ] 2+ y [Ag(bipy) 2 ] 2+ : estos son estables siempre que el contraión no pueda reducir la plata nuevamente al estado de oxidación +1. [AgF 4 ] 2− también se conoce en su sal de bario violeta, al igual que algunos complejos de plata(II) con ligandos donantes de N u O , como los carboxilatos de piridina. [52]
Con mucho, el estado de oxidación más importante para la plata en complejos es +1. El catión Ag + es diamagnético, como sus homólogos Cu + y Au + , ya que los tres tienen configuraciones electrónicas de capa cerrada sin electrones desapareados: sus complejos son incoloros siempre que los ligandos no se polaricen demasiado fácilmente, como I − . Ag + forma sales con la mayoría de los aniones, pero es reacio a coordinarse con el oxígeno y, por lo tanto, la mayoría de estas sales son insolubles en agua: las excepciones son el nitrato, el perclorato y el fluoruro. El ion acuoso tetraédrico tetracoordinado [Ag(H 2 O) 4 ] + es conocido, pero la geometría característica para el catión Ag + es lineal de 2 coordenadas. Por ejemplo, el cloruro de plata se disuelve fácilmente en exceso de amoníaco acuoso para formar [Ag(NH 3 ) 2 ] + ; Las sales de plata se disuelven en la fotografía debido a la formación del complejo tiosulfato [Ag(S 2 O 3 ) 2 ] 3− ; y la extracción de cianuro para plata (y oro) funciona mediante la formación del complejo [Ag(CN) 2 ] − . El cianuro de plata forma el polímero lineal {Ag–C≡N→Ag–C≡N→}; el tiocianato de plata tiene una estructura similar, pero forma un zigzag en su lugar debido al átomo de azufre hibridado sp 3 - . Los ligandos quelantes no pueden formar complejos lineales y, por lo tanto, los complejos de plata(I) con ellos tienden a formar polímeros; existen algunas excepciones, como los complejos casi tetraédricos de difosfina y diarsina [Ag(L–L) 2 ] + . [53]
En condiciones estándar, la plata no forma carbonilos simples, debido a la debilidad del enlace Ag–C. Se conocen algunos a temperaturas muy bajas, alrededor de 6–15 K, como el paramagnético planar verde Ag(CO) 3 , que dimeriza a 25–30 K, probablemente formando enlaces Ag–Ag. Además, se conoce el carbonilo de plata [Ag(CO)] [B(OTeF 5 ) 4 ]. Se conocen complejos poliméricos de AgLX con alquenos y alquinos , pero sus enlaces son termodinámicamente más débiles que incluso los de los complejos de platino (aunque se forman más fácilmente que los de los complejos de oro análogos): también son bastante asimétricos, mostrando el enlace π débil en el grupo 11. Los enlaces σ Ag–C también pueden formarse con plata(I), como cobre(I) y oro(I), pero los alquilos y arilos simples de plata(I) son incluso menos estables que los de cobre(I) (que tienden a explotar en condiciones ambientales). Por ejemplo, la mala estabilidad térmica se refleja en las temperaturas relativas de descomposición de AgMe (−50 °C) y CuMe (−15 °C), así como en las de PhAg (74 °C) y PhCu (100 °C). [54]
El enlace C–Ag se estabiliza mediante ligandos perfluoroalquilo , por ejemplo en AgCF(CF 3 ) 2 . [55] Los compuestos de alquenilplata también son más estables que sus contrapartes de alquilplata. [56] Los complejos de plata -NHC se preparan fácilmente y se usan comúnmente para preparar otros complejos de NHC desplazando ligandos lábiles. Por ejemplo, la reacción del complejo bis(NHC)plata(I) con dicloruro de bis(acetonitrilo)paladio o cloruro(dimetilsulfuro)oro(I) : [57]

La plata forma aleaciones con la mayoría de los demás elementos de la tabla periódica. Los elementos de los grupos 1 a 3, excepto el hidrógeno , el litio y el berilio , son muy miscibles con la plata en la fase condensada y forman compuestos intermetálicos; los de los grupos 4 a 9 son poco miscibles; los elementos de los grupos 10 a 14 (excepto el boro y el carbono ) tienen diagramas de fase Ag-M muy complejos y forman las aleaciones comercialmente más importantes; y los elementos restantes de la tabla periódica no tienen consistencia en sus diagramas de fase Ag-M. Las aleaciones más importantes de este tipo son, con mucho, las que se realizan con cobre: la mayor parte de la plata utilizada para acuñación de monedas y joyería es en realidad una aleación de plata y cobre, y la mezcla eutéctica se utiliza en la soldadura fuerte al vacío . Los dos metales son completamente miscibles como líquidos, pero no como sólidos; Su importancia en la industria proviene del hecho de que sus propiedades tienden a ser adecuadas en un amplio rango de variación en la concentración de plata y cobre, aunque la mayoría de las aleaciones útiles tienden a ser más ricas en plata que la mezcla eutéctica (71,9% de plata y 28,1% de cobre en peso, y 60,1% de plata y 28,1% de cobre por átomo). [58]
La mayoría de las demás aleaciones binarias son de poca utilidad: por ejemplo, las aleaciones de plata-oro son demasiado blandas y las de plata - cadmio demasiado tóxicas. Las aleaciones ternarias tienen mucha mayor importancia: las amalgamas dentales suelen ser aleaciones de plata-estaño-mercurio, las aleaciones de plata-cobre-oro son muy importantes en joyería (normalmente ricas en oro) y tienen una amplia gama de durezas y colores, las aleaciones de plata-cobre-cinc son útiles como aleaciones de soldadura fuerte de bajo punto de fusión, y la plata-cadmio- indio (que implica tres elementos adyacentes en la tabla periódica) es útil en reactores nucleares debido a su alta sección transversal de captura de neutrones térmicos , buena conducción del calor, estabilidad mecánica y resistencia a la corrosión en agua caliente. [58]
La palabra plata aparece en inglés antiguo en varias grafías, como seolfor y siolfor . Es cognado del alto alemán antiguo silabar ; gótico silubr ; o nórdico antiguo silfr , todos derivados en última instancia del protogermánico *silubra . Las palabras baltoeslavas para plata son bastante similares a las germánicas (por ejemplo, ruso серебро [ serebró ], polaco srebro , lituano sidãbras ), al igual que la forma celtíbera silabur . Pueden tener un origen indoeuropeo común, aunque su morfología sugiere más bien una Wanderwort no indoeuropea . [59] [60] Algunos académicos han propuesto así un origen paleohispánico , señalando la forma vasca zilharr como evidencia. [61]
El símbolo químico Ag proviene de la palabra latina para plata , argentum (compárese con el griego antiguo ἄργυρος , árgyros ), de la raíz protoindoeuropea * h₂erǵ- (anteriormente reconstruida como *arǵ- ), que significa ' blanco ' o ' brillante ' . Esta era la palabra protoindoeuropea habitual para el metal, cuyos reflejos faltan en el germánico y el baltoeslavo. [60]


La plata era conocida en tiempos prehistóricos: [62] los tres metales del grupo 11, cobre, plata y oro, se encuentran en forma elemental en la naturaleza y probablemente se usaron como las primeras formas primitivas de dinero en oposición al simple trueque. [63] A diferencia del cobre, la plata no condujo al crecimiento de la metalurgia , debido a su baja resistencia estructural; se usaba más a menudo de manera ornamental o como dinero. [64] Dado que la plata es más reactiva que el oro, los suministros de plata nativa eran mucho más limitados que los de oro. [63] Por ejemplo, la plata era más cara que el oro en Egipto hasta alrededor del siglo XV a. C.: [65] se cree que los egipcios separaron el oro de la plata calentando los metales con sal y luego reduciendo el cloruro de plata producido al metal. [66]
La situación cambió con el descubrimiento de la copelación , una técnica que permitía extraer el metal de plata de sus menas. Si bien los montones de escoria encontrados en Asia Menor y en las islas del mar Egeo indican que la plata se separaba del plomo ya en el cuarto milenio a. C. , [15] y uno de los primeros centros de extracción de plata en Europa fue Cerdeña en el período Calcolítico temprano , [67] estas técnicas no se difundieron ampliamente hasta más tarde, cuando se extendieron por toda la región y más allá. [65] Los orígenes de la producción de plata en la India , China y Japón fueron casi con certeza igualmente antiguos, pero no están bien documentados debido a su gran antigüedad. [66]

Cuando los fenicios llegaron por primera vez a lo que hoy es España , obtuvieron tanta plata que no pudieron meterla toda en sus barcos y, como resultado, utilizaron plata para lastrar sus anclas en lugar de plomo. [65] En la época de las civilizaciones griega y romana, las monedas de plata eran un elemento básico de la economía: [63] los griegos ya extraían plata de la galena en el siglo VII a. C., [65] y el ascenso de Atenas fue posible en parte gracias a las minas de plata cercanas a Laurium , de las que extraían unas 30 toneladas al año entre el 600 y el 300 a. C. [68] La estabilidad de la moneda romana dependía en gran medida del suministro de lingotes de plata, principalmente de España, que los mineros romanos producían en una escala sin precedentes antes del descubrimiento del Nuevo Mundo . Alcanzando una producción máxima de 200 toneladas por año, se estima que un stock de plata de 10.000 toneladas circulaba en la economía romana a mediados del siglo II d. C., cinco a diez veces más grande que la cantidad combinada de plata disponible en la Europa medieval y el califato abasí alrededor del año 800 d. C. [69] [70] Los romanos también registraron la extracción de plata en Europa central y septentrional en el mismo período de tiempo. Esta producción se detuvo casi por completo con la caída del Imperio romano, para no reanudarse hasta la época de Carlomagno : para entonces, ya se habían extraído decenas de miles de toneladas de plata. [66]
Europa Central se convirtió en el centro de producción de plata durante la Edad Media , ya que los depósitos mediterráneos explotados por las civilizaciones antiguas se habían agotado. Se abrieron minas de plata en Bohemia , Sajonia , Alsacia , la región de Lahn , Siegerland , Silesia , Hungría , Noruega , Estiria , Suabia y el sur de la Selva Negra . La mayoría de estos minerales eran bastante ricos en plata y podían separarse simplemente a mano de la roca restante y luego fundirse; también se encontraron algunos depósitos de plata nativa. Muchas de estas minas se agotaron pronto, pero algunas de ellas permanecieron activas hasta la Revolución Industrial , antes de la cual la producción mundial de plata rondaba las escasas 50 toneladas por año. [66] En América, la tecnología de copelación de plata y plomo a alta temperatura fue desarrollada por civilizaciones preincaicas ya en el 60-120 d. C.; los depósitos de plata en la India, China, Japón y la América precolombina continuaron siendo extraídos durante este tiempo. [66] [71]
Con el descubrimiento de América y el saqueo de plata por parte de los conquistadores españoles, América Central y del Sur se convirtieron en los principales productores de plata hasta principios del siglo XVIII, en particular Perú , Bolivia , Chile y Argentina : [66] el último de estos países más tarde tomó su nombre del metal que componía gran parte de su riqueza mineral. [68] El comercio de plata dio paso a una red global de intercambio . Como dijo un historiador, la plata "dio la vuelta al mundo y hizo que el mundo girara". [72] Gran parte de esta plata terminó en manos de los chinos. Un comerciante portugués en 1621 señaló que la plata "vaga por todo el mundo... antes de llegar a China, donde permanece como si fuera su centro natural". [73] Aún así, gran parte fue a España, lo que permitió a los gobernantes españoles perseguir ambiciones militares y políticas tanto en Europa como en las Américas. "Las minas del Nuevo Mundo", concluyeron varios historiadores, "sostenían al imperio español". [74]
En el siglo XIX, la producción primaria de plata se trasladó a América del Norte, en particular a Canadá , México y Nevada en los Estados Unidos : también se produjo cierta producción secundaria de minerales de plomo y zinc en Europa, y se explotaron depósitos en Siberia y el Lejano Oriente ruso , así como en Australia . [66] Polonia surgió como un productor importante durante la década de 1970 después del descubrimiento de depósitos de cobre ricos en plata, antes de que el centro de producción regresara a las Américas en la década siguiente. Hoy en día, Perú y México siguen estando entre los principales productores de plata, pero la distribución de la producción de plata en todo el mundo está bastante equilibrada y aproximadamente una quinta parte del suministro de plata proviene del reciclaje en lugar de la nueva producción. [66]

La plata desempeña un papel determinado en la mitología y ha encontrado diversos usos como metáfora y en el folclore. En Los trabajos y los días del poeta griego Hesíodo (versos 109-201) se enumeran diferentes eras del hombre que llevan el nombre de metales como el oro, la plata, el bronce y el hierro para dar cuenta de las sucesivas eras de la humanidad. [75] Las Metamorfosis de Ovidio contienen otra versión de la historia, que contiene una ilustración del uso metafórico de la plata para significar lo segundo mejor de una serie, mejor que el bronce pero peor que el oro:
Pero cuando el buen Saturno , desterrado de lo alto,
fue arrojado al infierno, el mundo quedó bajo el yugo de Júpiter .
En los tiempos siguientes, he aquí una edad de plata,
en la que el bronce era superior, pero el oro lo superaba aún más.— Ovidio, Metamorfosis , Libro I, trad. John Dryden
En el folclore, se creía comúnmente que la plata tenía poderes místicos: por ejemplo, a menudo se supone que una bala fundida en plata es la única arma eficaz contra un hombre lobo , una bruja u otros monstruos . [76] [77] [78] A partir de esto, el modismo de una bala de plata se desarrolló para referirse figurativamente a cualquier solución simple con una efectividad muy alta o resultados casi milagrosos, como en el artículo de ingeniería de software ampliamente discutido " No Silver Bullet ". [79] Otros poderes atribuidos a la plata incluyen la detección de veneno y la facilitación del paso al reino mítico de las hadas . [78]
La producción de plata también ha inspirado el lenguaje figurado. En todo el Antiguo Testamento de la Biblia aparecen claras referencias a la copelación , como en la reprensión de Jeremías a Judá: "Se quemó el fuelle, se consumió el plomo del fuego; en vano se funde el fundidor, porque los impíos no son arrancados. Plata reprobada los llamarán, porque Jehová los ha desechado" (Jeremías 6:19-20). Jeremías también conocía la plata laminada, ejemplificando la maleabilidad y ductilidad del metal: "La plata laminada es traída de Tarsis, y el oro de Ufaz, obra del artífice, y de las manos del fundidor; azul y púrpura es su vestidura; todo es obra de hombres hábiles" (Jeremías 10:9). [65]
La plata también tiene significados culturales más negativos: la expresión treinta piezas de plata, que se refiere a una recompensa por la traición, hace referencia al soborno que, según se dice en el Nuevo Testamento, Judas Iscariote recibió de los líderes judíos en Jerusalén para entregar a Jesús de Nazaret a los soldados del sumo sacerdote Caifás. [80] Éticamente, la plata también simboliza la codicia y la degradación de la conciencia; este es el aspecto negativo, la perversión de su valor. [81]

La abundancia de plata en la corteza terrestre es de 0,08 partes por millón , casi exactamente la misma que la del mercurio . Se encuentra principalmente en minerales de sulfuro , especialmente acantita y argentita , Ag2S . Los depósitos de argentita a veces también contienen plata nativa cuando se encuentran en ambientes reductores, y cuando entran en contacto con agua salada se convierten en clorargirita (incluida la plata córnea ), AgCl, que prevalece en Chile y Nueva Gales del Sur . [82] La mayoría de los demás minerales de plata son pnictidas o calcogenuros de plata ; generalmente son semiconductores brillantes. La mayoría de los verdaderos depósitos de plata, a diferencia de los depósitos argentíferos de otros metales, provienen del vulcanismo del período Terciario . [83]
Las principales fuentes de plata son los minerales de cobre, cobre-níquel, plomo y plomo-zinc obtenidos de Perú , Bolivia , México , China , Australia , Chile , Polonia y Serbia . [15] Perú, Bolivia y México han estado extrayendo plata desde 1546 y siguen siendo importantes productores mundiales. Las principales minas productoras de plata son Cannington (Australia), Fresnillo (México), San Cristóbal (Bolivia), Antamina (Perú), Rudna (Polonia) y Penasquito (México). [84] Los principales proyectos de desarrollo minero a corto plazo hasta 2015 son Pascua Lama (Chile), Navidad (Argentina), Jaunicipio (México), Malku Khota (Bolivia), [85] y Hackett River (Canadá). [84] En Asia Central , se sabe que Tayikistán tiene algunos de los depósitos de plata más grandes del mundo. [86 ]
La plata se encuentra generalmente en la naturaleza combinada con otros metales, o en minerales que contienen compuestos de plata, generalmente en forma de sulfuros como la galena (sulfuro de plomo) o la cerusita (carbonato de plomo). Por lo tanto, la producción primaria de plata requiere la fundición y luego copelación de minerales de plomo argentíferos, un proceso históricamente importante. [87] El plomo se funde a 327 °C, el óxido de plomo a 888 °C y la plata se funde a 960 °C. Para separar la plata, la aleación se funde nuevamente a la alta temperatura de 960 °C a 1000 °C en un entorno oxidante. El plomo se oxida a monóxido de plomo , conocido entonces como litargirio , que captura el oxígeno de los otros metales presentes. El óxido de plomo líquido se elimina o absorbe por acción capilar en los revestimientos del hogar. [88] [89] [90]
En la actualidad, el metal de plata se produce principalmente como subproducto secundario de la refinación electrolítica de cobre, plomo y zinc, y mediante la aplicación del proceso Parkes en lingotes de plomo de mineral que también contiene plata. [91] En tales procesos, la plata sigue al metal no ferroso en cuestión a través de su concentración y fundición, y luego se purifica. Por ejemplo, en la producción de cobre, el cobre purificado se deposita electrolíticamente en el cátodo, mientras que los metales preciosos menos reactivos, como la plata y el oro, se acumulan debajo del ánodo en forma del llamado "limo anódico". Luego, este se separa y se purifica de los metales básicos mediante el tratamiento con ácido sulfúrico diluido aireado caliente y calentamiento con fundente de cal o sílice, antes de que la plata se purifique a más del 99,9% de pureza mediante electrólisis en solución de nitrato . [82]
La plata fina de calidad comercial tiene una pureza de al menos el 99,9% y se encuentran disponibles purezas superiores al 99,999%. En 2022, México fue el principal productor de plata (6.300 toneladas o el 24,2% del total mundial de 26.000 t), seguido de China (3.600 t) y Perú (3.100 t). [91]
La concentración de plata es baja en el agua de mar (pmol/L). Los niveles varían según la profundidad y entre los cuerpos de agua. Las concentraciones de plata disuelta varían de 0,3 pmol/L en aguas superficiales costeras a 22,8 pmol/L en aguas profundas pelágicas. [92] Analizar la presencia y la dinámica de la plata en ambientes marinos es difícil debido a estas concentraciones particularmente bajas y las interacciones complejas en el medio ambiente. [93] Aunque es un metal traza raro, las concentraciones se ven muy afectadas por los aportes fluviales, eólicos, atmosféricos y de afloramiento, así como por los aportes antropogénicos a través de descargas, eliminación de desechos y emisiones de empresas industriales. [94] [95] Otros procesos internos como la descomposición de materia orgánica pueden ser una fuente de plata disuelta en aguas más profundas, que alimenta algunas aguas superficiales a través del afloramiento y la mezcla vertical. [95]
En el Atlántico y el Pacífico, las concentraciones de plata son mínimas en la superficie, pero aumentan en aguas más profundas. [96] La plata es absorbida por el plancton en la zona fótica, removilizada con la profundidad y enriquecida en aguas profundas. La plata es transportada desde el Atlántico a las demás masas de agua oceánicas. [94] En las aguas del Pacífico Norte, la plata se removiliza a un ritmo más lento y se enriquece cada vez más en comparación con las aguas profundas del Atlántico. La plata tiene concentraciones crecientes que siguen la principal cinta transportadora oceánica que cicla el agua y los nutrientes desde el Atlántico Norte al Atlántico Sur y al Pacífico Norte. [97]
No hay una gran cantidad de datos centrados en cómo la plata afecta la vida marina a pesar de los probables efectos nocivos que podría tener sobre los organismos a través de la bioacumulación , la asociación con partículas y la sorción . [92] No fue hasta alrededor de 1984 que los científicos comenzaron a comprender las características químicas de la plata y su potencial toxicidad. De hecho, el mercurio es el único otro metal traza que supera los efectos tóxicos de la plata; no se espera que la toxicidad total de la plata alcance su máximo nivel en condiciones oceánicas debido a su tendencia a transferirse a compuestos biológicos no reactivos. [98]
En un estudio, la presencia de un exceso de plata iónica y nanopartículas de plata provocó efectos de bioacumulación en los órganos del pez cebra y alteró las vías químicas dentro de sus branquias. [99] Además, estudios experimentales muy tempranos demostraron cómo los efectos tóxicos de la plata fluctúan con la salinidad y otros parámetros, así como entre etapas de vida y diferentes especies como peces, moluscos y crustáceos. [100] Otro estudio encontró concentraciones elevadas de plata en los músculos y el hígado de delfines y ballenas, lo que indica contaminación de este metal en las últimas décadas. La plata no es un metal fácil de eliminar para un organismo y las concentraciones elevadas pueden causar la muerte. [101]

Las primeras monedas conocidas fueron acuñadas en el reino de Lidia en Asia Menor alrededor del año 600 a. C. [102] Las monedas de Lidia estaban hechas de electrum , que es una aleación natural de oro y plata, que estaba disponible dentro del territorio de Lidia. [102] Desde entonces, los patrones de plata , en los que la unidad económica estándar de cuenta es un peso fijo de plata, se han extendido por todo el mundo hasta el siglo XX. Las monedas de plata notables a lo largo de los siglos incluyen la dracma griega , [103] el denario romano , [104] el dírham islámico , [105] la karshapana de la antigua India y la rupia de la época del Imperio mogol (agrupada con monedas de cobre y oro para crear un patrón trimetálico), [106] y el dólar español . [107]
La relación entre la cantidad de plata utilizada para acuñar monedas y la utilizada para otros fines ha fluctuado mucho a lo largo del tiempo; por ejemplo, en tiempos de guerra, se tendió a utilizar más plata para acuñar monedas para financiar la guerra. [108]
Hoy en día, el lingote de plata tiene el código monetario ISO 4217 XAG, uno de los cuatro únicos metales preciosos que lo tienen (los otros son el paladio , el platino y el oro). [109] Las monedas de plata se producen a partir de barras o lingotes fundidos, laminados hasta el grosor correcto, tratados térmicamente y luego utilizados para cortar piezas en bruto. Estas piezas en bruto luego se muelen y se acuñan en una prensa de acuñación; las prensas de acuñación modernas pueden producir 8000 monedas de plata por hora. [108]
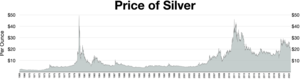
Los precios de la plata se expresan normalmente en onzas troy . Una onza troy equivale a 31,1034768 gramos. El precio de la plata fijado en Londres se publica todos los días laborables al mediodía, hora de Londres. [110] Este precio lo determinan varios bancos internacionales importantes y lo utilizan los miembros del mercado de lingotes de Londres para realizar transacciones ese día. Los precios se muestran más comúnmente en dólares estadounidenses (USD), libras esterlinas (GBP) y euros (EUR).


El principal uso de la plata, además de la acuñación de monedas, a lo largo de la mayor parte de la historia fue la fabricación de joyas y otros artículos de uso general, y este sigue siendo un uso importante en la actualidad. Algunos ejemplos incluyen la plata de mesa para cubiertos, para los que la plata es muy adecuada debido a sus propiedades antibacterianas. Las flautas de concierto occidentales suelen estar bañadas o hechas de plata esterlina ; [112] de hecho, la mayoría de los cubiertos solo están bañados en plata en lugar de estar hechos de plata pura; la plata normalmente se coloca en su lugar mediante galvanoplastia . El vidrio bañado en plata (a diferencia del metal) se utiliza para espejos, termos y adornos para árboles de Navidad. [113]
Como la plata pura es muy blanda, la mayor parte de la plata que se utiliza para estos fines se alea con cobre, siendo comunes las finuras de 925/1000, 835/1000 y 800/1000. Un inconveniente es que la plata se empaña fácilmente en presencia de sulfuro de hidrógeno y sus derivados. La inclusión de metales preciosos como el paladio, el platino y el oro confiere resistencia al empañamiento, pero es bastante costosa; los metales básicos como el zinc , el cadmio , el silicio y el germanio no evitan totalmente la corrosión y tienden a afectar el brillo y el color de la aleación. El enchapado de plata pura refinada electrolíticamente es eficaz para aumentar la resistencia al empañamiento. Las soluciones habituales para restaurar el brillo de la plata empañada son los baños de inmersión que reducen la superficie de sulfuro de plata a plata metálica y la limpieza de la capa de empañamiento con una pasta; este último enfoque también tiene el efecto secundario bienvenido de pulir la plata al mismo tiempo. [112]
En medicina, la plata se incorpora a los apósitos para heridas y se utiliza como revestimiento antibiótico en dispositivos médicos. Los apósitos para heridas que contienen sulfadiazina de plata o nanomateriales de plata se utilizan para tratar infecciones externas. La plata también se utiliza en algunas aplicaciones médicas, como catéteres urinarios (donde la evidencia tentativa indica que reduce las infecciones del tracto urinario relacionadas con el catéter ) y en tubos de respiración endotraqueales (donde la evidencia sugiere que reduce la neumonía asociada al respirador ). [114] [115] El ion de plata es bioactivo y en suficiente concentración mata fácilmente las bacterias in vitro . Los iones de plata interfieren con las enzimas en las bacterias que transportan nutrientes, forman estructuras y sintetizan paredes celulares; estos iones también se unen con el material genético de las bacterias. La plata y las nanopartículas de plata se utilizan como antimicrobianos en una variedad de aplicaciones industriales, de atención médica y domésticas: por ejemplo, infundir ropa con nanopartículas de plata les permite permanecer sin olor durante más tiempo. [116] [117] Las bacterias pueden desarrollar resistencia a la acción antimicrobiana de la plata. [118] Los compuestos de plata son absorbidos por el cuerpo como los compuestos de mercurio , pero carecen de la toxicidad de estos últimos. La plata y sus aleaciones se utilizan en cirugía craneal para reemplazar el hueso, y las amalgamas de plata-estaño-mercurio se utilizan en odontología. [113] El fluoruro de diamina de plata , la sal de fluoruro de un complejo de coordinación con la fórmula [Ag(NH 3 ) 2 ]F, es un medicamento tópico (droga) utilizado para tratar y prevenir la caries dental (cavidades) y aliviar la hipersensibilidad dentinaria. [119]
La plata es muy importante en electrónica para conductores y electrodos debido a su alta conductividad eléctrica incluso cuando está empañada. La plata a granel y las láminas de plata se usaban para hacer tubos de vacío y continúan usándose hoy en día en la fabricación de dispositivos semiconductores, circuitos y sus componentes. Por ejemplo, la plata se usa en conectores de alta calidad para RF , VHF y frecuencias más altas, particularmente en circuitos sintonizados como filtros de cavidad donde los conductores no se pueden escalar en más del 6%. Los circuitos impresos y las antenas RFID se hacen con pinturas de plata, [15] [120] La plata en polvo y sus aleaciones se usan en preparaciones de pasta para capas conductoras y electrodos, capacitores cerámicos y otros componentes cerámicos. [121]
Las aleaciones de soldadura fuerte que contienen plata se utilizan para soldar materiales metálicos, principalmente aleaciones a base de cobalto , níquel y cobre, aceros para herramientas y metales preciosos. Los componentes básicos son plata y cobre, con otros elementos seleccionados de acuerdo con la aplicación específica deseada: los ejemplos incluyen zinc, estaño, cadmio, paladio, manganeso y fósforo . La plata proporciona mayor trabajabilidad y resistencia a la corrosión durante el uso. [122]
La plata es útil en la fabricación de equipos químicos debido a su baja reactividad química, alta conductividad térmica y su fácil manejo. Los crisoles de plata (aleados con 0,15% de níquel para evitar la recristalización del metal al rojo vivo) se utilizan para llevar a cabo la fusión alcalina. El cobre y la plata también se utilizan cuando se hace química con flúor . Los equipos fabricados para trabajar a altas temperaturas suelen estar revestidos de plata. La plata y sus aleaciones con oro se utilizan como sellos de alambre o anillo para compresores de oxígeno y equipos de vacío. [123]
El metal de plata es un buen catalizador para las reacciones de oxidación ; de hecho, es demasiado bueno para la mayoría de los propósitos, ya que la plata finamente dividida tiende a dar como resultado una oxidación completa de las sustancias orgánicas a dióxido de carbono y agua, y por lo tanto, se tiende a utilizar plata de grano más grueso en su lugar. Por ejemplo, la plata al 15% soportada en α-Al 2 O 3 o silicatos es un catalizador para la oxidación de etileno a óxido de etileno a 230-270 °C. La deshidrogenación de metanol a formaldehído se lleva a cabo a 600-720 °C sobre gasa de plata o cristales como catalizador, al igual que la deshidrogenación de isopropanol a acetona . En la fase gaseosa, el glicol produce glioxal y el etanol produce acetaldehído , mientras que las aminas orgánicas se deshidratan a nitrilos . [123]
Antes de la llegada de la fotografía digital , que ahora es dominante, se aprovechaba la fotosensibilidad de los haluros de plata para su uso en la fotografía en película tradicional. La emulsión fotosensible que se utiliza en la fotografía en blanco y negro es una suspensión de cristales de haluro de plata en gelatina , posiblemente mezclados con algunos compuestos de metales nobles para mejorar la fotosensibilidad, el revelado y el ajuste [ aclarar ] .
La fotografía en color requiere la adición de componentes colorantes y sensibilizadores especiales, de modo que la imagen inicial en blanco y negro en plata se acople con un componente colorante diferente. Las imágenes originales en plata se blanquean y luego la plata se recupera y se recicla. El nitrato de plata es el material de partida en todos los casos. [124]
El mercado del nitrato de plata y de los haluros de plata para fotografía ha declinado rápidamente con el auge de las cámaras digitales. Desde el pico de demanda mundial de plata fotográfica en 1999 (267.000.000 onzas troy u 8.304,6 toneladas ), el mercado se contrajo casi un 70% en 2013. [125]
Las nanopartículas de plata, de entre 10 y 100 nanómetros de tamaño, se utilizan en muchas aplicaciones. Se utilizan en tintas conductoras para electrónica impresa y tienen un punto de fusión mucho más bajo que las partículas de plata más grandes de tamaño micrométrico. [126] También se utilizan con fines medicinales en antibacterianos y antifúngicos de la misma manera que las partículas de plata más grandes. [117] Además, según el Observatorio de Nanomateriales de la Unión Europea (EUON), las nanopartículas de plata se utilizan tanto en pigmentos como en cosméticos. [127] [128]

El metal de plata pura se utiliza como colorante alimentario. Tiene la designación E174 y está aprobado en la Unión Europea . [129] Los platos tradicionales indios y pakistaníes a veces incluyen papel de plata decorativo conocido como vark , [130] y en varias otras culturas, las grageas de plata se utilizan para decorar pasteles, galletas y otros postres. [131]
Las lentes fotocromáticas incluyen haluros de plata, de modo que la luz ultravioleta de la luz natural libera plata metálica, oscureciendo las lentes. Los haluros de plata se reforman en intensidades de luz más bajas. Las películas de cloruro de plata incoloras se utilizan en detectores de radiación . Los tamices de zeolita que incorporan iones Ag + se utilizan para desalinizar el agua de mar durante los rescates, utilizando iones de plata para precipitar el cloruro como cloruro de plata. La plata también se utiliza por sus propiedades antibacterianas para la higienización del agua, pero la aplicación de esto está limitada por los límites en el consumo de plata. La plata coloidal se utiliza de manera similar para desinfectar piscinas cerradas; si bien tiene la ventaja de no emitir un olor como lo hacen los tratamientos con hipoclorito , la plata coloidal no es lo suficientemente efectiva para piscinas abiertas más contaminadas. Los pequeños cristales de yoduro de plata se utilizan en la siembra de nubes para provocar lluvia. [117]
La Legislatura de Texas designó a la plata como el metal precioso oficial de Texas en 2007. [132]
Los compuestos de plata tienen una toxicidad baja en comparación con la mayoría de los otros metales pesados , ya que son poco absorbidos por el cuerpo humano cuando se ingieren, y lo que se absorbe se convierte rápidamente en compuestos de plata insolubles o se compleja con metalotioneína . El fluoruro de plata y el nitrato de plata son cáusticos y pueden causar daño tisular, lo que resulta en gastroenteritis , diarrea , caída de la presión arterial , calambres, parálisis o paro respiratorio . Se ha observado que los animales a los que se les administran repetidamente sales de plata experimentan anemia , crecimiento lento, necrosis del hígado y degeneración grasa del hígado y los riñones; se ha observado que las ratas implantadas con papel de plata o inyectadas con plata coloidal desarrollan tumores localizados. La plata coloidal administrada por vía parenteral causa intoxicación aguda por plata. [134] Algunas especies transmitidas por el agua son particularmente sensibles a las sales de plata y las de otros metales preciosos; en la mayoría de las situaciones, la plata no es un peligro ambiental grave. [134]
En grandes dosis, la plata y los compuestos que la contienen pueden ser absorbidos por el sistema circulatorio y depositarse en varios tejidos corporales, lo que produce argiria , que produce una pigmentación azul grisácea de la piel, los ojos y las mucosas . La argiria es poco frecuente y, hasta donde se sabe, no daña la salud de la persona, aunque es desfigurante y generalmente permanente. Las formas leves de argiria a veces se confunden con cianosis , un tinte azul en la piel causado por la falta de oxígeno. [134] [15]
La plata metálica, al igual que el cobre, es un agente antibacteriano conocido por los antiguos y que Carl Nägeli investigó científicamente por primera vez y denominó efecto oligodinámico . Los iones de plata dañan el metabolismo de las bacterias incluso en concentraciones tan bajas como 0,01-0,1 miligramos por litro; la plata metálica tiene un efecto similar debido a la formación de óxido de plata. Este efecto se pierde en presencia de azufre debido a la extrema insolubilidad del sulfuro de plata. [134]
Algunos compuestos de plata son muy explosivos, como los compuestos nitrogenados azida de plata, amida de plata y fulminato de plata, así como acetiluro de plata , oxalato de plata y óxido de plata (II). Pueden explotar al calentarlos, forzarlos, secarlos, iluminarlos o, a veces, de forma espontánea. Para evitar la formación de dichos compuestos, el amoníaco y el acetileno deben mantenerse alejados de los equipos de plata. Las sales de plata con ácidos fuertemente oxidantes, como el clorato de plata y el nitrato de plata, pueden explotar al entrar en contacto con materiales que se pueden oxidar fácilmente, como compuestos orgánicos, azufre y hollín. [134]