La retina (del latín rete , «red»; pl. retinae o retinas ) es la capa de tejido más interna y sensible a la luz del ojo de la mayoría de los vertebrados y algunos moluscos . La óptica del ojo crea una imagen bidimensional enfocada del mundo visual en la retina, que luego procesa esa imagen dentro de la retina y envía impulsos nerviosos a lo largo del nervio óptico a la corteza visual para crear la percepción visual . La retina cumple una función que es en muchos sentidos análoga a la de la película o el sensor de imagen de una cámara .
La retina neuronal consta de varias capas de neuronas interconectadas por sinapsis y está sostenida por una capa externa de células epiteliales pigmentadas. Las células sensibles a la luz primarias en la retina son las células fotorreceptoras , que son de dos tipos: bastones y conos . Los bastones funcionan principalmente en condiciones de poca luz y proporcionan una visión monocromática. Los conos funcionan en condiciones de buena iluminación y son responsables de la percepción del color mediante el uso de una variedad de opsinas , así como de la visión de alta agudeza utilizada para tareas como la lectura. Un tercer tipo de célula sensible a la luz, la célula ganglionar fotosensible , es importante para el arrastre de ritmos circadianos y respuestas reflejas como el reflejo pupilar a la luz .
La luz que llega a la retina desencadena una cascada de fenómenos químicos y eléctricos que, en última instancia, desencadenan impulsos nerviosos que se envían a varios centros visuales del cerebro a través de las fibras del nervio óptico . Las señales neuronales de los bastones y los conos son procesadas por otras neuronas, cuya salida toma la forma de potenciales de acción en las células ganglionares de la retina cuyos axones forman el nervio óptico. [1]
En el desarrollo embrionario de los vertebrados , la retina y el nervio óptico se originan como excrecencias del cerebro en desarrollo, específicamente del diencéfalo embrionario ; por lo tanto, la retina se considera parte del sistema nervioso central (SNC) y en realidad es tejido cerebral. [2] [3] Es la única parte del SNC que se puede visualizar de forma no invasiva . Como la mayor parte del cerebro, la retina está aislada del sistema vascular por la barrera hematoencefálica . La retina es la parte del cuerpo con la mayor demanda continua de energía. [4]
La retina de los vertebrados está invertida en el sentido de que las células sensibles a la luz están en la parte posterior de la retina, de modo que la luz tiene que pasar a través de capas de neuronas y capilares antes de llegar a las secciones fotosensibles de los bastones y conos. [5] Las células ganglionares, cuyos axones forman el nervio óptico, están en la parte delantera de la retina; por lo tanto, el nervio óptico debe atravesar la retina en su camino hacia el cerebro. No hay fotorreceptores en esta región, lo que da lugar al punto ciego . [6] Por el contrario, en la retina de los cefalópodos , los fotorreceptores están al frente, con neuronas de procesamiento y capilares detrás de ellos. Debido a esto, los cefalópodos no tienen un punto ciego.
Aunque el tejido neural suprayacente es parcialmente transparente y se ha demostrado que las células gliales que lo acompañan actúan como canales de fibra óptica para transportar fotones directamente a los fotorreceptores, [7] [8] se produce dispersión de la luz . [9] Algunos vertebrados, incluidos los humanos, tienen una zona de la retina central adaptada para una visión de alta agudeza. Esta zona, denominada fóvea central , es avascular (no tiene vasos sanguíneos) y tiene un tejido neural mínimo delante de los fotorreceptores, lo que minimiza la dispersión de la luz. [9]
Los cefalópodos tienen una retina no invertida, que es comparable en poder de resolución a los ojos de muchos vertebrados. Los ojos de los calamares no tienen un análogo del epitelio pigmentario de la retina (EPR) de los vertebrados. Aunque sus fotorreceptores contienen una proteína, el retinocromo, que recicla la retina y replica una de las funciones del EPR de los vertebrados, es probable que los fotorreceptores de los cefalópodos no se mantengan tan bien como en los vertebrados y que, como resultado, la vida útil de los fotorreceptores en los invertebrados sea mucho más corta que en los vertebrados. [10] Tener ojos pedunculados fácilmente reemplazables (algunas langostas) o retinas (algunas arañas, como Deinopis [11] ) es algo que ocurre raramente.
La retina de los cefalópodos no se origina como una extensión del cerebro, como ocurre en los vertebrados. Esta diferencia sugiere que los ojos de los vertebrados y los de los cefalópodos no son homólogos , sino que han evolucionado por separado. Desde una perspectiva evolutiva, una estructura más compleja como la retina invertida puede surgir generalmente como consecuencia de dos procesos alternativos: un "buen" compromiso ventajoso entre limitaciones funcionales en pugna, o como una reliquia histórica desadaptativa del enrevesado camino de la evolución y transformación de los órganos. La visión es una adaptación importante en los vertebrados superiores.
Una tercera visión del ojo vertebrado "invertido" es que combina dos beneficios: el mantenimiento de los fotorreceptores mencionados anteriormente y la reducción de la intensidad de la luz necesaria para evitar cegar a los fotorreceptores, que se basan en los ojos extremadamente sensibles de los ancestros de los mixinos modernos (peces que viven en aguas muy profundas y oscuras). [12]
Un estudio reciente de la APS (American Physical Society) sobre el propósito evolutivo de la estructura de la retina invertida [13] dice que "la dirección de las células gliales ayuda a aumentar la claridad de la visión humana. Pero también notamos algo bastante curioso: los colores que mejor pasaban a través de las células gliales eran el verde y el rojo, que el ojo necesita más para la visión diurna. El ojo suele recibir demasiado azul y, por lo tanto, tiene menos conos sensibles al azul.
Simulaciones por ordenador posteriores demostraron que las células gliales y sus respectivos conos concentran la luz verde y roja entre cinco y diez veces más que la luz azul. En cambio, el exceso de luz azul se dispersa hacia los bastones circundantes. Esta optimización es tal que la visión del color durante el día mejora, mientras que la visión nocturna se ve muy poco afectada".
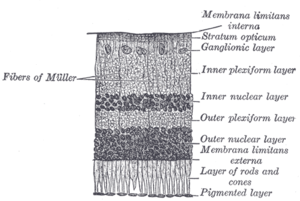



La retina de los vertebrados tiene 10 capas distintas. [15] De más cercana a más lejana del cuerpo vítreo:
Estas capas se pueden agrupar en cuatro etapas principales de procesamiento: fotorrecepción; transmisión a las células bipolares ; transmisión a las células ganglionares , que también contienen fotorreceptores, las células ganglionares fotosensibles ; y transmisión a lo largo del nervio óptico. En cada etapa sináptica, las células horizontales y amacrinas también están conectadas lateralmente.
El nervio óptico es un tracto central de muchos axones de células ganglionares que se conectan principalmente al cuerpo geniculado lateral , una estación de relevo visual en el diencéfalo (la parte posterior del prosencéfalo). También se proyecta al colículo superior , al núcleo supraquiasmático y al núcleo del tracto óptico. Pasa a través de las otras capas, creando el disco óptico en los primates. [21]
En algunos grupos de vertebrados se encuentran estructuras adicionales, no directamente asociadas con la visión, que se desarrollan a partir de la retina. En las aves , el pecten es una estructura vascular de forma compleja que se proyecta desde la retina hacia el humor vítreo ; suministra oxígeno y nutrientes al ojo y también puede ayudar a la visión. Los reptiles tienen una estructura similar, pero mucho más simple. [22]
En los humanos adultos, la retina entera es aproximadamente el 72% de una esfera de unos 22 mm de diámetro. La retina entera contiene alrededor de 7 millones de conos y de 75 a 150 millones de bastones. El disco óptico, una parte de la retina a veces llamada "el punto ciego" porque carece de fotorreceptores, está ubicado en la papila óptica , por donde las fibras del nervio óptico salen del ojo. Aparece como un área blanca ovalada de 3 mm 2 . Temporal (en la dirección de las sienes) a este disco está la mácula , en cuyo centro está la fóvea , una fosa que es responsable de la visión central nítida, pero que en realidad es menos sensible a la luz debido a su falta de bastones. Los primates humanos y no humanos poseen una fóvea, a diferencia de ciertas especies de aves, como los halcones, que son bifoviales, y los perros y gatos, que no poseen fóvea, sino una banda central conocida como la raya visual. [ cita requerida ] Alrededor de la fóvea se extiende la retina central durante unos 6 mm y luego la retina periférica. El borde más alejado de la retina está definido por la ora serrata . La distancia de una ora a la otra (o mácula), la zona más sensible a lo largo del meridiano horizontal , es de unos 32 mm. [ aclaración necesaria ]
En sección, la retina no tiene más de 0,5 mm de espesor. Tiene tres capas de células nerviosas y dos de sinapsis , incluida la sinapsis en cinta . El nervio óptico lleva los axones de las células ganglionares al cerebro y los vasos sanguíneos que irrigan la retina. Las células ganglionares se encuentran en la parte más interna del ojo, mientras que las células fotorreceptoras se encuentran más allá. Debido a esta disposición contraintuitiva, la luz primero debe pasar a través y alrededor de las células ganglionares y a través del espesor de la retina (incluidos sus vasos capilares, que no se muestran) antes de llegar a los bastones y conos. La luz es absorbida por el epitelio pigmentario de la retina o la coroides (ambos opacos).
Los glóbulos blancos de los capilares situados delante de los fotorreceptores pueden percibirse como pequeños puntos brillantes en movimiento cuando se los mira hacia una luz azul. Esto se conoce como fenómeno entóptico del campo azul (o fenómeno de Scheerer).
Entre la capa de células ganglionares y los conos y bastones hay dos capas de neuropilos , donde se realizan los contactos sinápticos. Las capas de neuropilos son la capa plexiforme externa y la capa plexiforme interna . En la capa de neuropilo externa, los conos y bastones se conectan a las células bipolares que corren verticalmente , y las células horizontales orientadas horizontalmente se conectan a las células ganglionares.
La retina central contiene predominantemente conos, mientras que la retina periférica contiene predominantemente bastones. En total, la retina tiene alrededor de siete millones de conos y cien millones de bastones. En el centro de la mácula se encuentra la fosa foveal donde los conos son estrechos y largos, y están dispuestos en un mosaico hexagonal , el más denso, en contraposición a los conos mucho más gruesos ubicados más periféricamente en la retina. [23] En la fosa foveal, las otras capas de la retina se desplazan, antes de acumularse a lo largo de la pendiente foveal hasta que se alcanza el borde de la fóvea, o parafóvea , que es la porción más gruesa de la retina. La mácula tiene una pigmentación amarilla, a partir de pigmentos de cribado, y se conoce como mácula lútea. El área que rodea directamente la fóvea tiene la mayor densidad de bastones que convergen en células bipolares individuales. Dado que sus conos tienen una convergencia de señales mucho menor, la fóvea permite la visión más nítida que el ojo puede alcanzar. [2]
Aunque los bastones y los conos forman una especie de mosaico , la transmisión desde los receptores a los bipolares y a las células ganglionares no es directa. Dado que existen unos 150 millones de receptores y sólo un millón de fibras del nervio óptico, debe producirse una convergencia y, por tanto, una mezcla de señales. Además, la acción horizontal de las células horizontales y amacrinas puede permitir que una zona de la retina controle a otra (por ejemplo, un estímulo inhibe a otro). Esta inhibición es clave para reducir la suma de mensajes enviados a las regiones superiores del cerebro. En algunos vertebrados inferiores (por ejemplo, la paloma ), el control de los mensajes es "centrífugo", es decir, una capa puede controlar a otra, o las regiones superiores del cerebro pueden controlar las células nerviosas de la retina, pero en los primates esto no ocurre. [2]
Mediante la tomografía de coherencia óptica (OCT) se pueden identificar 18 capas en la retina. Las capas y la correlación anatómica son: [24] [25] [26]



De más interna a más externa, las capas identificables por OCT son las siguientes:
El desarrollo de la retina comienza con el establecimiento de los campos oculares mediado por las proteínas SHH y SIX3 , con el desarrollo posterior de las vesículas ópticas reguladas por las proteínas PAX6 y LHX2 . [33] El papel de Pax6 en el desarrollo del ojo fue elegantemente demostrado por Walter Gehring y colegas, quienes mostraron que la expresión ectópica de Pax6 puede conducir a la formación del ojo en las antenas, alas y patas de Drosophila . [34] La vesícula óptica da lugar a tres estructuras: la retina neural, el epitelio pigmentado de la retina y el tallo óptico. La retina neural contiene las células progenitoras de la retina (RPC) que dan lugar a los siete tipos de células de la retina. La diferenciación comienza con las células ganglionares de la retina y concluye con la producción de la glía de Müller. [35] Aunque cada tipo de célula se diferencia de las RPC en un orden secuencial, existe una superposición considerable en el momento en que los tipos de células individuales se diferencian. [33] Las señales que determinan el destino de una célula hija de RPC están codificadas por múltiples familias de factores de transcripción, incluidos los factores bHLH y homeodominio . [36] [37]
Además de guiar la determinación del destino celular, existen señales en la retina para determinar los ejes dorso-ventral (DV) y nasal-temporal (NT). El eje DV se establece mediante un gradiente ventral a dorsal de VAX2 , mientras que el eje NT se coordina mediante la expresión de los factores de transcripción forkhead FOXD1 y FOXG1 . Se forman gradientes adicionales dentro de la retina. [37] Esta distribución espacial puede ayudar a la orientación adecuada de los axones RGC que funcionan para establecer el mapa retinotópico. [33]

La retina está estratificada en capas distintas, cada una de las cuales contiene tipos de células o compartimentos celulares específicos [38] que tienen metabolismos con diferentes requerimientos nutricionales. [39] Para satisfacer estos requerimientos, la arteria oftálmica se bifurca y abastece la retina a través de dos redes vasculares distintas: la red coroidea, que abastece la coroides y la retina externa, y la red retiniana, que abastece la capa interna de la retina. [40]
Aunque la retina invertida de los vertebrados parece contraintuitiva, es necesaria para el correcto funcionamiento de la retina. La capa de fotorreceptores debe estar incrustada en el epitelio pigmentario de la retina (EPR), que realiza al menos siete funciones vitales, [41] una de las más obvias es suministrar oxígeno y otros nutrientes necesarios para que los fotorreceptores funcionen.
Las necesidades energéticas de la retina son incluso mayores que las del cerebro. [4] Esto se debe a la energía adicional necesaria para renovar continuamente los segmentos externos de los fotorreceptores, de los cuales el 10% se desprende diariamente. [4] Las demandas energéticas son mayores durante la adaptación a la oscuridad, cuando su sensibilidad es más aumentada. [42] La coroides suministra alrededor del 75% de estos nutrientes a la retina y la vasculatura retiniana solo el 25%. [5]
Cuando la luz incide en el 11-cis-retinal (en los discos de los bastones y conos), el 11-cis-retinal cambia a todo-trans-retinal, lo que desencadena cambios en las opsinas. Ahora bien, los segmentos externos no regeneran el retinal de nuevo en la forma cis una vez que ha sido modificado por la luz. En cambio, el retinal se bombea al epitelio pigmentario retiniano circundante, donde se regenera y se transporta de nuevo a los segmentos externos de los fotorreceptores. Esta función de reciclaje del epitelio pigmentario retiniano protege a los fotorreceptores contra el daño fotooxidativo [43] [44] y permite que las células fotorreceptoras tengan una vida útil de décadas.
La retina de las aves carece de vasos sanguíneos, tal vez para permitir el paso de la luz sin obstáculos para la formación de imágenes, lo que proporciona una mejor resolución. Por lo tanto, se considera que la retina de las aves depende para su nutrición y suministro de oxígeno de un órgano especializado, llamado "pecten" o pecten oculi , ubicado en el punto ciego o disco óptico. Este órgano es extremadamente rico en vasos sanguíneos y se cree que suministra nutrición y oxígeno a la retina de las aves mediante difusión a través del cuerpo vítreo. El pecten es muy rico en actividad de fosfatasa alcalina y células polarizadas en su porción de puente, ambas adecuadas para su función secretora. [45] Las células del pecten están repletas de gránulos de melanina oscura, que se ha teorizado que mantienen este órgano caliente con la absorción de la luz difusa que cae sobre el pecten. Se considera que esto mejora la tasa metabólica del pecten, exportando así más moléculas nutritivas para satisfacer los estrictos requisitos de energía de la retina durante largos períodos de exposición a la luz. [46]
Se sabe que las bifurcaciones y otras características físicas de la red vascular retiniana interna varían entre individuos [47] , y estas variaciones individuales se han utilizado para la identificación biométrica y para la detección temprana de la aparición de enfermedades. El mapeo de las bifurcaciones vasculares es uno de los pasos básicos en la identificación biométrica [48] . Los resultados de tales análisis de la estructura de los vasos sanguíneos de la retina se pueden evaluar en comparación con los datos de verdad fundamental [49] de las bifurcaciones vasculares de las imágenes del fondo de ojo de la retina que se obtienen del conjunto de datos DRIVE [50] . Además, también se han identificado las clases de vasos del conjunto de datos DRIVE [51] y también está disponible un método automatizado para la extracción precisa de estas bifurcaciones [52] . Se observan cambios en la circulación sanguínea de la retina con el envejecimiento [53] y la exposición a la contaminación del aire [54] , y pueden indicar enfermedades cardiovasculares como la hipertensión y la aterosclerosis. [55] [56] [57] La determinación del ancho equivalente de arteriolas y vénulas cerca del disco óptico también es una técnica ampliamente utilizada para identificar riesgos cardiovasculares. [58]
La retina traduce una imagen óptica en impulsos neuronales a partir de la excitación pautada de los pigmentos sensibles al color de sus bastones y conos, las células fotorreceptoras de la retina . La excitación es procesada por el sistema neuronal y varias partes del cerebro que trabajan en paralelo para formar una representación del entorno externo en el cerebro. [ cita requerida ]
Los conos responden a la luz brillante y median la visión de color de alta resolución durante la iluminación de la luz del día (también llamada visión fotópica ). Las respuestas de los bastones están saturadas en los niveles de luz del día y no contribuyen a la visión de patrones. Sin embargo, los bastones sí responden a la luz tenue y median la visión monocromática de menor resolución en niveles muy bajos de iluminación (llamada visión escotópica ). La iluminación en la mayoría de los entornos de oficina se encuentra entre estos dos niveles y se llama visión mesópica . En los niveles de luz mesópica, tanto los bastones como los conos contribuyen activamente a la información de patrones. No está claro qué contribución hace la información de los bastones a la visión de patrones en estas circunstancias.
La respuesta de los conos a varias longitudes de onda de luz se llama sensibilidad espectral. En la visión humana normal, la sensibilidad espectral de un cono cae en uno de tres subtipos, a menudo llamados azul, verde y rojo, pero más exactamente conocidos como subtipos de cono sensibles a longitudes de onda cortas, medias y largas. Es la falta de uno o más de los subtipos de cono lo que hace que las personas tengan deficiencias en la visión del color o varios tipos de daltonismo . Estas personas no son ciegas a los objetos de un color particular, pero son incapaces de distinguir entre colores que pueden ser distinguidos por personas con visión normal. Los humanos tienen esta visión tricromática , mientras que la mayoría de los demás mamíferos carecen de conos con pigmento sensible al rojo y, por lo tanto, tienen una visión del color dicromática más pobre. Sin embargo, algunos animales tienen cuatro subtipos espectrales, por ejemplo, la trucha agrega un subgrupo ultravioleta a los subtipos corto, medio y largo que son similares a los humanos. Algunos peces también son sensibles a la polarización de la luz.
En los fotorreceptores, la exposición a la luz hiperpolariza la membrana en una serie de cambios graduales. El segmento celular externo contiene un fotopigmento . Dentro de la célula, los niveles normales de guanosina monofosfato cíclico (cGMP) mantienen abierto el canal de Na+ y, por lo tanto, en estado de reposo, la célula está despolarizada. El fotón hace que el retinal unido a la proteína receptora se isomerice a transretinal . Esto hace que el receptor active múltiples proteínas G. Esto, a su vez, hace que la subunidad Ga de la proteína active una fosfodiesterasa (PDE6), que degrada cGMP, lo que resulta en el cierre de los canales iónicos regulados por nucleótidos cíclicos (CNG) de Na+. Por lo tanto, la célula está hiperpolarizada. La cantidad de neurotransmisor liberado se reduce en la luz brillante y aumenta a medida que disminuyen los niveles de luz. El fotopigmento real se blanquea en la luz brillante y solo se reemplaza como un proceso químico, por lo que en una transición de la luz brillante a la oscuridad, el ojo puede tardar hasta treinta minutos en alcanzar la sensibilidad completa.
Cuando se excita de esta manera por la luz, el fotorreceptor envía una respuesta proporcional sinápticamente a las células bipolares que a su vez envían señales a las células ganglionares de la retina . Los fotorreceptores también están interconectados por células horizontales y células amacrinas , que modifican la señal sináptica antes de que llegue a las células ganglionares, y las señales neuronales se entremezclan y combinan. De las células nerviosas de la retina, solo las células ganglionares de la retina y algunas células amacrinas crean potenciales de acción .
En las células ganglionares de la retina existen dos tipos de respuesta, dependiendo del campo receptivo de la célula. Los campos receptivos de las células ganglionares de la retina comprenden una zona central, aproximadamente circular, donde la luz tiene un efecto sobre la activación de la célula, y un entorno anular, donde la luz tiene el efecto opuesto. En las células ON, un aumento de la intensidad de la luz en el centro del campo receptivo hace que la tasa de activación aumente. En las células OFF, la hace disminuir. En un modelo lineal, este perfil de respuesta se describe bien mediante una diferencia de gaussianas y es la base de los algoritmos de detección de bordes . Más allá de esta simple diferencia, las células ganglionares también se diferencian por la sensibilidad cromática y el tipo de suma espacial. Las células que muestran una suma espacial lineal se denominan células X (también llamadas parvocelulares, P o células ganglionares enanas), y las que muestran una suma no lineal son células Y (también llamadas magnocelulares, M o células ganglionares de la retina parasol), aunque la correspondencia entre las células X e Y (en la retina del gato) y las células P y M (en la retina de los primates) no es tan simple como parecía.
En la transmisión de las señales visuales al cerebro, la vía visual , la retina se divide verticalmente en dos: una mitad temporal (más cercana a la sien) y una mitad nasal (más cercana a la nariz). Los axones de la mitad nasal cruzan el cerebro en el quiasma óptico para unirse con los axones de la mitad temporal del otro ojo antes de pasar al cuerpo geniculado lateral .
Aunque hay más de 130 millones de receptores retinianos, sólo hay aproximadamente 1,2 millones de fibras (axones) en el nervio óptico. Por lo tanto, una gran cantidad de preprocesamiento se realiza dentro de la retina. La fóvea produce la información más precisa. A pesar de ocupar alrededor del 0,01% del campo visual (menos de 2° de ángulo visual ), alrededor del 10% de los axones del nervio óptico están dedicados a la fóvea. Se ha determinado que el límite de resolución de la fóvea es de alrededor de 10.000 puntos. La capacidad de información se estima en 500.000 bits por segundo (para más información sobre bits, véase teoría de la información ) sin color o alrededor de 600.000 bits por segundo incluyendo el color. [59]

Cuando la retina envía impulsos neuronales que representan una imagen al cerebro, codifica espacialmente (comprime) esos impulsos para que se ajusten a la capacidad limitada del nervio óptico. La compresión es necesaria porque hay 100 veces más células fotorreceptoras que células ganglionares . Esto se realiza mediante la " descorrelación ", que se lleva a cabo por las "estructuras centro-envolvente", que son implementadas por las células bipolares y ganglionares.
Existen dos tipos de estructuras centro-entorno en la retina: las centradas y las descentradas. Las centradas tienen un centro ponderado positivamente y un entorno ponderado negativamente. Las descentradas son exactamente lo opuesto. La ponderación positiva se conoce más comúnmente como excitatoria y la ponderación negativa como inhibitoria .
Estas estructuras centro-envolventes no son aparentes físicamente, en el sentido de que no se pueden ver tiñendo muestras de tejido ni examinando la anatomía de la retina. Las estructuras centro-envolventes son lógicas (es decir, matemáticamente abstractas) en el sentido de que dependen de la fuerza de conexión entre las células bipolares y ganglionares. Se cree que la fuerza de conexión entre las células se debe a la cantidad y los tipos de canales iónicos incrustados en las sinapsis entre las células bipolares y ganglionares.
Las estructuras centro-entorno son matemáticamente equivalentes a los algoritmos de detección de bordes que utilizan los programadores informáticos para extraer o mejorar los bordes de una fotografía digital. De este modo, la retina realiza operaciones sobre los impulsos que representan la imagen para mejorar los bordes de los objetos dentro de su campo visual. Por ejemplo, en una fotografía de un perro, un gato y un coche, son los bordes de estos objetos los que contienen la mayor parte de la información. Para que las funciones superiores del cerebro (o de un ordenador, en este caso) extraigan y clasifiquen objetos como un perro y un gato, la retina es el primer paso para separar los distintos objetos dentro de la escena.
Como ejemplo, la siguiente matriz es el núcleo de un algoritmo informático que implementa la detección de bordes. Esta matriz es el equivalente informático de la estructura centro-entorno. En este ejemplo, cada cuadro (elemento) dentro de esta matriz estaría conectado a un fotorreceptor. El fotorreceptor en el centro es el receptor actual que se está procesando. El fotorreceptor central se multiplica por el factor de ponderación +1. Los fotorreceptores circundantes son los "vecinos más cercanos" al centro y se multiplican por el valor -1/8. Finalmente, se calcula la suma de estos nueve elementos. Esta suma se repite para cada fotorreceptor en la imagen desplazándose hacia la izquierda hasta el final de una fila y luego hacia abajo hasta la siguiente línea.
La suma total de esta matriz es cero, si todas las entradas de los nueve fotorreceptores tienen el mismo valor. El resultado cero indica que la imagen era uniforme (no cambiaba) dentro de este pequeño parche. Las sumas negativas o positivas significan que la imagen variaba (cambiaba) dentro de este pequeño parche de nueve fotorreceptores.
La matriz anterior es sólo una aproximación a lo que realmente ocurre dentro de la retina. Las diferencias son:
A continuación se muestra un ejemplo de una imagen de entrada y cómo la detección de bordes la modificaría.
Una vez que la imagen está codificada espacialmente por las estructuras centro-periferia, la señal se envía a lo largo del nervio óptico (a través de los axones de las células ganglionares) a través del quiasma óptico hasta el núcleo geniculado lateral (NGL ). La función exacta del NGL se desconoce en este momento. La salida del NGL se envía luego a la parte posterior del cerebro. Específicamente, la salida del NGL "irradia" hacia la corteza visual primaria V1 .
Flujo de señal simplificado: Fotorreceptores → Bipolar → Ganglio → Quiasma → LGN → Corteza V1
Existen muchas enfermedades o trastornos hereditarios y adquiridos que pueden afectar la retina. Algunas de ellas son:
Además, se ha descrito la retina como una "ventana" hacia el cerebro y el cuerpo, dado que las anomalías detectadas a través de un examen de la retina pueden descubrir enfermedades tanto neurológicas como sistémicas. [61]
Existen diversos instrumentos disponibles para el diagnóstico de enfermedades y trastornos que afectan a la retina. La oftalmoscopia y la fotografía del fondo de ojo se han utilizado durante mucho tiempo para examinar la retina. Recientemente, se ha utilizado la óptica adaptativa para obtener imágenes de bastones y conos individuales en la retina humana viva, y una empresa con sede en Escocia ha diseñado una tecnología que permite a los médicos observar la retina completa sin ninguna molestia para los pacientes. [62]
El electrorretinograma se utiliza para medir de forma no invasiva la actividad eléctrica de la retina, que se ve afectada por ciertas enfermedades. Una tecnología relativamente nueva, que ahora se está volviendo ampliamente disponible, es la tomografía de coherencia óptica (OCT). Esta técnica no invasiva permite obtener una tomografía tridimensional volumétrica o transversal de alta resolución de las estructuras finas de la retina, con calidad histológica . El análisis de los vasos retinianos es un método no invasivo para examinar las pequeñas arterias y venas de la retina que permite extraer conclusiones sobre la morfología y la función de los pequeños vasos en otras partes del cuerpo humano. Se ha establecido como un predictor de la enfermedad cardiovascular [63] y parece tener, según un estudio publicado en 2019, potencial en la detección temprana de la enfermedad de Alzheimer. [64]
El tratamiento depende de la naturaleza de la enfermedad o trastorno.
Las siguientes son modalidades comunes de tratamiento para la enfermedad de la retina:
Terapia génica de la retina
La terapia génica es una vía prometedora para curar una amplia gama de enfermedades de la retina. Esto implica el uso de un virus no infeccioso para transportar un gen a una parte de la retina. Los vectores de virus adenoasociados recombinantes (rAAV) poseen una serie de características que los hacen ideales para la terapia génica de la retina, incluida la falta de patogenicidad, inmunogenicidad mínima y la capacidad de transducir células postmitóticas de manera estable y eficiente. [65] Los vectores rAAV se utilizan cada vez más por su capacidad para mediar la transducción eficiente del epitelio pigmentario de la retina (RPE), las células fotorreceptoras y las células ganglionares de la retina . Cada tipo de célula puede ser el objetivo específico eligiendo la combinación adecuada de serotipo de AAV , promotor y sitio de inyección intraocular.
Varios ensayos clínicos ya han informado de resultados positivos utilizando rAAV para tratar la amaurosis congénita de Leber , demostrando que la terapia era segura y eficaz. [66] [67] No hubo eventos adversos graves, y los pacientes en los tres estudios mostraron una mejoría en su función visual medida por varios métodos. Los métodos utilizados variaron entre los tres ensayos, pero incluyeron tanto métodos funcionales como la agudeza visual [67] [68] [69] y la movilidad funcional [68] [69] [70] así como medidas objetivas que son menos susceptibles al sesgo, como la capacidad de la pupila para responder a la luz [66] [71] y mejoras en la resonancia magnética funcional. [72] Las mejoras se mantuvieron a largo plazo, y los pacientes siguieron estando bien después de más de 1,5 años. [66] [67]
La arquitectura única de la retina y su entorno relativamente privilegiado desde el punto de vista inmunológico ayudan a este proceso. [73] Las uniones estrechas que forman la barrera hematorretiniana separan el espacio subretinal del suministro de sangre, protegiéndolo así de los microbios y la mayoría de los daños mediados por el sistema inmunológico, y mejorando su potencial para responder a las terapias mediadas por vectores. La anatomía altamente compartimentalizada del ojo facilita la administración precisa de suspensiones de vectores terapéuticos a tejidos específicos bajo visualización directa mediante técnicas microquirúrgicas. [74] En el entorno protegido de la retina, los vectores AAV pueden mantener altos niveles de expresión de transgenes en el epitelio pigmentado de la retina (EPR), los fotorreceptores o las células ganglionares durante largos períodos de tiempo después de un solo tratamiento. Además, el ojo y el sistema visual pueden ser monitoreados de manera rutinaria y fácil para la función visual y los cambios estructurales de la retina después de inyecciones con tecnología avanzada no invasiva, como agudeza visual, sensibilidad al contraste , autofluorescencia del fondo de ojo (FAF), umbrales visuales adaptados a la oscuridad, diámetros vasculares, pupilometría, electrorretinografía (ERG), ERG multifocal y tomografía de coherencia óptica (OCT). [75]
Esta estrategia es eficaz contra una serie de enfermedades de la retina que se han estudiado, incluidas las enfermedades neovasculares que son características de la degeneración macular relacionada con la edad , la retinopatía diabética y la retinopatía del prematuro . Dado que la regulación de la vascularización en la retina madura implica un equilibrio entre los factores de crecimiento positivos endógenos , como el factor de crecimiento endotelial vascular (VEGF) y los inhibidores de la angiogénesis , como el factor derivado del epitelio pigmentario ( PEDF ), se ha demostrado que la expresión mediada por rAAV de PEDF, angiostatina y el receptor soluble de VEGF sFlt-1, que son todas proteínas antiangiogénicas, reducen la formación de vasos aberrantes en modelos animales. [76] Dado que las terapias genéticas específicas no se pueden utilizar fácilmente para tratar una fracción significativa de pacientes con distrofia retiniana, existe un gran interés en desarrollar una terapia de factores de supervivencia de aplicación más general. Los factores neurotróficos tienen la capacidad de modular el crecimiento neuronal durante el desarrollo para mantener las células existentes y permitir la recuperación de las poblaciones neuronales lesionadas en el ojo. Los factores neurotróficos que codifican AAV, como los miembros de la familia del factor de crecimiento de fibroblastos (FGF) y el GDNF, protegieron a los fotorreceptores de la apoptosis o desaceleraron la muerte celular. [76]
Trasplante de órganos Se ha intentado el trasplante de retina, pero sin mucho éxito. En el MIT , la Universidad del Sur de California, la Universidad RWTH de Aachen y la Universidad de Nueva Gales del Sur se está desarrollando una "retina artificial": un implante que evitará los fotorreceptores de la retina y estimulará las células nerviosas adheridas directamente, con señales de una cámara digital.
Alrededor del año 300 a. C. , Herófilo identificó la retina a partir de disecciones de ojos de cadáveres. La llamó capa aracnoidea , por su parecido con una telaraña, y retiforme , por su parecido con una red de pesca. El término aracnoidea pasó a referirse a una capa alrededor del cerebro; el término retiforme pasó a referirse a la retina . [77]
Entre 1011 y 1021 d. C., Ibn Al-Haytham publicó numerosos experimentos que demostraban que la visión se produce a partir de la luz que se refleja desde los objetos hacia el ojo. Esto es coherente con la teoría de la intromisión y contra la teoría de la emisión , la teoría de que la visión se produce a partir de rayos emitidos por los ojos. Sin embargo, Ibn Al-Haytham decidió que la retina no podía ser responsable del comienzo de la visión porque la imagen formada en ella estaba invertida. En cambio, decidió que debía comenzar en la superficie del cristalino. [78]
En 1604, Johannes Kepler desarrolló la óptica del ojo y decidió que la retina debía ser el punto de partida de la visión. Dejó en manos de otros científicos la tarea de conciliar la imagen retiniana invertida con nuestra percepción del mundo en posición vertical. [79]
En 1894, Santiago Ramón y Cajal publicó la primera caracterización importante de las neuronas de la retina en Retina der Wirbelthiere ( La retina de los vertebrados ). [80]
George Wald , Haldan Keffer Hartline y Ragnar Granit ganaron el Premio Nobel de Fisiología o Medicina en 1967 por su investigación científica sobre la retina. [81]
Un estudio reciente de la Universidad de Pensilvania calculó que el ancho de banda aproximado de las retinas humanas es de 8,75 megabits por segundo, mientras que la tasa de transferencia retiniana de un conejillo de indias es de 875 kilobits por segundo. [82]
En 2006, MacLaren & Pearson y sus colegas del University College London y del Moorfields Eye Hospital de Londres demostraron que las células fotorreceptoras podían trasplantarse con éxito en la retina de ratones si las células donantes se encontraban en una etapa crítica de desarrollo. [83] Recientemente, Ader y sus colegas en Dublín demostraron, utilizando el microscopio electrónico, que los fotorreceptores trasplantados formaban conexiones sinápticas. [84]
En 2012, Sebastian Seung y su laboratorio en el MIT lanzaron EyeWire , un juego de ciencia ciudadana en línea donde los jugadores rastrean neuronas en la retina. [85] Los objetivos del proyecto EyeWire son identificar tipos de células específicos dentro de las amplias clases conocidas de células de la retina y mapear las conexiones entre las neuronas en la retina, lo que ayudará a determinar cómo funciona la visión. [86] [87]
{{cite news}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: DOI inactivo a partir de junio de 2024 ( enlace )