La tiamina , también conocida como tiamina y vitamina B 1 , es una vitamina , un micronutriente esencial para los seres humanos y los animales. [3] [4] Se encuentra en los alimentos y se sintetiza comercialmente para ser un suplemento dietético o un medicamento . [1] [5] Las formas fosforiladas de tiamina son necesarias para algunas reacciones metabólicas , incluida la descomposición de la glucosa y los aminoácidos . [1]
Las fuentes alimentarias de tiamina incluyen cereales integrales , legumbres y algunas carnes y pescados. [1] [6] El procesamiento de los granos elimina gran parte del contenido de vitaminas, por lo que en muchos países los cereales y las harinas se enriquecen con tiamina. [1] Existen suplementos y medicamentos disponibles para tratar y prevenir la deficiencia de tiamina y los trastornos que se derivan de ella, como el beriberi y la encefalopatía de Wernicke . También se utilizan para tratar la enfermedad de la orina con olor a jarabe de arce y el síndrome de Leigh . Los suplementos y medicamentos se toman normalmente por vía oral , pero también se pueden administrar mediante inyección intravenosa o intramuscular . [7]
Los suplementos de tiamina suelen tolerarse bien. Pueden producirse reacciones alérgicas , incluida la anafilaxia , cuando se administran dosis repetidas mediante inyección. [7] [8] La tiamina está en la Lista de medicamentos esenciales de la Organización Mundial de la Salud . [9] Está disponible como medicamento genérico y, en algunos países, como suplemento dietético sin receta. [7]
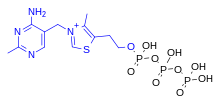
La tiamina es una de las vitaminas del grupo B y también se la conoce como vitamina B 1 . [3] [4] Es un catión que se suele suministrar como sal de cloruro . Es soluble en agua, metanol y glicerol , pero prácticamente insoluble en disolventes orgánicos menos polares . [10] [11] En el organismo, la tiamina puede formar derivados ; el más conocido de ellos es el pirofosfato de tiamina (TPP), una coenzima del catabolismo de azúcares y aminoácidos. [3]
La estructura química consiste en una aminopirimidina y un anillo de tiazolio unidos por un puente de metileno . El tiazol está sustituido con cadenas laterales de metilo e hidroxietilo . La tiamina es estable a pH ácido , pero es inestable en soluciones alcalinas y por exposición al calor . [10] [11] Reacciona fuertemente en reacciones de tipo Maillard . [10] La oxidación produce el derivado fluorescente tiocromo , que puede usarse para determinar la cantidad de vitamina presente en muestras biológicas. [12]
Los trastornos conocidos causados por la deficiencia de tiamina incluyen beriberi , síndrome de Wernicke-Korsakoff , neuropatía óptica , enfermedad de Leigh , ataxia estacional africana (o ataxia estacional nigeriana) y mielinólisis pontina central . [13] Los síntomas incluyen malestar , pérdida de peso, irritabilidad y confusión. [10] [14] [15]
En los países occidentales, el alcoholismo crónico es un factor de riesgo de deficiencia. También corren riesgo los adultos mayores, las personas con VIH/SIDA o diabetes y quienes se han sometido a cirugía bariátrica . [1] Se han asociado diversos grados de insuficiencia de tiamina con el uso prolongado de diuréticos . [16] [17]

Se conocen cinco derivados naturales del fosfato de tiamina: monofosfato de tiamina (ThMP), pirofosfato de tiamina (TPP), trifosfato de tiamina (ThTP), difosfato de adenosina tiamina (AThDP) y trifosfato de adenosina tiamina (AThTP). Están involucrados en muchos procesos celulares. [18] La forma mejor caracterizada es la TPP, una coenzima en el catabolismo de azúcares y aminoácidos. Si bien su papel es bien conocido, la acción no coenzimática de la tiamina y sus derivados puede realizarse a través de la unión a proteínas que no utilizan ese mecanismo. [19] No se conoce ningún papel fisiológico para el monofosfato excepto como intermediario en la conversión celular de tiamina en difosfatos y trifosfatos. [20]
El pirofosfato de tiamina (TPP), también llamado difosfato de tiamina (ThDP), participa como coenzima en reacciones metabólicas, incluidas aquellas en las que tiene lugar la inversión de polaridad . [21] Su síntesis es catalizada por la enzima tiamina difosfoquinasa según la reacción tiamina + ATP → TPP + AMP (EC 2.7.6.2). El TPP es una coenzima de varias enzimas que catalizan la transferencia de unidades de dos carbonos y en particular la deshidrogenación ( descarboxilación y posterior conjugación con la coenzima A ) de 2-oxoácidos (alfa-cetoácidos). El mecanismo de acción del TPP como coenzima se basa en su capacidad para formar un iluro . [22] Los ejemplos incluyen:
Las enzimas transcetolasa, piruvato deshidrogenasa (PDH) y 2-oxoglutarato deshidrogenasa (OGDH) son importantes en el metabolismo de los carbohidratos . La PDH vincula la glucólisis al ciclo del ácido cítrico . La OGDH cataliza la conversión general de 2-oxoglutarato (alfa-cetoglutarato) en succinil-CoA y CO 2 durante el ciclo del ácido cítrico . La reacción catalizada por la OGDH es un paso limitante de la velocidad en el ciclo del ácido cítrico. La enzima citosólica transcetolasa es fundamental para la vía de las pentosas fosfato , una ruta principal para la biosíntesis de los azúcares pentosos desoxirribosa y ribosa . La PDH y la OGDH mitocondriales son parte de las vías bioquímicas que dan como resultado la generación de trifosfato de adenosina (ATP), que es la principal molécula de transferencia de energía para la célula. En el sistema nervioso, la PDH también participa en la síntesis de mielina y del neurotransmisor acetilcolina . [11]
El ThTP está implicado en la activación del canal de cloruro en las neuronas de mamíferos y otros animales, aunque su papel no se entiende bien. [20] Se ha encontrado ThTP en bacterias, hongos y plantas, lo que sugiere que tiene otras funciones celulares. [23] En Escherichia coli , está implicado en la respuesta a la inanición de aminoácidos. [24]
El AThDP existe en pequeñas cantidades en el hígado de los vertebrados, pero su función sigue siendo desconocida. [24]
El AThTP está presente en E. coli , donde se acumula como resultado de la falta de carbono. En esta bacteria, el AThTP puede representar hasta el 20% de la tiamina total. También existe en cantidades menores en levaduras , raíces de plantas superiores y tejido animal. [24]
Durante el embarazo, la tiamina se envía al feto a través de la placenta . Las mujeres embarazadas tienen un mayor requerimiento de esta vitamina que otros adultos, especialmente durante el tercer trimestre . Las mujeres embarazadas con hiperémesis gravídica tienen un mayor riesgo de deficiencia de tiamina debido a las pérdidas al vomitar. [25] En las mujeres lactantes , la tiamina se administra en la leche materna incluso si resulta en deficiencia de tiamina en la madre. [4] [26]
La tiamina es importante no sólo para el desarrollo de la membrana mitocondrial , sino también para el funcionamiento de la membrana sináptica . [27] También se ha sugerido que una deficiencia obstaculiza el desarrollo del cerebro en los bebés y puede ser una causa del síndrome de muerte súbita del lactante . [20]
La Academia Nacional de Medicina de los Estados Unidos actualizó los requerimientos promedio estimados (EAR) y las ingestas dietéticas recomendadas (RDA) de tiamina en 1998. Las EAR de tiamina para mujeres y hombres de 14 años o más son 0,9 mg/día y 1,1 mg/día, respectivamente; las RDA son 1,1 y 1,2 mg/día, respectivamente. Las RDA son más altas que las EAR para proporcionar niveles de ingesta adecuados para individuos con requerimientos superiores al promedio. La RDA durante el embarazo y para mujeres lactantes es de 1,4 mg/día. Para bebés de hasta 12 meses, la ingesta adecuada (IA) es de 0,2 a 0,3 mg/día y para niños de 1 a 13 años la RDA aumenta con la edad de 0,5 a 0,9 mg/día. [4]
La Autoridad Europea de Seguridad Alimentaria (AESA) denomina al conjunto colectivo de información Valores Dietéticos de Referencia (DDR), con Ingestas de Referencia de Población (PRI) en lugar de RDA, y Requerimientos Promedio en lugar de EAR. Para las mujeres (incluidas las embarazadas o lactantes), los hombres y los niños, el PRI es de 0,1 mg de tiamina por megajulio (MJ) de energía en su dieta. Como la conversión es 1 MJ = 239 kcal, un adulto que consume 2390 kilocalorías debería consumir 1,0 mg de tiamina. Esto es ligeramente inferior a la RDA de EE. UU. [29]
Ni la Academia Nacional de Medicina ni la EFSA han establecido un nivel máximo de ingesta de tiamina, ya que no existen datos en humanos sobre efectos adversos de dosis altas. [4] [28]
La tiamina generalmente se tolera bien y no es tóxica cuando se administra por vía oral . [7] Hay informes raros de efectos secundarios adversos cuando la tiamina se administra por vía intravenosa , incluidas reacciones alérgicas, náuseas , letargo y alteración de la coordinación . [28] [3]
A los efectos del etiquetado de alimentos y suplementos dietéticos en los EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario. Desde el 27 de mayo de 2016, el valor diario ha sido de 1,2 mg, de acuerdo con la dosis diaria recomendada. [30] [31]
La tiamina se encuentra en una amplia variedad de alimentos procesados y enteros, [18] incluidos lentejas , guisantes , cereales integrales , carne de cerdo y nueces . [6] [32] Un producto vitamínico prenatal diario típico contiene alrededor de 1,5 mg de tiamina. [33]
Algunos países exigen o recomiendan la fortificación de alimentos a base de cereales como el trigo , el arroz o el maíz porque el procesamiento reduce el contenido de vitaminas. [34] En febrero de 2022, 59 países, principalmente en África del Norte y Subsahariana, exigen la fortificación de alimentos de trigo, arroz o maíz con tiamina o mononitrato de tiamina. Las cantidades estipuladas varían de 2,0 a 10,0 mg/kg. [35] Otros 18 países tienen un programa de fortificación voluntaria. Por ejemplo, el gobierno de la India recomienda 3,5 mg/kg para la harina "maida" (blanca) y "atta" (integral) . [36]
La biosíntesis de tiamina ocurre en bacterias, algunos protozoos, plantas y hongos. [37] [38] Las fracciones de tiazol y pirimidina se biosintetizan por separado y luego se combinan para formar ThMP por la acción de la tiamina-fosfato sintasa .
El sistema de anillo de pirimidina se forma en una reacción catalizada por la fosfometilpirimidina sintasa (ThiC), una enzima de la superfamilia radical SAM de proteínas de hierro-azufre , que utiliza S-adenosil metionina como cofactor . [39] [40]
El material de partida es ribótido de 5-aminoimidazol , que sufre una reacción de reordenamiento a través de intermediarios radicales que incorporan los fragmentos azul, verde y rojo que se muestran en el producto. [41] [42]
El anillo de tiazol se forma en una reacción catalizada por la tiazol sintasa (EC 2.8.1.10). [39] Los precursores finales son la 1-desoxi-D-xilulosa 5-fosfato, el 2-iminoacetato y una proteína transportadora de azufre llamada ThiS. También se requiere una proteína adicional, ThiG, para reunir todos los componentes del anillo en el sitio activo de la enzima. [43]
El paso final para formar ThMP implica la descarboxilación del intermediario tiazol, que reacciona con el derivado pirofosfato de fosfometilpirimidina, un producto de una quinasa , la fosfometilpirimidina quinasa . [39]
Las vías biosintéticas difieren entre organismos. En E. coli y otras enterobacterias , la ThMP se fosforila al cofactor TPP por una tiamina-fosfato quinasa (ThMP + ATP → TPP + ADP). [39] En la mayoría de las bacterias y en eucariotas , la ThMP se hidroliza a tiamina y luego se pirofosforila a TPP por la tiamina difosfoquinasa (tiamina + ATP → TPP + AMP). [44]
Las vías biosintéticas están reguladas por riboswitches . [3] Si hay suficiente tiamina presente en la célula, entonces la tiamina se une a los ARNm para las enzimas que se requieren en la vía y evita su traducción . Si no hay tiamina presente, entonces no hay inhibición y se producen las enzimas necesarias para la biosíntesis. El riboswitch específico, el riboswitch TPP , es el único riboswitch conocido que se encuentra tanto en organismos eucariotas como procariotas . [45]
En la primera síntesis total en 1936, el 3-etoxipropanoato de etilo se trató con formiato de etilo para dar un compuesto dicarbonílico intermedio que, cuando reaccionó con acetamidina, formó una pirimidina sustituida . La conversión de su grupo hidroxilo en un grupo amino se llevó a cabo por sustitución aromática nucleófila , primero en el derivado de cloruro utilizando oxicloruro de fósforo , seguido de un tratamiento con amoníaco . El grupo etoxi se convirtió luego en un derivado de bromo utilizando ácido bromhídrico . En la etapa final, se formó tiamina (como su sal de dibromuro) en una reacción de alquilación utilizando 4-metil-5-(2-hidroxietil)tiazol. [46] : 7 [47]

Merck & Co. adaptó la síntesis a escala de laboratorio de 1936, lo que les permitió fabricar tiamina en Rahway en 1937. [47] Sin embargo, Hoffman La Roche investigó una ruta alternativa que utilizaba la diamina intermedia de Grewe (5-(aminometil)-2-metil-4-pirimidinamina), publicada por primera vez en 1937, [48] y se siguieron procesos de fabricación competitivos. Las rutas eficientes para la diamina han seguido siendo de interés. [47] [49] En el Espacio Económico Europeo , la tiamina está registrada bajo la regulación REACH y entre 100 y 1.000 toneladas por año se fabrican o importan allí. [50]
Muchos análogos de la vitamina B1 , como la benfotiamina , la fursultiamina y la sulbutiamina , son derivados sintéticos de la tiamina. La mayoría se desarrollaron en Japón en los años 1950 y 1960 como formas que tenían como objetivo mejorar la absorción en comparación con la tiamina. [51] Algunos están aprobados para su uso en algunos países como medicamento o suplemento dietético sin receta para el tratamiento de la neuropatía diabética u otras afecciones de salud. [52] [53] [54]
En la parte superior del intestino delgado, los ésteres de fosfato de tiamina presentes en los alimentos son hidrolizados por las enzimas fosfatasas alcalinas . En concentraciones bajas, el proceso de absorción está mediado por transportadores. En concentraciones más altas, la absorción también se produce mediante difusión pasiva . [3] El transporte activo puede verse inhibido por el consumo de alcohol o por la deficiencia de folato . [10]
La mayor parte de la tiamina en suero está unida a proteínas, principalmente a la albúmina . Aproximadamente el 90% de la tiamina total en sangre se encuentra en los eritrocitos . Se ha identificado una proteína de unión específica llamada proteína de unión a tiamina en suero de rata y se cree que es una proteína transportadora regulada por hormonas importante para la distribución tisular de la tiamina. [14] La captación de tiamina por las células de la sangre y otros tejidos se produce mediante transporte activo y difusión pasiva. [10] Dos miembros de la familia de proteínas transportadoras codificadas por los genes SLC19A2 y SLC19A3 son capaces de transportar tiamina. [20] En algunos tejidos, la captación y secreción de tiamina parecen estar mediadas por un transportador dependiente de Na + y un gradiente de protones transcelular. [14]
La tiamina almacenada por los seres humanos es de unos 25 a 30 mg, con las mayores concentraciones en el músculo esquelético, el corazón, el cerebro, el hígado y los riñones. La ThMP y la tiamina libre (no fosforilada) están presentes en el plasma, la leche, el líquido cefalorraquídeo y, se presume, en todo el líquido extracelular . A diferencia de las formas altamente fosforiladas de tiamina, la ThMP y la tiamina libre son capaces de atravesar las membranas celulares. Se ha demostrado que el calcio y el magnesio afectan la distribución de la tiamina en el cuerpo y se ha demostrado que la deficiencia de magnesio agrava la deficiencia de tiamina. [20] El contenido de tiamina en los tejidos humanos es menor que el de otras especies. [14] [55]
La tiamina y sus metabolitos (ácido 2-metil-4-amino-5-pirimidina carboxílico, ácido 4-metil-tiazol-5-acético y otros) se excretan principalmente en la orina. [3]
La biodisponibilidad de la tiamina en los alimentos puede verse afectada de diversas formas. Los sulfitos , añadidos a los alimentos como conservantes, [56] atacarán a la tiamina en el puente de metileno, escindiendo el anillo de pirimidina del anillo de tiazol. La velocidad de esta reacción aumenta en condiciones ácidas. [14] La tiamina se degrada por las tiaminasas termolábiles presentes en algunas especies de pescado, mariscos y otros alimentos. [10] Las pupas de un gusano de seda africano, Anaphe venata , son un alimento tradicional en Nigeria. Su consumo conduce a una deficiencia de tiamina. [57] La literatura más antigua informó que en Tailandia, el consumo de pescado fermentado y crudo causaba deficiencia de tiamina, pero abstenerse de comer el pescado o calentarlo primero revertía la deficiencia. [58] En los rumiantes, las bacterias intestinales sintetizan tiamina y tiaminasas. Las tiaminasas bacterianas son enzimas de la superficie celular que deben disociarse de la membrana celular antes de activarse; La disociación puede ocurrir en rumiantes en condiciones acidóticas . En vacas lecheras , la sobrealimentación con granos causa acidosis ruminal subaguda y aumento de la liberación de tiaminasa por parte de las bacterias ruminales, lo que resulta en deficiencia de tiamina. [59]
Según los informes de dos pequeños estudios realizados en Tailandia, masticar rodajas de nuez de areca envueltas en hojas de betel y masticar hojas de té redujo la biodisponibilidad de tiamina en los alimentos mediante un mecanismo que puede involucrar a los taninos . [58] [60]
Se sabe que la cirugía bariátrica para bajar de peso interfiere con la absorción de vitaminas. [61] Un metanálisis informó que el 27% de las personas que se sometieron a cirugías bariátricas experimentan deficiencia de vitamina B 1. [62]
La tiamina fue la primera de las vitaminas solubles en agua que se aisló. [63] Las primeras observaciones en humanos y en pollos habían demostrado que las dietas compuestas principalmente de arroz blanco pulido causaban beriberi, pero no lo atribuyeron a la ausencia de un nutriente esencial previamente desconocido. [64] [65]
En 1884, Takaki Kanehiro , cirujano general de la Armada Imperial Japonesa , rechazó la teoría anterior de los gérmenes para el beriberi y sugirió en cambio que la enfermedad se debía a insuficiencias en la dieta. [64] Al cambiar las dietas en un barco de la marina, descubrió que reemplazar una dieta de solo arroz blanco por otra que también contenía cebada, carne, leche, pan y verduras, casi eliminó el beriberi en un viaje por mar de nueve meses. Sin embargo, Takaki había agregado muchos alimentos a la dieta exitosa y atribuyó incorrectamente el beneficio a una mayor ingesta de proteínas, ya que las vitaminas eran desconocidas en ese momento. La Armada no estaba convencida de la necesidad de un programa tan costoso de mejora dietética, y muchos hombres continuaron muriendo de beriberi, incluso durante la guerra ruso-japonesa de 1904-5. No fue hasta 1905, después de que se descubriera el factor antiberiberi en el salvado de arroz (eliminado al pulirlo en arroz blanco ) y en el salvado de cebada, que el experimento de Takaki fue recompensado. Fue nombrado barón en el sistema nobiliario japonés, por lo que se le llamó cariñosamente "Barón de la Cebada". [64]
La conexión específica con el grano fue hecha en 1897 por Christiaan Eijkman , un médico militar en las Indias Orientales Holandesas , quien descubrió que las aves alimentadas con una dieta de arroz cocido y pulido desarrollaban parálisis que podía revertirse al descontinuar el pulido del arroz. [65] Atribuyó el beriberi a los altos niveles de almidón en el arroz que es tóxico. Creía que la toxicidad se contrarrestaba en un compuesto presente en los pulidos del arroz. [66] Un asociado, Gerrit Grijns , interpretó correctamente la conexión entre el consumo excesivo de arroz pulido y el beriberi en 1901: concluyó que el arroz contiene un nutriente esencial en las capas externas del grano que se elimina al pulirlo. [67] Eijkman finalmente recibió el Premio Nobel de Fisiología y Medicina en 1929, porque sus observaciones llevaron al descubrimiento de las vitaminas.
En 1910, un químico agrícola japonés de la Universidad Imperial de Tokio , Umetaro Suzuki , aisló un compuesto de tiamina soluble en agua del salvado de arroz, al que llamó ácido abérico . (Más tarde lo rebautizó como orizanina ). Describió el compuesto no solo como un factor antiberiberi, sino también como esencial para la nutrición humana; sin embargo, este hallazgo no obtuvo publicidad fuera de Japón, porque se omitió una afirmación de que el compuesto era un hallazgo nuevo en la traducción de su publicación del japonés al alemán. [63] En 1911, un bioquímico polaco Casimir Funk aisló la sustancia antineurítica del salvado de arroz (la tiamina moderna) que llamó "vitamina" (debido a que contenía un grupo amino). [68] [69] Sin embargo, Funk no caracterizó completamente su estructura química. Los químicos holandeses Barend Coenraad Petrus Jansen y su colaborador más cercano Willem Frederik Donath aislaron y cristalizaron el agente activo en 1926, [70] cuya estructura fue determinada por Robert Runnels Williams en 1934. El equipo de Williams nombró a la tiamina como un acrónimo de "tio" (que significa que contiene azufre) y "vitamina". El término "vitamina" proviene indirectamente, a través de Funk, del grupo amina de la propia tiamina (aunque en ese momento se sabía que las vitaminas no siempre eran aminas, por ejemplo, la vitamina C ). La tiamina también fue sintetizada por el grupo de Williams en 1936. [71]
Sir Rudolph Peters , en Oxford , utilizó palomas para entender cómo la deficiencia de tiamina resulta en los síntomas patológicos-fisiológicos del beriberi. Las palomas alimentadas exclusivamente con arroz pulido desarrollaron opistótonos , una condición caracterizada por la retracción de la cabeza. Si no se trataba, los animales morían después de unos días. La administración de tiamina después de que se observó opistótonos condujo a una curación completa en 30 minutos. Como no se observaron modificaciones morfológicas en el cerebro de las palomas antes y después del tratamiento con tiamina, Peters introdujo el concepto de una lesión inducida bioquímicamente. [72] En 1937, Lohmann y Schuster demostraron que el derivado de tiamina difosforilada, TPP, era un cofactor necesario para la descarboxilación oxidativa del piruvato. [73]
Algunos casos aislados de puritis...