La inflamación (del latín : inflammatio ) es parte de la respuesta biológica de los tejidos corporales a estímulos dañinos, como patógenos , células dañadas o irritantes . [1] [2] Los cinco signos cardinales son calor, dolor, enrojecimiento, hinchazón y pérdida de función (del latín calor , dolor , rubor , tumor y functio laesa ).
La inflamación es una respuesta genérica y, por lo tanto, se considera un mecanismo de inmunidad innata , mientras que la inmunidad adaptativa es específica de cada patógeno. [3]
La inflamación es una respuesta protectora que involucra células inmunes , vasos sanguíneos y mediadores moleculares. La función de la inflamación es eliminar la causa inicial de la lesión celular, limpiar las células y tejidos dañados e iniciar la reparación tisular. Una inflamación demasiado escasa podría conducir a la destrucción progresiva del tejido por el estímulo dañino (por ejemplo, bacterias) y comprometer la supervivencia del organismo. Sin embargo, la inflamación también puede tener efectos negativos. [4] Demasiada inflamación, en forma de inflamación crónica, se asocia con varias enfermedades, como la fiebre del heno , la enfermedad periodontal , la aterosclerosis y la osteoartritis .
La inflamación puede clasificarse como aguda o crónica . La inflamación aguda es la respuesta inicial del cuerpo a estímulos nocivos y se logra mediante el aumento del movimiento de plasma y leucocitos (en particular granulocitos ) desde la sangre hacia los tejidos lesionados. Una serie de eventos bioquímicos propaga y madura la respuesta inflamatoria, involucrando el sistema vascular local , el sistema inmunológico y varias células en el tejido lesionado. La inflamación prolongada, conocida como inflamación crónica , conduce a un cambio progresivo en el tipo de células presentes en el sitio de la inflamación, como las células mononucleares , e implica la destrucción y curación simultáneas del tejido.
La inflamación también se ha clasificado como tipo 1 y tipo 2 según el tipo de citocinas y células T auxiliares (Th1 y Th2) implicadas. [5]
La primera referencia conocida del término inflamación data de principios del siglo XV. La raíz de la palabra proviene del francés antiguo inflammation , que data del siglo XIV, y que a su vez proviene del latín inflamatio o inflammem . Literalmente, el término se relaciona con la palabra "llama", como la propiedad de "prenderse fuego" o "quemarse". [6]
El término inflamación no es sinónimo de infección . La infección describe la interacción entre la acción de la invasión microbiana y la reacción de la respuesta inflamatoria del cuerpo: los dos componentes se consideran juntos en la discusión de la infección, y la palabra se utiliza para implicar una causa invasiva microbiana para la reacción inflamatoria observada. La inflamación , por otro lado, describe solo la respuesta inmunovascular del cuerpo, independientemente de la causa. Pero, debido a que los dos a menudo están correlacionados , las palabras que terminan en el sufijo -itis (que significa inflamación) a veces se describen informalmente como una referencia a la infección: por ejemplo, la palabra uretritis significa estrictamente solo "inflamación uretral", pero los proveedores de atención médica clínica generalmente discuten la uretritis como una infección uretral porque la invasión microbiana uretral es la causa más común de uretritis. Sin embargo, la distinción entre inflamación e infección es crucial en situaciones de patología y diagnóstico médico que involucran inflamación que no es impulsada por invasión microbiana, como casos de aterosclerosis , trauma , isquemia y enfermedades autoinmunes (incluida la hipersensibilidad tipo III ).
Biológico:
Químico: [7]
Psicológico:
La inflamación aguda es un proceso de corta duración, que suele aparecer en unos minutos u horas y comienza a cesar cuando se elimina el estímulo nocivo. [10] Implica una respuesta de movilización sistémica y coordinada a nivel local de varios mediadores inmunitarios, endocrinos y neurológicos de la inflamación aguda. En una respuesta sana normal, se activa, elimina el patógeno y comienza un proceso de reparación para luego cesar. [11]
La inflamación aguda se produce inmediatamente después de la lesión y dura solo unos días. [12] Las citocinas y las quimiocinas promueven la migración de neutrófilos y macrófagos al sitio de la inflamación. [12] Los patógenos, los alérgenos, las toxinas, las quemaduras y la congelación son algunas de las causas típicas de la inflamación aguda. [12] Los receptores tipo Toll (TLR) reconocen patógenos microbianos. [12] La inflamación aguda puede ser un mecanismo defensivo para proteger los tejidos contra las lesiones. [12] La inflamación que dura de 2 a 6 semanas se denomina inflamación subaguda. [12] [13]
La inflamación se caracteriza por cinco signos cardinales , [16] [17] (cuyos nombres tradicionales provienen del latín):
Los primeros cuatro (signos clásicos) fueron descritos por Celso ( c. 30 a. C. – 38 d. C.). [19]
El dolor se debe a la liberación de sustancias químicas como la bradicinina y la histamina, que estimulan las terminaciones nerviosas. [16] La inflamación aguda del pulmón (normalmente en respuesta a una neumonía ) no causa dolor, a menos que la inflamación afecte a la pleura parietal , que sí tiene terminaciones nerviosas sensibles al dolor . [16] El calor y el enrojecimiento se deben al aumento del flujo sanguíneo a la temperatura corporal central en el sitio inflamado. La hinchazón es causada por la acumulación de líquido.
Se cree que el quinto signo, la pérdida de función , fue añadido posteriormente por Galeno , [20] Thomas Sydenham [21] o Rudolf Virchow . [10] [16] [17] Los ejemplos de pérdida de función incluyen dolor que inhibe la movilidad, hinchazón severa que impide el movimiento, tener un peor sentido del olfato durante un resfriado o tener dificultad para respirar cuando hay bronquitis. [22] [23] La pérdida de función tiene múltiples causas. [16]


El proceso de inflamación aguda es iniciado por células inmunes residentes ya presentes en el tejido involucrado, principalmente macrófagos residentes , células dendríticas , histiocitos , células de Kupffer y mastocitos . Estas células poseen receptores de superficie conocidos como receptores de reconocimiento de patrones (PRR), que reconocen (es decir, se unen) a dos subclases de moléculas: patrones moleculares asociados a patógenos (PAMP) y patrones moleculares asociados a daños (DAMP). Los PAMP son compuestos que están asociados con varios patógenos , pero que son distinguibles de las moléculas del huésped. Los DAMP son compuestos que están asociados con lesiones relacionadas con el huésped y daño celular.
Al inicio de una infección, quemadura u otras lesiones, estas células experimentan una activación (uno de los PRR reconoce un PAMP o DAMP) y liberan mediadores inflamatorios responsables de los signos clínicos de inflamación. La vasodilatación y el aumento del flujo sanguíneo resultante provocan el enrojecimiento ( rubor ) y el aumento del calor ( calor ). El aumento de la permeabilidad de los vasos sanguíneos da como resultado una exudación (fuga) de proteínas plasmáticas y líquido en el tejido ( edema ), que se manifiesta como hinchazón ( tumor ). Algunos de los mediadores liberados, como la bradicinina, aumentan la sensibilidad al dolor ( hiperalgesia , dolor ). Las moléculas mediadoras también alteran los vasos sanguíneos para permitir la migración de leucocitos, principalmente neutrófilos y macrófagos , para fluir fuera de los vasos sanguíneos (extravasación) y hacia el tejido. Los neutrófilos migran a lo largo de un gradiente quimiotáctico creado por las células locales para alcanzar el sitio de la lesión. [10] La pérdida de función ( functio laesa ) es probablemente el resultado de un reflejo neurológico en respuesta al dolor.
Además de los mediadores derivados de las células, varios sistemas de cascada bioquímica acelular (que consisten en proteínas plasmáticas preformadas) actúan en paralelo para iniciar y propagar la respuesta inflamatoria. Entre ellos se incluyen el sistema del complemento activado por bacterias y los sistemas de coagulación y fibrinólisis activados por necrosis (p. ej., quemaduras, traumatismos). [10]
La inflamación aguda puede considerarse la primera línea de defensa contra las lesiones. La respuesta inflamatoria aguda requiere una estimulación constante para mantenerse. Los mediadores inflamatorios tienen una vida corta y se degradan rápidamente en el tejido. Por lo tanto, la inflamación aguda comienza a cesar una vez que se elimina el estímulo. [10]
La inflamación crónica es una inflamación que dura meses o años. [13] Los macrófagos, linfocitos y células plasmáticas predominan en la inflamación crónica, en contraste con los neutrófilos que predominan en la inflamación aguda. [13] La diabetes , las enfermedades cardiovasculares , las alergias y la enfermedad pulmonar obstructiva crónica (EPOC) son ejemplos de enfermedades mediadas por la inflamación crónica. [13] La obesidad , el tabaquismo, el estrés y la dieta insuficiente son algunos de los factores que promueven la inflamación crónica. [13] Un estudio de 2014 informó que el 60% de los estadounidenses tenían al menos una condición inflamatoria crónica y el 42% tenía más de una. [13]
Los signos y síntomas comunes que se desarrollan durante la inflamación crónica son: [13]
Según la definición, la inflamación aguda es una respuesta inmunovascular a estímulos inflamatorios, que pueden incluir infección o trauma. [25] [26] Esto significa que la inflamación aguda se puede dividir en términos generales en una fase vascular que ocurre primero, seguida de una fase celular que involucra células inmunes (más específicamente granulocitos mieloides en el contexto agudo). [25] El componente vascular de la inflamación aguda implica el movimiento del líquido plasmático , que contiene proteínas importantes como fibrina e inmunoglobulinas ( anticuerpos ), hacia el tejido inflamado.
Al entrar en contacto con los PAMP, los macrófagos tisulares y los mastocitos liberan aminas vasoactivas como la histamina y la serotonina , así como eicosanoides como la prostaglandina E2 y el leucotrieno B4 para remodelar la vasculatura local. [27] Los macrófagos y las células endoteliales liberan óxido nítrico . [28] Estos mediadores vasodilatan y permeabilizan los vasos sanguíneos , lo que da como resultado la distribución neta del plasma sanguíneo desde el vaso hacia el espacio tisular. La mayor acumulación de líquido en el tejido hace que se hinche ( edema ). [27] Este líquido tisular exudado contiene varios mediadores antimicrobianos del plasma, como el complemento , la lisozima y los anticuerpos , que pueden dañar inmediatamente a los microbios y opsonizarlos en preparación para la fase celular. Si el estímulo inflamatorio es una herida lacerante, las plaquetas exudadas , los coagulantes , la plasmina y las cininas pueden coagular el área herida utilizando mecanismos dependientes de la vitamina K [29] y proporcionar hemostasia en primera instancia. Estos mediadores de la coagulación también proporcionan un marco de estadificación estructural en el sitio del tejido inflamatorio en forma de una red de fibrina , como lo haría el andamiaje de construcción en un sitio de construcción, con el fin de ayudar al desbridamiento fagocítico y la reparación de la herida más adelante. Parte del líquido tisular exudado también es canalizado por los vasos linfáticos a los ganglios linfáticos regionales, arrastrando bacterias para iniciar la fase de reconocimiento y ataque del sistema inmunológico adaptativo .

La inflamación aguda se caracteriza por cambios vasculares marcados, incluyendo vasodilatación , aumento de la permeabilidad y aumento del flujo sanguíneo, que son inducidos por las acciones de varios mediadores inflamatorios. [27] La vasodilatación ocurre primero a nivel de las arteriolas , progresando al nivel capilar , y produce un aumento neto en la cantidad de sangre presente, causando el enrojecimiento y el calor de la inflamación. El aumento de la permeabilidad de los vasos da como resultado el movimiento del plasma hacia los tejidos, con estasis resultante debido al aumento en la concentración de las células dentro de la sangre, una condición caracterizada por vasos agrandados llenos de células. La estasis permite que los leucocitos marginen (se muevan) a lo largo del endotelio , un proceso crítico para su reclutamiento en los tejidos. El flujo normal de sangre evita esto, ya que la fuerza de corte a lo largo de la periferia de los vasos mueve las células en la sangre hacia el medio del vaso.
* lista no exhaustiva
El componente celular involucra leucocitos , que normalmente residen en la sangre y deben moverse hacia el tejido inflamado a través de extravasación para ayudar en la inflamación. [25] Algunos actúan como fagocitos , ingiriendo bacterias, virus y restos celulares. Otros liberan gránulos enzimáticos que dañan a los invasores patógenos. Los leucocitos también liberan mediadores inflamatorios que desarrollan y mantienen la respuesta inflamatoria. En general, la inflamación aguda está mediada por granulocitos , mientras que la inflamación crónica está mediada por células mononucleares como monocitos y linfocitos .

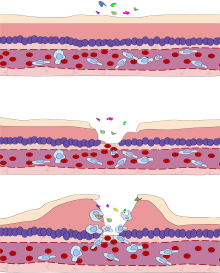
Diversos leucocitos , en particular los neutrófilos, participan de manera crítica en el inicio y el mantenimiento de la inflamación. Estas células deben poder desplazarse al lugar de la lesión desde su ubicación habitual en la sangre, por lo que existen mecanismos para reclutar y dirigir a los leucocitos al lugar apropiado. El proceso de movimiento de los leucocitos desde la sangre hasta los tejidos a través de los vasos sanguíneos se conoce como extravasación y puede dividirse, a grandes rasgos, en una serie de pasos:
Los neutrófilos extravasados en la fase celular entran en contacto con los microbios en el tejido inflamado. Los fagocitos expresan receptores de reconocimiento de patrones endocíticos (PRR) de superficie celular que tienen afinidad y eficacia contra patrones moleculares asociados a microbios (PAMP) no específicos . La mayoría de los PAMP que se unen a los PRR endocíticos e inician la fagocitosis son componentes de la pared celular, incluidos carbohidratos complejos como mananos y β- glucanos , lipopolisacáridos (LPS), peptidoglicanos y proteínas de superficie. Los PRR endocíticos en los fagocitos reflejan estos patrones moleculares, con receptores de lectina de tipo C que se unen a mananos y β-glucanos, y receptores carroñeros que se unen a LPS.
Tras la unión endocítica del PRR, se produce un reordenamiento del citoesqueleto de actina - miosina adyacente a la membrana plasmática de forma que se endocitosa la membrana plasmática que contiene el complejo PRR-PAMP y el microbio. Se ha implicado a las vías de señalización del fosfatidilinositol y Vps34 - Vps15 - Beclin1 en el tráfico del fagosoma endocitado a los lisosomas intracelulares , donde la fusión del fagosoma y el lisosoma produce un fagolisosoma. Las especies reactivas de oxígeno , los superóxidos y el blanqueador de hipoclorito dentro de los fagolisosomas matan a los microbios dentro del fagocito.
La eficacia fagocítica puede mejorarse mediante la opsonización . El complemento C3b derivado del plasma y los anticuerpos que exudan en el tejido inflamado durante la fase vascular se unen a los antígenos microbianos y los recubren. Además de los PRR endocíticos, los fagocitos también expresan receptores de opsonina , el receptor Fc y el receptor 1 del complemento (CR1), que se unen a los anticuerpos y al C3b, respectivamente. La coestimulación del PRR endocítico y del receptor de opsonina aumenta la eficacia del proceso fagocítico, mejorando la eliminación lisosomal del agente infeccioso.
* lista no exhaustiva
Se observan patrones específicos de inflamación aguda y crónica durante situaciones particulares que surgen en el cuerpo, como cuando la inflamación ocurre en una superficie epitelial o están involucradas bacterias piógenas .


Las anomalías inflamatorias son un amplio grupo de trastornos que subyacen a una amplia variedad de enfermedades humanas. El sistema inmunitario suele estar involucrado en los trastornos inflamatorios, como se demuestra tanto en las reacciones alérgicas como en algunas miopatías , y muchos trastornos del sistema inmunitario dan lugar a una inflamación anormal. Las enfermedades no inmunitarias con orígenes causales en procesos inflamatorios incluyen el cáncer, la aterosclerosis y la cardiopatía isquémica . [10]
Algunos ejemplos de trastornos asociados con la inflamación incluyen:
La aterosclerosis, antes considerada un trastorno de almacenamiento de lípidos , ahora se entiende como una enfermedad inflamatoria crónica que afecta las paredes arteriales. [34] La investigación ha establecido un papel fundamental de la inflamación en la mediación de todas las etapas de la aterosclerosis desde el inicio hasta la progresión y, en última instancia, las complicaciones trombóticas derivadas de ella. [34] Estos nuevos hallazgos revelan vínculos entre los factores de riesgo tradicionales como los niveles de colesterol y los mecanismos subyacentes de la aterogénesis .
Los estudios clínicos han demostrado que esta biología emergente de la inflamación en la aterosclerosis se aplica directamente a las personas. [34] Por ejemplo, la elevación de los marcadores de inflamación predice los resultados de las personas con síndromes coronarios agudos , independientemente del daño miocárdico. Además, la inflamación crónica de bajo grado, como lo indican los niveles del marcador inflamatorio proteína C reactiva , define prospectivamente el riesgo de complicaciones ateroscleróticas, lo que se suma a la información pronóstica proporcionada por los factores de riesgo tradicionales, como los niveles de LDL. [35] [34]
Además, ciertos tratamientos que reducen el riesgo coronario también limitan la inflamación. Cabe destacar que los medicamentos para reducir los lípidos, como las estatinas, han demostrado tener efectos antiinflamatorios, lo que puede contribuir a su eficacia más allá de la simple reducción de los niveles de LDL. [36] Esta comprensión emergente del papel de la inflamación en la aterosclerosis ha tenido implicaciones clínicas significativas, que influyen tanto en la estratificación del riesgo como en las estrategias terapéuticas.
Los últimos avances en el tratamiento de la aterosclerosis se han centrado en abordar directamente la inflamación. Se han estudiado nuevos fármacos antiinflamatorios, como los anticuerpos monoclonales dirigidos a la IL-1β, en grandes ensayos clínicos, que han mostrado resultados prometedores en la reducción de los eventos cardiovasculares. [37] Estos fármacos ofrecen una posible nueva vía de tratamiento, en particular para los pacientes que no responden adecuadamente a las estatinas. Sin embargo, las preocupaciones sobre la seguridad y el costo a largo plazo siguen siendo barreras importantes para su adopción generalizada.
Los procesos inflamatorios pueden desencadenarse por la cognición negativa o sus consecuencias, como el estrés, la violencia o la privación. Por lo tanto, la cognición negativa puede contribuir a la inflamación, que a su vez puede conducir a la depresión. Un metaanálisis de 2019 descubrió que la inflamación crónica está asociada con un aumento del 30 % del riesgo de desarrollar un trastorno depresivo mayor, lo que respalda el vínculo entre la inflamación y la salud mental. [38]
Una reacción alérgica, formalmente conocida como hipersensibilidad tipo 1 , es el resultado de una respuesta inmunitaria inapropiada que desencadena inflamación, vasodilatación e irritación nerviosa. Un ejemplo común es la fiebre del heno , que es causada por una respuesta hipersensible de los mastocitos a los alérgenos . Los mastocitos presensibilizados responden desgranulándose , liberando sustancias químicas vasoactivas como la histamina. Estas sustancias químicas propagan una respuesta inflamatoria excesiva caracterizada por la dilatación de los vasos sanguíneos, la producción de moléculas proinflamatorias, la liberación de citocinas y el reclutamiento de leucocitos. [10] La respuesta inflamatoria grave puede madurar hasta convertirse en una respuesta sistémica conocida como anafilaxia .
Las miopatías inflamatorias son causadas por el ataque inadecuado del sistema inmunológico a los componentes del músculo, lo que provoca signos de inflamación muscular. Pueden presentarse junto con otros trastornos inmunológicos, como la esclerosis sistémica , e incluyen dermatomiositis , polimiositis y miositis por cuerpos de inclusión . [10]
Debido al papel central de los leucocitos en el desarrollo y propagación de la inflamación, los defectos en la funcionalidad de los leucocitos a menudo resultan en una capacidad reducida para la defensa inflamatoria con la consiguiente vulnerabilidad a las infecciones. [10] Los leucocitos disfuncionales pueden ser incapaces de unirse correctamente a los vasos sanguíneos debido a mutaciones del receptor de superficie, digerir bacterias ( síndrome de Chédiak-Higashi ) o producir microbicidas ( enfermedad granulomatosa crónica ). Además, las enfermedades que afectan a la médula ósea pueden dar lugar a leucocitos anormales o escasos.
Se sabe que ciertos fármacos o compuestos químicos exógenos afectan la inflamación. La deficiencia de vitamina A , por ejemplo, provoca un aumento de las respuestas inflamatorias, [39] y los fármacos antiinflamatorios actúan específicamente inhibiendo las enzimas que producen eicosanoides inflamatorios . Además, ciertas drogas ilícitas como la cocaína y el éxtasis pueden ejercer algunos de sus efectos perjudiciales activando factores de transcripción íntimamente relacionados con la inflamación (por ejemplo, NF-κB ). [40] [41]
La inflamación orquesta el microambiente alrededor de los tumores, contribuyendo a la proliferación, supervivencia y migración. [42] Las células cancerosas usan selectinas , quimiocinas y sus receptores para la invasión, migración y metástasis. [43] Por otro lado, muchas células del sistema inmunológico contribuyen a la inmunología del cáncer , suprimiendo el cáncer. [44] La intersección molecular entre los receptores de hormonas esteroides, que tienen efectos importantes en el desarrollo celular, y los factores de transcripción que juegan papeles clave en la inflamación, como NF-κB , puede mediar algunos de los efectos más críticos de los estímulos inflamatorios en las células cancerosas. [45] Es muy probable que esta capacidad de un mediador de la inflamación para influir en los efectos de las hormonas esteroides en las células afecte la carcinogénesis. Por otro lado, debido a la naturaleza modular de muchos receptores de hormonas esteroides, esta interacción puede ofrecer formas de interferir con la progresión del cáncer, a través de la orientación de un dominio proteico específico en un tipo de célula específico. Este enfoque puede limitar los efectos secundarios que no están relacionados con el tumor de interés y puede ayudar a preservar las funciones homeostáticas vitales y los procesos de desarrollo en el organismo.
Hay algunas evidencias de 2009 que sugieren que la inflamación relacionada con el cáncer (IRC) puede conducir a la acumulación de alteraciones genéticas aleatorias en las células cancerosas. [46] [ necesita actualización ]
En 1863, Rudolf Virchow planteó la hipótesis de que el origen del cáncer se encontraba en sitios de inflamación crónica. [43] [47] En 2012, se estimó que la inflamación crónica contribuía a aproximadamente el 15% al 25% de los cánceres humanos. [47] [48]
Un mediador inflamatorio es un mensajero que actúa sobre los vasos sanguíneos y/o células para promover una respuesta inflamatoria. [49] Los mediadores inflamatorios que contribuyen a la neoplasia incluyen prostaglandinas , citocinas inflamatorias como IL-1β , TNF-α , IL-6 e IL-15 y quimiocinas como IL-8 y GRO-alfa . [50] [47] Estos mediadores inflamatorios, y otros, orquestan un entorno que fomenta la proliferación y la supervivencia. [43] [50]
La inflamación también causa daños en el ADN debido a la inducción de especies reactivas de oxígeno (ROS) por varios mediadores inflamatorios intracelulares. [43] [50] [47] Además, los leucocitos y otras células fagocíticas atraídas al sitio de la inflamación inducen daños en el ADN en las células proliferantes a través de su generación de ROS y especies reactivas de nitrógeno (RNS). ROS y RNS son normalmente producidas por estas células para combatir infecciones. [43] ROS, por sí solas, causan más de 20 tipos de daño en el ADN. [51] Los daños oxidativos en el ADN causan tanto mutaciones [52] como alteraciones epigenéticas. [53] [47] [54] RNS también causan daños mutagénicos en el ADN. [55]
Una célula normal puede sufrir carcinogénesis y convertirse en una célula cancerosa si se la somete frecuentemente a daños en el ADN durante largos períodos de inflamación crónica. Los daños en el ADN pueden causar mutaciones genéticas debido a una reparación inexacta . Además, los errores en el proceso de reparación del ADN pueden causar alteraciones epigenéticas . [47] [50] [54] Las mutaciones y alteraciones epigenéticas que se replican y proporcionan una ventaja selectiva durante la proliferación de células somáticas pueden ser cancerígenas.
Los análisis de todo el genoma de los tejidos cancerosos humanos revelan que una sola célula cancerosa típica puede poseer aproximadamente 100 mutaciones en regiones codificantes , 10-20 de las cuales son "mutaciones impulsoras" que contribuyen al desarrollo del cáncer. [47] Sin embargo, la inflamación crónica también causa cambios epigenéticos como las metilaciones del ADN , que a menudo son más comunes que las mutaciones. Normalmente, varios cientos a miles de genes están metilados en una célula cancerosa (véase Metilación del ADN en el cáncer ). Los sitios de daño oxidativo en la cromatina pueden reclutar complejos que contienen metiltransferasas de ADN (DNMT), una histona desacetilasa ( SIRT1 ) y una histona metiltransferasa (EZH2) , y así inducir la metilación del ADN. [47] [56] [57] La metilación del ADN de una isla CpG en una región promotora puede causar el silenciamiento de su gen corriente abajo (véase Sitio CpG y regulación de la transcripción en el cáncer ). Los genes de reparación del ADN, en particular, se inactivan con frecuencia por metilación en varios tipos de cáncer (ver hipermetilación de genes de reparación del ADN en el cáncer ). Un informe de 2018 [58] evaluó la importancia relativa de las mutaciones y alteraciones epigenéticas en la progresión a dos tipos diferentes de cáncer. Este informe mostró que las alteraciones epigenéticas eran mucho más importantes que las mutaciones en la generación de cánceres gástricos (asociados con la inflamación). [59] Sin embargo, las mutaciones y las alteraciones epigenéticas fueron de importancia aproximadamente igual en la generación de cánceres de células escamosas de esófago (asociados con sustancias químicas del tabaco y acetaldehído , un producto del metabolismo del alcohol).
Desde hace mucho tiempo se reconoce que la infección por VIH se caracteriza no solo por el desarrollo de una inmunodeficiencia profunda , sino también por una inflamación sostenida y una activación inmunitaria. [60] [61] [62] Un conjunto sustancial de evidencia implica a la inflamación crónica como un factor crítico de disfunción inmunitaria, aparición prematura de enfermedades relacionadas con el envejecimiento y deficiencia inmunitaria. [60] [63] Muchos ahora consideran la infección por VIH no solo como una inmunodeficiencia inducida por el virus en evolución, sino también como una enfermedad inflamatoria crónica. [64] Incluso después de la introducción de una terapia antirretroviral (TAR) eficaz y una supresión eficaz de la viremia en individuos infectados por VIH, la inflamación crónica persiste. Los estudios en animales también respaldan la relación entre la activación inmunitaria y la deficiencia inmunitaria celular progresiva: la infección por SIV sm de sus huéspedes primates no humanos naturales, el mangabey hollín , causa una replicación viral de alto nivel pero evidencia limitada de enfermedad. [65] [66] Esta falta de patogenicidad está acompañada por una falta de inflamación, activación inmunitaria y proliferación celular. En marcado contraste, la infección experimental con SIV sm en macacos rhesus produce activación inmunitaria y una enfermedad similar al SIDA con muchos paralelismos con la infección humana por VIH. [67]
Delinear cómo se agotan las células T CD4 y cómo se induce la inflamación crónica y la activación inmunológica es fundamental para comprender la patogénesis del VIH, una de las principales prioridades para la investigación del VIH por parte de la Oficina de Investigación del SIDA, Institutos Nacionales de Salud . Estudios recientes demostraron que la piroptosis mediada por caspasa-1 , una forma altamente inflamatoria de muerte celular programada, impulsa el agotamiento de las células T CD4 y la inflamación por el VIH. [68] [69] [70] Estos son los dos eventos característicos que impulsan la progresión de la enfermedad del VIH al SIDA . La piroptosis parece crear un círculo vicioso patogénico en el que las células T CD4 moribundas y otras células inmunes (incluidos los macrófagos y los neutrófilos) liberan señales inflamatorias que reclutan más células en los tejidos linfoides infectados para morir. La naturaleza de retroalimentación de esta respuesta inflamatoria produce inflamación crónica y daño tisular. [71] La identificación de la piroptosis como el mecanismo predominante que causa la depleción de células T CD4 y la inflamación crónica ofrece nuevas oportunidades terapéuticas, en concreto la caspasa-1, que controla la vía piroptótica. En este sentido, la piroptosis de las células T CD4 y la secreción de citocinas proinflamatorias como IL-1β e IL-18 pueden bloquearse en los tejidos linfoides humanos infectados por el VIH mediante la adición del inhibidor de la caspasa-1 VX-765 [68] , que ya ha demostrado ser seguro y bien tolerado en ensayos clínicos en humanos de fase II. [72] Estos hallazgos podrían impulsar el desarrollo de una clase totalmente nueva de terapias "anti-SIDA" que actúen dirigiéndose al huésped en lugar del virus. Es casi seguro que dichos agentes se utilizarían en combinación con la terapia antirretroviral. Al promover la "tolerancia" del virus en lugar de suprimir su replicación, el VX-765 o medicamentos relacionados pueden imitar las soluciones evolutivas que ocurren en múltiples huéspedes monos (por ejemplo, el mangabey hollín) infectados con lentivirus específicos de la especie que han llevado a una ausencia de enfermedad, a ninguna disminución en los recuentos de células T CD4 y a ninguna inflamación crónica.
La respuesta inflamatoria debe terminarse de forma activa cuando ya no es necesaria para evitar daños innecesarios a los tejidos. [10] Si no se hace esto, se produce una inflamación crónica y destrucción celular. La resolución de la inflamación se produce por diferentes mecanismos en diferentes tejidos. Los mecanismos que sirven para terminar la inflamación incluyen: [10] [73]
La inflamación aguda normalmente se resuelve por mecanismos que han permanecido algo esquivos. Evidencias emergentes ahora sugieren que un programa activo y coordinado de resolución se inicia en las primeras horas después de que comienza una respuesta inflamatoria. Después de entrar en los tejidos, los granulocitos promueven el cambio de prostaglandinas y leucotrienos derivados del ácido araquidónico a lipoxinas, que inician la secuencia de terminación. El reclutamiento de neutrófilos cesa así y se activa la muerte programada por apoptosis . Estos eventos coinciden con la biosíntesis, a partir de ácidos grasos poliinsaturados omega-3 , de resolvinas y protectinas , que acortan críticamente el período de infiltración de neutrófilos al iniciar la apoptosis. Como consecuencia, los neutrófilos apoptóticos experimentan fagocitosis por parte de los macrófagos , lo que conduce a la eliminación de neutrófilos y la liberación de citocinas antiinflamatorias y reparadoras como el factor de crecimiento transformante-β1. El programa antiinflamatorio termina con la salida de los macrófagos a través de los vasos linfáticos . [84]
Hay evidencia de un vínculo entre la inflamación y la depresión . [85] Los procesos inflamatorios pueden ser desencadenados por cogniciones negativas o sus consecuencias, como el estrés, la violencia o la privación. Por lo tanto, las cogniciones negativas pueden causar inflamación que, a su vez, puede conducir a la depresión. [86] [87] [ dudoso – discutir ] Además, hay cada vez más evidencia de que la inflamación puede causar depresión debido al aumento de citocinas, lo que pone al cerebro en un "modo de enfermedad". [88]
Los síntomas clásicos de estar físicamente enfermo, como el letargo, muestran una gran superposición con los comportamientos que caracterizan a la depresión. Los niveles de citocinas tienden a aumentar bruscamente durante los episodios depresivos de las personas con trastorno bipolar y disminuyen durante la remisión. [89] Además, se ha demostrado en ensayos clínicos que los medicamentos antiinflamatorios tomados además de los antidepresivos no solo mejoran significativamente los síntomas, sino que también aumentan la proporción de sujetos que responden positivamente al tratamiento. [90] Las inflamaciones que conducen a una depresión grave podrían estar causadas por infecciones comunes, como las causadas por un virus, una bacteria o incluso parásitos. [91]
Existe evidencia de un vínculo entre la inflamación y el delirio basado en los resultados de un estudio longitudinal reciente que investigó la PCR en pacientes con COVID-19. [92]
Un organismo infeccioso puede escapar de los confines del tejido inmediato a través del sistema circulatorio o el sistema linfático , donde puede propagarse a otras partes del cuerpo. Si un organismo no es contenido por las acciones de la inflamación aguda, puede acceder al sistema linfático a través de los vasos linfáticos cercanos . Una infección de los vasos linfáticos se conoce como linfangitis , y la infección de un ganglio linfático se conoce como linfadenitis . Cuando los ganglios linfáticos no pueden destruir todos los patógenos, la infección se propaga aún más. Un patógeno puede acceder al torrente sanguíneo a través del drenaje linfático hacia el sistema circulatorio.
Cuando la inflamación supera al huésped, se diagnostica el síndrome de respuesta inflamatoria sistémica . Cuando se debe a una infección, se aplica el término sepsis , y los términos bacteriemia se aplican específicamente a la sepsis bacteriana y viremia específicamente a la sepsis viral. La vasodilatación y la disfunción orgánica son problemas graves asociados con la infección generalizada que pueden provocar un choque séptico y la muerte. [93]
La inflamación también se caracteriza por niveles sistémicos elevados de proteínas de fase aguda . En la inflamación aguda, estas proteínas resultan beneficiosas; sin embargo, en la inflamación crónica, pueden contribuir a la amiloidosis . [10] Estas proteínas incluyen la proteína C reactiva , el amiloide sérico A y el amiloide sérico P , que causan una variedad de efectos sistémicos, entre ellos: [10]
La inflamación a menudo afecta la cantidad de leucocitos presentes en el cuerpo:
Con el descubrimiento de las interleucinas (IL), se desarrolló el concepto de inflamación sistémica . Aunque los procesos implicados son idénticos a la inflamación tisular, la inflamación sistémica no se limita a un tejido en particular, sino que involucra al endotelio y a otros sistemas orgánicos.
La inflamación crónica se observa ampliamente en la obesidad . [94] [95] Las personas obesas comúnmente tienen muchos marcadores elevados de inflamación, incluidos: [96] [97]
La inflamación crónica de bajo grado se caracteriza por un aumento de dos a tres veces en las concentraciones sistémicas de citocinas como TNF-α, IL-6 y PCR. [100] La circunferencia de la cintura se correlaciona significativamente con la respuesta inflamatoria sistémica. [101]
La pérdida de tejido adiposo blanco reduce los niveles de marcadores de inflamación. [94] En 2017, la asociación de la inflamación sistémica con la resistencia a la insulina y la diabetes tipo 2 , y con la aterosclerosis , estaba bajo investigación preliminar, aunque no se habían realizado ensayos clínicos rigurosos para confirmar dichas relaciones. [102]
La proteína C reactiva (PCR) se genera en un nivel más alto en personas obesas y puede aumentar el riesgo de enfermedades cardiovasculares . [103]
El resultado en una circunstancia particular estará determinado por el tejido en el que se haya producido la lesión y el agente lesivo que la esté causando. Estos son los posibles resultados de la inflamación: [10]
La inflamación suele indicarse añadiendo el sufijo "itis", como se muestra a continuación. Sin embargo, algunas afecciones, como el asma y la neumonía , no siguen esta convención. Hay más ejemplos disponibles en Lista de tipos de inflamación .