La química es el estudio científico de las propiedades y el comportamiento de la materia . [1] Es una ciencia física dentro de las ciencias naturales que estudia los elementos químicos que forman la materia y los compuestos hechos de átomos , moléculas e iones : su composición, estructura, propiedades, comportamiento y los cambios que sufren durante las reacciones con otras sustancias . [2] [3] [4] [5] La química también aborda la naturaleza de los enlaces químicos en los compuestos químicos .
En el ámbito de su objeto de estudio, la química ocupa una posición intermedia entre la física y la biología . [6] A veces se la denomina la ciencia central porque proporciona una base para comprender tanto las disciplinas científicas básicas como las aplicadas a un nivel fundamental. [7] Por ejemplo, la química explica aspectos del crecimiento de las plantas ( botánica ), la formación de rocas ígneas ( geología ), cómo se forma el ozono atmosférico y cómo se degradan los contaminantes ambientales ( ecología ), las propiedades del suelo en la Luna ( cosmoquímica ), cómo funcionan los medicamentos ( farmacología ) y cómo recolectar evidencia de ADN en la escena de un crimen ( ciencia forense ).
La química ha existido bajo diversos nombres desde la antigüedad. [8] Ha evolucionado y ahora abarca varias áreas de especialización o subdisciplinas que siguen aumentando en número y se interrelacionan para crear más campos de estudio interdisciplinarios. Las aplicaciones de varios campos de la química se utilizan con frecuencia con fines económicos en la industria química .
La palabra química proviene de una modificación durante el Renacimiento de la palabra alquimia , que se refería a un conjunto anterior de prácticas que abarcaban elementos de la química, la metalurgia , la filosofía , la astrología , la astronomía , el misticismo y la medicina . La alquimia se asocia a menudo con la búsqueda de convertir el plomo u otros metales básicos en oro, aunque los alquimistas también estaban interesados en muchas de las cuestiones de la química moderna. [9] [10]
La palabra moderna alquimia a su vez se deriva de la palabra árabe al-kīmīā ( الكیمیاء ). Esto puede tener orígenes egipcios ya que al-kīmīā se deriva del griego antiguo χημία , que a su vez se deriva de la palabra Kemet , que es el antiguo nombre de Egipto en el idioma egipcio. [11] Alternativamente, al-kīmīā puede derivar de χημεία 'fundir juntos'. [12]

El modelo actual de la estructura atómica es el modelo mecánico cuántico . [13] La química tradicional comienza con el estudio de partículas elementales , átomos , moléculas , [14] sustancias , metales , cristales y otros agregados de materia . La materia puede estudiarse en estados sólido, líquido, gas y plasma , de forma aislada o en combinación. Las interacciones, reacciones y transformaciones que se estudian en química suelen ser el resultado de interacciones entre átomos, que dan lugar a reordenamientos de los enlaces químicos que mantienen unidos a los átomos. Tales comportamientos se estudian en un laboratorio de química .
El laboratorio de química utiliza, por lo general, diversos tipos de cristalería de laboratorio . Sin embargo, la cristalería no es fundamental para la química y gran parte de la química experimental (así como la química industrial o aplicada) se realiza sin ella.

Una reacción química es una transformación de algunas sustancias en una o más sustancias diferentes. [15] La base de dicha transformación química es la reorganización de los electrones en los enlaces químicos entre átomos. Puede representarse simbólicamente a través de una ecuación química , que generalmente involucra átomos como sujetos. El número de átomos a la izquierda y a la derecha en la ecuación para una transformación química es igual. (Cuando el número de átomos a cada lado es desigual, la transformación se conoce como reacción nuclear o desintegración radiactiva ). El tipo de reacciones químicas que puede experimentar una sustancia y los cambios de energía que pueden acompañarla están limitados por ciertas reglas básicas, conocidas como leyes químicas .
Las consideraciones de energía y entropía son invariablemente importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican en términos de su estructura , fase, así como sus composiciones químicas . Pueden analizarse utilizando las herramientas del análisis químico , por ejemplo, la espectroscopia y la cromatografía . Los científicos dedicados a la investigación química se conocen como químicos . [16] La mayoría de los químicos se especializan en una o más subdisciplinas. Varios conceptos son esenciales para el estudio de la química; algunos de ellos son: [17]
En química, la materia se define como todo aquello que tiene masa en reposo y volumen (ocupa espacio) y está formado por partículas . Las partículas que forman la materia también tienen masa en reposo; no todas las partículas tienen masa en reposo, como el fotón . La materia puede ser una sustancia química pura o una mezcla de sustancias. [18]

El átomo es la unidad básica de la química. Está formado por un núcleo denso llamado núcleo atómico rodeado por un espacio ocupado por una nube de electrones . El núcleo está formado por protones con carga positiva y neutrones sin carga (llamados en conjunto nucleones ), mientras que la nube de electrones está formada por electrones con carga negativa que orbitan alrededor del núcleo. En un átomo neutro, los electrones con carga negativa equilibran la carga positiva de los protones. El núcleo es denso; la masa de un nucleón es aproximadamente 1.836 veces la de un electrón, pero el radio de un átomo es unas 10.000 veces el de su núcleo. [19] [20]
El átomo es también la entidad más pequeña que puede concebirse que conserve las propiedades químicas del elemento, como la electronegatividad , el potencial de ionización , el estado de oxidación preferido , el número de coordinación y los tipos de enlaces preferidos para formar (por ejemplo, metálico , iónico , covalente ).
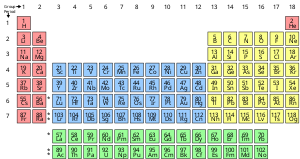
Un elemento químico es una sustancia pura que está compuesta por un solo tipo de átomo, caracterizado por su número particular de protones en los núcleos de sus átomos, conocido como número atómico y representado por el símbolo Z. El número másico es la suma del número de protones y neutrones en un núcleo. Aunque todos los núcleos de todos los átomos pertenecientes a un elemento tendrán el mismo número atómico, no necesariamente tendrán el mismo número másico; los átomos de un elemento que tienen diferentes números másicos se conocen como isótopos . Por ejemplo, todos los átomos con 6 protones en sus núcleos son átomos del elemento químico carbono , pero los átomos de carbono pueden tener números másicos de 12 o 13. [20]
La presentación estándar de los elementos químicos se encuentra en la tabla periódica , que ordena los elementos por número atómico. La tabla periódica está organizada en grupos , o columnas, y períodos , o filas. La tabla periódica es útil para identificar tendencias periódicas . [21]

Un compuesto es una sustancia química pura compuesta por más de un elemento. Las propiedades de un compuesto tienen poca similitud con las de sus elementos. [22] La nomenclatura estándar de los compuestos la establece la Unión Internacional de Química Pura y Aplicada (IUPAC). Los compuestos orgánicos se nombran de acuerdo con el sistema de nomenclatura orgánica . [23] Los nombres de los compuestos inorgánicos se crean de acuerdo con el sistema de nomenclatura inorgánica . Cuando un compuesto tiene más de un componente, se dividen en dos clases, los componentes electropositivos y los electronegativos. [24] Además, el Chemical Abstracts Service ha ideado un método para indexar sustancias químicas. En este esquema, cada sustancia química es identificable por un número conocido como su número de registro CAS .

Una molécula es la porción indivisible más pequeña de una sustancia química pura que tiene su conjunto único de propiedades químicas, es decir, su potencial para experimentar un determinado conjunto de reacciones químicas con otras sustancias. Sin embargo, esta definición solo funciona bien para sustancias que están compuestas de moléculas, lo que no es cierto para muchas sustancias (ver más abajo). Las moléculas son típicamente un conjunto de átomos unidos entre sí por enlaces covalentes , de modo que la estructura es eléctricamente neutra y todos los electrones de valencia están emparejados con otros electrones ya sea en enlaces o en pares solitarios .
Por lo tanto, las moléculas existen como unidades eléctricamente neutras, a diferencia de los iones. Cuando se rompe esta regla, lo que da a la "molécula" una carga, el resultado a veces se denomina ion molecular o ion poliatómico. Sin embargo, la naturaleza discreta y separada del concepto molecular generalmente requiere que los iones moleculares estén presentes solo en forma bien separada, como un haz dirigido en el vacío en un espectrómetro de masas . Las colecciones poliatómicas cargadas que residen en sólidos (por ejemplo, iones comunes de sulfato o nitrato) generalmente no se consideran "moléculas" en química. Algunas moléculas contienen uno o más electrones desapareados, lo que crea radicales . La mayoría de los radicales son comparativamente reactivos, pero algunos, como el óxido nítrico (NO), pueden ser estables.

Los elementos "inertes" o gases nobles ( helio , neón , argón , criptón , xenón y radón ) están compuestos de átomos solitarios como su unidad discreta más pequeña, pero los demás elementos químicos aislados consisten en moléculas o redes de átomos unidos entre sí de alguna manera. Las moléculas identificables componen sustancias familiares como el agua, el aire y muchos compuestos orgánicos como el alcohol, el azúcar, la gasolina y los diversos productos farmacéuticos .
Sin embargo, no todas las sustancias o compuestos químicos consisten en moléculas discretas y, de hecho, la mayoría de las sustancias sólidas que forman la corteza sólida, el manto y el núcleo de la Tierra son compuestos químicos sin moléculas. Estos otros tipos de sustancias, como los compuestos iónicos y los sólidos en red , están organizados de tal manera que carecen de la existencia de moléculas identificables per se . En cambio, estas sustancias se analizan en términos de unidades de fórmula o celdas unitarias como la estructura repetitiva más pequeña dentro de la sustancia. Ejemplos de tales sustancias son las sales minerales (como la sal de mesa ), sólidos como el carbono y el diamante, metales y minerales familiares de sílice y silicato como el cuarzo y el granito.
Una de las principales características de una molécula es su geometría, a menudo denominada estructura . Si bien la estructura de las moléculas diatómicas, triatómicas o tetraatómicas puede ser trivial (lineal, piramidal angular, etc.), la estructura de las moléculas poliatómicas, que están constituidas por más de seis átomos (de varios elementos), puede ser crucial para su naturaleza química.
Una sustancia química es un tipo de materia con una composición y un conjunto de propiedades definidos . [25] Un conjunto de sustancias se denomina mezcla. Ejemplos de mezclas son el aire y las aleaciones . [26]
El mol es una unidad de medida que denota una cantidad de sustancia (también llamada cantidad química). Un mol se define como el contenido exacto de6.022 140 76 × 10 23 partículas ( átomos , moléculas , iones o electrones ), donde el número de partículas por mol se conoce como la constante de Avogadro . [27] La concentración molar es la cantidad de una sustancia particular por volumen de solución y comúnmente se informa en mol/ dm 3 . [28]

Además de las propiedades químicas específicas que distinguen a las distintas clasificaciones químicas, las sustancias químicas pueden existir en varias fases. En su mayor parte, las clasificaciones químicas son independientes de estas clasificaciones de fase global; sin embargo, algunas fases más exóticas son incompatibles con ciertas propiedades químicas. Una fase es un conjunto de estados de un sistema químico que tienen propiedades estructurales globales similares, en un rango de condiciones, como presión o temperatura .
Las propiedades físicas, como la densidad y el índice de refracción, tienden a estar dentro de los valores característicos de la fase. La fase de la materia se define por la transición de fase , que es cuando la energía que se introduce o se extrae del sistema se destina a reorganizar la estructura del sistema, en lugar de cambiar las condiciones generales.
A veces la distinción entre fases puede ser continua en lugar de tener un límite discreto; en este caso se considera que la materia está en un estado supercrítico . Cuando se reúnen tres estados en función de las condiciones, se conoce como punto triple y, dado que es invariante, es una forma conveniente de definir un conjunto de condiciones.
Los ejemplos más conocidos de fases son los sólidos , los líquidos y los gases . Muchas sustancias presentan múltiples fases sólidas. Por ejemplo, existen tres fases del hierro sólido (alfa, gamma y delta) que varían en función de la temperatura y la presión. Una diferencia principal entre las fases sólidas es la estructura cristalina o la disposición de los átomos. Otra fase que se encuentra comúnmente en el estudio de la química es la fase acuosa , que es el estado de las sustancias disueltas en solución acuosa (es decir, en agua).
Las fases menos conocidas incluyen plasmas , condensados de Bose-Einstein y condensados fermiónicos y las fases paramagnéticas y ferromagnéticas de materiales magnéticos . Si bien la mayoría de las fases conocidas tratan con sistemas tridimensionales, también es posible definir análogos en sistemas bidimensionales, lo que ha recibido atención por su relevancia para los sistemas en biología .

Se dice que los átomos que se unen en moléculas o cristales están unidos entre sí. Un enlace químico puede visualizarse como el equilibrio multipolar entre las cargas positivas en los núcleos y las cargas negativas que oscilan a su alrededor. [29] Más que la simple atracción y repulsión, las energías y distribuciones caracterizan la disponibilidad de un electrón para unirse a otro átomo.
El enlace químico puede ser un enlace covalente , un enlace iónico , un enlace de hidrógeno o simplemente por la fuerza de Van der Waals . Cada uno de estos tipos de enlaces se atribuye a algún potencial. Estos potenciales crean las interacciones que mantienen unidos a los átomos en moléculas o cristales . En muchos compuestos simples, la teoría del enlace de valencia , el modelo de repulsión de pares de electrones de la capa de valencia ( VSEPR ) y el concepto de número de oxidación se pueden utilizar para explicar la estructura y la composición molecular.
Un enlace iónico se forma cuando un metal pierde uno o más de sus electrones, convirtiéndose en un catión con carga positiva, y luego los electrones son ganados por el átomo no metálico, convirtiéndose en un anión con carga negativa. Los dos iones con carga opuesta se atraen entre sí, y el enlace iónico es la fuerza electrostática de atracción entre ellos. Por ejemplo, el sodio (Na), un metal, pierde un electrón para convertirse en un catión Na + mientras que el cloro (Cl), un no metal, gana este electrón para convertirse en Cl− . Los iones se mantienen unidos debido a la atracción electrostática, y se forma ese compuesto, el cloruro de sodio (NaCl), o sal de mesa común.

En un enlace covalente, uno o más pares de electrones de valencia son compartidos por dos átomos: el grupo eléctricamente neutro resultante de átomos enlazados se denomina molécula . Los átomos compartirán electrones de valencia de tal manera que creen una configuración electrónica de gas noble (ocho electrones en su capa más externa) para cada átomo. Se dice que los átomos que tienden a combinarse de tal manera que cada uno tiene ocho electrones en su capa de valencia siguen la regla del octeto . Sin embargo, algunos elementos como el hidrógeno y el litio necesitan solo dos electrones en su capa más externa para alcanzar esta configuración estable; se dice que estos átomos siguen la regla del dúo , y de esta manera están alcanzando la configuración electrónica del gas noble helio , que tiene dos electrones en su capa externa.
De manera similar, las teorías de la física clásica se pueden utilizar para predecir muchas estructuras iónicas. En el caso de compuestos más complejos, como los complejos metálicos , la teoría del enlace de valencia es menos aplicable y, por lo general, se utilizan enfoques alternativos, como la teoría de orbitales moleculares . Véase el diagrama sobre orbitales electrónicos.
En el contexto de la química, la energía es un atributo de una sustancia como consecuencia de su estructura atómica , molecular o agregada . Dado que una transformación química va acompañada de un cambio en uno o más de estos tipos de estructuras, invariablemente va acompañada de un aumento o disminución de la energía de las sustancias involucradas. Parte de la energía se transfiere entre el entorno y los reactivos de la reacción en forma de calor o luz ; por lo tanto, los productos de una reacción pueden tener más o menos energía que los reactivos.
Se dice que una reacción es exergónica si el estado final es inferior en la escala de energía al estado inicial; en el caso de las reacciones endergónicas la situación es la inversa. Se dice que una reacción es exotérmica si la reacción libera calor al entorno; en el caso de las reacciones endotérmicas , la reacción absorbe calor del entorno.
Las reacciones químicas no son posibles a menos que los reactivos superen una barrera energética conocida como energía de activación . La velocidad de una reacción química (a una temperatura dada T) está relacionada con la energía de activación E, mediante el factor de población de Boltzmann , que es la probabilidad de que una molécula tenga una energía mayor o igual a E a la temperatura dada T. Esta dependencia exponencial de la velocidad de una reacción con respecto a la temperatura se conoce como la ecuación de Arrhenius . La energía de activación necesaria para que se produzca una reacción química puede presentarse en forma de calor, luz, electricidad o fuerza mecánica en forma de ultrasonidos . [30]
Un concepto relacionado , la energía libre , que también incorpora consideraciones de entropía, es un medio muy útil para predecir la viabilidad de una reacción y determinar el estado de equilibrio de una reacción química, en termodinámica química . Una reacción es factible solo si el cambio total en la energía libre de Gibbs es negativo ; si es igual a cero, se dice que la reacción química está en equilibrio .
Existen sólo unos pocos estados de energía posibles para los electrones, átomos y moléculas. Estos están determinados por las reglas de la mecánica cuántica , que exigen la cuantificación de la energía de un sistema ligado. Se dice que los átomos o moléculas en un estado de energía más alto están excitados. Las moléculas o átomos de una sustancia en un estado de energía excitado suelen ser mucho más reactivos, es decir, más susceptibles a las reacciones químicas.
La fase de una sustancia está determinada invariablemente por su energía y la energía de su entorno. Cuando las fuerzas intermoleculares de una sustancia son tales que la energía del entorno no es suficiente para vencerlas, se presenta en una fase más ordenada como líquido o sólido como es el caso del agua (H 2 O); un líquido a temperatura ambiente porque sus moléculas están unidas por enlaces de hidrógeno . [31] Mientras que el sulfuro de hidrógeno (H 2 S) es un gas a temperatura ambiente y presión estándar, ya que sus moléculas están unidas por interacciones dipolo-dipolo más débiles .
La transferencia de energía de una sustancia química a otra depende del tamaño de los cuantos de energía emitidos por una sustancia. Sin embargo, la energía térmica suele transferirse más fácilmente de casi cualquier sustancia a otra porque los fonones responsables de los niveles de energía vibracional y rotacional en una sustancia tienen mucha menos energía que los fotones invocados para la transferencia de energía electrónica. Por lo tanto, debido a que los niveles de energía vibracional y rotacional están más espaciados que los niveles de energía electrónica, el calor se transfiere más fácilmente entre sustancias en relación con la luz u otras formas de energía electrónica. Por ejemplo, la radiación electromagnética ultravioleta no se transfiere con tanta eficacia de una sustancia a otra como la energía térmica o eléctrica.
La existencia de niveles de energía característicos para diferentes sustancias químicas es útil para su identificación mediante el análisis de líneas espectrales . En la espectroscopia química se utilizan a menudo diferentes tipos de espectros , por ejemplo, IR , microondas , RMN , ESR , etc. La espectroscopia también se utiliza para identificar la composición de objetos remotos, como estrellas y galaxias lejanas, mediante el análisis de sus espectros de radiación.

El término energía química se utiliza a menudo para indicar el potencial de una sustancia química de sufrir una transformación a través de una reacción química o de transformar otras sustancias químicas.

Cuando una sustancia química se transforma como resultado de su interacción con otra sustancia o con energía, se dice que ha ocurrido una reacción química. Por lo tanto, una reacción química es un concepto relacionado con la "reacción" de una sustancia cuando entra en contacto cercano con otra, ya sea como una mezcla o una solución ; exposición a alguna forma de energía, o ambas. Da como resultado un intercambio de energía entre los componentes de la reacción, así como con el entorno del sistema, que puede ser recipientes diseñados, a menudo material de vidrio de laboratorio .
Las reacciones químicas pueden dar lugar a la formación o disociación de moléculas, es decir, a la separación de moléculas para formar dos o más moléculas o a la reorganización de átomos dentro de las moléculas o entre ellas. Las reacciones químicas suelen implicar la formación o la ruptura de enlaces químicos. La oxidación, la reducción , la disociación , la neutralización ácido-base y la reorganización molecular son algunos ejemplos de reacciones químicas comunes.
Una reacción química se puede representar simbólicamente mediante una ecuación química . Mientras que en una reacción química no nuclear el número y tipo de átomos en ambos lados de la ecuación son iguales, en una reacción nuclear esto es válido solo para las partículas nucleares, es decir, protones y neutrones. [32]
La secuencia de pasos en los que puede tener lugar la reorganización de los enlaces químicos en el curso de una reacción química se denomina mecanismo . Se puede imaginar que una reacción química se lleva a cabo en varios pasos, cada uno de los cuales puede tener una velocidad diferente. Por lo tanto, se pueden imaginar muchos intermediarios de reacción con estabilidad variable durante el curso de una reacción. Los mecanismos de reacción se proponen para explicar la cinética y la mezcla relativa de productos de una reacción. Muchos químicos físicos se especializan en explorar y proponer los mecanismos de varias reacciones químicas. Varias reglas empíricas, como las reglas de Woodward-Hoffmann, a menudo resultan útiles al proponer un mecanismo para una reacción química.
Según el libro de oro de la IUPAC , una reacción química es "un proceso que da como resultado la interconversión de especies químicas". [33] En consecuencia, una reacción química puede ser una reacción elemental o una reacción por pasos . Se hace una salvedad adicional, ya que esta definición incluye casos en los que la interconversión de confórmeros es observable experimentalmente. Tales reacciones químicas detectables normalmente involucran conjuntos de entidades moleculares como lo indica esta definición, pero a menudo es conceptualmente conveniente usar el término también para cambios que involucran entidades moleculares individuales (es decir, 'eventos químicos microscópicos').

Un ion es una especie cargada, un átomo o una molécula, que ha perdido o ganado uno o más electrones. Cuando un átomo pierde un electrón y, por lo tanto, tiene más protones que electrones, el átomo es un ion o catión con carga positiva . Cuando un átomo gana un electrón y, por lo tanto, tiene más electrones que protones, el átomo es un ion o anión con carga negativa . Los cationes y aniones pueden formar una red cristalina de sales neutras , como los iones Na + y Cl− que forman cloruro de sodio o NaCl. Ejemplos de iones poliatómicos que no se dividen durante las reacciones ácido-base son el hidróxido (OH− ) y el fosfato (PO43− ) .
El plasma está compuesto de materia gaseosa que ha sido completamente ionizada, generalmente a través de alta temperatura.

Una sustancia puede clasificarse a menudo como ácido o base . Existen varias teorías diferentes que explican el comportamiento ácido-base. La más simple es la teoría de Arrhenius , que establece que un ácido es una sustancia que produce iones hidronio cuando se disuelve en agua, y una base es una que produce iones hidróxido cuando se disuelve en agua. Según la teoría ácido-base de Brønsted-Lowry , los ácidos son sustancias que donan un ion hidrógeno positivo a otra sustancia en una reacción química; por extensión, una base es la sustancia que recibe ese ion hidrógeno.
Una tercera teoría común es la teoría ácido-base de Lewis , que se basa en la formación de nuevos enlaces químicos. La teoría de Lewis explica que un ácido es una sustancia que es capaz de aceptar un par de electrones de otra sustancia durante el proceso de formación de un enlace, mientras que una base es una sustancia que puede proporcionar un par de electrones para formar un nuevo enlace. Hay otras muchas formas en las que una sustancia puede clasificarse como ácido o base, como es evidente en la historia de este concepto. [34]
La fuerza ácida se mide comúnmente mediante dos métodos. Una medida, basada en la definición de acidez de Arrhenius, es el pH , que es una medida de la concentración de iones hidronio en una solución, expresada en una escala logarítmica negativa . Por lo tanto, las soluciones que tienen un pH bajo tienen una concentración alta de iones hidronio y se puede decir que son más ácidas. La otra medida, basada en la definición de Brønsted-Lowry, es la constante de disociación ácida (K a ), que mide la capacidad relativa de una sustancia para actuar como un ácido según la definición de ácido de Brønsted-Lowry. Es decir, las sustancias con una K a más alta tienen más probabilidades de donar iones de hidrógeno en reacciones químicas que aquellas con valores de K a más bajos .
Las reacciones redox ( reducción - oxidación ) incluyen todas las reacciones químicas en las que los átomos cambian su estado de oxidación , ya sea ganando electrones (reducción) o perdiendo electrones (oxidación). Las sustancias que tienen la capacidad de oxidar otras sustancias se denominan oxidativas y se conocen como agentes oxidantes , oxidantes u oxidantes. Un oxidante elimina electrones de otra sustancia. De manera similar, las sustancias que tienen la capacidad de reducir otras sustancias se denominan reductoras y se conocen como agentes reductores , reductores o reductores.
Un reductor transfiere electrones a otra sustancia y, por lo tanto, se oxida a sí mismo. Y como "dona" electrones, también se lo llama donador de electrones. La oxidación y la reducción se refieren propiamente a un cambio en el número de oxidación; es posible que la transferencia real de electrones nunca ocurra. Por lo tanto, la oxidación se define mejor como un aumento en el número de oxidación y la reducción como una disminución en el número de oxidación.
Aunque el concepto de equilibrio se utiliza ampliamente en todas las ciencias, en el contexto de la química surge siempre que son posibles varios estados diferentes de la composición química, como por ejemplo en una mezcla de varios compuestos químicos que pueden reaccionar entre sí, o cuando una sustancia puede estar presente en más de un tipo de fase.
Un sistema de sustancias químicas en equilibrio, aunque tenga una composición invariable, no suele ser estático ; las moléculas de las sustancias siguen reaccionando entre sí, dando lugar así a un equilibrio dinámico . Por tanto, el concepto describe el estado en el que los parámetros como la composición química permanecen invariables a lo largo del tiempo.
Las reacciones químicas se rigen por ciertas leyes que se han convertido en conceptos fundamentales de la química. Algunas de ellas son:
La historia de la química abarca un período que va desde el pasado antiguo hasta el presente. Desde varios milenios antes de Cristo, las civilizaciones utilizaban tecnologías que con el tiempo formarían la base de las diversas ramas de la química. Algunos ejemplos incluyen la extracción de metales de los minerales , la fabricación de cerámica y esmaltes, la fermentación de cerveza y vino, la extracción de sustancias químicas de las plantas para la medicina y el perfume, la conversión de grasa en jabón , la fabricación de vidrio y la fabricación de aleaciones como el bronce .
La química fue precedida por su protociencia, la alquimia , que aplicaba un enfoque no científico para comprender los constituyentes de la materia y sus interacciones. A pesar de no tener éxito en la explicación de la naturaleza de la materia y sus transformaciones, los alquimistas sentaron las bases para la química moderna al realizar experimentos y registrar los resultados. Robert Boyle , aunque escéptico respecto de los elementos y convencido de la alquimia, jugó un papel clave en la elevación del "arte sagrado" como una disciplina independiente, fundamental y filosófica en su obra El químico escéptico (1661). [35]
Si bien tanto la alquimia como la química se ocupan de la materia y sus transformaciones, la diferencia crucial la dio el método científico que emplearon los químicos en su trabajo. La química, como un cuerpo de conocimiento distinto de la alquimia, se convirtió en una ciencia establecida con el trabajo de Antoine Lavoisier , quien desarrolló una ley de conservación de la masa que exigía una medición cuidadosa y observaciones cuantitativas de los fenómenos químicos. La historia de la química posterior se entrelaza con la historia de la termodinámica , especialmente a través del trabajo de Willard Gibbs . [36]
La definición de química ha cambiado con el tiempo, a medida que nuevos descubrimientos y teorías se suman a la funcionalidad de la ciencia. El término "química", en la opinión del célebre científico Robert Boyle en 1661, significaba el tema de los principios materiales de los cuerpos mixtos. [37] En 1663, el químico Christopher Glaser describió la "química" como un arte científico, mediante el cual se aprende a disolver los cuerpos, y a extraer de ellos las diferentes sustancias según su composición, y cómo unirlas de nuevo, y elevarlas a una perfección superior. [38]
La definición de 1730 de la palabra "química", tal como la utilizó Georg Ernst Stahl , significaba el arte de resolver cuerpos mixtos, compuestos o agregados en sus principios; y de componer dichos cuerpos a partir de esos principios. [39] En 1837, Jean-Baptiste Dumas consideró que la palabra "química" se refería a la ciencia que se ocupa de las leyes y efectos de las fuerzas moleculares. [40] Esta definición evolucionó aún más hasta que, en 1947, llegó a significar la ciencia de las sustancias: su estructura, sus propiedades y las reacciones que las transforman en otras sustancias, una caracterización aceptada por Linus Pauling . [41] Más recientemente, en 1998, el profesor Raymond Chang amplió la definición de "química" para significar el estudio de la materia y los cambios que sufre. [42]

Las civilizaciones antiguas, como los egipcios [43], los babilonios y los indios [44], acumularon conocimientos prácticos sobre las artes de la metalurgia, la cerámica y los tintes, pero no desarrollaron una teoría sistemática.
Una hipótesis química básica surgió por primera vez en la Grecia clásica con la teoría de los cuatro elementos propuesta definitivamente por Aristóteles, que afirmaba que el fuego , el aire , la tierra y el agua eran los elementos fundamentales a partir de los cuales todo se forma como una combinación. El atomismo griego se remonta al 440 a. C., y surgió en obras de filósofos como Demócrito y Epicuro . En el 50 a. C., el filósofo romano Lucrecio amplió la teoría en su poema De rerum natura (Sobre la naturaleza de las cosas). [45] [46] A diferencia de los conceptos modernos de ciencia, el atomismo griego era de naturaleza puramente filosófica, con poca preocupación por las observaciones empíricas y ninguna preocupación por los experimentos químicos. [47]
Una forma temprana de la idea de la conservación de la masa es la noción de que " Nada viene de la nada " en la filosofía griega antigua , que se puede encontrar en Empédocles (aproximadamente el siglo IV a. C.): "Pues es imposible que algo provenga de lo que no es, y no se puede provocar ni oír que lo que es sea destruido por completo". [48] y Epicuro (siglo III a. C.), quien, describiendo la naturaleza del Universo, escribió que "la totalidad de las cosas siempre fue tal como es ahora, y siempre lo será". [49]

En el mundo helenístico, el arte de la alquimia proliferó por primera vez, mezclando magia y ocultismo en el estudio de sustancias naturales con el objetivo final de transmutar elementos en oro y descubrir el elixir de la vida eterna. [50] El trabajo, particularmente el desarrollo de la destilación , continuó en el período bizantino temprano y el practicante más famoso fue el greco-egipcio del siglo IV Zósimo de Panópolis . [51] La alquimia continuó desarrollándose y practicándose en todo el mundo árabe después de las conquistas musulmanas , [52] y desde allí, y desde los restos bizantinos, [53] se difundió en la Europa medieval y renacentista a través de traducciones latinas.
Las obras árabes atribuidas a Jabir ibn Hayyan introdujeron una clasificación sistemática de sustancias químicas y proporcionaron instrucciones para derivar un compuesto inorgánico ( sal amoniacal o cloruro de amonio ) de sustancias orgánicas (como plantas, sangre y cabello) por medios químicos. [54] Algunas obras árabes jabirianas (por ejemplo, el "Libro de la Misericordia" y el "Libro de los Setenta") fueron traducidas más tarde al latín con el nombre latinizado "Geber", [55] y en la Europa del siglo XIII un escritor anónimo, generalmente conocido como pseudo-Geber , comenzó a producir escritos alquímicos y metalúrgicos bajo este nombre. [56] Filósofos musulmanes influyentes posteriores, como Abū al-Rayhān al-Bīrūnī [57] y Avicena [58] disputaron las teorías de la alquimia, particularmente la teoría de la transmutación de metales .

Las mejoras en el refinado de los minerales y su extracción para fundir metales fueron una fuente de información muy utilizada por los primeros químicos del siglo XVI, entre ellos Georg Agricola (1494-1555), que publicó su obra principal De re metallica en 1556. Su obra, que describe procesos altamente desarrollados y complejos de extracción de minerales metálicos, fue la cumbre de la metalurgia durante esa época. Su enfoque eliminó todo el misticismo asociado con el tema, creando la base práctica sobre la que otros podrían y querrían construir. La obra describe los muchos tipos de hornos utilizados para fundir minerales y estimuló el interés por los minerales y su composición. A Agricola ha sido descrito como el "padre de la metalurgia" y el fundador de la geología como disciplina científica. [62] [60] [61]
Bajo la influencia de los nuevos métodos empíricos propuestos por Sir Francis Bacon y otros, un grupo de químicos de Oxford , Robert Boyle , Robert Hooke y John Mayow, comenzaron a reformular las antiguas tradiciones alquímicas para convertirlas en una disciplina científica. Boyle, en particular, cuestionó algunas teorías químicas comúnmente aceptadas y abogó por que los profesionales químicos fueran más "filosóficos" y menos centrados en lo comercial en The Sceptical Chemyst . [35] Formuló la ley de Boyle , rechazó los "cuatro elementos" clásicos y propuso una alternativa mecanicista de átomos y reacciones químicas que podrían estar sujetas a experimentos rigurosos. [63]
.jpg/440px-David_-_Portrait_of_Monsieur_Lavoisier_(cropped).jpg)
En las décadas siguientes se hicieron muchos descubrimientos importantes, como la naturaleza del «aire», que se descubrió que estaba compuesto de muchos gases diferentes. El químico escocés Joseph Black y el flamenco Jan Baptist van Helmont descubrieron el dióxido de carbono , o lo que Black llamó «aire fijo», en 1754; Henry Cavendish descubrió el hidrógeno y dilucidó sus propiedades, y Joseph Priestley e, independientemente, Carl Wilhelm Scheele aislaron el oxígeno puro . La teoría del flogisto (una sustancia en la raíz de toda combustión) fue propuesta por el alemán Georg Ernst Stahl a principios del siglo XVIII y solo fue refutada a finales de siglo por el químico francés Antoine Lavoisier , el análogo químico de Newton en física. Lavoisier hizo más que ningún otro para establecer la nueva ciencia sobre una base teórica adecuada, al dilucidar el principio de conservación de la masa y desarrollar un nuevo sistema de nomenclatura química que se utiliza hasta el día de hoy. [65]
El científico inglés John Dalton propuso la teoría moderna de los átomos : todas las sustancias están compuestas de "átomos" indivisibles de materia y que los diferentes átomos tienen pesos atómicos variables.
El desarrollo de la teoría electroquímica de las combinaciones químicas se produjo a principios del siglo XIX como resultado del trabajo de dos científicos en particular, Jöns Jacob Berzelius y Humphry Davy , que fue posible gracias a la invención previa de la pila voltaica por parte de Alessandro Volta . Davy descubrió nueve elementos nuevos, incluidos los metales alcalinos , extrayéndolos de sus óxidos con corriente eléctrica. [66]

El británico William Prout fue el primero en proponer ordenar todos los elementos por su peso atómico, ya que todos los átomos tenían un peso que era un múltiplo exacto del peso atómico del hidrógeno. JAR Newlands ideó una tabla temprana de elementos, que luego fue desarrollada en la tabla periódica moderna de elementos [69] en la década de 1860 por Dmitri Mendeleev e independientemente por varios otros científicos, incluido Julius Lothar Meyer . [70] [71] Los gases inertes, más tarde llamados gases nobles , fueron descubiertos por William Ramsay en colaboración con Lord Rayleigh a fines del siglo, completando así la estructura básica de la tabla.

A principios del siglo XX, los fundamentos teóricos de la química finalmente se entendieron debido a una serie de descubrimientos notables que lograron investigar y descubrir la naturaleza misma de la estructura interna de los átomos. En 1897, JJ Thomson de la Universidad de Cambridge descubrió el electrón y poco después el científico francés Becquerel, así como la pareja Pierre y Marie Curie, investigaron el fenómeno de la radiactividad . En una serie de experimentos pioneros de dispersión, Ernest Rutherford, de la Universidad de Manchester , descubrió la estructura interna del átomo y la existencia del protón, clasificó y explicó los diferentes tipos de radiactividad y transmutó con éxito el primer elemento bombardeando nitrógeno con partículas alfa .
Sus trabajos sobre la estructura atómica fueron mejorados por sus alumnos, el físico danés Niels Bohr , el inglés Henry Moseley y el alemán Otto Hahn , quien más tarde fue el padre de la química nuclear emergente y descubrió la fisión nuclear . La teoría electrónica de los enlaces químicos y los orbitales moleculares fue desarrollada por los científicos estadounidenses Linus Pauling y Gilbert N. Lewis .
El año 2011 fue declarado por las Naciones Unidas como el Año Internacional de la Química. [72] Fue una iniciativa de la Unión Internacional de Química Pura y Aplicada y de la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura e involucra a sociedades químicas, académicos e instituciones de todo el mundo y se basó en iniciativas individuales para organizar actividades locales y regionales.
La química orgánica fue desarrollada por Justus von Liebig y otros, siguiendo la síntesis de urea de Friedrich Wöhler . [73] Otros avances cruciales del siglo XIX fueron; la comprensión del enlace de valencia ( Edward Frankland en 1852) y la aplicación de la termodinámica a la química ( JW Gibbs y Svante Arrhenius en la década de 1870).
En la práctica de la química, la química pura es el estudio de los principios fundamentales de la química, mientras que la química aplicada aplica ese conocimiento para desarrollar tecnología y resolver problemas del mundo real.
La química suele dividirse en varias subdisciplinas principales. También existen varios campos principales de la química que son interdisciplinarios y más especializados. [74]





Otras subdivisiones incluyen electroquímica , femtoquímica , química del sabor , química de flujo , inmunohistoquímica , química de hidrogenación , química matemática , mecánica molecular , química de productos naturales , química organometálica , petroquímica , fotoquímica , química orgánica física , química de polímeros , radioquímica , sonoquímica , química supramolecular , química sintética y muchas otras.
Los campos interdisciplinarios incluyen agroquímica , astroquímica (y cosmoquímica ), química atmosférica , ingeniería química , biología química , quimioinformática , química ambiental , geoquímica , química verde , inmunoquímica , química marina , ciencia de los materiales , mecanoquímica , química medicinal , biología molecular , nanotecnología , enología , farmacología , fitoquímica , química del estado sólido , ciencia de superficies , termoquímica y muchos otros.
La industria química representa una actividad económica importante a nivel mundial. En 2013, los 50 principales productores químicos del mundo tuvieron ventas por 980,5 mil millones de dólares con un margen de beneficio del 10,3%. [86]
Lectura popular
Libros de texto introductorios de pregrado
Libros de texto avanzados de nivel de pregrado o posgrado