Henry Cavendish FRS ( / ˈ k æ v ən d ɪ ʃ / KAV -ən-dish ; 10 de octubre de 1731 - 24 de febrero de 1810) fue un filósofo natural y científico inglés que fue un importante químico y físico experimental y teórico . Se destaca por su descubrimiento del hidrógeno , al que denominó "aire inflamable". [1] Describió la densidad del aire inflamable, que formaba agua durante la combustión, en un artículo de 1766, On Factitious Airs . Antoine Lavoisier reprodujo más tarde el experimento de Cavendish y le dio su nombre al elemento.
Hombre tímido, Cavendish se distinguió por su gran exactitud y precisión en sus investigaciones sobre la composición del aire atmosférico , las propiedades de los diferentes gases, la síntesis del agua, la ley que rige la atracción y repulsión eléctrica , una teoría mecánica del calor y cálculos de la densidad (y por tanto la masa ) de la Tierra . Su experimento para medir la densidad de la Tierra (que, a su vez, permite calcular la constante gravitacional ) ha pasado a conocerse como experimento de Cavendish .
Henry Cavendish nació el 10 de octubre de 1731 en Niza , donde vivía su familia en ese momento. [2] Su madre era Lady Anne de Grey, cuarta hija de Henry Grey, primer duque de Kent , y su padre era Lord Charles Cavendish , el tercer hijo de William Cavendish, segundo duque de Devonshire . [2] La familia remontó su linaje a lo largo de ocho siglos hasta la época normanda y estaba estrechamente relacionada con muchas familias aristocráticas de Gran Bretaña. La madre de Henry murió en 1733, tres meses después del nacimiento de su segundo hijo, Frederick, y poco antes del segundo cumpleaños de Henry, dejando a Lord Charles Cavendish a cargo de criar a sus dos hijos. Henry Cavendish fue llamado "El Honorable Henry Cavendish". [3]
Desde los 11 años Henry asistió a Newcome's School , una escuela privada cerca de Londres. A la edad de 18 años (el 24 de noviembre de 1748) ingresó en la Universidad de Cambridge en St Peter's College, ahora conocido como Peterhouse , pero abandonó tres años más tarde, el 23 de febrero de 1751, sin obtener un título (en ese momento, una práctica común). [4] [5] Luego vivió con su padre en Londres, donde pronto tuvo su propio laboratorio.
Lord Charles Cavendish pasó su vida primero en la política y luego cada vez más en la ciencia, especialmente en la Royal Society de Londres. En 1758, llevó a Henry a las reuniones de la Royal Society y también a cenas del Royal Society Club. En 1760, Henry Cavendish fue elegido para ambos grupos, y después de eso fue asiduo en su asistencia. [2] Prácticamente no participó en política, pero siguió a su padre en la ciencia, a través de sus investigaciones y su participación en organizaciones científicas. Participó activamente en el Consejo de la Royal Society de Londres (para el que fue elegido en 1765).
Su interés y experiencia en el uso de instrumentos científicos lo llevaron a encabezar un comité para revisar los instrumentos meteorológicos de la Royal Society y ayudar a evaluar los instrumentos del Observatorio Real de Greenwich . Su primer artículo, Factitious Airs , apareció en 1766. Otros comités en los que formó parte incluyeron el comité de artículos, que eligió los artículos para su publicación en Philosophical Transactions of the Royal Society , y los comités para el tránsito de Venus (1769). por la atracción gravitacional de las montañas (1774), y por las instrucciones científicas para la expedición de Constantine Phipps (1773) en busca del Polo Norte y el Paso del Noroeste . En 1773, Henry se unió a su padre como administrador electo del Museo Británico , al que dedicó mucho tiempo y esfuerzo. Poco después de que se estableciera la Institución Real de Gran Bretaña, Cavendish se convirtió en gerente (1800) y se interesó activamente, especialmente en el laboratorio, donde observó y ayudó en los experimentos químicos de Humphry Davy .
Aproximadamente en el momento de la muerte de su padre, Cavendish comenzó a trabajar estrechamente con Charles Blagden , asociación que ayudó a Blagden a entrar de lleno en la sociedad científica de Londres. A cambio, Blagden ayudó a mantener al mundo alejado de Cavendish. Cavendish no publicó ningún libro y publicó pocos artículos, pero logró mucho. Varias áreas de investigación, incluidas la mecánica , la óptica y el magnetismo , aparecen ampliamente en sus manuscritos, pero apenas aparecen en sus trabajos publicados. Cavendish es considerado uno de los llamados químicos neumáticos de los siglos XVIII y XIX, junto con, por ejemplo, Joseph Priestley , Joseph Black y Daniel Rutherford . Cavendish descubrió que un gas definido, peculiar y altamente inflamable, al que denominó "aire inflamable", se producía por la acción de ciertos ácidos sobre ciertos metales . Este gas era hidrógeno , que Cavendish supuso correctamente que estaba en una proporción dos a uno en el agua. [6]
Aunque otros, como Robert Boyle , habían preparado gas hidrógeno antes, a Cavendish se le suele atribuir el mérito de reconocer su naturaleza elemental. En 1777, Cavendish descubrió que el aire exhalado por los mamíferos se convierte en "aire fijo" ( dióxido de carbono ), no en "aire flogistizado" como predijo Joseph Priestley. [7] Además, al disolver álcalis en ácidos, Cavendish produjo dióxido de carbono, que recogió, junto con otros gases, en botellas invertidas sobre agua o mercurio . Luego midió su solubilidad en agua y su gravedad específica , y anotó su combustibilidad . Concluyó en su artículo de 1778 "Consideraciones generales sobre los ácidos" que el aire respirable constituye acidez. [7] Cavendish recibió la Medalla Copley de la Royal Society por este artículo. La química de los gases fue de creciente importancia en la segunda mitad del siglo XVIII y se volvió crucial para la reforma de la química del francés Antoine-Laurent Lavoisier , generalmente conocida como la revolución química .
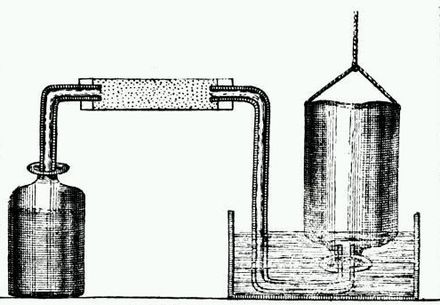
En 1783, Cavendish publicó un artículo sobre eudiometría (la medición de la bondad de los gases para respirar). Describió un nuevo eudiómetro de su invención, con el que logró los mejores resultados hasta la fecha, utilizando lo que en otras manos había sido el método inexacto de medir gases pesándolos. Luego, después de una repetición de un experimento realizado por Priestley en 1781, Cavendish publicó un artículo sobre la producción de agua pura quemando hidrógeno en " aire deflogistizado " (aire en proceso de combustión, ahora conocido como oxígeno ). [7] [8] [9] Cavendish concluyó que, en lugar de sintetizarse, la quema de hidrógeno provocaba que el agua se condensara del aire. Algunos físicos interpretaron el hidrógeno como flogisto puro . Cavendish informó de sus hallazgos a Priestley a más tardar en marzo de 1783, pero no los publicó hasta el año siguiente. El inventor escocés James Watt publicó un artículo sobre la composición del agua en 1783; Se produjo una controversia sobre quién hizo el descubrimiento primero. [7]
En 1785, Cavendish investigó la composición del aire común (es decir, atmosférico) , obteniendo resultados impresionantemente precisos. Realizó experimentos en los que se combinaron hidrógeno y aire ordinario en proporciones conocidas y luego explotaron con una chispa de electricidad. Además, también describió un experimento en el que pudo eliminar, en terminología moderna, los gases oxígeno y nitrógeno de una muestra de aire atmosférico hasta que sólo quedó una pequeña burbuja de gas sin reaccionar en la muestra original. Utilizando sus observaciones, Cavendish observó que, cuando había determinado las cantidades de aire flogistizado ( nitrógeno ) y aire desflogistizado (oxígeno), quedaba un volumen de gas que ascendía a 1/120 del volumen original de nitrógeno. [10] [11] Mediante mediciones cuidadosas llegó a la conclusión de que "el aire común consiste en una parte de aire desflogistizado [oxígeno], mezclado con cuatro de flogisticado [nitrógeno]". [12] [13]
En la década de 1890 (alrededor de 100 años después), dos físicos británicos, William Ramsay y Lord Rayleigh , se dieron cuenta de que su gas inerte recién descubierto , el argón , era responsable del problemático residuo de Cavendish; no había cometido ningún error. Lo que había hecho era realizar experimentos cuantitativos rigurosos, utilizando instrumentos y métodos estandarizados, destinados a resultados reproducibles; tomado la media del resultado de varios experimentos; e identificar y permitir fuentes de error. La balanza que utilizó, fabricada por un artesano llamado Harrison, fue la primera de las balanzas de precisión del siglo XVIII, y tan precisa como la de Lavoisier (que se ha estimado que mide una parte en 400.000). Cavendish trabajó con sus fabricantes de instrumentos, generalmente mejorando los instrumentos existentes en lugar de inventar otros completamente nuevos.
Cavendish, como se indicó anteriormente, utilizó el lenguaje de la antigua teoría del flogisto en química. En 1787, se convirtió en uno de los primeros fuera de Francia en convertirse a la nueva teoría antiflogística de Lavoisier, aunque se mantuvo escéptico sobre la nomenclatura de la nueva teoría. [ cita necesaria ] También se opuso a la identificación de Lavoisier del calor como si tuviera una base material o elemental. Trabajando dentro del marco del mecanismo newtoniano, Cavendish había abordado el problema de la naturaleza del calor en la década de 1760, explicando el calor como resultado del movimiento de la materia.
En 1783 publicó un artículo sobre la temperatura a la que se congela el mercurio y en ese artículo hizo uso de la idea de calor latente , aunque no utilizó el término porque creía que implicaba la aceptación de una teoría material del calor. Hizo explícitas sus objeciones en su artículo de 1784 sobre el aire. Continuó desarrollando una teoría general del calor, y el manuscrito de esa teoría ha sido fechado de manera convincente a finales de la década de 1780. Su teoría era a la vez matemática y mecánica: contenía el principio de conservación del calor (más tarde entendido como un ejemplo de conservación de la energía ) e incluso incluía el concepto (aunque no la etiqueta) del equivalente mecánico del calor .
Tras la muerte de su padre, Henry compró otra casa en la ciudad y también una casa en Clapham Common (construida por Thomas Cubitt ), en aquella época al suroeste de Londres. [14] La casa de Londres contenía la mayor parte de su biblioteca, mientras que guardaba la mayoría de sus instrumentos en Clapham Common, donde llevó a cabo la mayoría de sus experimentos. El más famoso de esos experimentos, publicado en 1798, tuvo como objetivo determinar la densidad de la Tierra y pasó a ser conocido como el experimento Cavendish . El aparato que utilizó Cavendish para pesar la Tierra fue una modificación de la balanza de torsión construida por el geólogo John Michell , quien murió antes de poder comenzar el experimento. El aparato fue enviado en cajas a Cavendish, quien completó el experimento en 1797-1798 [15] y publicó los resultados. [dieciséis]
El aparato experimental consistía en una balanza de torsión con un par de esferas de plomo de 2 pulgadas y 1,61 libras suspendidas del brazo de una balanza de torsión y dos bolas de plomo estacionarias mucho más grandes (350 libras). Cavendish pretendía medir la fuerza de atracción gravitacional entre los dos. [15] Se dio cuenta de que el aparato de Michell sería sensible a las diferencias de temperatura y a las corrientes de aire inducidas, por lo que hizo modificaciones aislando el aparato en una habitación separada con controles externos y telescopios para realizar observaciones. [17]
Con este equipo, Cavendish calculó la atracción entre las bolas a partir del período de oscilación de la balanza de torsión y luego utilizó este valor para calcular la densidad de la Tierra. Cavendish descubrió que la densidad media de la Tierra es 5,48 veces mayor que la del agua. John Henry Poynting señaló más tarde que los datos deberían haber conducido a un valor de 5,448, [18] y, de hecho, ese es el valor promedio de las veintinueve determinaciones que Cavendish incluyó en su artículo. [19] El error en el número publicado se debió a un simple error aritmético de su parte. [20] Lo extraordinario del experimento de Cavendish fue la eliminación de toda fuente de error y de todo factor que pudiera perturbar el experimento, y su precisión al medir una atracción sorprendentemente pequeña, apenas 1/50.000.000 del peso de las bolas de plomo. El resultado que obtuvo Cavendish para la densidad de la Tierra está dentro del 1 por ciento de la cifra actualmente aceptada.
El trabajo de Cavendish llevó a otros a obtener valores precisos para la constante gravitacional ( G ) y la masa de la Tierra. Con base en sus resultados, se puede calcular un valor para G de 6,754 × 10 −11 N-m 2 /kg 2 , [21] que se compara favorablemente con el valor moderno de 6,67428 × 10 −11 N-m 2 /kg 2 . [22]
Los libros suelen describir el trabajo de Cavendish como una medida de G o de la masa de la Tierra. Dado que estos están relacionados con la densidad de la Tierra mediante una red trivial de relaciones algebraicas, ninguna de estas fuentes está equivocada, pero no coinciden con la palabra exacta elegida por Cavendish, [23] [24] y este error ha sido señalado por varios autores. [25] [26] El objetivo declarado de Cavendish era medir la densidad de la Tierra.
La primera vez que la constante recibió este nombre fue en 1873, casi 100 años después del experimento de Cavendish. [27] Los resultados de Cavendish también dan la masa de la Tierra .
Los experimentos eléctricos y químicos de Cavendish, al igual que los relacionados con el calor, habían comenzado mientras vivía con su padre en un laboratorio de su casa en Londres. Lord Charles Cavendish murió en 1783, dejando casi todos sus importantes bienes a Henry. Al igual que su teoría del calor, la teoría integral de la electricidad de Cavendish tenía una forma matemática y se basaba en experimentos cuantitativos precisos. Trabajando con su colega, Timothy Lane , creó un pez torpedo artificial que podía administrar descargas eléctricas para demostrar que la fuente de descarga de estos peces era la electricidad. [28] Publicó una primera versión de su teoría de la electricidad en 1771, basada en un fluido eléctrico expansivo que ejercía presión. Demostró que si la intensidad de la fuerza eléctrica fuera inversamente proporcional a la distancia, entonces habría más fluido eléctrico del necesario para la neutralidad eléctrica en la superficie exterior de una esfera electrificada; luego lo confirmó experimentalmente. Cavendish continuó trabajando en electricidad después de este artículo inicial, pero no publicó más sobre el tema.
Cavendish escribió artículos sobre temas eléctricos para la Royal Society [29] [30] pero la mayor parte de sus experimentos eléctricos no se conoció hasta que fueron recopilados y publicados por James Clerk Maxwell un siglo después, en 1879, mucho después de que otros científicos hubieran se le atribuyen los mismos resultados. Los artículos sobre electricidad de Cavendish de Philosophical Transactions of the Royal Society of London se han reimpreso, junto con la mayoría de sus manuscritos sobre electricidad, en The Scientific Papers of the Honorable Henry Cavendish, FRS (1921). Según la edición de 1911 de la Encyclopædia Britannica , entre los descubrimientos de Cavendish se encuentran el concepto de potencial eléctrico (al que llamó "grado de electrificación"), una de las primeras unidades de capacitancia (la de una esfera de una pulgada de diámetro), la fórmula para la capacitancia de un capacitor de placas , [31] el concepto de constante dieléctrica de un material, la relación entre potencial eléctrico y corriente (ahora llamada ley de Ohm ) (1781), leyes para la división de corriente en circuitos paralelos (ahora atribuidas a Charles Wheatstone ), y la ley del cuadrado inverso de variación de la fuerza eléctrica con la distancia, ahora llamada ley de Coulomb . [32]
Cavendish murió en Clapham el 24 de febrero de 1810 [2] (como uno de los hombres más ricos de Gran Bretaña) y fue enterrado, junto con muchos de sus antepasados, en la iglesia que ahora es la Catedral de Derby . La carretera en la que solía vivir en Derby lleva su nombre, al igual que una carretera cerca de su casa en Clapham, cuya parte norte forma parte de South Circular Road . El Laboratorio Cavendish de la Universidad de Cambridge fue donado por uno de los parientes posteriores de Cavendish, William Cavendish, séptimo duque de Devonshire (canciller de la Universidad de 1861 a 1891).
Cavendish heredó dos fortunas tan grandes que Jean Baptiste Biot lo llamó "el más rico de todos los sabios y el más conocedor de los ricos". A su muerte, Cavendish era el mayor depositante del Banco de Inglaterra . Era un hombre tímido que se sentía incómodo en sociedad y la evitaba cuando podía. Sólo podía hablar con una persona a la vez, y sólo si la conocía y era hombre. [33] Conversaba poco, siempre vestía un traje anticuado y no desarrolló vínculos personales profundos conocidos fuera de su familia. Cavendish era taciturno y solitario y muchos lo consideraban excéntrico. Se comunicaba con sus sirvientas sólo mediante notas. Según un relato, Cavendish hizo agregar una escalera trasera a su casa para evitar encontrarse con su ama de llaves, porque era especialmente tímido con las mujeres. Los relatos contemporáneos sobre su personalidad han llevado a algunos comentaristas modernos, como Oliver Sacks , a especular que era autista . [34]
Su única salida social era el Royal Society Club, cuyos miembros cenaban juntos antes de las reuniones semanales. Cavendish rara vez faltaba a estas reuniones y sus contemporáneos lo respetaban profundamente. Sin embargo, su timidez dificultaba la conversación; Se recomendó a los invitados que se acercaran a él y luego hablaran como si estuvieran "en el vacío. Si sus comentarios fueran científicamente valiosos, podrían recibir una respuesta entre dientes". Lo más probable era que Cavendish no respondiera en absoluto. [15] Las opiniones religiosas de Cavendish también se consideraban excéntricas para su época. Se le consideraba agnóstico . Como comenta su biógrafo, George Wilson: "En cuanto a la religión de Cavendish, él no era nada en absoluto". [35] [36]
La disposición de su residencia reservaba sólo una fracción del espacio para la comodidad personal, ya que su biblioteca estaba separada, las habitaciones superiores y el césped eran para la observación astronómica y su salón era un laboratorio con una fragua en una habitación contigua. [37] También disfrutaba coleccionando muebles finos, ejemplificado por la compra de un juego de "diez sillas de madera satinada con incrustaciones y un sofá con patas cabriolé a juego ". [38]
Debido a su comportamiento asocial y reservado, Cavendish a menudo evitaba publicar su trabajo, y muchos de sus hallazgos ni siquiera fueron comunicados a sus colegas científicos. A finales del siglo XIX, mucho después de su muerte, James Clerk Maxwell examinó los artículos de Cavendish y encontró observaciones y resultados por los que otros habían recibido crédito. Ejemplos de lo que se incluyó en los descubrimientos o anticipaciones de Cavendish fueron la ley de proporciones recíprocas de Richter , la ley de Ohm , la ley de presiones parciales de Dalton , los principios de conductividad eléctrica (incluida la ley de Coulomb ) y la ley de los gases de Charles . Un manuscrito "Heat", fechado provisionalmente entre 1783 y 1790, describe una "teoría mecánica del calor". Hasta ahora desconocido, el manuscrito fue analizado a principios del siglo XXI. El historiador de la ciencia Russell McCormmach propuso que "Calor" es la única obra del siglo XVIII que prefigura la termodinámica . El físico teórico Dietrich Belitz concluyó que en este trabajo Cavendish "entendió esencialmente la naturaleza del calor". [39]
Mientras Cavendish realizaba su famoso experimento de densidad de la Tierra en una dependencia del jardín de su propiedad en Clapham Common, sus vecinos señalaban el edificio y decían a sus hijos que era allí donde se pesaba el mundo. [38] En honor a los logros de Henry Cavendish y debido a una donación otorgada por el pariente de Henry, William Cavendish, séptimo duque de Devonshire, el laboratorio de física de la Universidad de Cambridge fue nombrado Laboratorio Cavendish por Maxwell, el primer profesor Cavendish de Física y un admirador de la obra de Cavendish.
La cifra que da para la gravedad específica de la Tierra es 5,48, siendo el agua 1, pero en realidad la media de los 29 resultados que registra es 5,448.
No asistía a la iglesia y era considerado agnóstico. "En cuanto a la religión, Cavendish no era nada en absoluto", escribe su biógrafo, el Dr. G. Wilson.
Un miembro de la Royal Society, que tenía buenos medios para juzgar, afirma que: "En cuanto a la religión de Cavendish, no era nada en absoluto. Los únicos temas en los que parecía interesarse eran los científicos...". ... De lo que se ha dicho, parecerá que sería vano afirmar que sabemos con certeza qué doctrina sostenía Cavendish sobre las cosas espirituales; pero podemos afirmar con cierta confianza que el mundo venidero no absorbió sus pensamientos; que no dio ninguna demostración externa de interés en la religión y no se unió a sus semejantes en la adoración a Dios. ...Murió y no dio ninguna señal, rechazando la simpatía humana y sin dejarnos medios para determinar si anticipaba la aniquilación o esperaba una vida sin fin. ...Él no amaba; él no odiaba; no tenía esperanzas; no tuvo miedo; no adoraba como lo hacen los demás. Se separó de sus semejantes y aparentemente de Dios.