La fibrosis quística ( FQ ) es un trastorno genético que se hereda de forma autosómica recesiva y que altera la eliminación normal de la mucosidad de los pulmones , lo que facilita la colonización e infección de los pulmones por bacterias, en particular Staphylococcus aureus . [6] La FQ es un trastorno genético poco común [7] [8] que afecta principalmente a los pulmones, pero también al páncreas , el hígado , los riñones y el intestino . [1] [9] La característica distintiva de la FQ es la acumulación de moco espeso en diferentes órganos. Los problemas a largo plazo incluyen dificultad para respirar y toser moco como resultado de infecciones pulmonares frecuentes . [1] Otros signos y síntomas pueden incluir infecciones de los senos nasales , crecimiento deficiente , heces grasas , dedos en palillo de tambor y de los pies e infertilidad en la mayoría de los hombres. [1] Diferentes personas pueden tener diferentes grados de síntomas. [1]
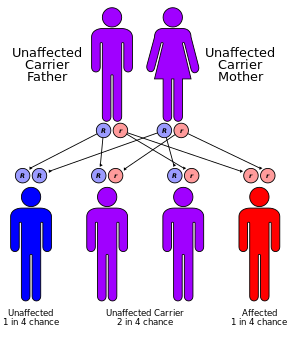
La fibrosis quística se hereda de forma autosómica recesiva . [1] Es causada por la presencia de mutaciones en ambas copias (alelos) del gen que codifica la proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR). [1] Aquellos con una sola copia funcional son portadores y, por lo demás, en su mayoría sanos. [3] El CFTR está involucrado en la producción de sudor, fluidos digestivos y moco. [10] Cuando el CFTR no es funcional, las secreciones que normalmente son líquidas se vuelven espesas. [11] La afección se diagnostica mediante una prueba de sudor y pruebas genéticas . [1] La prueba de sudor mide la concentración de sodio, ya que las personas con fibrosis quística tienen un sudor anormalmente salado, que a menudo puede ser percibido por los padres que besan a sus hijos. En algunas áreas del mundo se realizan pruebas de detección de bebés al nacer. [1]
No existe cura conocida para la fibrosis quística. [3] Las infecciones pulmonares se tratan con antibióticos que pueden administrarse por vía intravenosa, inhalados o por vía oral. [1] A veces, el antibiótico azitromicina se usa a largo plazo. [1] La solución salina hipertónica inhalada y el salbutamol también pueden ser útiles. [1] El trasplante de pulmón puede ser una opción si la función pulmonar continúa empeorando. [1] La reposición de enzimas pancreáticas y la suplementación con vitaminas liposolubles son importantes, especialmente en los jóvenes. [1] Las técnicas de depuración de las vías respiratorias, como la fisioterapia torácica, pueden tener algún beneficio a corto plazo, pero los efectos a largo plazo no están claros. [12] La esperanza de vida promedio es de entre 42 y 50 años en el mundo desarrollado , [5] [13] con una mediana de 40,7 años. [14] Los problemas pulmonares son responsables de la muerte en el 70% de las personas con fibrosis quística. [1]
La fibrosis quística es más común entre las personas de ascendencia del norte de Europa , en quienes afecta a aproximadamente 1 de cada 3000 recién nacidos [1] , y entre los cuales alrededor de 1 de cada 25 personas es portadora [3] . Es menos común en africanos y asiáticos, aunque se presenta en todas las razas [1 ] . Dorothy Andersen la reconoció por primera vez como una enfermedad específica en 1938, con descripciones que se ajustan a la condición que se dan al menos desde 1595 [9] . El nombre "fibrosis quística" se refiere a la fibrosis característica y los quistes que se forman dentro del páncreas [9] [15]

La fibrosis quística se manifiesta típicamente en etapas tempranas de la vida. Los recién nacidos y los bebés con fibrosis quística tienden a tener heces frecuentes, grandes y grasosas (como resultado de la malabsorción ) y tienen bajo peso para su edad . [16] : Manifestaciones clínicas Entre el 15 y el 20 % de los recién nacidos tienen el intestino delgado bloqueado por meconio , lo que a menudo requiere cirugía para corregirlo. [16] : Manifestaciones clínicas Los recién nacidos ocasionalmente tienen ictericia neonatal debido al bloqueo de los conductos biliares . [16] : Manifestaciones clínicas Los niños con fibrosis quística pierden sal en exceso en el sudor y los padres a menudo notan que la sal se cristaliza en la piel o un sabor salado cuando besan a su hijo. [16] : Manifestaciones clínicas
La principal causa de morbilidad y muerte en personas con fibrosis quística es la enfermedad pulmonar progresiva, que eventualmente conduce a insuficiencia respiratoria . [16] : Tracto respiratorio Esto generalmente comienza como una infección respiratoria prolongada que continúa hasta que se trata con antibióticos . [16] : Tracto respiratorio La infección crónica del tracto respiratorio es casi universal en personas con fibrosis quística, con Pseudomonas aeruginosa , hongos y micobacterias cada vez más comunes con el tiempo. [17] La inflamación de las vías respiratorias superiores produce secreción nasal frecuente y obstrucción nasal . Los pólipos nasales son comunes, particularmente en niños y adolescentes. [16] : Tracto respiratorio A medida que la enfermedad progresa, las personas tienden a tener dificultad para respirar y tos crónica que produce esputo . [16] : Tracto biliar Los problemas respiratorios hacen que sea cada vez más difícil hacer ejercicio, y la enfermedad prolongada hace que los afectados tengan bajo peso para su edad. [16] : Tracto biliar A finales de la adolescencia o en la edad adulta, las personas comienzan a desarrollar signos graves de enfermedad pulmonar: sibilancia, hipocratismo digital , cianosis , tos con sangre , cardiopatía pulmonar y colapso pulmonar ( atelectasia o neumotórax ). [16] : Tracto respiratorio
En casos raros, la fibrosis quística puede manifestarse como un trastorno de la coagulación . La vitamina K normalmente se absorbe de la leche materna , la fórmula y, más tarde, los alimentos sólidos. Esta absorción se ve afectada en algunos pacientes con fibrosis quística. Los niños pequeños son especialmente sensibles a los trastornos de malabsorción de la vitamina K porque solo una cantidad muy pequeña de vitamina K atraviesa la placenta, lo que deja al niño con reservas muy bajas y una capacidad limitada para absorber la vitamina K de las fuentes dietéticas después del nacimiento. Debido a que los factores de coagulación II, VII, IX y X dependen de la vitamina K, los niveles bajos de vitamina K pueden provocar problemas de coagulación. En consecuencia, cuando un niño presenta hematomas inexplicables, puede estar justificada una evaluación de la coagulación para determinar si existe una enfermedad subyacente. [18]

La enfermedad pulmonar resulta de la obstrucción de las vías respiratorias debido a la acumulación de moco, disminución del aclaramiento mucociliar y la inflamación resultante . [19] [20] En etapas posteriores, los cambios en la arquitectura del pulmón, como la patología en las vías respiratorias principales ( bronquiectasias ), exacerban aún más las dificultades para respirar. Otros signos incluyen presión arterial alta en el pulmón ( hipertensión pulmonar ), insuficiencia cardíaca , dificultades para obtener suficiente oxígeno para el cuerpo ( hipoxia ) e insuficiencia respiratoria que requiere apoyo con máscaras respiratorias, como máquinas de presión positiva de dos niveles en las vías respiratorias o ventiladores . [21] Staphylococcus aureus , Haemophilus influenzae y Pseudomonas aeruginosa son los tres organismos más comunes que causan infecciones pulmonares en pacientes con fibrosis quística. [20] : 1254 Además, puede ocurrir una infección oportunista debido al complejo Burkholderia cepacia , especialmente a través de la transmisión de un paciente a otro. [22]
Además de las infecciones bacterianas típicas, las personas con fibrosis quística desarrollan con mayor frecuencia otros tipos de enfermedades pulmonares. Entre ellas se encuentra la aspergilosis broncopulmonar alérgica , en la que la respuesta del organismo al hongo común Aspergillus fumigatus provoca un empeoramiento de los problemas respiratorios. Otra es la infección por el complejo Mycobacterium avium , un grupo de bacterias relacionadas con la tuberculosis , que puede causar daño pulmonar y no responde a los antibióticos comunes. [23]
La mucosidad en los senos paranasales es igualmente espesa y también puede causar obstrucción de los conductos nasales, lo que lleva a una infección. Esto puede causar dolor facial, fiebre, secreción nasal y dolores de cabeza . Las personas con fibrosis quística pueden desarrollar un crecimiento excesivo del tejido nasal ( pólipos nasales ) debido a la inflamación causada por infecciones crónicas de los senos nasales. [24] Los pólipos sinonasales recurrentes pueden ocurrir en el 10% al 25% de los pacientes con fibrosis quística. [20] : 1254 Estos pólipos pueden bloquear los conductos nasales y aumentar las dificultades respiratorias. [25] [26]
Las complicaciones cardiorrespiratorias son las causas más comunes de muerte (alrededor del 80%) en pacientes en la mayoría de los centros de fibrosis quística en los Estados Unidos. [20] : 1254
Los problemas digestivos también son frecuentes en las personas con fibrosis quística. Aproximadamente entre el 15% y el 20% de los recién nacidos diagnosticados con fibrosis quística sufren obstrucción intestinal ( íleo meconial ) y pueden surgir otros problemas digestivos debido a la acumulación de moco en el páncreas. [27] En consecuencia, se altera la producción de insulina, lo que conduce a la diabetes mellitus relacionada con la fibrosis quística. Además, la alteración del transporte de enzimas desde el páncreas hasta los intestinos da lugar a problemas digestivos como diarrea recurrente o pérdida de peso. [28]
En la fibrosis quística, la secreción de cloruro se ve alterada por la mutación del CFTR. Esto altera el equilibrio iónico, provoca una secreción deficiente de bicarbonato y altera el pH. Las enzimas pancreáticas que funcionan en un rango de pH específico no pueden actuar porque el quimo no es neutralizado por los iones de bicarbonato. Esto provoca un deterioro del proceso de digestión. [29]
La mucosidad espesa que se observa en los pulmones tiene una contraparte en las secreciones espesas del páncreas , un órgano responsable de proporcionar jugos digestivos que ayudan a descomponer los alimentos. Estas secreciones bloquean el movimiento exocrino de las enzimas digestivas hacia el duodeno y dan como resultado un daño irreversible al páncreas, a menudo con una inflamación dolorosa ( pancreatitis ). [30] Los conductos pancreáticos están totalmente obstruidos en los casos más avanzados, que generalmente se observan en niños mayores o adolescentes. [20] Esto causa atrofia de las glándulas exocrinas y fibrosis progresiva. [20]
Además, la protrusión de las membranas rectales internas ( prolapso rectal ) es más común y ocurre en hasta el 10 % de los niños con fibrosis quística, [20] y es causada por un aumento del volumen fecal, desnutrición y aumento de la presión intraabdominal debido a la tos. [31]
Las personas con fibrosis quística también tienen dificultades para absorber las vitaminas liposolubles A , D , E y K. [ 32]
Además de los problemas del páncreas, las personas con fibrosis quística experimentan más acidez estomacal , [32] bloqueo intestinal por intususcepción y estreñimiento . [33] Las personas mayores con fibrosis quística pueden desarrollar el síndrome de obstrucción intestinal distal , que ocurre cuando las heces se vuelven espesas con moco ( espesadas ) y pueden causar hinchazón, dolor y obstrucción intestinal incompleta o completa. [34] [32]
La insuficiencia pancreática exocrina ocurre en la mayoría (85-90%) de los pacientes con fibrosis quística. [20] : 1253 Se asocia principalmente con mutaciones "graves" de CFTR, donde ambos alelos son completamente no funcionales (p. ej. , ΔF508 /ΔF508). [20] : 1253 Ocurre en el 10-15% de los pacientes con una mutación "grave" y una "leve" de CFTR donde todavía ocurre poca actividad de CFTR, o donde existen dos mutaciones "leves" de CFTR. [20] : 1253 En estos casos más leves, todavía está presente una función exocrina pancreática suficiente, por lo que no se requiere suplementación enzimática. [20] : 1253 Por lo general, no ocurren otras complicaciones gastrointestinales en fenotipos con páncreas suficiente y, en general, estos individuos suelen tener un crecimiento y desarrollo excelentes. [20] : 1254 A pesar de esto, la pancreatitis crónica idiopática puede ocurrir en un subconjunto de individuos con fibrosis quística con páncreas suficiente, y está asociada con dolor abdominal recurrente y complicaciones potencialmente mortales. [20]
Las enfermedades hepáticas son otra complicación común en los pacientes con fibrosis quística. La prevalencia observada en los estudios varió del 18 % a los dos años de edad al 41 % a los 12 años, sin un aumento significativo a partir de entonces. [35] Otro estudio encontró que los varones con fibrosis quística son más propensos a las enfermedades hepáticas en comparación con las mujeres, y aquellos con íleo meconial tienen un mayor riesgo de enfermedades hepáticas. [36]
Las secreciones espesas también pueden causar problemas hepáticos en pacientes con fibrosis quística. La bilis secretada por el hígado para ayudar en la digestión puede bloquear los conductos biliares , lo que provoca daño hepático. La digestión o absorción deficiente de lípidos puede provocar esteatorrea . Con el tiempo, esto puede provocar cicatrización y nodularidad ( cirrosis ). El hígado no puede eliminar las toxinas de la sangre y no produce proteínas importantes, como las responsables de la coagulación sanguínea . [37] [38] La enfermedad hepática es la tercera causa más común de muerte asociada con la fibrosis quística. [20]
Entre el 5 y el 7 % de las personas sufren daño hepático lo suficientemente grave como para causar síntomas: típicamente cálculos biliares que causan cólico biliar . [16] : Tracto biliar
El páncreas contiene los islotes de Langerhans , que son responsables de producir insulina , una hormona que ayuda a regular la glucosa en sangre . El daño al páncreas puede provocar la pérdida de las células de los islotes, lo que lleva a un tipo de diabetes exclusivo de quienes padecen la enfermedad. [39] Esta diabetes relacionada con la fibrosis quística comparte características de la diabetes tipo 1 y tipo 2 , y es una de las principales complicaciones no pulmonares de la fibrosis quística. [40]
La vitamina D interviene en la regulación del calcio y el fosfato . La absorción deficiente de vitamina D a través de la dieta debido a una mala absorción puede provocar osteoporosis, una enfermedad ósea en la que los huesos debilitados son más susceptibles a las fracturas . [41]
La infertilidad afecta tanto a hombres como a mujeres. Al menos el 97% de los hombres con fibrosis quística son infértiles, pero no estériles, y pueden tener hijos con técnicas de reproducción asistida. [42] La principal causa de infertilidad en hombres con fibrosis quística es la ausencia congénita de los conductos deferentes (que normalmente conectan los testículos con los conductos eyaculadores del pene ), pero potencialmente también por otros mecanismos que causan falta de espermatozoides , espermatozoides de forma anormal y pocos espermatozoides con poca motilidad . [43] Muchos hombres a los que se les descubre una ausencia congénita de los conductos deferentes durante una evaluación de infertilidad tienen una forma leve, no diagnosticada previamente, de fibrosis quística . [44] Si bien las mujeres con fibrosis quística son generalmente fértiles, alrededor del 20% de las mujeres con fibrosis quística tienen dificultades de fertilidad debido al moco cervical espeso o la desnutrición. En casos graves, la desnutrición altera la ovulación y provoca la falta de menstruación . [45]
La fibrosis quística es causada por no tener copias funcionales (alelos) del gen regulador de la conductancia transmembrana de la fibrosis quística ( CFTR ). Hasta 2018, se han descrito más de 1.900 mutaciones que conducen a la fibrosis quística, pero solo 5 de ellas tienen una frecuencia mayor al 1% entre los pacientes. El alelo mutante más común, ΔF508 (también denominado F508del), es una deleción ( Δ significa deleción) de tres nucleótidos que resulta en una pérdida del residuo de aminoácido fenilalanina (F) en la posición 508 de la proteína. [46] [47] Este alelo mutante ya está presente en 1 de cada 20 a 25 personas de ascendencia del norte de Europa; representa el 70% de los casos de fibrosis quística en todo el mundo y el 90% de los casos en los Estados Unidos ; sin embargo, más de otros 700 alelos mutantes, algunos de los cuales representan nuevas mutaciones, pueden producir fibrosis quística. [48] Aunque la mayoría de las personas tienen dos copias funcionales (alelos) del gen CFTR , solo se necesita uno para prevenir la fibrosis quística. La fibrosis quística se desarrolla cuando ningún alelo puede producir una proteína CFTR funcional. Por lo tanto, la fibrosis quística se considera una enfermedad autosómica recesiva . [49]
El gen CFTR , que se encuentra en el locus q31.2 del cromosoma 7 , tiene una longitud de 230.000 pares de bases y codifica una proteína de 1.480 aminoácidos . Más específicamente, la ubicación está entre el par de bases 117.120.016 y 117.308.718 en el brazo largo del cromosoma 7, región 3, banda 1, subbanda 2, representada como 7q31.2. Estructuralmente, el CFTR es un tipo de gen conocido como gen ABC . El producto de este gen (la proteína CFTR) es un canal de iones de cloruro importante en la creación de sudor, jugos digestivos y moco. Esta proteína posee dos dominios hidrolizadores de ATP , lo que permite que la proteína utilice energía en forma de ATP . También contiene dos dominios que comprenden seis hélices alfa cada uno, que permiten que la proteína cruce la membrana celular. Un sitio de unión regulador en la proteína permite la activación por fosforilación , principalmente por la proteína quinasa dependiente de AMPc . [21] La terminal carboxilo de la proteína está anclada al citoesqueleto por una interacción del dominio PDZ . [50] La mayoría de CFTR en los conductos pulmonares es producida por células raras transportadoras de iones que regulan las propiedades del moco. [51]
Además, cada vez hay más pruebas de que otros modificadores genéticos, además del CFTR, modulan la frecuencia y la gravedad de la enfermedad. Un ejemplo es la lectina de unión a manano , que participa en la inmunidad innata al facilitar la fagocitosis de microorganismos. Los polimorfismos en uno o ambos alelos de la lectina de unión a manano que dan lugar a niveles circulantes más bajos de la proteína se asocian con un riesgo tres veces mayor de enfermedad pulmonar terminal, así como con una mayor carga de infecciones bacterianas crónicas. [20]
Hasta uno de cada 25 individuos de ascendencia del norte de Europa se considera portador genético . [52] La enfermedad aparece solo cuando dos de estos portadores tienen hijos, ya que cada embarazo entre ellos tiene una probabilidad del 25% de producir un niño con la enfermedad. Aunque solo alrededor de uno de cada 3.000 recién nacidos de la ascendencia afectada tiene fibrosis quística, desde el descubrimiento del gen CFTR en 1989, se han identificado más de 2.000 variantes, pero solo alrededor de 700 de ellas han sido reconocidas como responsables de causar fibrosis quística. [53] Las pruebas actuales buscan las mutaciones más comunes. [52]
Los alelos mutantes que se detectan mediante la prueba varían según el grupo étnico de la persona o la presencia de fibrosis quística en la familia. Más de 10 millones de estadounidenses, incluido uno de cada 25 estadounidenses blancos, son portadores de un alelo mutante del gen de la fibrosis quística. La fibrosis quística está presente en otras razas , aunque no con tanta frecuencia como en los individuos blancos. Aproximadamente uno de cada 46 estadounidenses hispanos, uno de cada 65 estadounidenses afroamericanos y uno de cada 90 estadounidenses asiáticos son portadores de una mutación del gen de la fibrosis quística. [52]

El gen CFTR regula el transporte de sales y agua a través de las membranas celulares, proporcionando instrucciones para crear una vía que permita el paso de iones de cloruro. [54] Una mutación en el gen CFTR puede perjudicar la función normal de los canales de cloruro, lo que lleva a un transporte anormal de iones de cloruro y agua, lo que resulta en la formación de moco espeso y anormal. [55]
En el conducto pancreático, el transporte de cloruro se produce a través de canales de cloruro dependientes del voltaje, que están influenciados por el CFTR (regulador de la conductancia transmembrana de la fibrosis quística). Estos canales están localizados en la membrana apical de la célula epitelial del conducto pancreático. [56]
Pueden producirse varias mutaciones en el gen CFTR , y diferentes mutaciones causan diferentes defectos en la proteína CFTR, a veces causando una enfermedad más leve o más grave. Estos defectos proteicos también son objetivos de medicamentos que a veces pueden restaurar su función. La mutación del gen ΔF508-CFTR , que se produce en más del 90 % de los pacientes en los EE. UU., crea una proteína que no se pliega normalmente y no se transporta adecuadamente a la membrana celular, lo que resulta en su degradación. [57]
Otras mutaciones dan lugar a proteínas demasiado cortas (truncadas) porque la producción finaliza prematuramente. Otras mutaciones producen proteínas que no utilizan energía (en forma de ATP) normalmente, no permiten que el cloruro, el yoduro y el tiocianato atraviesen la membrana de forma adecuada [58] y se degradan a un ritmo más rápido de lo normal. Las mutaciones también pueden provocar que se produzcan menos copias de la proteína CFTR [21] .
La proteína creada por este gen está anclada a la membrana externa de las células de las glándulas sudoríparas , pulmones, páncreas y todas las demás glándulas exocrinas restantes del cuerpo. La proteína atraviesa esta membrana y actúa como un canal que conecta la parte interna de la célula ( citoplasma ) con el fluido circundante . Este canal es el principal responsable de controlar el movimiento de aniones haluro desde el interior hacia el exterior de la célula; sin embargo, en los conductos sudoríparos, facilita el movimiento del cloruro desde el conducto sudoríparo hacia el citoplasma. Cuando la proteína CFTR no reabsorbe iones en los conductos sudoríparos, el cloruro y el tiocianato [59] liberados por las glándulas sudoríparas quedan atrapados dentro de los conductos y bombeados a la piel.
Además, el hipotiocianito , OSCN, no puede ser producido por el sistema de defensa inmune. [60] [61] Debido a que el cloruro está cargado negativamente , esto modifica el potencial eléctrico dentro y fuera de la célula que normalmente hace que los cationes crucen hacia la célula. El sodio es el catión más común en el espacio extracelular. El exceso de cloruro dentro de los conductos sudoríparos impide la reabsorción de sodio por los canales de sodio epiteliales y la combinación de sodio y cloruro crea la sal, que se pierde en grandes cantidades en el sudor de las personas con fibrosis quística. Esta sal perdida forma la base de la prueba del sudor. [21]
La mayor parte del daño en la fibrosis quística se debe al bloqueo de los conductos estrechos de los órganos afectados con secreciones espesas. Estos bloqueos conducen a la remodelación e infección en el pulmón, daño por enzimas digestivas acumuladas en el páncreas, bloqueo de los intestinos por heces espesas, etc. Se han postulado varias teorías sobre cómo los defectos en la proteína y la función celular causan los efectos clínicos. La teoría más actual sugiere que el transporte iónico defectuoso conduce a la deshidratación en los epitelios de las vías respiratorias, espesando la mucosidad. [62] En las células epiteliales de las vías respiratorias, los cilios existen entre la superficie apical de la célula y la mucosidad en una capa conocida como líquido de la superficie de las vías respiratorias (ASL). El flujo de iones desde la célula hacia esta capa está determinado por canales iónicos como el CFTR. El CFTR no solo permite que los iones de cloruro sean extraídos de la célula hacia el ASL, sino que también regula otro canal llamado ENac, que permite que los iones de sodio salgan del ASL y entren en el epitelio respiratorio. El CFTR normalmente inhibe este canal, pero si el CFTR es defectuoso, entonces el sodio fluye libremente desde el ASL hacia la célula. [ cita requerida ]
A medida que el agua sigue al sodio, la profundidad de la capa de ASL se agotará y los cilios quedarán en la capa mucosa. [63] Como los cilios no pueden moverse eficazmente en un entorno espeso y viscoso, la depuración mucociliar es deficiente y se produce una acumulación de moco, que obstruye las vías respiratorias pequeñas. [64] La acumulación de moco más viscoso y rico en nutrientes en los pulmones permite que las bacterias se escondan del sistema inmunológico del cuerpo, lo que provoca infecciones respiratorias repetidas. La presencia de las mismas proteínas CFTR en el conducto pancreático y las glándulas sudoríparas de la piel también causa síntomas en estos sistemas. [ cita requerida ]
Los pulmones de las personas con fibrosis quística son colonizados e infectados por bacterias desde una edad temprana. Estas bacterias, que a menudo se propagan entre las personas con fibrosis quística, prosperan en el moco alterado, que se acumula en las vías respiratorias pequeñas de los pulmones. Este moco conduce a la formación de microambientes bacterianos conocidos como biopelículas que son difíciles de penetrar para las células inmunes y los antibióticos. Las secreciones viscosas y las infecciones respiratorias persistentes dañan repetidamente el pulmón al remodelar gradualmente las vías respiratorias, lo que hace que la infección sea aún más difícil de erradicar. [65] La historia natural de las infecciones pulmonares y la remodelación de las vías respiratorias en la fibrosis quística es poco conocida, en gran parte debido a la inmensa heterogeneidad espacial y temporal tanto dentro como entre los microbiomas de los pacientes con fibrosis quística. [66]
Con el tiempo, tanto los tipos de bacterias como sus características individuales cambian en los individuos con FQ. En la etapa inicial, bacterias comunes como S. aureus y H. influenzae colonizan e infectan los pulmones. [20] Finalmente, domina Pseudomonas aeruginosa (y a veces Burkholderia cepacia ). A los 18 años de edad, el 80% de los pacientes con FQ clásica albergan P. aeruginosa y el 3,5% albergan B. cepacia . [20] Una vez dentro de los pulmones, estas bacterias se adaptan al medio ambiente y desarrollan resistencia a los antibióticos de uso común. Las Pseudomonas pueden desarrollar características especiales que permiten la formación de grandes colonias, conocidas como Pseudomonas "mucoides" , que rara vez se ven en personas que no tienen FQ. [65] La evidencia científica sugiere que la vía de la interleucina 17 juega un papel clave en la resistencia y modulación de la respuesta inflamatoria durante la infección por P. aeruginosa en la FQ. [67] En particular, la inmunidad mediada por interleucina 17 desempeña una actividad de doble filo durante la infección crónica de las vías respiratorias: por un lado, contribuye al control de la carga de P. aeruginosa , mientras que por el otro, propaga la neutrofilia pulmonar exacerbada y la remodelación tisular. [67]
La infección puede propagarse al pasar de una persona a otra con fibrosis quística. [68] En el pasado, las personas con fibrosis quística participaban a menudo en "campamentos de fibrosis quística" de verano y otras reuniones recreativas. [69] [70] Los hospitales agrupaban a los pacientes con fibrosis quística en áreas comunes y el equipo de rutina (como los nebulizadores ) [71] no se esterilizaba entre pacientes individuales. [72] Esto condujo a la transmisión de cepas de bacterias más peligrosas entre grupos de pacientes. Como resultado, ahora las personas con fibrosis quística se aíslan rutinariamente entre sí en el ámbito sanitario, y se anima a los proveedores de atención médica a usar batas y guantes cuando examinan a los pacientes con fibrosis quística para limitar la propagación de cepas bacterianas virulentas. [73]
Los pacientes con fibrosis quística también pueden tener sus vías respiratorias colonizadas crónicamente por hongos filamentosos (como Aspergillus fumigatus , Scedosporium apiospermum , Aspergillus terreus ) y/o levaduras (como Candida albicans ); otros hongos filamentosos menos comúnmente aislados incluyen Aspergillus flavus y Aspergillus nidulans (aparecen transitoriamente en las secreciones respiratorias de la fibrosis quística) y Exophiala dermatitidis y Scedosporium prolificans (colonizadores crónicos de las vías respiratorias); algunos hongos filamentosos como Penicillium emersonii y Acrophialophora fusispora se encuentran en pacientes casi exclusivamente en el contexto de la fibrosis quística . [74] El aclaramiento mucociliar defectuoso que caracteriza a la fibrosis quística se asocia con trastornos inmunológicos locales. Además, la terapia prolongada con antibióticos y el uso de tratamientos con corticosteroides también pueden facilitar el crecimiento de hongos. Aunque la relevancia clínica de la colonización fúngica de las vías respiratorias todavía es un tema de debate, los hongos filamentosos pueden contribuir a la respuesta inflamatoria local y, por lo tanto, al deterioro progresivo de la función pulmonar, como sucede a menudo con la aspergilosis broncopulmonar alérgica , la enfermedad fúngica más común en el contexto de la fibrosis quística, que implica una respuesta inmune impulsada por Th2 a las especies de Aspergillus . [74] [75]

El diagnóstico de fibrosis quística se basa inicialmente en hallazgos clínicos indicativos de enfermedades respiratorias, diversos problemas digestivos, íleo meconial y más. El diagnóstico definitivo puede implicar pruebas genéticas basadas en los antecedentes familiares o pruebas de concentración de cloruro en el sudor, que es relativamente alta (>60 mEq/L) en personas con fibrosis quística.
En muchas localidades, todos los recién nacidos son examinados para fibrosis quística dentro de los primeros días de vida, típicamente mediante un análisis de sangre para niveles altos de tripsinógeno inmunorreactivo . [76] Los recién nacidos con pruebas positivas o aquellos que son sospechosos de tener fibrosis quística según los síntomas o antecedentes familiares, luego se someten a una prueba de sudor . Se utiliza una corriente eléctrica para introducir pilocarpina en la piel, estimulando la sudoración. El sudor se recoge y se analiza para determinar los niveles de sal. Tener niveles inusualmente altos de cloruro en el sudor sugiere que CFTR es disfuncional; entonces se diagnostica a la persona con fibrosis quística. [16] : Diagnóstico y evaluación [nota 1] También hay pruebas genéticas disponibles para identificar las mutaciones de CFTR típicamente asociadas con la fibrosis quística. Muchos laboratorios pueden realizar pruebas para las 30 a 96 mutaciones de CFTR más comunes, que pueden identificar a más del 90% de las personas con fibrosis quística. [16] : Diagnóstico y evaluación
Las personas con fibrosis quística tienen menos tiocianato e hipotiocianato en la saliva [78] y en la mucosidad (Banfi et al.). En el caso de las formas más leves de fibrosis quística, las mediciones de la diferencia de potencial transepitelial pueden ser útiles. La fibrosis quística también se puede diagnosticar mediante la identificación de mutaciones en el gen CFTR. [79]
En muchos casos, el diagnóstico lo realiza un padre porque el sabor del bebé es salado. [20] Los niveles de tripsinógeno inmunorreactivo pueden aumentar en individuos que tienen una sola copia mutada del gen CFTR (portadores) o, en casos raros, en individuos con dos copias normales del gen CFTR . Debido a estos falsos positivos , la detección de fibrosis quística en recién nacidos puede ser controvertida. [80] [81]
En 2010, todos los estados de EE. UU. habían instituido programas de detección de recién nacidos [82] y en 2016, [update]21 países europeos tenían programas en al menos algunas regiones. [83]
Las mujeres embarazadas o las parejas que planean quedarse embarazadas pueden hacerse la prueba de detección de mutaciones del gen CFTR para determinar el riesgo de que su hijo nazca con fibrosis quística. La prueba se realiza generalmente primero en uno o ambos padres y, si el riesgo de fibrosis quística es alto, se realiza la prueba en el feto. El Colegio Estadounidense de Obstetras y Ginecólogos recomienda que todas las personas que estén pensando en quedarse embarazadas se hagan la prueba para ver si son portadoras. [84]
Debido a que el desarrollo de la fibrosis quística en el feto requiere que cada padre transmita una copia mutada del gen CFTR y debido a que las pruebas de fibrosis quística son costosas, las pruebas a menudo se realizan inicialmente en uno de los padres. Si las pruebas muestran que el padre es portador de la mutación del gen CFTR , se realiza la prueba al otro padre para calcular el riesgo de que sus hijos tengan fibrosis quística. La fibrosis quística puede ser el resultado de más de mil mutaciones diferentes. [49] A partir de 2016 [update], normalmente solo se analizan las mutaciones más comunes, como ΔF508. [49] La mayoría de las pruebas disponibles comercialmente buscan 32 o menos mutaciones diferentes. Si una familia tiene una mutación poco común conocida, se puede realizar una detección específica para esa mutación. Debido a que no todas las mutaciones conocidas se encuentran en las pruebas actuales, un análisis negativo no garantiza que un niño no tenga fibrosis quística. [85]
Durante el embarazo, se pueden realizar pruebas en la placenta ( muestreo de vellosidades coriónicas ) o en el líquido que rodea al feto ( amniocentesis ). Sin embargo, el muestreo de vellosidades coriónicas tiene un riesgo de muerte fetal de uno en 100 y la amniocentesis de uno en 200; [86] un estudio reciente ha indicado que este puede ser mucho menor, aproximadamente uno en 1.600. [87]
Económicamente, para las parejas portadoras de fibrosis quística, al comparar el diagnóstico genético preimplantacional (DGP) con la concepción natural (CN) seguida de pruebas prenatales y aborto de los embarazos afectados, el DGP proporciona beneficios económicos netos hasta una edad materna de alrededor de 40 años, después de la cual la CN, las pruebas prenatales y el aborto tienen un mayor beneficio económico. [88]
El tratamiento para la fibrosis quística es diverso, se adapta a los diferentes síntomas e incluye varios dispositivos, medicamentos inhalatorios para aliviar las dificultades respiratorias, suplementos enzimáticos orales para abordar la insuficiencia pancreática exocrina y, en algunos casos, intervenciones quirúrgicas para afecciones como el íleo meconial. [89] Si bien el tratamiento alivia los síntomas y previene posibles complicaciones, actualmente no existe cura para la enfermedad.
El tratamiento de la fibrosis quística ha mejorado significativamente en los últimos 70 años. Si bien hace 70 años los bebés que nacían con ella probablemente no vivirían más allá de su primer año, hoy es probable que vivan hasta bien entrada la edad adulta. Los avances en el tratamiento de la fibrosis quística han significado que las personas con fibrosis quística pueden vivir una vida más plena y menos agobiadas por su condición. Los pilares del tratamiento son el tratamiento proactivo de la infección de las vías respiratorias , el fomento de una buena nutrición y un estilo de vida activo. La rehabilitación pulmonar como tratamiento de la fibrosis quística continúa durante toda la vida de una persona y tiene como objetivo maximizar la función orgánica y, por lo tanto, la calidad de vida. [90] Los terapeutas ocupacionales utilizan técnicas de conservación de energía en el proceso de rehabilitación de los pacientes con fibrosis quística. [91] Algunos ejemplos de técnicas de conservación de energía son los principios ergonómicos, la respiración con los labios fruncidos y la respiración diafragmática. [92] Las personas con fibrosis quística tienden a tener fatiga y disnea debido a infecciones pulmonares crónicas, por lo que reducir la cantidad de energía gastada durante las actividades puede ayudar a las personas a sentirse mejor y ganar más independencia. [91] En el mejor de los casos, los tratamientos actuales retrasan el deterioro de la función orgánica. [ cita requerida ] Debido a la amplia variación de los síntomas de la enfermedad, el tratamiento suele realizarse en centros multidisciplinarios especializados y se adapta a cada individuo. Los objetivos de la terapia son los pulmones, el tracto gastrointestinal (incluidos los suplementos de enzimas pancreáticas), los órganos reproductivos (incluida la tecnología de reproducción asistida ) y el apoyo psicológico. [93]
El aspecto más consistente de la terapia en la fibrosis quística es limitar y tratar el daño pulmonar causado por la mucosidad espesa y la infección, con el objetivo de mantener la calidad de vida . Se utilizan antibióticos intravenosos , inhalados y orales para tratar infecciones crónicas y agudas. Se utilizan dispositivos mecánicos y medicamentos inhalatorios para alterar y limpiar la mucosidad espesa. Estas terapias, aunque efectivas, pueden requerir mucho tiempo. La terapia de oxígeno en el hogar se recomienda en aquellos con niveles significativamente bajos de oxígeno. [94] Muchas personas con fibrosis quística usan probióticos , que se cree que pueden corregir la disbiosis intestinal y la inflamación, pero la evidencia de los ensayos clínicos con respecto a la efectividad de los probióticos para reducir las exacerbaciones pulmonares en personas con fibrosis quística es incierta. [95]
Muchas personas con fibrosis quística toman uno o más antibióticos en todo momento, incluso cuando están sanas, para suprimir profilácticamente la infección. La elección de antibióticos para la fibrosis quística depende de las bacterias específicas que causan la infección, así como de la edad, el peso y otras condiciones médicas del paciente. [ cita requerida ] Los antibióticos son absolutamente necesarios siempre que se sospeche neumonía o se observe una disminución notable en la función pulmonar, y generalmente se eligen según los resultados de un análisis de esputo y la respuesta previa de la persona. [ cita requerida ] Esta terapia prolongada a menudo requiere hospitalización e inserción de una vía intravenosa más permanente , como un catéter central de inserción periférica o Port-a-Cath . La terapia inhalada con antibióticos como tobramicina , colistina y aztreonam a menudo se administra durante meses para mejorar la función pulmonar al impedir el crecimiento de bacterias colonizadas. [96] [97] [98] La terapia con antibióticos inhalados mejora la función pulmonar al combatir las infecciones, pero también presenta inconvenientes importantes, como el desarrollo de resistencia a los antibióticos, tinnitus y cambios en la voz. [99] La levofloxacina inhalada se puede utilizar para tratar la Pseudomonas aeruginosa en personas con fibrosis quística infectadas. [100]
Se administran antibióticos por vía oral, como ciprofloxacino o azitromicina , para ayudar a prevenir la infección o controlar la infección en curso. [101] Los antibióticos aminoglucósidos (por ejemplo, tobramicina) utilizados pueden causar pérdida de audición , daño al sistema de equilibrio en el oído interno o insuficiencia renal con el uso a largo plazo. [102] Para prevenir estos efectos secundarios , la cantidad de antibióticos en la sangre se mide de forma rutinaria y se ajusta en consecuencia. [103]
Actualmente, no hay evidencia confiable de ensayos clínicos que demuestre la efectividad de los antibióticos para las exacerbaciones pulmonares en personas con fibrosis quística y complejo Burkholderia cepacia [104] o para el uso de antibióticos para tratar micobacterias no tuberculosas en personas con fibrosis quística. [105]
El tratamiento temprano de la infección por Pseudomonas aeruginosa se suele sugerir con antibióticos nebulizados con o sin antibióticos orales para eliminar las bacterias de las vías respiratorias de la persona durante un período de tiempo. [106] Al elegir antibióticos para tratar infecciones pulmonares causadas por Pseudomonas aeruginosa en personas con fibrosis quística, todavía no está claro si la elección de antibióticos debe basarse en los resultados de las pruebas de antibióticos por separado (uno a la vez) o en combinación entre sí. [107] Tampoco está claro si estos enfoques de tratamiento para la infección por Pseudomonas aeruginosa mejoran la calidad de vida o la esperanza de vida de la persona. [106] Los efectos secundarios negativos de los antibióticos para esta infección tampoco están bien estudiados. [106] Se ha demostrado que la terapia antibiótica intravenosa para tratar las infecciones por Pseudomonas aeruginosa no es mejor que los antibióticos tomados por vía oral. [106]
Las infecciones por Staphylococcus aureus resistente a la meticilina (SARM) pueden ser peligrosas para las personas con fibrosis quística y pueden empeorar el daño pulmonar, lo que lleva a un deterioro más rápido. El tratamiento temprano con antibióticos es la norma; sin embargo, se necesitan más investigaciones para determinar los efectos y beneficios a largo plazo (3 a 6 meses después del tratamiento o más) y las tasas de supervivencia asociadas con diferentes opciones de tratamiento. [108]
Los factores relacionados con el uso de antibióticos, la cronicidad de la enfermedad y la aparición de bacterias resistentes exigen una mayor exploración de diferentes estrategias como la terapia adyuvante con antibióticos . [109] La terapia adyuvante con antibióticos se refiere a los enfoques terapéuticos que tienen como objetivo mejorar la acción de los antibióticos, como agentes farmacéuticos o suplementos que inciden en la virulencia de la bacteria o que cambian la susceptibilidad del organismo al antibiótico para que los antibióticos sean más efectivos. [109] No existe evidencia sólida para recomendar terapias adyuvantes con antibióticos específicos, como β-caroteno , óxido nítrico , suplementos de zinc o KB001-A. [109]
Los medicamentos en aerosol que ayudan a aflojar las secreciones incluyen la dornasa alfa y la solución salina hipertónica . [110] La dornasa es una desoxirribonucleasa humana recombinante , que descompone el ADN en el esputo, disminuyendo así su viscosidad. [111] La dornasa alfa mejora la función pulmonar y probablemente disminuye el riesgo de exacerbaciones, pero no hay evidencia suficiente para saber si es más o menos efectiva que otros medicamentos similares. [112] La dornasa alfa puede mejorar la función pulmonar; sin embargo, no hay evidencia sólida de que sea mejor que otras terapias hiperosmolares. [112]
El denufosol , un fármaco en investigación, abre un canal de cloruro alternativo, lo que ayuda a licuar la mucosidad. [113] No está claro si los corticosteroides inhalados son útiles, pero suspender la terapia con corticosteroides inhalados es seguro. [114] Hay evidencia débil de que el tratamiento con corticosteroides puede causar daño al interferir con el crecimiento. [114] La vacunación neumocócica no se ha estudiado hasta 2014. [update][ 115] Hasta 2014 [update], no hay evidencia clara de ensayos controlados aleatorios de que la vacuna contra la influenza sea beneficiosa para las personas con fibrosis quística. [116]
Ivacaftor es un medicamento que se toma por vía oral para el tratamiento de la fibrosis quística debido a una serie de mutaciones específicas que responden a la mejora de la proteína CFTR inducida por ivacaftor. [117] [118] Mejora la función pulmonar en aproximadamente un 10%; sin embargo, a partir de 2014 [update]es caro. [117] El primer año que estuvo en el mercado, el precio de lista era de más de $300,000 por año en los Estados Unidos. [117] [ necesita actualización ] En julio de 2015, la Administración de Alimentos y Medicamentos de los EE. UU. aprobó lumacaftor/ivacaftor . [119] En 2018, la FDA aprobó la combinación ivacaftor/tezacaftor ; el fabricante anunció un precio de lista de $292,000 por año. [120] El tezacaftor ayuda a mover la proteína CFTR a la posición correcta en la superficie celular y está diseñado para tratar a las personas con la mutación F508del . [121]
En 2019, el fármaco combinado elexacaftor/ivacaftor/tezacaftor , comercializado como Trikafta, fue aprobado para pacientes con FQ mayores de 12 años en los Estados Unidos. [122] [123] En 2021, esto se amplió para incluir a pacientes mayores de 6 años. [124] En Europa, este fármaco fue aprobado en 2020 y se comercializó como Kaftrio. [125] Se utiliza en aquellos que tienen una mutación f508del, que ocurre en aproximadamente el 90% de los pacientes con fibrosis quística. [122] [126] Según la Cystic Fibrosis Foundation , "este medicamento representa el mayor avance terapéutico en la historia de la FQ, ofreciendo un tratamiento para la causa subyacente de la enfermedad que eventualmente podría llevar la terapia moduladora al 90 por ciento de las personas con FQ". [127] En un ensayo clínico, los participantes a los que se les administró el fármaco combinado experimentaron una disminución posterior del 63% en las exacerbaciones pulmonares y una disminución de 41,8 mmol/L en la concentración de cloruro en el sudor. [128] Al mitigar un repertorio de síntomas asociados con la fibrosis quística, el fármaco combinado también mejoró significativamente las métricas de calidad de vida entre los pacientes con la enfermedad. [128] [127] También se sabe que el fármaco combinado interactúa con los inductores de CYP3A, [129] como la carbamazepina utilizada en el tratamiento del trastorno bipolar, lo que hace que el elexafaftor/ivacaftor/tezacaftor circule en el cuerpo en concentraciones reducidas. Como tal, no se recomienda el uso concurrente. [130] El precio de lista en los EE. UU. será de $311 000 por año; [131] sin embargo, el seguro puede cubrir gran parte del costo del fármaco. [132]
Se ha utilizado el ácido ursodesoxicólico , una sal biliar ; sin embargo, no hay datos suficientes para demostrar si es eficaz. [133]
No se sabe con certeza si la suplementación con vitamina A o betacaroteno tiene algún efecto sobre los problemas oculares y cutáneos causados por la deficiencia de vitamina A. [134]
No hay evidencia sólida de que las personas con fibrosis quística puedan prevenir la osteoporosis aumentando su ingesta de vitamina D. [ 135]
En el caso de las personas con deficiencia de vitamina E y fibrosis quística, hay evidencia de que la suplementación con vitamina E puede mejorar los niveles de vitamina E, aunque todavía no se sabe con certeza qué efecto tiene la suplementación sobre los trastornos de deficiencia específicos de vitamina E o sobre la función pulmonar. [136]
Hasta el año 2020, no existe evidencia sólida sobre los efectos de la suplementación con vitamina K en personas con fibrosis quística . [137]
Varios estudios han examinado los efectos de la suplementación con ácidos grasos omega-3 para personas con fibrosis quística, pero la evidencia es incierta respecto de si tiene beneficios o efectos adversos. [138]
Se utilizan varias técnicas mecánicas para desalojar el esputo y estimular su expectoración. Una técnica buena para la limpieza de las vías respiratorias a corto plazo es la fisioterapia torácica , en la que un terapeuta respiratorio percute el tórax de un individuo con la mano varias veces al día para aflojar las secreciones. Este "efecto percusivo" también se puede administrar a través de dispositivos específicos que utilizan la oscilación de la pared torácica o un ventilador percusivo intrapulmonar . Otros métodos, como la ventilación bifásica con coraza y el modo de limpieza asociado disponible en dichos dispositivos, integran una fase de asistencia para la tos, así como una fase de vibración para desalojar las secreciones. Estos son portátiles y están adaptados para uso doméstico. [12]
Otra técnica es la fisioterapia con presión espiratoria positiva que consiste en proporcionar una contrapresión a las vías respiratorias durante la espiración. Este efecto se proporciona mediante dispositivos que consisten en una máscara o una boquilla en la que se aplica una resistencia solo en la fase de espiración. [139] Los principios operativos de esta técnica parecen ser el aumento de la presión del gas detrás de la mucosidad a través de la ventilación colateral junto con un aumento temporal de la capacidad residual funcional que evita el colapso temprano de las vías respiratorias pequeñas durante la exhalación. [140] [141]
A medida que la enfermedad pulmonar empeora, puede ser necesario el apoyo respiratorio mecánico. Las personas con fibrosis quística pueden necesitar usar máscaras especiales por la noche para ayudar a impulsar el aire hacia sus pulmones. Estas máquinas, conocidas como ventiladores de presión positiva de dos niveles en las vías respiratorias (BiPAP), ayudan a prevenir los niveles bajos de oxígeno en sangre durante el sueño. Se pueden utilizar ventiladores no invasivos durante la fisioterapia para mejorar la depuración del esputo. [142] No se sabe si este tipo de terapia tiene un impacto en las exacerbaciones pulmonares o la progresión de la enfermedad. [142] No se sabe qué papel tiene la terapia de ventilación no invasiva para mejorar la capacidad de ejercicio en personas con fibrosis quística. [142] Sin embargo, los autores señalaron que "la ventilación no invasiva puede ser un complemento útil para otras técnicas de depuración de las vías respiratorias, en particular en personas con fibrosis quística que tienen dificultad para expectorar esputo". [143] Durante una enfermedad grave, se puede colocar un tubo en la garganta (un procedimiento conocido como traqueotomía ) para permitir la respiración asistida por un ventilador. [144] [145]
En el caso de los niños, los estudios preliminares muestran que la terapia de masaje puede mejorar la calidad de vida de las personas y sus familias. [146]
Algunas infecciones pulmonares requieren la extirpación quirúrgica de la parte infectada del pulmón. Si esto es necesario muchas veces, la función pulmonar se reduce gravemente. [147] No está claro cuáles son las opciones de tratamiento más eficaces para las personas con fibrosis quística que presentan neumotórax espontáneos o recurrentes . [148]
El trasplante de pulmón puede llegar a ser necesario para las personas con fibrosis quística a medida que la función pulmonar y la tolerancia al ejercicio disminuyen. Aunque el trasplante de un solo pulmón es posible en otras enfermedades, las personas con fibrosis quística deben tener ambos pulmones reemplazados porque el pulmón restante puede contener bacterias que podrían infectar el pulmón trasplantado. Se puede realizar un trasplante de páncreas o hígado al mismo tiempo para aliviar la enfermedad hepática y/o la diabetes. [149] El trasplante de pulmón se considera cuando la función pulmonar disminuye hasta el punto en que se requiere asistencia de dispositivos mecánicos o la supervivencia de alguien está amenazada. [150] Según el Manual Merck , "el trasplante de pulmón bilateral para la enfermedad pulmonar grave se está volviendo más rutinario y más exitoso con la experiencia y las técnicas mejoradas. Entre los adultos con fibrosis quística, la supervivencia media después del trasplante es de unos 9 años". [151]

Los recién nacidos con obstrucción intestinal suelen requerir cirugía, mientras que los adultos con síndrome de obstrucción intestinal distal no suelen necesitarla. El tratamiento de la insuficiencia pancreática mediante la reposición de las enzimas digestivas faltantes permite que el duodeno absorba adecuadamente los nutrientes y las vitaminas que de otro modo se perderían en las heces. Sin embargo, no está clara la mejor dosis y forma de reposición de las enzimas pancreáticas, como tampoco lo están los riesgos y la eficacia a largo plazo de este tratamiento. [152]
Hasta el momento, no se ha llevado a cabo ninguna investigación a gran escala que involucre la incidencia de la aterosclerosis y la enfermedad cardíaca coronaria en adultos con fibrosis quística. Esto probablemente se debe a que la gran mayoría de las personas con fibrosis quística no viven lo suficiente como para desarrollar aterosclerosis o enfermedad cardíaca coronaria clínicamente significativas. [153]
La diabetes es la complicación no pulmonar más frecuente de la fibrosis quística. Combina características de la diabetes tipo 1 y tipo 2, y se reconoce como una entidad distinta, la diabetes relacionada con la fibrosis quística . [40] [154] Aunque a veces se utilizan fármacos antidiabéticos orales, el tratamiento recomendado es el uso de inyecciones de insulina o una bomba de insulina , [155] y, a diferencia de la diabetes tipo 1 y 2, no se recomiendan restricciones dietéticas. [40] Aunque Stenotrophomonas maltophilia es relativamente común en personas con fibrosis quística, la evidencia sobre la eficacia de los antibióticos para S. maltophilia es incierta. [156]
Los bifosfonatos tomados por vía oral o intravenosa se pueden utilizar para mejorar la densidad mineral ósea en personas con fibrosis quística, pero no hay pruebas de que esto reduzca las fracturas o aumente las tasas de supervivencia. [157] Cuando se toman bifosfatos por vía intravenosa, pueden presentarse efectos adversos como dolor y síntomas similares a los de la gripe. [157] No se conocen los efectos adversos de los bifosfatos tomados por vía oral en el tracto gastrointestinal. [157]
El crecimiento deficiente se puede evitar mediante la inserción de una sonda de alimentación para aumentar la energía alimentaria a través de alimentos complementarios o mediante la administración de hormona de crecimiento inyectada . [158]
Las infecciones de los senos nasales se tratan con tratamientos prolongados con antibióticos. La aparición de pólipos nasales u otros cambios crónicos en los conductos nasales puede limitar gravemente el flujo de aire a través de la nariz y, con el tiempo, reducir el sentido del olfato de la persona. La cirugía de los senos nasales se utiliza a menudo para aliviar la obstrucción nasal y limitar futuras infecciones. Los esteroides nasales, como el propionato de fluticasona, se utilizan para disminuir la inflamación nasal. [159]
La infertilidad femenina puede ser superada mediante técnicas de reproducción asistida , en particular técnicas de transferencia de embriones . La infertilidad masculina causada por la ausencia de los conductos deferentes puede ser superada con la extracción de espermatozoides testiculares , recogiendo células espermáticas directamente de los testículos. Si la muestra recogida contiene muy pocos espermatozoides para que haya probabilidades de que haya una fecundación espontánea, se puede realizar una inyección intracitoplasmática de espermatozoides . [160] La reproducción por terceros también es una posibilidad para las mujeres con fibrosis quística. No está claro si la toma de antioxidantes afecta a los resultados. [161]
El ejercicio físico suele ser parte de la atención ambulatoria para las personas con fibrosis quística. [162] El ejercicio aeróbico parece ser beneficioso para la capacidad de ejercicio aeróbico, la función pulmonar y la calidad de vida relacionada con la salud; sin embargo, la calidad de la evidencia fue deficiente. [162]
Debido al uso de antibióticos aminoglucósidos, la ototoxicidad es frecuente. Los síntomas pueden incluir “tinnitus, pérdida de audición, hiperacusia, sensación de plenitud auditiva, mareos y vértigo”. [163]
Los problemas del sistema gastrointestinal, como el estreñimiento y la obstrucción del tracto gastrointestinal, incluido el síndrome de obstrucción intestinal distal, son complicaciones frecuentes en las personas con fibrosis quística. [34] Es necesario tratar los problemas gastrointestinales para prevenir una obstrucción completa, reducir otros síntomas de fibrosis quística y mejorar la calidad de vida. [34] Aunque a menudo se sugieren ablandadores de heces, laxantes y procinéticos (tratamientos centrados en el tracto gastrointestinal), no hay un consenso claro entre los expertos sobre qué enfoque es el mejor y conlleva menos riesgos. [34] A veces también se sugieren mucolíticos o tratamientos sistémicos dirigidos a CFTR disfuncional para mejorar los síntomas. [164] [ necesita actualización ]
El pronóstico de la fibrosis quística ha mejorado gracias a un diagnóstico más temprano mediante pruebas de detección y un mejor tratamiento y acceso a la atención sanitaria. En 1959, la mediana de edad de supervivencia de los niños con fibrosis quística en los Estados Unidos era de seis meses. [165] En 2010, se estima que la supervivencia es de 37 años para las mujeres y de 40 años para los hombres. [166] En Canadá, la mediana de supervivencia aumentó de 24 años en 1982 a 47,7 en 2007. [167] En los Estados Unidos, los nacidos con fibrosis quística en 2016 tienen una esperanza de vida prevista de 47,7 años cuando son atendidos en clínicas especializadas. [168] Debido al reciente desarrollo de nuevos tratamientos, como los moduladores de CFTR, la esperanza de vida ha aumentado rápidamente durante los últimos años. En 2020, la mediana de esperanza de vida prevista era de unos 59 años, aunque existen incertidumbres en las estimaciones debido al bajo número de muertes anuales de personas con fibrosis quística. [169]
En los EE. UU., de las personas con fibrosis quística que tenían más de 18 años en 2009, el 92 % se había graduado de la escuela secundaria, el 67 % tenía al menos algún tipo de educación universitaria, el 15 % estaba discapacitado, el 9 % estaba desempleado, el 56 % era soltero y el 39 % estaba casado o vivía con una pareja. [170]
Las enfermedades crónicas pueden ser difíciles de controlar. La fibrosis quística es una enfermedad crónica que afecta a los "tractos digestivo y respiratorio, lo que produce desnutrición generalizada e infecciones respiratorias crónicas". [171] Las secreciones espesas obstruyen las vías respiratorias de los pulmones, lo que a menudo causa inflamación e infecciones pulmonares graves. [172] [173] Si se ve comprometida, afecta la calidad de vida de una persona con fibrosis quística y su capacidad para realizar tareas como las de la vida cotidiana. [ cita requerida ]
Según Schmitz y Goldbeck (2006), la fibrosis quística aumenta significativamente el estrés emocional tanto del individuo como de la familia, "y la rutina diaria de tratamiento que requiere mucho tiempo puede tener efectos negativos adicionales en la calidad de vida". [174] Sin embargo, Havermans y colegas (2006) han establecido que los pacientes ambulatorios jóvenes con fibrosis quística que han participado en el Cuestionario de fibrosis quística revisado "puntuaron algunos dominios de calidad de vida más altos que sus padres". [175] En consecuencia, los pacientes ambulatorios con fibrosis quística tienen una perspectiva más positiva de sí mismos. Como señala el Manual Merck , "con el apoyo adecuado, la mayoría de los pacientes pueden hacer un ajuste apropiado a su edad en el hogar y la escuela. A pesar de los innumerables problemas, los éxitos educativos, laborales y matrimoniales de los pacientes son impresionantes". [151]
Además, existen muchas maneras de mejorar la calidad de vida de los pacientes con fibrosis quística. Se promueve el ejercicio para aumentar la función pulmonar. La integración de un régimen de ejercicio en la rutina diaria del paciente con fibrosis quística puede mejorar significativamente la calidad de vida. [176] No se conoce una cura definitiva para la fibrosis quística, pero se utilizan diversos medicamentos, como mucolíticos, broncodilatadores, esteroides y antibióticos, que tienen el propósito de aflojar la mucosidad, expandir las vías respiratorias, disminuir la inflamación y combatir las infecciones pulmonares, respectivamente. [177]
La fibrosis quística es la enfermedad autosómica recesiva limitante de la vida más común entre las personas de ascendencia europea. [179] En los Estados Unidos, alrededor de 30.000 personas tienen fibrosis quística; la mayoría son diagnosticadas a los seis meses de edad. En Canadá, alrededor de 4.000 personas tienen fibrosis quística. [180] Alrededor de 1 de cada 25 personas de ascendencia europea, y una de cada 30 de los estadounidenses blancos, [181] es portadora de una mutación de fibrosis quística. Aunque la fibrosis quística es menos común en estos grupos, aproximadamente uno de cada 46 hispanos , uno de cada 65 africanos y uno de cada 90 asiáticos son portadores de al menos un gen CFTR anormal. [182] [183] Irlanda tiene la prevalencia más alta del mundo de fibrosis quística, una de cada 1353; [184] La prevalencia de fibrosis quística en Japón está entre las más bajas del mundo, una de cada 350.000. [185]
Aunque técnicamente es una enfermedad rara, la fibrosis quística está clasificada como una de las enfermedades genéticas que acortan la vida más extendidas. Es más común entre las naciones del mundo occidental. Una excepción es Finlandia , donde solo una de cada 80 personas es portadora de una mutación de fibrosis quística. [186] La Organización Mundial de la Salud afirma: "En la Unión Europea, uno de cada 2000 a 3000 recién nacidos está afectado por fibrosis quística". [187] En los Estados Unidos, uno de cada 3500 niños nace con fibrosis quística. [188] En 1997, aproximadamente uno de cada 3300 niños blancos en los Estados Unidos nació con fibrosis quística. En contraste, solo uno de cada 15 000 niños afroamericanos la padece, y en los asiático-americanos, la tasa fue incluso menor, uno de cada 32 000. [189]
La fibrosis quística se diagnostica por igual en hombres y mujeres. Por razones que aún no están claras, los datos han demostrado que los hombres tienden a tener una mayor esperanza de vida que las mujeres, [190] [191] aunque estudios recientes sugieren que esta brecha de género puede que ya no exista, tal vez debido a las mejoras en los centros de atención de la salud. [192] [193] Un estudio reciente de Irlanda identificó un vínculo entre la hormona femenina estrógeno y peores resultados en la fibrosis quística. [194]
La distribución de los alelos de fibrosis quística varía entre poblaciones. Se ha estimado que la frecuencia de portadores de ΔF508 es de uno por cada 200 en el norte de Suecia, uno por cada 143 en los lituanos y uno por cada 38 en Dinamarca. No se encontraron portadores de ΔF508 entre 171 finlandeses y 151 saami . [195] ΔF508 se encuentra en Finlandia, pero es un alelo minoritario allí. Se sabe que la fibrosis quística se presenta en solo 20 familias (pedigríes) en Finlandia. [196]
Se estima que la mutación ΔF508 se produjo hace hasta 52.000 años. [197] Se han propuesto numerosas hipótesis sobre por qué un alelo tan letal ha persistido y se ha propagado en la población humana. Se ha descubierto que otras enfermedades autosómicas recesivas comunes, como la anemia de células falciformes, protegen a los portadores de otras enfermedades, una compensación evolutiva conocida como ventaja heterocigótica . Se han propuesto todas las siguientes como posibles fuentes de ventaja heterocigótica:

Se supone que la fibrosis quística apareció alrededor del año 3000 a. C. debido a la migración de personas, mutaciones genéticas y nuevas condiciones en la alimentación. [207] Aunque el espectro clínico completo de la fibrosis quística no se reconoció hasta la década de 1930, ciertos aspectos de la fibrosis quística se identificaron mucho antes. De hecho, la literatura de Alemania y Suiza del siglo XVIII advertía: "Wehe dem Kind, das beim Kuß auf die Stirn salzig schmeckt, es ist verhext und muss bald sterben" ("Ay del niño que siente el sabor salado de un beso en la frente, porque está hechizado y pronto debe morir"), reconociendo la asociación entre la pérdida de sal en la fibrosis quística y la enfermedad. [207]
En el siglo XIX, Carl von Rokitansky describió un caso de muerte fetal con peritonitis meconial , una complicación del íleo meconial asociado con la fibrosis quística. El íleo meconial fue descrito por primera vez en 1905 por Karl Landsteiner . [207] En 1936, Guido Fanconi describió una conexión entre la enfermedad celíaca , la fibrosis quística del páncreas y la bronquiectasia . [208]
En 1938, Dorothy Hansine Andersen publicó un artículo, "Fibrosis quística del páncreas y su relación con la enfermedad celíaca: un estudio clínico y patológico", en el American Journal of Diseases of Children . Fue la primera en describir la fibrosis quística característica del páncreas y correlacionarla con la enfermedad pulmonar e intestinal prominente en la fibrosis quística. [15] También fue la primera en plantear la hipótesis de que la fibrosis quística era una enfermedad recesiva y utilizó por primera vez el reemplazo de enzimas pancreáticas para tratar a los niños afectados. En 1952, Paul di Sant'Agnese descubrió anomalías en los electrolitos del sudor; se desarrolló una prueba del sudor y se mejoró durante la siguiente década. [209]
El primer vínculo entre la fibrosis quística y otro marcador ( paraoxonasa ) fue descubierto en 1985 por Hans Eiberg , lo que indica que sólo existe un locus para la fibrosis quística. [210] En 1988, Francis Collins , Lap-Chee Tsui y John R. Riordan descubrieron la primera mutación para la fibrosis quística, ΔF508 , en el séptimo cromosoma. [211] Investigaciones posteriores han encontrado más de 1000 mutaciones diferentes que causan fibrosis quística. [212]
Debido a que las mutaciones en el gen CFTR son típicamente pequeñas, las técnicas de genética clásica no habían podido identificar con precisión el gen mutado. [213] Utilizando marcadores de proteínas, los estudios de ligamiento genético pudieron mapear la mutación al cromosoma 7. Luego se utilizaron técnicas de caminata cromosómica y salto cromosómico para identificar y secuenciar el gen. [213] En 1989, Lap-Chee Tsui dirigió un equipo de investigadores en el Hospital para Niños Enfermos en Toronto que descubrió el gen responsable de la fibrosis quística. [214] La fibrosis quística representa un ejemplo clásico de cómo un trastorno genético humano fue dilucidado estrictamente por el proceso de genética directa . [213] [215]
Las personas con fibrosis quística pueden figurar en un registro de enfermedades que permite a los investigadores y médicos hacer un seguimiento de los resultados de salud e identificar candidatos para ensayos clínicos. [216]
La terapia génica se ha estudiado como posible cura para la fibrosis quística. Los resultados de los ensayos clínicos han demostrado un éxito limitado hasta 2016 [update], y no se recomienda su uso como terapia de rutina. [217] Un pequeño estudio publicado en 2015 encontró un pequeño beneficio. [218]
El objetivo de gran parte de la investigación sobre terapia génica en la fibrosis quística es tratar de colocar una copia normal del gen CFTR en las células afectadas. La transferencia del gen CFTR normal a las células epiteliales afectadas daría como resultado la producción de proteína CFTR funcional en todas las células diana, sin reacciones adversas ni una respuesta inflamatoria; esto se conoce como terapia de células somáticas. Para prevenir las manifestaciones pulmonares de la fibrosis quística, solo se necesita entre el 5 y el 10 % de la cantidad normal de expresión del gen CFTR. [219] Se han probado múltiples enfoques para la transferencia génica, como los liposomas y los vectores virales en modelos animales y ensayos clínicos. Sin embargo, se encontró que ambos métodos eran opciones de tratamiento relativamente ineficientes, [220] principalmente porque muy pocas células absorben el vector y expresan el gen, por lo que el tratamiento tiene poco efecto. Además, se han observado problemas en la recombinación de ADNc, de modo que el gen introducido por el tratamiento se vuelve inutilizable. [221] Se ha producido una reparación funcional en cultivo de CFTR mediante CRISPR/Cas9 en organoides de células madre intestinales de pacientes con fibrosis quística. [222]
La terapia con bacteriófagos ( terapia con fagos ) se está estudiando para bacterias resistentes a múltiples fármacos en personas con fibrosis quística. [223] [224] La terapia con bacteriófagos es un método de tratamiento que utiliza virus, conocidos como bacteriófagos , para atacar y destruir bacterias dañinas en el cuerpo. A diferencia de los antibióticos, que pueden matar una amplia gama de bacterias y potencialmente alterar la flora normal del cuerpo, la terapia con fagos es altamente específica, apuntando solo a las bacterias dañinas mientras deja intactas a las beneficiosas. Como tal, la terapia con bacteriófagos es una alternativa prometedora para tratar infecciones causadas por bacterias resistentes a múltiples fármacos, como Staphylococcus aureus, Haemophilus influenzae y Pseudomonas aeruginosa en pacientes con fibrosis quística, que a menudo están protegidas por biopelículas y, por lo tanto, son resistentes a los antibióticos convencionales. [225] [226] [227]
La terapia con bacteriófagos utiliza virus como agentes antimicrobianos para superar la resistencia a los antibióticos en bacterias con biopelículas [228]. La terapia con fagos se utiliza para tratar la infección por Pseudomonas aeruginosa en los pulmones, que se observa con frecuencia en pacientes con fibrosis quística, ya que estas bacterias producen biopelículas que les dan resistencia a múltiples fármacos. [229]
Se están desarrollando varias moléculas pequeñas que tienen como objetivo compensar diversas mutaciones del gen CFTR . Las terapias moduladoras del CFTR se han utilizado en lugar de otros tipos de terapias genéticas. Estas terapias se centran en la expresión de una mutación genética en lugar del gen mutado en sí. Los moduladores se dividen en dos clases: potenciadores y correctores. Los potenciadores actúan sobre los canales iónicos CFTR que están incrustados en la membrana celular, y estos tipos de fármacos ayudan a abrir el canal para permitir el flujo transmembrana. Los correctores están destinados a ayudar en el transporte de proteínas nacientes, una proteína que se forma en los ribosomas antes de que se transforme en una forma específica, a la superficie celular para ser implementada en la membrana celular. [230]
La mayoría de los fármacos se dirigen a la etapa de transcripción de la expresión genética. Un enfoque ha sido tratar de desarrollar medicamentos que hagan que el ribosoma supere el codón de terminación y produzca una proteína CFTR de longitud completa. Aproximadamente el 10% de la fibrosis quística es resultado de un codón de terminación prematuro en el ADN, lo que lleva a la terminación temprana de la síntesis de proteínas y proteínas truncadas. Estos fármacos se dirigen a mutaciones sin sentido como G542X, que consiste en la sustitución del aminoácido glicina en la posición 542 por un codón de terminación. Los antibióticos aminoglucósidos interfieren con la síntesis de proteínas y la corrección de errores. En algunos casos, pueden hacer que la célula supere un codón de terminación prematuro insertando un aminoácido aleatorio, lo que permite la expresión de una proteína de longitud completa. La investigación futura de estos moduladores se centra en los objetivos celulares que pueden verse afectados por un cambio en la expresión de un gen. De lo contrario, se utilizará la terapia genética como tratamiento cuando las terapias moduladoras no funcionen, dado que el 10% de las personas con fibrosis quística no se ven afectadas por estos fármacos. [231]
El elexacaftor/ivacaftor/tezacaftor fue aprobado en los Estados Unidos en 2019 para la fibrosis quística. [232] Esta combinación de medicamentos desarrollados previamente puede tratar hasta el 90% de las personas con fibrosis quística. [230] [232] Este medicamento restaura cierta eficacia de la proteína CFTR para que pueda funcionar como un canal iónico en la superficie de la célula. [233]
Se ha demostrado previamente que las interacciones entre especies son un contribuyente importante a la patología de las infecciones pulmonares por fibrosis quística. Los ejemplos incluyen la producción de enzimas que degradan antibióticos, como las β-lactamasas, y la producción de subproductos metabólicos, como los ácidos grasos de cadena corta (AGCC), por parte de especies anaeróbicas, que pueden aumentar la patogenicidad de patógenos tradicionales, como Pseudomonas aeruginosa . [234] Debido a esto, se ha sugerido que la alteración directa de la composición de la comunidad microbiana y la función metabólica de la fibrosis quística proporcionaría una alternativa a las terapias antibióticas tradicionales. [66]
Se están realizando investigaciones sobre la terapia antisentido para tratar un subconjunto de mutaciones que tienen una respuesta limitada o nula a los moduladores de CFTR. [235] Dichas mutaciones se dividen en dos clases: splicing (p. ej., c.3718-2477C>T) y sin sentido (p. ej., G542X, W1282X), ambas de las cuales resultan en una expresión muy baja de la proteína CFTR, aunque la proteína en sí no suele verse afectada. Esto es contrario a las mutaciones más comunes como ΔF508 que tienen una expresión normal de CFTR pero en una forma no funcional. Los moduladores sirven solo para corregir estas proteínas aberrantes y son de poco o ningún beneficio en el caso de una expresión insuficiente. Los oligonucleótidos antisentido (ASO) pueden resolver este problema a través de la promoción de la degradación del ARNm o modificando el splicing del pre-ARNm, la descomposición del ARNm mediada por sin sentido o la traducción, aumentando así la expresión de CFTR.
{{cite web}}: CS1 maint: url-status (link)