

Los transportadores ABC , transportadores de casetes de unión a ATP sintasa (ATP) , son una superfamilia de sistemas de transporte que es una de las familias de genes más grandes y posiblemente una de las más antiguas . Está representado en todos los filos existentes , desde procariotas hasta humanos . [1] [2] [3] Los transportadores ABC pertenecen a las translocasas .
Los transportadores ABC a menudo constan de múltiples subunidades, una o dos de las cuales son proteínas transmembrana y una o dos son ATPasas AAA asociadas a la membrana . [ cita necesaria ] Las subunidades de ATPasa utilizan la energía de la unión e hidrólisis del trifosfato de adenosina (ATP) para proporcionar la energía necesaria para la translocación de sustratos a través de las membranas, ya sea para la absorción o la exportación del sustrato.
La mayoría de los sistemas de captación también tienen un receptor extracitoplasmático, una proteína fijadora de solutos. Algunas ATPasas homólogas funcionan en procesos no relacionados con el transporte, como la traducción del ARN y la reparación del ADN . [4] [5] Los transportadores ABC se consideran una superfamilia ABC basándose en las similitudes de la secuencia y organización de sus dominios del casete de unión a ATP (ABC), a pesar de que las proteínas integrales de membrana parecen haber evolucionado de forma independiente varias veces, y por tanto comprenden diferentes familias de proteínas. [6] Al igual que los exportadores de ABC, es posible que las proteínas integrales de membrana de los sistemas de absorción de ABC también evolucionaran al menos tres veces de forma independiente, basándose en sus estructuras tridimensionales de alta resolución. [7] Los transportadores de absorción ABC absorben una gran variedad de nutrientes, precursores biosintéticos, trazas de metales y vitaminas , mientras que los exportadores transportan lípidos , esteroles , fármacos y una gran variedad de metabolitos primarios y secundarios. Algunos de estos exportadores en humanos están involucrados en la resistencia a tumores, la fibrosis quística y una variedad de otras enfermedades humanas hereditarias. La expresión de alto nivel de los genes que codifican algunos de estos exportadores en organismos tanto procarióticos como eucariotas (incluidos los humanos) da como resultado el desarrollo de resistencia a múltiples fármacos, como antibióticos y agentes anticancerígenos.
Se han caracterizado cientos de transportadores ABC tanto de procariotas como de eucariotas. [8] Los genes ABC son esenciales para muchos procesos en la célula, y las mutaciones en genes humanos causan o contribuyen a varias enfermedades genéticas humanas. [9] Se han informado cuarenta y ocho genes ABC en humanos. Entre estos, muchos se han caracterizado y se ha demostrado que están relacionados causalmente con enfermedades presentes en humanos como la fibrosis quística , la adrenoleucodistrofia , la enfermedad de Stargardt , los tumores resistentes a los medicamentos, el síndrome de Dubin-Johnson , la enfermedad de Byler, la colestasis intrahepática familiar progresiva, la enfermedad sideroblástica ligada al cromosoma X. anemia , ataxia e hipoglucemia persistente e hiperinsuliménica. [8] Los transportadores ABC también están involucrados en la resistencia a múltiples medicamentos , y así es como algunos de ellos fueron identificados por primera vez. Cuando las proteínas de transporte ABC se sobreexpresan en las células cancerosas, pueden exportar medicamentos contra el cáncer y hacer que los tumores sean resistentes. [10]
Los transportadores ABC utilizan la energía de la unión y la hidrólisis del ATP para transportar diversos sustratos a través de las membranas celulares . Se dividen en tres categorías funcionales principales. En los procariotas, los importadores median la absorción de nutrientes en la célula. Los sustratos que pueden transportarse incluyen iones , aminoácidos , péptidos , azúcares y otras moléculas que son en su mayoría hidrófilas . La región que atraviesa la membrana del transportador ABC protege los sustratos hidrófilos de los lípidos de la bicapa de la membrana , proporcionando así una vía a través de la membrana celular. Los eucariotas no poseen importadores. Los exportadores o efluyentes , que están presentes tanto en procariotas como en eucariotas, funcionan como bombas que expulsan toxinas y fármacos fuera de la célula. En las bacterias gramnegativas , los exportadores transportan lípidos y algunos polisacáridos desde el citoplasma al periplasma . El tercer subgrupo de proteínas ABC no funcionan como transportadores, sino que participan en procesos de traducción y reparación del ADN. [4]
Los transportadores ABC bacterianos son esenciales en la viabilidad, virulencia y patogenicidad celular . [1] [4] Los sistemas de absorción de hierro ABC, por ejemplo, son importantes efectores de la virulencia. [11] Los patógenos utilizan sideróforos , como la enterobactina , para eliminar el hierro que está en complejo con proteínas de unión al hierro de alta afinidad o eritrocitos . Se trata de moléculas quelantes de hierro de alta afinidad que son secretadas por bacterias y reabsorben el hierro en complejos hierro-sideróforo. El gen chvE-gguAB de Agrobacterium tumefaciens codifica importadores de glucosa y galactosa que también están asociados con la virulencia. [12] [13] Los transportadores son extremadamente vitales en la supervivencia celular, de modo que funcionan como sistemas de proteínas que contrarrestan cualquier cambio indeseable que ocurra en la célula. Por ejemplo, un posible aumento letal de la fuerza osmótica se contrarresta mediante la activación de los transportadores ABC osmosensibles que median la absorción de solutos. [14] Además de funcionar en el transporte, algunas proteínas bacterianas ABC también participan en la regulación de varios procesos fisiológicos. [4]
En los sistemas de eflujo bacteriano, ciertas sustancias que deben ser extruidas de la célula incluyen componentes de la superficie de la célula bacteriana (p. ej., polisacáridos capsulares, lipopolisacáridos y ácido teicoico ), proteínas involucradas en la patogénesis bacteriana (p. ej. , hemólisis , proteína de unión al hemo y alcalina). proteasa ), hemo, enzimas hidrolíticas , proteínas de la capa S, factores de competencia, toxinas , antibióticos , bacteriocinas , antibióticos peptídicos , fármacos y sideróforos. [15] También desempeñan funciones importantes en las vías biosintéticas, incluida la biosíntesis de polisacáridos extracelulares [16] y la biogénesis del citocromo . [17]
Aunque la mayoría de los transportadores ABC eucariotas son eflujos, algunos no participan directamente en el transporte de sustratos. En el regulador transmembrana de la fibrosis quística ( CFTR ) y en el receptor de sulfonilurea (SUR), la hidrólisis del ATP está asociada con la regulación de la apertura y cierre de los canales iónicos transportados por la propia proteína ABC u otras proteínas. [5]
Los transportadores ABC humanos están involucrados en varias enfermedades que surgen de polimorfismos en los genes ABC y rara vez se deben a la pérdida completa de la función de proteínas ABC individuales. [18] Tales enfermedades incluyen enfermedades mendelianas y trastornos genéticos complejos como fibrosis quística, adrenoleucodistrofia , enfermedad de Stargardt , enfermedad de Tánger , deficiencias inmunes, colestasis intrahepática familiar progresiva , síndrome de Dubin-Johnson , pseudoxantoma elástico , hipoglucemia hiperinsulinémica persistente de la infancia debido a adenomas focales. hiperplasia , sideroblastosis y anemia ligadas al cromosoma X, degeneración macular relacionada con la edad , hipoapoproteinemia familiar, retinitis pigmentosa, distrofia de conos y bastones y otras. [5] La familia humana ABCB (MDR/TAP) es responsable de la resistencia a múltiples fármacos (MDR) contra una variedad de fármacos estructuralmente no relacionados. La glicoproteína P ABCB1 o MDR1 también participa en otros procesos biológicos cuya función principal es el transporte de lípidos. Se ha descubierto que media la secreción del esteroide aldosterona por las glándulas suprarrenales, y su inhibición bloqueó la migración de células inmunes dendríticas , [19] posiblemente relacionada con el transporte hacia afuera del factor activador de plaquetas lipídicas (PAF). También se ha informado que ABCB1 media el transporte de cortisol y dexametasona , pero no de progesterona en células transfectadas con ABCB1. MDR1 también puede transportar colesterol , análogos de cadena corta y cadena larga de fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilserina (PS), esfingomielina (SM) y glucosilceramida (GlcCer). El transporte multiespecífico de diversos lípidos endógenos a través del transportador MDR1 posiblemente pueda afectar la distribución transbicapa de los lípidos, en particular de especies normalmente predominantes en la valva de la membrana plasmática interna, como PS y PE. [18]
Más recientemente, se ha demostrado que existen transportadores ABC dentro de la placenta , lo que indica que podrían desempeñar un papel protector para el feto en desarrollo contra los xenobióticos . [20] La evidencia ha demostrado que la expresión placentaria de la glicoproteína P (P-gp) de los transportadores ABC y la proteína de resistencia al cáncer de mama (BCRP) aumenta en las placentas prematuras en comparación con las placentas a término, y la expresión de P-gp aumenta aún más en los embarazos prematuros con corioamnionitis. [21] En menor medida, el aumento del IMC materno también se asoció con una mayor expresión del transportador ABC placentario, pero solo en los casos prematuros. [21]


Todas las proteínas de transporte ABC comparten una organización estructural que consta de cuatro dominios centrales. [22] Estos dominios constan de dos dominios transmembrana (T) y dos dominios citosólicos (A). Los dos dominios T alternan entre una orientación hacia adentro y hacia afuera, y la alternancia está impulsada por la hidrólisis del trifosfato de adenosina o ATP . El ATP se une a las subunidades A y luego se hidroliza para impulsar la alternancia, pero se desconoce el proceso exacto por el cual esto sucede. Los cuatro dominios pueden estar presentes en cuatro polipéptidos separados, que se encuentran principalmente en bacterias, o estar presentes en uno o dos polipéptidos de múltiples dominios . [10] Cuando los polipéptidos son un dominio, se les puede denominar un dominio completo, y cuando son dos dominios múltiples, se les puede denominar medio dominio. [9] Cada uno de los dominios T está formado por típicamente 10 hélices alfa que atraviesan la membrana, a través de las cuales la sustancia transportada puede atravesar la membrana plasmática . Además, la estructura de los dominios T determina la especificidad de cada proteína ABC. En la conformación orientada hacia adentro, el sitio de unión en el dominio A está abierto directamente a las soluciones acuosas circundantes. Esto permite que las moléculas hidrófilas entren en el sitio de unión directamente desde la valva interna de la bicapa de fosfolípidos . Además, se puede acceder a un espacio en la proteína directamente desde el núcleo hidrofóbico de la valva interna de la bicapa de membrana. Esto permite que las moléculas hidrófobas entren en el sitio de unión directamente desde la valva interna de la bicapa de fosfolípidos . Después de que el ATP se mueve hacia la conformación orientada hacia afuera, las moléculas se liberan del sitio de unión y se les permite escapar hacia la valva exoplásmica o directamente hacia el medio extracelular . [10]
La característica común de todos los transportadores ABC es que constan de dos dominios distintos, el dominio transmembrana (TMD) y el dominio de unión a nucleótidos (NBD) . El TMD, también conocido como dominio que abarca la membrana (MSD) o dominio integral de membrana (IM), consta de hélices alfa , incrustadas en la bicapa de la membrana. Reconoce una variedad de sustratos y sufre cambios conformacionales para transportar el sustrato a través de la membrana. La secuencia y arquitectura de los TMD es variable, lo que refleja la diversidad química de los sustratos que pueden translocarse. El dominio NBD o casete de unión a ATP (ABC), por otro lado, se encuentra en el citoplasma y tiene una secuencia altamente conservada. El NBD es el sitio de unión del ATP. [23] En la mayoría de los exportadores, el dominio transmembrana N-terminal y los dominios ABC C-terminal están fusionados como una única cadena polipeptídica, dispuesta como TMD-NBD-TMD-NBD. Un ejemplo es el exportador de hemolisina de E. coli HlyB. Los importadores tienen una organización invertida, es decir, NBD-TMD-NBD-TMD, donde el dominio ABC es N-terminal mientras que TMD es C-terminal, como en la proteína MacB de E. coli responsable de la resistencia a los macrólidos . [4] [5]
La arquitectura estructural de los transportadores ABC consta mínimamente de dos TMD y dos NBD. Cuatro cadenas polipeptídicas individuales, incluidas dos subunidades TMD y dos NBD, pueden combinarse para formar un transportador completo , como en el importador BtuCD [24] [25] de E. coli implicado en la absorción de vitamina B 12 . La mayoría de los exportadores, como en el exportador de múltiples fármacos Sav1866 [26] de Staphylococcus aureus , están formados por un homodímero que consta de dos mitades de transportadores o monómeros de un TMD fusionado a un dominio de unión a nucleótidos (NBD). A menudo se requiere un transportador completo para ganar funcionalidad. Algunos transportadores ABC tienen elementos adicionales que contribuyen a la función reguladora de esta clase de proteínas. En particular, los importadores tienen una proteína de unión (BP) de alta afinidad que se asocia específicamente con el sustrato en el periplasma para su entrega al transportador ABC apropiado. Los exportadores no tienen la proteína de unión, pero tienen un dominio intracelular (ICD) que une las hélices que atraviesan la membrana y el dominio ABC. Se cree que el ICD es responsable de la comunicación entre TMD y NBD. [23]
La mayoría de los transportadores tienen dominios transmembrana que constan de un total de 12 hélices α con 6 hélices α por monómero. Dado que los TMD son estructuralmente diversos, algunos transportadores tienen un número variable de hélices (entre seis y once). Los dominios TM se clasifican en tres conjuntos distintos de pliegues: pliegues importador ABC de tipo I , importador ABC de tipo II y pliegues exportadores ABC . La clasificación de los pliegues importadores se basa en una caracterización detallada de las secuencias. [23]
El pliegue importador ABC tipo I se observó originalmente en la subunidad ModB TM del transportador de molibdato . [27] Este pliegue diagnóstico también se puede encontrar en las subunidades MalF y MalG TM de MalFGK 2 [28] y en el transportador Met MetI. [29] En el transportador MetI, un conjunto mínimo de cinco hélices transmembrana constituye este pliegue, mientras que hay una hélice adicional presente tanto para ModB como para MalG. La organización común del pliegue es la topología "arriba-abajo" de las hélices TM2-5 que recubren la vía de translocación y la hélice TM1 envuelta alrededor de la superficie exterior orientada a la membrana y en contacto con las otras hélices TM.
El pliegue importador ABC de tipo II se observa en el dominio de hélice de veinte TM de BtuCD [24] y en Hi1471, [30] un transportador homólogo de Haemophilus influenzae . En BtuCD, el empaquetamiento de las hélices es complejo. El patrón notable es que la hélice TM2 se coloca a través del centro de la subunidad, donde está rodeada muy cerca por las otras hélices. Mientras tanto, las hélices TM5 y TM10 están ubicadas en la interfaz TMD. La región que abarca la membrana de los exportadores ABC está organizada en dos "alas" que se componen de hélices TM1 y TM2 de una subunidad y TM3-6 de la otra, en una disposición de dominio intercambiado. Un patrón destacado es que las hélices TM1-3 están relacionadas con TM4-6 mediante una rotación doble aproximada alrededor de un eje en el plano de la membrana. [23]
El pliegue exportador se observó originalmente en la estructura Sav1866. Contiene 12 hélices TM, 6 por monómero. [23]
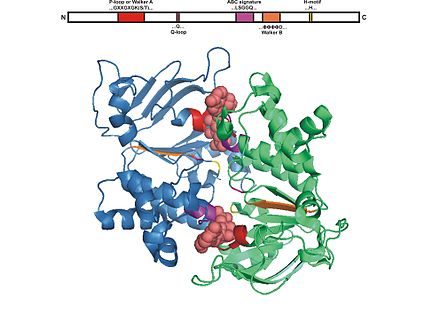
El dominio ABC consta de dos dominios, el dominio del núcleo catalítico similar a las ATPasas motoras tipo RecA y un subdominio de hélice α más pequeño y estructuralmente diverso que es exclusivo de los transportadores ABC. El dominio más grande normalmente consta de dos láminas β y seis hélices α, donde el motivo catalítico Walker A (GXXGXGKS/T donde X es cualquier aminoácido) o el bucle P y el motivo Walker B (ΦΦΦΦD, del cual Φ es un residuo hidrofóbico ) está situado. El dominio helicoidal consta de tres o cuatro hélices y el motivo característico ABC , también conocido como motivo LSGGQ , péptido conector o motivo C. El dominio ABC también tiene un residuo de glutamina que reside en un bucle flexible llamado bucle Q , tapa o interruptor de fosfato γ, que conecta el TMD y el ABC. Se supone que el bucle Q está involucrado en la interacción de NBD y TMD, particularmente en el acoplamiento de la hidrólisis de nucleótidos a los cambios conformacionales del TMD durante la translocación del sustrato. El motivo H o región de cambio contiene un residuo de histidina altamente conservado que también es importante en la interacción del dominio ABC con ATP. El nombre casete de unión a ATP se deriva de la disposición diagnóstica de los pliegues o motivos de esta clase de proteínas tras la formación del sándwich de ATP y la hidrólisis de ATP. [4] [15] [23]
La formación de dímeros de los dos dominios ABC de los transportadores requiere la unión de ATP. [31] Generalmente se observa que el estado unido a ATP está asociado con la interfaz más extensa entre los dominios ABC, mientras que las estructuras de los transportadores libres de nucleótidos exhiben conformaciones con mayores separaciones entre los dominios ABC. [23] Se han informado estructuras del estado unido a ATP de NBD aislados para importadores que incluyen HisP, [32] GlcV, [33] MJ1267, [34] E. coli MalK (EcMalK), [35] T. litoralis MalK ( TlMalK), [36] y exportadores como TAP, [37] HlyB, [38] MJ0796, [39] [40] Sav1866, [26] y MsbA. [41] En estos transportadores, el ATP está vinculado al dominio ABC. Dos moléculas de ATP están situadas en la interfaz del dímero, intercaladas entre el motivo Walker A de una subunidad y el motivo LSGGQ de la otra. [23] Esto se observó por primera vez en Rad50 [42] y se informó en estructuras de MJ0796, la subunidad NBD del transportador LolD de Methanococcus jannaschii [40] y EcMalK de un transportador de maltosa. [35] Estas estructuras también fueron consistentes con los resultados de estudios bioquímicos que revelan que el ATP está en estrecho contacto con residuos en el bucle P y el motivo LSGGQ durante la catálisis . [43]
La unión de nucleótidos es necesaria para garantizar la integridad electrostática y/o estructural del sitio activo y contribuir a la formación de un dímero NBD activo. [44] La unión de ATP se estabiliza mediante las siguientes interacciones: (1) interacción de apilamiento de anillos de un residuo aromático conservado que precede al motivo Walker A y el anillo de adenosina de ATP, [45] [46] (2) enlaces de hidrógeno entre un residuo de lisina conservado en el motivo Walker A y los átomos de oxígeno de los fosfatos β y γ de ATP y la coordinación de estos fosfatos y algunos residuos en el motivo Walker A con el ion Mg 2+ , [33] [37] y ( 3) Coordinación del γ-fosfato con la cadena lateral de los grupos serina y amida del esqueleto de los residuos de glicina en el motivo LSGGQ. [47] Además, un residuo que sugiere el estrecho acoplamiento de la unión y dimerización del ATP es la histidina conservada en el bucle H. Esta histidina contacta residuos a través de la interfaz del dímero en el motivo Walker A y el bucle D, una secuencia conservada que sigue al motivo Walker B. [35] [40] [42] [48]
La hidrólisis enzimática del ATP requiere la unión adecuada de los fosfatos y la colocación del γ-fosfato en el agua atacante. [23] En el sitio de unión de nucleótidos, los átomos de oxígeno de los fosfatos β y γ de ATP se estabilizan mediante residuos en el motivo Walker A [49] [50] y se coordinan con Mg 2+ . [23] Este ion Mg 2+ también se coordina con el residuo de aspartato terminal en el motivo Walker B a través del H 2 O atacante. [33] [34] [39] Una base general, que puede ser el residuo de glutamato adyacente al Walker Se encuentra el motivo B, [31] [40] [46] glutamina en el bucle Q, [30] [36] [40] o una histidina en la región de cambio que forma un enlace de hidrógeno con el γ-fosfato de ATP. para catalizar la tasa de hidrólisis de ATP promoviendo el ataque H 2 O. [35] [36] [40] [48] El mecanismo molecular preciso de la hidrólisis de ATP aún es controvertido. [4]
Los transportadores ABC son transportadores activos , es decir, utilizan energía en forma de trifosfato de adenosina (ATP) para translocar sustratos a través de las membranas celulares. Estas proteínas aprovechan la energía de la unión y/o hidrólisis del ATP para impulsar cambios conformacionales en el dominio transmembrana (TMD) y, en consecuencia, transportar moléculas. [51] Los importadores y exportadores de ABC tienen un mecanismo común para transportar sustratos. Son similares en sus estructuras. El modelo que describe los cambios conformacionales asociados con la unión del sustrato es el modelo de acceso alterno . En este modelo, el sitio de unión del sustrato alterna entre conformaciones orientadas hacia afuera y hacia adentro . Las afinidades de unión relativas de las dos conformaciones por el sustrato determinan en gran medida la dirección neta del transporte. Para los importadores, dado que la translocación se dirige desde el periplasma al citoplasma, la conformación orientada hacia afuera tiene una mayor afinidad de unión por el sustrato. Por el contrario, la afinidad de unión al sustrato en los exportadores es mayor en la conformación orientada hacia adentro. [23] Un modelo que describe los cambios conformacionales en el dominio de unión a nucleótidos (NBD) como resultado de la unión e hidrólisis del ATP es el modelo de cambio de ATP . Este modelo presenta dos conformaciones principales de los NBD: formación de un dímero cerrado al unirse dos moléculas de ATP y disociación a un dímero abierto facilitada por la hidrólisis del ATP y la liberación de fosfato inorgánico (P i ) y difosfato de adenosina (ADP). El cambio entre las conformaciones de dímero abierto y cerrado induce cambios conformacionales en el TMD que resultan en la translocación del sustrato. [52]
El mecanismo general del ciclo de transporte de los transportadores ABC no se ha dilucidado completamente, pero se han acumulado importantes datos estructurales y bioquímicos para respaldar un modelo en el que la unión y la hidrólisis del ATP se acoplan a cambios conformacionales en el transportador. El estado de reposo de todos los transportadores ABC tiene los NBD en una configuración de dímero abierto, con baja afinidad por el ATP. Esta conformación abierta posee una cámara accesible al interior del transportador. El ciclo de transporte se inicia mediante la unión del sustrato al sitio de alta afinidad de los TMD, lo que induce cambios conformacionales en los NBD y mejora la unión de ATP. Dos moléculas de ATP se unen cooperativamente para formar la configuración de dímero cerrado. El dímero NBD cerrado induce un cambio conformacional en los TMD de modo que el TMD se abre, formando una cámara con una apertura opuesta a la del estado inicial. La afinidad del sustrato por el TMD se reduce, liberando así el sustrato. Sigue la hidrólisis de ATP y luego la liberación secuencial de Pi y luego ADP restaura el transportador a su configuración basal. Aunque se ha sugerido un mecanismo común, todavía se debate el orden de unión del sustrato, unión e hidrólisis de nucleótidos y cambios conformacionales, así como las interacciones entre los dominios. [4] [15] [18] [23] [41] [44] [51] [52] [53] [54] [55]
Varios grupos que estudian los transportadores ABC tienen suposiciones diferentes sobre la fuerza impulsora de la función del transportador. Generalmente se supone que la hidrólisis del ATP proporciona el principal aporte de energía o "golpe de potencia" para el transporte y que los NBD operan alternativamente y posiblemente participan en diferentes pasos del ciclo de transporte. [56] Sin embargo, datos estructurales y bioquímicos recientes muestran que la unión de ATP, en lugar de la hidrólisis de ATP, proporciona el "golpe de potencia". [57] También puede ser que, dado que la unión de ATP desencadena la dimerización de NBD, la formación del dímero puede representar el "golpe de poder". Además, algunos transportadores tienen NBD que no tienen capacidades similares para unirse e hidrolizar ATP y el hecho de que la interfaz del dímero NBD consista en dos bolsas de unión de ATP sugiere una función concurrente de los dos NBD en el ciclo de transporte. [52]
Se informó alguna evidencia que demuestra que la unión de ATP es de hecho el golpe de fuerza del ciclo de transporte. [52] Se ha demostrado que la unión de ATP induce cambios en las propiedades de unión al sustrato de los TMD. La afinidad de los transportadores ABC por los sustratos ha sido difícil de medir directamente, y las mediciones indirectas, por ejemplo mediante la estimulación de la actividad ATPasa, a menudo reflejan otros pasos limitantes de la velocidad. Recientemente, la medición directa de la unión de vinblastina a la glicoproteína permeasa ( glicoproteína P ) en presencia de análogos de ATP no hidrolizables, por ejemplo, 5'-adenilil-β-γ-imidodifosfato (AMP-PNP), mostró que la unión de ATP, en ausencia de La hidrólisis es suficiente para reducir la afinidad de unión al sustrato. [58] Además, la unión de ATP induce cambios conformacionales sustanciales en los TMD. Los estudios espectroscópicos , de accesibilidad de proteasas y de reticulación han demostrado que la unión de ATP a los NBD induce cambios conformacionales en la proteína 1 asociada a resistencia a múltiples fármacos (MRP1), [59] HisPMQ, [60] LmrA, [61] y Pgp. [62] Las estructuras cristalinas bidimensionales de Pgp unida a AMP-PNP mostraron que el principal cambio conformacional durante el ciclo de transporte ocurre con la unión de ATP y que la hidrólisis posterior de ATP introduce cambios más limitados. [63] La rotación y la inclinación de las hélices α transmembrana pueden contribuir a estos cambios conformacionales. Otros estudios se han centrado en confirmar que la unión de ATP induce la formación de dímeros cerrados de NBD. Los estudios bioquímicos de complejos de transporte intactos sugieren que los cambios conformacionales en los NBD son relativamente pequeños. En ausencia de ATP, los NBD pueden ser relativamente flexibles, pero no implican una reorientación importante de los NBD con respecto a los otros dominios. La unión de ATP induce una rotación del cuerpo rígido de los dos subdominios ABC entre sí, lo que permite la alineación adecuada del nucleótido en el sitio activo y la interacción con los motivos designados. Existe fuerte evidencia bioquímica de que la unión de dos moléculas de ATP puede ser cooperativa, es decir, el ATP debe unirse a los dos sitios activos antes de que los NBD puedan dimerizarse y formar la conformación cerrada y catalíticamente activa. [52]
La mayoría de los transportadores ABC que median en la absorción de nutrientes y otras moléculas en las bacterias dependen de una proteína de unión a solutos (BP) de alta afinidad. Las BP son proteínas solubles ubicadas en el espacio periplásmico entre las membranas interna y externa de las bacterias gramnegativas . Los microorganismos grampositivos carecen de periplasma , por lo que su proteína de unión suele ser una lipoproteína unida a la cara externa de la membrana celular . Algunas bacterias grampositivas tienen BP fusionadas al dominio transmembrana del propio transportador. [4] La primera estructura cristalina de rayos X exitosa de un importador ABC intacto es el transportador de molibdeno (ModBC-A) de Archaeoglobus fulgidus . [27] Estructuras de resolución atómica de otros tres importadores bacterianos, E. coli BtuCD, [24] transportador de maltosa de E. coli (MalFGK 2 -E), [28] y el supuesto transportador de quelato metálico de Haemophilus influenzae , HI1470/1 , [30] también han sido determinados. Las estructuras proporcionaron imágenes detalladas de la interacción de los dominios transmembrana y ABC y revelaron dos conformaciones diferentes con una apertura en dos direcciones opuestas. Otra característica común de los importadores es que cada NBD está unido a un TMD principalmente a través de una hélice citoplasmática corta del TMD, la "hélice de acoplamiento". Esta porción del bucle EAA se acopla en una hendidura superficial formada entre los subdominios ABC helicoidal y tipo RecA y se encuentra aproximadamente paralela a la bicapa de membrana. [54]
El BtuCD y el HI1470/1 están clasificados como grandes importadores ABC (Tipo II). La subunidad transmembrana del importador de vitamina B 12 , BtuCD, contiene 10 hélices TM y la unidad funcional consta de dos copias de cada una del dominio de unión a nucleótidos (NBD) y del dominio transmembrana (TMD). El TMD y el NBD interactúan entre sí a través del bucle citoplasmático entre dos hélices TM y el bucle Q en el ABC. En ausencia de nucleótidos, los dos dominios ABC están plegados y la interfaz del dímero está abierta. Una comparación de las estructuras con (BtuCDF) y sin proteína de unión (BtuCD) revela que BtuCD tiene una abertura que mira hacia el periplasma, mientras que en BtuCDF, la conformación orientada hacia afuera está cerrada a ambos lados de la membrana. Las estructuras de BtuCD y el homólogo de BtuCD, HI1470/1, representan dos estados conformacionales diferentes de un transportador ABC. La vía de translocación prevista en BtuCD está abierta al periplasma y cerrada en el lado citoplasmático de la membrana, mientras que la de HI1470/1 mira en la dirección opuesta y se abre solo al citoplasma. La diferencia en las estructuras es un giro de 9° de una subunidad TM con respecto a la otra. [4] [23] [54]
Las estructuras de ModBC-A y MalFGK 2 -E, que están en complejo con su proteína de unión, corresponden a pequeños importadores de ABC (Tipo I). Los TMD de ModBC-A y MalFGK 2 -E tienen sólo seis hélices por subunidad. El homodímero de ModBC-A tiene una conformación en la que las subunidades TM (ModB) se orientan en forma de V invertida con una cavidad accesible al citoplasma. Las subunidades ABC (ModC), por otro lado, están dispuestas en una conformación abierta, libre de nucleótidos, en la que el bucle P de una subunidad se enfrenta pero está separado del motivo LSGGQ de la otra. La proteína de unión ModA tiene una conformación cerrada con un sustrato unido en una hendidura entre sus dos lóbulos y unido a los bucles extracelulares de ModB, donde el sustrato se encuentra directamente encima de la entrada cerrada del transportador. La estructura de MalFGK 2 -E se asemeja al estado de transición catalítico de la hidrólisis de ATP. Tiene una conformación cerrada donde contiene dos moléculas de ATP, intercaladas entre los motivos Walker A y B de una subunidad y el motivo LSGGQ de la otra subunidad. La proteína de unión a maltosa (MBP o MalE) está acoplada en el lado periplásmico de las subunidades TM (MalF y MalG) y se puede encontrar una cavidad grande y ocluida en la interfaz de MalF y MalG. La disposición de las hélices de TM tiene una conformación cerrada hacia el citoplasma pero con una abertura que mira hacia afuera. La estructura sugiere la posibilidad de que MBP pueda estimular la actividad ATPasa del transportador al unirse. [4] [23] [54]

El mecanismo de transporte para los importadores sustenta el modelo de acceso alterno. El estado de reposo de los importadores está orientado hacia adentro, donde los TMD mantienen abierta la interfaz del dímero del dominio de unión de nucleótidos (NBD) y mira hacia afuera pero ocluida del citoplasma. Al acoplarse la proteína de unión cerrada cargada de sustrato hacia el lado periplásmico de los dominios transmembrana, el ATP se une y el dímero NBD se cierra. Esto cambia el estado de reposo del transportador a una conformación orientada hacia afuera, en la que los TMD se han reorientado para recibir sustrato de la proteína de unión. Después de la hidrólisis del ATP, el dímero NBD se abre y el sustrato se libera al citoplasma. La liberación de ADP y Pi devuelve el transportador a su estado de reposo. La única inconsistencia de este mecanismo con el modelo de cambio de ATP es que la conformación en su estado de reposo, libre de nucleótidos, es diferente de la conformación esperada hacia afuera. Aunque ese es el caso, el punto clave es que el NBD no se dimeriza a menos que el ATP y la proteína de unión estén unidos al transportador. [4] [15] [23] [52] [54]
Los exportadores de ABC procarióticos son abundantes y tienen homólogos cercanos en eucariotas. Esta clase de transportadores se estudia en función del tipo de sustrato que se transporta. Una clase está implicada en la exportación de proteínas (p. ej. , toxinas , enzimas hidrolíticas , proteínas de la capa S, lantibióticos , bacteriocinas y factores de competencia) y la otra en la salida de fármacos. Los transportadores ABC han recibido mucha atención porque contribuyen a la resistencia de las células a los antibióticos y agentes anticancerígenos al bombear medicamentos fuera de las células. [1] [64] [4] Un mecanismo común es la sobreexpresión de exportadores ABC como la glicoproteína P (P-gp/ABCB1), la proteína 1 asociada a la resistencia a múltiples fármacos ( MRP1 / ABCC1 ) y la proteína de resistencia al cáncer de mama (BCRP/ ABCG2) en las células cancerosas que limitan la exposición a los medicamentos contra el cáncer. [sesenta y cinco]
En los organismos gramnegativos, los transportadores ABC median la secreción de sustratos proteicos a través de las membranas interna y externa simultáneamente sin atravesar el periplasma. Este tipo de secreción se conoce como secreción de tipo I , que involucra tres componentes que funcionan en conjunto: un exportador ABC , una proteína de fusión de membrana (MFP) y un factor de membrana externa (OMF) . Un ejemplo es la secreción de hemolisina (HlyA) de E. coli , donde el transportador ABC de la membrana interna, HlyB, interactúa con una proteína de fusión de la membrana interna, HlyD, y un facilitador de la membrana externa, TolC. TolC permite que la hemolisina se transporte a través de las dos membranas, sin pasar por el periplasma. [1] [64] [15]
La resistencia bacteriana a los medicamentos se ha convertido en un problema de salud cada vez más importante. Uno de los mecanismos de resistencia a los medicamentos está asociado con un aumento en la salida de antibióticos de la célula bacteriana. La resistencia a los medicamentos asociada con la salida de fármacos, mediada por la glicoproteína P , se informó originalmente en células de mamíferos. En bacterias, Levy y sus colegas presentaron la primera evidencia de que la resistencia a los antibióticos era causada por la salida activa de un fármaco. [66] La glicoproteína P es la bomba de eflujo mejor estudiada y, como tal, ha ofrecido importantes conocimientos sobre el mecanismo de las bombas bacterianas. [4] Aunque algunos exportadores transportan un tipo específico de sustrato, la mayoría de los transportadores extruyen una clase diversa de medicamentos con estructura variable. [18] Estos transportadores se denominan comúnmente transportadores ABC resistentes a múltiples fármacos (MDR) y, a veces, se denominan "aspiradoras hidrofóbicas". [55]
La glicoproteína P (3.A.1.201.1) es una proteína bien estudiada asociada con la resistencia a múltiples fármacos. Pertenece a la familia humana ABCB (MDR/TAP) y también se conoce como ABCB1 o MDR1 Pgp . MDR1 consta de un monómero funcional con dos dominios transmembrana (TMD) y dos dominios de unión a nucleótidos (NBD). Esta proteína puede transportar sustratos principalmente catiónicos o eléctricamente neutros, así como un amplio espectro de sustratos anfifílicos. La estructura del monómero ABCB1 de tamaño completo se obtuvo en presencia y ausencia de nucleótidos mediante criocristalografía electrónica . Sin el nucleótido, los TMD son aproximadamente paralelos y forman un barril que rodea un poro central, con la abertura orientada hacia el lado extracelular de la membrana y cerrada en la cara intracelular. En presencia del análogo de ATP no hidrolizable, AMP-PNP, los TMD tienen una reorganización sustancial con tres dominios claramente segregados. Un poro central, que está encerrado entre los TMD, está ligeramente abierto hacia la cara intracelular con un espacio entre dos dominios que permite el acceso del sustrato desde la fase lipídica. El reempaquetado sustancial y la posible rotación de las hélices de TM tras la unión de nucleótidos sugieren un modelo de rotación de hélice para el mecanismo de transporte. [18]
El genoma de la planta modelo Arabidopsis thaliana es capaz de codificar 120 proteínas ABC frente a las 50-70 proteínas ABC que codifican el genoma humano y la mosca de la fruta ( Drosophila melanogaster ). Las proteínas ABC de las plantas se clasifican en 13 subfamilias según su tamaño (completo, medio o cuarto), orientación y similitud general de la secuencia de aminoácidos. [67] Los homólogos resistentes a múltiples fármacos (MDR), también conocidos como glicoproteínas P, representan la subfamilia más grande de plantas con 22 miembros y la segunda subfamilia ABC más grande en general. La subfamilia B de transportadores ABC de plantas (ABCB) se caracteriza por su localización en la membrana plasmática. [68] Los transportadores ABCB de plantas se caracterizan por expresarlos de forma heteróloga en Escherichia coli , Saccharomyces cerevisiae , Schizosaccharomyces pombe (levadura de fisión) y células HeLa para determinar la especificidad del sustrato. Se ha demostrado que los transportadores ABCB de plantas transportan la fitohormona ácido indol-3-acético (IAA), [69] también conocida como auxina , el regulador esencial para el crecimiento y desarrollo de las plantas. [70] [71] El transporte polar direccional de auxina media las respuestas ambientales de las plantas a través de procesos como el fototropismo y el gravitropismo. [72] Dos de los transportadores de auxinas mejor estudiados, ABCB1 y ABCB19, se han caracterizado por ser exportadores primarios de auxinas [70] Otros transportadores ABCB, como ABCB4, participan tanto en la exportación como en la importación de auxinas [70] A bajas concentraciones de auxinas intracelulares ABCB4 importa auxina hasta que alcanza un cierto umbral que luego invierte la función para exportar solo auxina. [70] [73]
La primera estructura de alta resolución reportada para un exportador ABC fue la de Sav1866 (3.A.1.106.2) de Staphylococcus aureus . [18] [74] Sav1866 es un homólogo de los transportadores ABC de múltiples fármacos. Muestra una similitud de secuencia significativa con los transportadores ABC humanos de la subfamilia B que incluye MDR1 y TAP1/TAP2. Se sabe que la actividad ATPasa de Sav1866 es estimulada por fármacos contra el cáncer como la doxorrubicina , la vinblastina y otros, [75] lo que sugiere una especificidad de sustrato similar a la glicoproteína P y, por lo tanto, un posible mecanismo común de translocación de sustrato. Sav1866 es un homodímero de medios transportadores y cada subunidad contiene un TMD N-terminal con seis hélices y un NBD C-terminal. Los NBD son similares en estructura a los de otros transportadores ABC, en los que los dos sitios de unión de ATP se forman en la interfaz del dímero entre el motivo Walker A de un NBD y el motivo LSGGQ del otro. La estructura unida a ADP de Sav1866 muestra los NBD en un dímero cerrado y las hélices de TM divididas en dos "alas" orientadas hacia el periplasma, formando la conformación orientada hacia afuera. Cada ala consta de hélices TM1-2 de una subunidad y TM3-6 de la otra subunidad. Contiene largos bucles intracelulares (ICL o ICD) que conectan los TMD que se extienden más allá de la bicapa lipídica hacia el citoplasma e interactúan con el 8=D. Mientras que los importadores contienen una hélice de acoplamiento corta que contacta con un solo NBD, Sav1866 tiene dos hélices de acoplamiento intracelulares, una (ICL1) que contacta los NBD de ambas subunidades y la otra (ICL2) que interactúa solo con la subunidad opuesta de NBD. [23] [26] [54]
MsbA (3.A.1.106.1) es un transportador ABC resistente a múltiples fármacos (MDR) y posiblemente una flippasa lipídica . Es una ATPasa que transporta el lípido A , la fracción hidrofóbica del lipopolisacárido (LPS), un sacarolípido a base de glucosamina que forma la monocapa externa de las membranas externas de la mayoría de las bacterias gramnegativas. El lípido A es una endotoxina y, por lo tanto, la pérdida de MsbA de la membrana celular o las mutaciones que interrumpen el transporte dan como resultado la acumulación de lípido A en la membrana celular interna, lo que provoca la muerte celular. Es un homólogo bacteriano cercano de la glicoproteína P (Pgp) por homología de secuencia de proteínas y tiene especificidades de sustrato superpuestas con el transportador MDR-ABC LmrA de Lactococcus lactis . [76] MsbA de E. coli es 36% idéntico a la mitad NH2 - terminal del MDR1 humano, lo que sugiere un mecanismo común para el transporte de sustratos anfifáticos e hidrófobos. El gen MsbA codifica un medio transportador que contiene un dominio transmembrana (TMD) fusionado con un dominio de unión a nucleótidos (NBD). Está ensamblado como un homodímero con una masa molecular total de 129,2 kD. MsbA contiene 6 TMD en el lado periplásmico, un NBD ubicado en el lado citoplasmático de la membrana celular y un dominio intracelular (ICD), que une el TMD y el NBD. Esta hélice conservada que se extiende desde los segmentos TMD hacia el sitio activo del NBD o cerca de él es en gran medida responsable de la diafonía entre TMD y NBD. En particular, ICD1 sirve como un pivote conservado alrededor del cual el NBD puede girar, permitiendo así que el NBD se disocia y dimerice durante la unión e hidrólisis del ATP. [4] [15] [18] [23] [44] [54] [55] [77]

Las estructuras de rayos X de MsbA publicadas anteriormente (y ahora retractadas) eran inconsistentes con el homólogo bacteriano Sav1866. [78] [79] Las estructuras fueron reexaminadas y se encontró que tenían un error en la asignación de la mano que resultó en modelos incorrectos de MsbA. Recientemente, se han rectificado los errores y se han informado nuevas estructuras. [41] El estado de reposo de E. coli MsbA exhibe una forma de "V" invertida con una cámara accesible al interior del transportador, lo que sugiere una conformación abierta orientada hacia adentro . Los contactos del dímero se concentran entre los bucles extracelulares y, aunque los NBD están separados por ≈50 Å, las subunidades están una frente a la otra. La distancia entre los residuos en el sitio de la interfaz del dímero se ha verificado mediante experimentos de entrecruzamiento [80] y estudios de espectroscopía EPR . [81] La cámara relativamente grande le permite acomodar grandes grupos de cabezas como los presentes en el lípido A. Se requieren cambios conformacionales significativos para mover los grandes grupos de cabezas de azúcar a través de la membrana. La diferencia entre las dos estructuras libres de nucleótidos (apo) es el pivote de ≈30° de las hélices TM4/TM5 en relación con las hélices TM3/TM6. En el estado de apo cerrado (de V. cholerae MsbA), los NBD están alineados y, aunque más cerca, no han formado un sándwich de ATP, y los bucles P de los monómeros opuestos están colocados uno al lado del otro. En comparación con la conformación abierta, la interfaz dímera de los TMD en la conformación cerrada orientada hacia adentro tiene contactos extensos. Para ambas conformaciones apo de MsbA, la abertura de la cámara mira hacia adentro. La estructura de MsbA-AMP-PNP (5'-adenilil-β-γ-imidodifosfato), obtenida de S. typhimurium , es similar a Sav1866. Los NBD en esta conformación orientada hacia afuera y unida a nucleótidos , se unen para formar un sándwich de dímero de ATP canónico, es decir, el nucleótido está situado entre el bucle P y el motivo LSGGQ. La transición conformacional de MsbA-apo cerrado a MsbA-AMP-PNP implica dos pasos, que probablemente estén concertados: un pivote de ≈10° de las hélices TM4/TM5 hacia TM3/TM6, acercando los NBD pero no alineándolos, seguido de Inclinación de hélices TM4/TM5 ≈20° fuera del plano. El movimiento de torsión da como resultado la separación de las hélices TM3/TM6 de TM1/TM2, lo que lleva a un cambio de una conformación orientada hacia adentro a una orientada hacia afuera. Por lo tanto, los cambios tanto en la orientación como en el espaciado de los NBD reorganizan drásticamente el empaquetamiento de las hélices transmembrana y cambian efectivamente el acceso a la cámara desde la valva interna a la externa de la membrana. [41] Las estructuras determinadas para MsbA son la base para el modelo de transporte basculante. [18]Las estructuras descritas también resaltan la naturaleza dinámica de los exportadores de ABC, como también lo sugieren los estudios de fluorescencia y EPR. [54] [81] [82] Trabajos recientes han dado como resultado el descubrimiento de inhibidores de MsbA. [83] [84]

Los exportadores ABC tienen un mecanismo de transporte que es consistente tanto con el modelo de acceso alterno como con el modelo de cambio ATP. En los estados apo de los exportadores, la conformación está orientada hacia adentro y los TMD y NBD están relativamente separados para acomodar sustratos anfifílicos o hidrofóbicos. En particular, para MsbA, el tamaño de la cámara es lo suficientemente grande como para acomodar los grupos de azúcar de los lipopolisacáridos (LPS). Como han sugerido varios grupos, la unión del sustrato inicia el ciclo de transporte. El "golpe de potencia", es decir, la unión de ATP que induce la dimerización de NBD y la formación del sándwich de ATP, impulsa los cambios conformacionales en los TMD. En MsbA, los grupos de cabeza de azúcar están secuestrados dentro de la cámara durante el "golpe de potencia". La cavidad está revestida con residuos cargados y polares que probablemente estén solvatados creando un ambiente energéticamente desfavorable para sustratos hidrofóbicos y energéticamente favorable para restos polares en compuestos anfifílicos o grupos de azúcares de LPS. Dado que el lípido no puede permanecer estable durante mucho tiempo en el ambiente de la cámara, el lípido A y otras moléculas hidrofóbicas pueden "voltear" a una posición energéticamente más favorable dentro de la valva de la membrana externa. El "volteo" también puede ser impulsado por el corte del cuerpo rígido de los TMD mientras las colas hidrofóbicas del LPS son arrastradas a través de la bicapa lipídica. El reempaquetado de las hélices cambia la conformación a un estado orientado hacia afuera. La hidrólisis del ATP puede ampliar la abertura periplásmica y empujar el sustrato hacia la valva exterior de la bicapa lipídica. La hidrólisis de la segunda molécula de ATP y la liberación de Pi separan los NBD seguidos de la restauración del estado de reposo, abriendo la cámara hacia el citoplasma para otro ciclo. [41] [44] [52] [55] [78] [79] [81] [85]
Se sabe que los transportadores ABC desempeñan un papel crucial en el desarrollo de la resistencia a múltiples fármacos (MDR). En la MDR, los pacientes que toman medicamentos eventualmente desarrollan resistencia no solo al medicamento que están tomando sino también a varios tipos diferentes de medicamentos. Esto se debe a varios factores, uno de los cuales es el aumento de la expulsión del fármaco de la célula por los transportadores ABC. Por ejemplo, la proteína ABCB1 ( glicoproteína P ) funciona bombeando fármacos supresores de tumores fuera de la célula. Pgp, también llamado MDR1, ABCB1, es el prototipo de los transportadores ABC y también el gen más estudiado. Se sabe que Pgp transporta compuestos orgánicos catiónicos o neutros. También se ha demostrado que algunos miembros de la familia ABCC, también conocidos como MRP, confieren MDR a compuestos aniónicos orgánicos. El miembro más estudiado de la familia ABCG es ABCG2, también conocido como BCRP (proteína de resistencia al cáncer de mama) que confiere resistencia a la mayoría de los inhibidores de la topoisomerasa I o II, como topotecán, irinotecán y doxorrubicina.
No está claro exactamente cómo estas proteínas pueden translocar una variedad tan amplia de fármacos; sin embargo, un modelo (el modelo de aspiradora hidrófoba) afirma que, en la glicoproteína P, los fármacos se unen indiscriminadamente desde la fase lipídica en función de su hidrofobicidad.
El descubrimiento de la primera proteína transportadora ABC eucariota provino de estudios en células tumorales y células cultivadas que mostraban resistencia a varios fármacos con estructuras químicas no relacionadas. Se demostró que estas células expresan niveles elevados de proteína transportadora de resistencia a múltiples fármacos (MDR), que originalmente se llamaba glicoproteína P (P-gp), pero también se conoce como proteína 1 de resistencia a múltiples fármacos (MDR1) o ABCB1. Esta proteína utiliza la hidrólisis del ATP , al igual que el resto de transportadores ABC, para exportar una gran variedad de fármacos desde el citosol al medio extracelular. En las células resistentes a múltiples fármacos, el gen MDR1 suele estar amplificado. Esto da como resultado una gran sobreproducción de la proteína MDR1. Los sustratos de ABCB1 de mamíferos son principalmente moléculas planas solubles en lípidos con una o más cargas positivas. Todos estos sustratos compiten entre sí por el transporte, lo que sugiere que se unen a los mismos sitios o a sitios superpuestos de la proteína. Muchos de los fármacos transportados por ABCB1 son fármacos pequeños y no polares que se difunden a través del medio extracelular hacia el citosol, donde bloquean diversas funciones celulares. Fármacos como la colchicina y la vinblastina , que bloquean el ensamblaje de los microtúbulos, cruzan libremente la membrana hacia el citosol, pero la exportación de estos fármacos por ABCB1 reduce su concentración en la célula. Por lo tanto, se necesita una concentración más alta de fármacos para matar las células que expresan ABCB1 que aquellas que no expresan el gen. [10]
Otros transportadores ABC que contribuyen a la resistencia a múltiples fármacos son ABCC1 (MRP1) y ABCG2 (proteína de resistencia al cáncer de mama). [86]
Para resolver los problemas asociados con la resistencia a múltiples fármacos por parte de MDR1, se pueden utilizar diferentes tipos de fármacos o se deben inhibir los propios transportadores ABC. Para que otros tipos de fármacos funcionen, deben sortear el mecanismo de resistencia, que es el transportador ABC. Para hacer esto, se pueden utilizar otros medicamentos contra el cáncer, como los alquilantes ( ciclofosfamida ), los antimetabolitos ( 5-fluorouracilo ) y los medicamentos modificados con antraciclina ( anamicina y doxorrubicina -péptido). Estos fármacos no funcionarían como sustrato de los transportadores ABC y, por tanto, no serían transportados. La otra opción es utilizar una combinación de fármacos inhibidores de ABC y fármacos anticancerígenos al mismo tiempo. Esto revertiría la resistencia a los medicamentos contra el cáncer para que pudieran funcionar según lo previsto. Los sustratos que revierten la resistencia a los fármacos anticancerígenos se denominan quimiosensibilizadores. [8]
La resistencia a los medicamentos es un problema clínico común que ocurre en pacientes con enfermedades infecciosas y en pacientes con cáncer. Los microorganismos procarióticos y eucariotas , así como las células neoplásicas, suelen ser resistentes a los fármacos. MDR se asocia frecuentemente con la sobreexpresión de transportadores ABC. La inhibición de los transportadores ABC por compuestos de bajo peso molecular se ha investigado ampliamente en pacientes con cáncer; sin embargo, los resultados clínicos han sido decepcionantes. Recientemente, se han aplicado varias estrategias de ARNi para revertir la MDR en diferentes modelos tumorales y esta tecnología es eficaz para revertir la MDR mediada por el transportador ABC en células cancerosas y, por lo tanto, es una estrategia prometedora para superar la MDR mediante aplicaciones terapéuticas genéticas. La tecnología de ARNi también podría considerarse para superar la MDR en enfermedades infecciosas causadas por patógenos microbianos. [87]
Además de conferir MDR a las células tumorales, los transportadores ABC también se expresan en las membranas de las células sanas, donde facilitan el transporte de diversas sustancias endógenas, así como de sustancias extrañas al organismo. Por ejemplo, los transportadores ABC como Pgp, MRP y BCRP limitan la absorción de muchos fármacos en el intestino y bombean fármacos desde las células del hígado a la bilis [88] como medio para eliminar sustancias extrañas del cuerpo. Un gran número de drogas son transportadas por los propios transportadores ABC o afectan el transporte de otras drogas. Este último escenario puede dar lugar a interacciones entre fármacos , [89] que en ocasiones provocan efectos alterados de los fármacos. [90]
Existen varios tipos de ensayos que permiten la detección de interacciones del transportador ABC con compuestos endógenos y xenobióticos. [91] La complejidad del ensayo varía desde ensayos de membrana relativamente simples. [92] como el ensayo de transporte vesicular, el ensayo de ATPasa y ensayos basados en células más complejos hasta intrincados in vivo Jeffrey P, Summerfield SG (2007). "Desafíos para el cribado de la barrera hematoencefálica (BHE)". Xenobiótica . 37 (10–11): 1135–51. doi :10.1080/00498250701570285. PMID 17968740. S2CID 25944548.Metodologías de detección. [93]
El ensayo de transporte vesicular detecta la translocación de moléculas mediante transportadores ABC. [94] Las membranas preparadas en condiciones adecuadas contienen vesículas orientadas de adentro hacia afuera con el sitio de unión de ATP y el sitio de unión de sustrato del transportador mirando hacia el exterior del tampón. Los sustratos del transportador son absorbidos por las vesículas de forma dependiente del ATP. Se utiliza filtración rápida utilizando filtros de fibra de vidrio o membranas de nitrocelulosa para separar las vesículas de la solución de incubación y el compuesto de prueba atrapado dentro de las vesículas se retiene en el filtro. La cantidad de moléculas no marcadas transportadas se determina mediante HPLC, LC/MS, LC/MS/MS. Alternativamente, los compuestos están radiomarcados, son fluorescentes o tienen una etiqueta fluorescente de modo que se pueda cuantificar la radiactividad o fluorescencia retenida en el filtro.
En los estudios de transporte vesicular se utilizan varios tipos de membranas de diferentes fuentes (por ejemplo, células de insectos, líneas celulares de mamíferos transfectadas o seleccionadas). Las membranas están disponibles comercialmente o pueden prepararse a partir de diversas células o incluso tejidos, por ejemplo, membranas canaliculares del hígado. Este tipo de ensayo tiene la ventaja de medir la disposición real del sustrato a través de la membrana celular. Su desventaja es que los compuestos con permeabilidad pasiva media a alta no se retienen dentro de las vesículas, lo que dificulta la realización de mediciones de transporte directo con esta clase de compuestos.
El ensayo de transporte vesicular se puede realizar en un entorno "indirecto", donde los fármacos de prueba que interactúan modulan la velocidad de transporte de un compuesto informador. Este tipo de ensayo es particularmente adecuado para la detección de posibles interacciones entre fármacos e interacciones entre fármacos y sustratos endógenos. No es sensible a la permeabilidad pasiva de los compuestos y, por tanto, detecta todos los compuestos que interactúan. Sin embargo, no proporciona información sobre si el compuesto probado es un inhibidor del transportador o un sustrato del transportador que inhibe su función de manera competitiva. Un ejemplo típico de un ensayo de transporte vesicular indirecto es la detección de la inhibición del transporte de taurocolato por ABCB11 ( BSEP ).
Las células que expresan el transportador de eflujo bombean activamente sustratos fuera de la célula, lo que da como resultado una menor tasa de acumulación de sustrato, una menor concentración intracelular en estado estacionario o una tasa más rápida de eliminación de sustrato de las células cargadas con el sustrato. Los sustratos radiactivos transportados o los tintes fluorescentes marcados se pueden medir directamente o, en una configuración indirecta, se puede determinar la modulación de la acumulación de un sustrato sonda (por ejemplo, tintes fluorescentes como rodamina 123 o calceína) en presencia de un fármaco de prueba. [89]
Calceína-AM, un derivado altamente permeable de la calceína, penetra fácilmente en las células intactas, donde las esterasas endógenas lo hidrolizan rápidamente a la calceína fluorescente. A diferencia de la calceína-AM, la calceína tiene una baja permeabilidad y, por tanto, queda atrapada en la célula y se acumula. Como la calceína-AM es un excelente sustrato de los transportadores de eflujo MDR1 y MRP1, las células que expresan los transportadores MDR1 y/o MRP1 bombean la calceína-AM fuera de la célula antes de que las esterasas puedan hidrolizarla. Esto da como resultado una menor tasa de acumulación celular de calceína. Cuanto mayor es la actividad de MDR en la membrana celular, menos calceína se acumula en el citoplasma. En las células que expresan MDR, la adición de un inhibidor de MDR o un sustrato de MDR en exceso aumenta drásticamente la tasa de acumulación de calceína. La actividad del transportador multifármaco se refleja en la diferencia entre las cantidades de tinte acumuladas en presencia y ausencia de inhibidor. Utilizando inhibidores selectivos, se puede distinguir fácilmente la actividad de transporte de MDR1 y MRP1. Este ensayo se puede utilizar para detectar interacciones entre transportadores y también para cuantificar la actividad MDR de las células. El ensayo de calceína es un ensayo patentado de SOLVO Biotechnology.
Hay 49 transportadores ABC conocidos presentes en los humanos, que la Organización del Genoma Humano clasifica en siete familias.
Puede encontrar una lista completa de transportadores ABC humanos en. [95]
La subfamilia ABCA está compuesta por 12 transportadores completos divididos en dos subgrupos. El primer subgrupo consta de siete genes que se asignan a seis cromosomas diferentes . Estos son ABCA1 , ABCA2 , ABCA3 y ABCA4 , ABCA7 , ABCA12 y ABCA13 . El otro subgrupo está formado por ABCA5 y ABCA6 y ABCA8 , ABCA9 y ABCA10 . A8-10. Todo el subgrupo 2 está organizado en un grupo de cromosomas de cabeza a cola en el cromosoma 17q 24. Los genes de este segundo subgrupo se distinguen de los genes similares a ABCA1 por tener 37-38 exones en comparación con los 50 exones de ABCA1. El subgrupo ABCA1 está implicado en el desarrollo de enfermedades genéticas. En la enfermedad recesiva de Tánger, la proteína ABCA1 está mutada. Además, ABCA4 se asigna a una región del cromosoma 1p21 que contiene el gen de la enfermedad de Stargardt. Se encuentra que este gen está altamente expresado en los fotorreceptores de bastones y está mutado en la enfermedad de Stargardt, el pigmentismo de la retinitis recesiva y la mayoría de las distrofias recesivas de conos y bastones. [9]
La subfamilia ABCB está compuesta por cuatro transportadores completos y dos medios transportadores. Esta es la única subfamilia humana que tiene tipos de transportadores completos y medios. ABCB1 se descubrió como una proteína sobreexpresada en ciertas células tumorales resistentes a los medicamentos. Se expresa principalmente en la barrera hematoencefálica y en el hígado y se cree que participa en la protección de las células contra las toxinas. Las células que sobreexpresan esta proteína exhiben resistencia a múltiples fármacos . [9]
La subfamilia ABCC contiene trece miembros y nueve de estos transportadores se denominan proteínas de resistencia a múltiples fármacos (MRP). Las proteínas MRP se encuentran en toda la naturaleza y median en muchas funciones importantes. [96] Se sabe que participan en el transporte de iones, la secreción de toxinas y la transducción de señales. [9] De las nueve proteínas MRP, cuatro de ellas, MRP4, 5, 8, 9 (ABCC4, 5, 11 y 12), tienen una estructura ABC típica con cuatro dominios, que comprenden dos dominios que atraviesan la membrana, cada uno de los cuales abarca dominio seguido de un dominio de unión a nucleótidos. Estos se conocen como MRP cortos. Los 5 MRP restantes (MRP1, 2, 6, 7) (ABCC1, 2, 3, 6 y 10) se conocen como MRP largos y presentan un quinto dominio adicional en su extremo N. [96]
También se considera parte de esta subfamilia el CFTR , el transportador implicado en la enfermedad de la fibrosis quística . La fibrosis quística ocurre tras la mutación y la pérdida de la función de CFTR. [9]
También forman parte de esta familia de proteínas los receptores de sulfonilurea (SUR) , implicados en la secreción de insulina, la función neuronal y la función muscular. Las mutaciones en las proteínas SUR son una causa potencial de diabetes mellitus neonatal . SUR es también el sitio de unión de fármacos como las sulfonilureas y activadores de los abridores de los canales de potasio como el diazóxido .
La subfamilia ABCD consta de cuatro genes que codifican medios transportadores expresados exclusivamente en el peroxisoma . ABCD1 es responsable de la forma de adrenoleucodistrofia (ALD) ligada al cromosoma X, que es una enfermedad caracterizada por neurodegeneración y deficiencia suprarrenal que generalmente se inicia al final de la infancia. Las células de los pacientes con ALD presentan una acumulación de ácidos grasos saturados no ramificados, pero el papel exacto de ABCD1 en el proceso aún está indeterminado. Además, aún no se ha determinado la función de otros genes ABCD, pero se cree que ejercen funciones relacionadas en el metabolismo de los ácidos grasos . [9]
Ambos subgrupos están compuestos por genes que tienen dominios de unión a ATP que están estrechamente relacionados con otros transportadores ABC, pero estos genes no codifican dominios transmembrana. ABCE consta de un solo miembro, OABP o ABCE1 , que se sabe que reconoce ciertos oligodendrocitos producidos en respuesta a ciertas infecciones virales. Cada miembro del subgrupo ABCF consta de un par de dominios de unión a ATP. [9]
Seis medios transportadores con sitios de unión de ATP en el extremo N y dominios transmembrana en el extremo C forman la subfamilia ABCG. Esta orientación es opuesta a todos los demás genes ABC. Sólo hay cinco genes ABCG en el genoma humano, pero hay 15 en el genoma de Drosophila y 10 en la levadura. El gen ABCG2 se descubrió en líneas celulares seleccionadas por su alto nivel de resistencia a la mitoxantrona y sin expresión de ABCB1 o ABCC1 . ABCG2 puede exportar fármacos anticancerígenos antraciclina , así como topotecán , mitoxantrona o doxorrubicina como sustratos. Se ha descubierto que las translocaciones cromosómicas causan la amplificación o reordenamiento de ABCG2 que se encuentra en líneas celulares resistentes. [9]
En la TCDB se ha construido el siguiente sistema de clasificación para transportadores transmembrana de solutos. [97]
Tres familias de exportadores ABC se definen por sus orígenes evolutivos. [6] Los exportadores ABC1 evolucionaron por triplicación intragénica de un precursor de 2 TMS (TMS = segmento transmembrana. Una proteína "2 TMS" tiene 2 segmentos transmembrana) para dar 6 proteínas TMS. Los exportadores ABC2 evolucionaron por duplicación intragénica de un precursor de 3 TMS, y los exportadores de ABC3 evolucionaron a partir de un precursor de 4 TMS que se duplicó extragénicamente para dar dos proteínas 4 TMS, ambas necesarias para la función de transporte, o intragénicamente para dar 8 o 10 proteínas TMS. Las 10 proteínas TMS parecen tener dos TMS adicionales entre las dos unidades repetitivas de 4 TMS. [98] La mayoría de los sistemas de absorción (todos excepto 3.A.1.21) son del tipo ABC2, divididos en tipo I y tipo II por la forma en que manejan los nucleótidos. Una subfamilia especial de importadores ABC2 llamada ECF utiliza una subunidad separada para el reconocimiento de sustratos. [99]
ABC1 ( InterPro : IPR036640 ):
ABC2 ( InterPro : IPR000412 [parcial]):
ABC3 ( InterPro : IPR003838 ):
Ver Proteínas pertenecientes a la Superfamilia ABC: aquí
En los últimos años se han producido muchas estructuras de dominios solubles en agua de proteínas ABC. [2]