Un producto natural es un compuesto o sustancia natural producida por un organismo vivo, es decir, que se encuentra en la naturaleza . [2] [3] En el sentido más amplio, los productos naturales incluyen cualquier sustancia producida por la vida. [4] [5] Los productos naturales también se pueden preparar mediante síntesis química (tanto semisíntesis como síntesis total ) y han desempeñado un papel central en el desarrollo del campo de la química orgánica al proporcionar objetivos sintéticos desafiantes. El término producto natural también se ha extendido con fines comerciales para referirse a cosméticos , suplementos dietéticos y alimentos producidos a partir de fuentes naturales sin ingredientes artificiales añadidos. [6]
Dentro del campo de la química orgánica, la definición de productos naturales suele restringirse a compuestos orgánicos aislados de fuentes naturales que se producen por las vías del metabolismo primario o secundario . [7] Dentro del campo de la química medicinal , la definición suele restringirse aún más a los metabolitos secundarios. [8] [9] Los metabolitos secundarios (o metabolitos especializados) no son esenciales para la supervivencia, pero sin embargo proporcionan a los organismos que los producen una ventaja evolutiva. [10] Muchos metabolitos secundarios son citotóxicos y han sido seleccionados y optimizados a través de la evolución para su uso como agentes de "guerra química" contra presas, depredadores y organismos competidores. [11] Los metabolitos secundarios o especializados suelen ser exclusivos de especies específicas, mientras que los metabolitos primarios se encuentran comúnmente en múltiples reinos. Los metabolitos secundarios se caracterizan por su complejidad química, por lo que son de gran interés para los químicos.
Las fuentes naturales pueden conducir a la investigación básica sobre posibles componentes bioactivos para el desarrollo comercial como compuestos principales en el descubrimiento de fármacos . [12] Aunque los productos naturales han inspirado numerosos fármacos, el desarrollo de fármacos a partir de fuentes naturales ha recibido una atención decreciente en el siglo XXI por parte de las empresas farmacéuticas, en parte debido al acceso y suministro poco fiables, la propiedad intelectual, los problemas de costes y beneficios , la variabilidad estacional o ambiental de la composición y la pérdida de fuentes debido al aumento de las tasas de extinción . [12] A pesar de ello, los productos naturales y sus derivados todavía representaron alrededor del 10% de las aprobaciones de nuevos fármacos entre 2017 y 2019. [13]
La definición más amplia de producto natural es todo lo que es producido por la vida, [4] [14] e incluye materiales bióticos (por ejemplo, madera, seda), materiales de origen biológico (por ejemplo, bioplásticos , almidón de maíz), fluidos corporales (por ejemplo, leche, exudados de plantas) y otros materiales naturales (por ejemplo, suelo, carbón).
Los productos naturales pueden clasificarse según su función biológica, vía biosintética o fuente. Según la fuente, el número de moléculas conocidas de productos naturales oscila entre 300.000 [15] [16] y 400.000 [17] .
Siguiendo la propuesta original de Albrecht Kossel en 1891, [18] los productos naturales suelen dividirse en dos clases principales, los metabolitos primarios y secundarios. [19] [20] Los metabolitos primarios tienen una función intrínseca que es esencial para la supervivencia del organismo que los produce. Los metabolitos secundarios, en cambio, tienen una función extrínseca que afecta principalmente a otros organismos. Los metabolitos secundarios no son esenciales para la supervivencia, pero sí aumentan la competitividad del organismo dentro de su entorno. Por ejemplo, los alcaloides como la morfina y la nicotina actúan como sustancias químicas de defensa contra los herbívoros, mientras que los flavonoides atraen a los polinizadores y los terpenos como el mentol sirven para repeler insectos. Debido a su capacidad para modular las vías bioquímicas y de transducción de señales , algunos metabolitos secundarios tienen propiedades medicinales útiles. [21]
Los productos naturales, especialmente en el campo de la química orgánica , a menudo se definen como metabolitos primarios y secundarios. [8] [9] Una definición más restrictiva que limita los productos naturales a los metabolitos secundarios se utiliza comúnmente en los campos de la química médica y la farmacognosia . [14]

Los metabolitos primarios, según la definición de Kossel , son componentes esenciales de las vías metabólicas básicas necesarias para la vida. Están asociados con funciones celulares fundamentales como la asimilación de nutrientes, la producción de energía y el crecimiento y el desarrollo. Estos metabolitos tienen una amplia distribución en muchos filos y a menudo abarcan más de un reino . Los metabolitos primarios incluyen los componentes básicos de la vida: carbohidratos , lípidos , aminoácidos y ácidos nucleicos . [22]
Los metabolitos primarios que intervienen en la producción de energía incluyen enzimas esenciales para los procesos respiratorios y fotosintéticos . Estas enzimas están compuestas de aminoácidos y a menudo requieren cofactores no peptídicos para su correcto funcionamiento. [23] Las estructuras básicas de las células y los organismos también se construyen a partir de metabolitos primarios, incluidos componentes como las membranas celulares (p. ej., fosfolípidos ), las paredes celulares (p. ej., peptidoglicano , quitina ) y los citoesqueletos (proteínas). [24]
Los cofactores enzimáticos que son metabolitos primarios incluyen varios miembros de la familia de la vitamina B. Por ejemplo, la vitamina B1 (difosfato de tiamina) funciona como coenzima para enzimas como la piruvato deshidrogenasa , la 2-oxoglutarato deshidrogenasa y la transcetolasa , todas las cuales están involucradas en el metabolismo de los carbohidratos. La vitamina B2 (riboflavina) es un precursor de FMN y FAD , esencial para numerosas reacciones redox. La vitamina B3 (ácido nicotínico o niacina), sintetizada a partir del triptófano, es un componente clave de las coenzimas NAD + y NADP + , que son necesarias para el transporte de electrones en el ciclo de Krebs , la fosforilación oxidativa y otras reacciones redox. La vitamina B5 (ácido pantoténico) forma parte de la coenzima A , que es fundamental para el metabolismo de los carbohidratos y aminoácidos y la biosíntesis de ácidos grasos. La vitamina B6 (piridoxol, piridoxal y piridoxamina), como piridoxal 5'-fosfato, actúa como cofactor de las enzimas, en particular las transaminasas, implicadas en el metabolismo de los aminoácidos. La vitamina B12 (cobalaminas) contiene un anillo de corrina , similar a la porfirina , y actúa como coenzima para el catabolismo de los ácidos grasos y la biosíntesis de la metionina . [25] : Cap. 2
Otras vitaminas metabolitas primarias incluyen el retinol (vitamina A), [25] : 304–305 sintetizado en animales a partir de carotenoides derivados de plantas a través de la vía del mevalonato , y el ácido ascórbico (vitamina C), [25] : 492–493 que se sintetiza a partir de glucosa en el hígado de los animales, aunque no en los humanos.
El ADN y el ARN , que almacenan y transmiten información genética , se sintetizan a partir de metabolitos primarios, específicamente ácidos nucleicos y carbohidratos. [23]
Los primeros mensajeros son moléculas de señalización que regulan el metabolismo y la diferenciación celular . Entre ellos se encuentran las hormonas y los factores de crecimiento compuestos por péptidos, aminas biógenas , hormonas esteroides , auxinas y giberelinas . Estos primeros mensajeros interactúan con los receptores celulares, que están basados en proteínas, y desencadenan la activación de segundos mensajeros para transmitir la señal extracelular a los objetivos intracelulares. Los segundos mensajeros suelen incluir metabolitos primarios como los nucleótidos cíclicos y el diacilglicerol . [26]

Los metabolitos secundarios, a diferencia de los primarios, son prescindibles y no son absolutamente necesarios para la supervivencia. Además, los metabolitos secundarios suelen tener una distribución limitada entre especies. [27]
Los metabolitos secundarios tienen una amplia gama de funciones. Estas incluyen feromonas que actúan como moléculas de señalización social con otros individuos de la misma especie, moléculas de comunicación que atraen y activan organismos simbióticos , agentes que solubilizan y transportan nutrientes ( sideróforos , etc.) y armas competitivas ( repelentes , venenos , toxinas , etc.) que se utilizan contra competidores, presas y depredadores. [28] Para muchos otros metabolitos secundarios, la función es desconocida. Una hipótesis es que confieren una ventaja competitiva al organismo que los produce. [29] Una visión alternativa es que, en analogía con el sistema inmunológico , estos metabolitos secundarios no tienen una función específica, pero tener la maquinaria en su lugar para producir estas diversas estructuras químicas es importante y, por lo tanto, se producen y seleccionan unos pocos metabolitos secundarios. [30]
Las clases estructurales generales de metabolitos secundarios incluyen alcaloides , fenilpropanoides , policétidos y terpenoides . [7]

A continuación se describen las vías biosintéticas que conducen a las principales clases de productos naturales. [14] [25] : Cap. 2
Los carbohidratos son moléculas orgánicas esenciales para el almacenamiento de energía, el soporte estructural y diversos procesos biológicos en los organismos vivos. Se producen mediante la fotosíntesis en las plantas o la gluconeogénesis en los animales y pueden convertirse en polisacáridos más grandes :
Los carbohidratos son una fuente de energía primaria para la mayoría de las formas de vida. Además, los polisacáridos derivados de azúcares más simples son componentes estructurales vitales que forman las paredes celulares de las bacterias [31] y las plantas. [32] [33]
Durante la fotosíntesis, las plantas producen inicialmente 3-fosfogliceraldehído , una triosa de tres carbonos . [25] : Cap. 8 Esto se puede convertir en glucosa (un azúcar de seis carbonos) o varias pentosas (azúcares de cinco carbonos) a través del ciclo de Calvin . En los animales, los precursores de tres carbonos como el lactato o el glicerol se convierten en piruvato , que luego se puede sintetizar en carbohidratos en el hígado. [34]
Los ácidos grasos y los policétidos se sintetizan a través de la vía del acetato , que comienza a partir de bloques de construcción básicos derivados de los azúcares:
Durante la glucólisis , los azúcares se descomponen en acetil-CoA . En una reacción enzimática dependiente de ATP, el acetil-CoA se carboxila para formar malonil-CoA . Luego, el acetil-CoA y el malonil-CoA experimentan una condensación de Claisen , liberando dióxido de carbono para formar acetoacetil-CoA . Las reacciones de condensación adicionales generan cadenas poli-β-ceto, que posteriormente se convierten en varios policétidos. [25] : Cap. 3 La clase de policétidos de productos naturales tiene diversas estructuras y funciones [35] e incluye compuestos importantes como los antibióticos macrólidos . [36]
En la producción de ácidos grasos , una molécula de acetil-CoA (la "unidad de inicio") y varias moléculas de malonil-CoA (las "unidades extensoras") son condensadas por la sintasa de ácidos grasos . [25] : Cap. 3 Los ácidos grasos son componentes esenciales de las bicapas lipídicas que forman las membranas celulares [37] y sirven como almacenamiento de energía en forma de grasa en los animales. [38]
La vía del shikimato es una ruta metabólica clave responsable de la producción de aminoácidos aromáticos y sus derivados en plantas, hongos, bacterias y algunos protozoos:
La vía del shikimato conduce a la biosíntesis de aminoácidos aromáticos (AAA): fenilalanina , tirosina y triptófano . [39] [40] Esta vía es vital ya que conecta el metabolismo primario con procesos metabólicos especializados, dirigiendo aproximadamente entre el 20 y el 50 % de todo el carbono fijado a través de sus reacciones. [39] [41] Comienza con la condensación de fosfoenolpiruvato (PEP) y eritrosa-4-fosfato (E4P), que conduce a través de varios pasos enzimáticos para formar corismato , el precursor de los tres AAA. [40] [42]
A partir del corismato, la biosíntesis se ramifica para producir los AAA individuales. En las plantas, a diferencia de lo que ocurre en las bacterias, la producción de fenilalanina y tirosina ocurre típicamente a través del intermediario arogenato . [42] La fenilalanina sirve como punto de partida para la vía de los fenilpropanoides , que conduce a una variedad diversa de metabolitos secundarios. [42]
Más allá de la síntesis de proteínas, los AAA y sus derivados tienen papeles cruciales en la fisiología de las plantas, incluyendo la producción de pigmentos, la síntesis de hormonas, la formación de la pared celular y la defensa contra diversos tipos de estrés. [39] [40] Debido a que los animales no pueden sintetizar estos aminoácidos, la vía del shikimato también se ha convertido en un objetivo para los herbicidas, en particular el glifosato, que inhibe una de las enzimas clave en esta vía. [39] [41]
La biosíntesis de terpenoides y esteroides involucra dos vías principales, que producen componentes básicos esenciales para estos compuestos:
Las vías del mevalonato (MVA) y del fosfato de metileritritol (MEP) producen las unidades de cinco carbonos difosfato de isopentenilo (IPP) y difosfato de dimetilalilo (DMAPP), que son los componentes básicos de todos los terpenoides. [43] [44]
La vía MVA, descubierta en la década de 1950, funciona en eucariotas, algunas bacterias y plantas. Convierte acetil-CoA en IPP a través de HMG-CoA y mevalonato, y es esencial para la biosíntesis de esteroides. Las estatinas, que reducen el colesterol, funcionan inhibiendo la HMG-CoA reductasa en esta vía. [43] [44] La vía MEP, que se encuentra en bacterias, algunos parásitos y cloroplastos de plantas, comienza con piruvato y gliceraldehído 3-fosfato para producir IPP y DMAPP. Esta vía es crucial para la síntesis de terpenoides plastídicos como carotenoides y clorofilas. [45] [46] Ambas vías convergen en IPP y DMAPP, que se combinan para formar difosfatos de prenilo más largos como geranilo (C10), farnesilo (C15) y geranilgeranilo (C20). [43] Estos compuestos sirven como precursores de una amplia gama de terpenoides, incluidos monoterpenos, sesquiterpenos y triterpenos. [44]
La diversidad de terpenoides surge de modificaciones como la ciclización , oxidación y glicosilación , lo que les permite desempeñar funciones en la defensa de las plantas, la atracción de polinizadores y la señalización. [47] Los esteroides, sintetizados principalmente a través de la vía MVA, se derivan del farnesil difosfato a través de intermediarios como el escualeno y el lanosterol , que son precursores del colesterol y otras moléculas esteroides. [44]
Los alcaloides son compuestos orgánicos que contienen nitrógeno y que las plantas producen a través de complejas vías biosintéticas, a partir de aminoácidos. La biosíntesis de alcaloides a partir de aminoácidos es esencial para producir muchos compuestos biológicamente activos en las plantas. Estos compuestos van desde aminas cicloalifáticas simples hasta heterociclos nitrogenados policíclicos complejos . [48]
La biosíntesis de alcaloides generalmente sigue cuatro pasos clave: (i) síntesis de un precursor de amina , (ii) síntesis de un precursor de aldehído , (iii) formación de un catión iminio y (iv) una reacción similar a la de Mannich . Estos pasos forman la estructura central de muchos alcaloides y representan los pasos iniciales comprometidos en su producción. [49] Los aminoácidos como el triptófano , la tirosina , la lisina , la arginina y la ornitina sirven como precursores esenciales. Su acumulación se facilita mediante mecanismos como el aumento de la expresión génica, la duplicación génica o la evolución de enzimas con especificidades de sustrato más amplias. [49]
Una reacción clave en la biosíntesis de alcaloides es la reacción de Pictet-Spengler , que es crucial para la formación de la estructura β-carbolina presente en muchos alcaloides. Esta reacción implica la condensación de un aldehído con una amina, como se observa en la biosíntesis de la estrictosidina, un precursor de numerosos alcaloides indólicos monoterpénicos. [50]
Las oxidorreductasas , incluidas las del citocromo P450 y las monooxigenasas que contienen flavina , desempeñan un papel vital en la modificación de las estructuras centrales de los alcaloides a través de la oxidación, lo que contribuye a su diversidad estructural y bioactividad. Por ejemplo, en la biosíntesis de la morfina , el acoplamiento oxidativo es esencial para formar las complejas estructuras policíclicas típicas de estos alcaloides. [48] Las vías biosintéticas de los alcaloides implican numerosos pasos enzimáticos. Por ejemplo, los alcaloides tropanos , derivados de la ornitina, experimentan procesos como la descarboxilación , la oxidación y la ciclización. De manera similar, la biosíntesis de los alcaloides de isoquinolina a partir de la tirosina implica transformaciones complejas, incluida la formación de (S)-reticulina , un intermediario clave en la vía. [48]
La biosíntesis de péptidos, proteínas y otros derivados de aminoácidos ensambla los aminoácidos en moléculas biológicamente activas, produciendo compuestos como hormonas peptídicas, péptidos modificados y sustancias derivadas de plantas. [25] : Cap. 8
Los péptidos y las proteínas se sintetizan mediante la síntesis o traducción de proteínas , un proceso que implica la transcripción del ADN en ARN mensajero (ARNm). El ARNm sirve como plantilla para el ensamblaje de proteínas en los ribosomas . Durante la traducción, el ARN de transferencia (ARNt) transporta aminoácidos específicos para que coincidan con los codones del ARNm, formando enlaces peptídicos para crear la cadena de proteínas.
Las hormonas peptídicas , como la oxitocina y la vasopresina , son cadenas cortas de aminoácidos que regulan procesos fisiológicos, incluidos los vínculos sociales y la retención de agua. [51] Los péptidos modificados incluyen antibióticos como las penicilinas y las cefalosporinas , que se caracterizan por su estructura de anillo de β-lactama, que es esencial para su actividad antibacteriana. [52] Estos compuestos experimentan modificaciones enzimáticas complejas durante la biosíntesis. [53]
Los glucósidos cianogénicos son derivados de aminoácidos de las plantas que pueden liberar cianuro de hidrógeno cuando los tejidos están dañados, sirviendo como mecanismo de defensa. [54] Su biosíntesis implica la conversión de aminoácidos en cianhidrinas, que luego se glicosilan. [55] Los glucosinolatos son compuestos que contienen azufre en vegetales crucíferos como el brócoli y la mostaza . Su biosíntesis comienza con aminoácidos como la metionina o el triptófano e implica agregar grupos de azufre y glucosa. [56] Cuando los tejidos están dañados, los glucosinolatos se descomponen en isotiocianatos, que contribuyen a los sabores picantes de estos vegetales y ofrecen posibles beneficios para la salud. [56]
Los productos naturales pueden extraerse de las células , tejidos y secreciones de microorganismos , plantas y animales. [57] [58] Un extracto crudo ( no fraccionado ) de cualquiera de estas fuentes contendrá una gama de compuestos químicos estructuralmente diversos y a menudo novedosos. La diversidad química en la naturaleza se basa en la diversidad biológica, por lo que los investigadores recogen muestras de todo el mundo para analizarlas y evaluarlas en pruebas de descubrimiento de fármacos o bioensayos . Este esfuerzo por buscar productos naturales biológicamente activos se conoce como bioprospección . [57] [58]
La farmacognosia proporciona las herramientas para detectar, aislar e identificar productos naturales bioactivos que podrían desarrollarse para uso medicinal. Cuando se aísla un "principio activo" de una medicina tradicional u otro material biológico, esto se conoce como un "éxito". Luego se realiza un trabajo científico y legal posterior para validar el éxito (por ejemplo, la elucidación del mecanismo de acción , la confirmación de que no hay ningún conflicto de propiedad intelectual). A esto le sigue la etapa de descubrimiento de fármacos, en la que se producen derivados del compuesto activo en un intento de mejorar su potencia y seguridad . [59] [60] De esta y otras formas relacionadas, los medicamentos modernos pueden desarrollarse directamente a partir de fuentes naturales. [61]
Aunque las medicinas tradicionales y otros materiales biológicos se consideran una excelente fuente de compuestos novedosos, la extracción y el aislamiento de estos compuestos puede ser un proceso lento, costoso e ineficiente. Por lo tanto, para la fabricación a gran escala, se pueden hacer intentos para producir el nuevo compuesto mediante síntesis total o semisíntesis. [62] Debido a que los productos naturales son generalmente metabolitos secundarios con estructuras químicas complejas , su síntesis total o semisíntesis no siempre es comercialmente viable. En estos casos, se pueden hacer esfuerzos para diseñar análogos más simples con potencia y seguridad comparables que sean susceptibles de síntesis total o semisíntesis. [63]

El descubrimiento fortuito y el posterior éxito clínico de la penicilina impulsaron una búsqueda a gran escala de otros microorganismos ambientales que pudieran producir productos naturales antiinfecciosos. Se recogieron muestras de suelo y agua de todo el mundo, lo que condujo al descubrimiento de la estreptomicina (derivada de Streptomyces griseus ) y a la comprensión de que las bacterias, no solo los hongos, representan una fuente importante de productos naturales farmacológicamente activos. [65] Esto, a su vez, condujo al desarrollo de un impresionante arsenal de agentes antibacterianos y antifúngicos, entre ellos la anfotericina B , el cloranfenicol , la daptomicina y la tetraciclina (de Streptomyces spp. ), [66] las polimixinas (de Paenibacillus polymyxa ), [67] y las rifamicinas (de Amycolatopsis rifamycinica ). [68] De manera similar, se han derivado fármacos antiparasitarios y antivirales a partir de metabolitos bacterianos. [69]
Aunque la mayoría de los fármacos derivados de bacterias se emplean como antiinfecciosos, algunos han encontrado uso en otros campos de la medicina. La toxina botulínica (de Clostridium botulinum ) y la bleomicina (de Streptomyces verticillus ) son dos ejemplos. La toxina botulínica, la neurotoxina responsable del botulismo , se puede inyectar en músculos específicos (como los que controlan el párpado) para prevenir el espasmo muscular . [64] Además, el glicopéptido bleomicina se utiliza para el tratamiento de varios tipos de cáncer, incluido el linfoma de Hodgkin , el cáncer de cabeza y cuello y el cáncer testicular . [70] Las tendencias más nuevas en el campo incluyen el perfil metabólico y el aislamiento de productos naturales de nuevas especies bacterianas presentes en entornos poco explorados. Los ejemplos incluyen simbiontes o endófitos de entornos tropicales, [71] bacterias subterráneas que se encuentran en las profundidades de la tierra a través de la minería/perforación, [72] [73] y bacterias marinas . [74]
Debido a que muchas Archaea se han adaptado a la vida en ambientes extremos como regiones polares , aguas termales , manantiales ácidos, manantiales alcalinos, lagos salados y la alta presión del agua de los océanos profundos , poseen enzimas que son funcionales en condiciones bastante inusuales. Estas enzimas son de uso potencial en las industrias alimentaria , química y farmacéutica , donde los procesos biotecnológicos frecuentemente involucran altas temperaturas, extremos de pH, altas concentraciones de sal y/o alta presión. Los ejemplos de enzimas identificadas hasta la fecha incluyen amilasas , pululanasas , ciclodextrina glicosiltransferasas , celulasas , xilanasas , quitinasas , proteasas , alcohol deshidrogenasa y esterasas . [75] Archaea también representa una fuente de nuevos compuestos químicos , por ejemplo, éteres de isoprenil glicerol 1 y 2 de Thermococcus S557 y Methanocaldococcus jannaschii , respectivamente. [76]

Varios medicamentos antiinfecciosos se han derivado de hongos, incluyendo la penicilina y las cefalosporinas (medicamentos antibacterianos de Penicillium rubens y Cephalosporium acremonium , respectivamente) [77] [65] y la griseofulvina (un fármaco antimicótico de Penicillium griseofulvum ). [78] Otros metabolitos fúngicos medicinalmente útiles incluyen la lovastatina (de Pleurotus ostreatus ), que se convirtió en el líder de una serie de medicamentos que reducen los niveles de colesterol , la ciclosporina (de Tolypocladium inflatum ), que se utiliza para suprimir la respuesta inmune después de las operaciones de trasplante de órganos , y la ergometrina (de Claviceps spp.), que actúa como vasoconstrictor y se utiliza para prevenir el sangrado después del parto. [25] : Cap. 6 La asperlicina (de Aspergillus alliaceus ) es otro ejemplo. La asperlicina es un nuevo antagonista de la colecistoquinina , un neurotransmisor que se cree que está involucrado en los ataques de pánico , y podría usarse potencialmente para tratar la ansiedad . [79]

Las plantas son una fuente importante de compuestos químicos complejos y estructuralmente muy diversos ( fitoquímicos ), esta diversidad estructural se atribuye en parte a la selección natural de organismos que producen compuestos potentes para disuadir la herbivoría ( disuasores de alimentación ). [80] Las principales clases de fitoquímicos incluyen fenoles , polifenoles , taninos , terpenos y alcaloides. [81] Aunque el número de plantas que se han estudiado ampliamente es relativamente pequeño, ya se han identificado muchos productos naturales farmacológicamente activos. Los ejemplos clínicamente útiles incluyen los agentes anticancerígenos paclitaxel y omacetaxina mepesuccinato (de Taxus brevifolia y Cephalotaxus harringtonii , respectivamente), [82] el agente antipalúdico artemisinina (de Artemisia annua ), [83] y el inhibidor de la acetilcolinesterasa galantamina (de Galanthus spp.), utilizado para tratar la enfermedad de Alzheimer . [84] Otras drogas derivadas de plantas, utilizadas con fines medicinales y/o recreativos, incluyen la morfina , la cocaína , la quinina , la tubocurarina , la muscarina y la nicotina . [25] : Cap. 6

Los animales también representan una fuente de productos naturales bioactivos. En particular, los animales venenosos como serpientes, arañas, escorpiones, orugas, abejas, avispas, ciempiés, hormigas, sapos y ranas han atraído mucha atención. Esto se debe a que los componentes del veneno (péptidos, enzimas, nucleótidos, lípidos, aminas biógenas, etc.) a menudo tienen interacciones muy específicas con un objetivo macromolecular en el cuerpo (por ejemplo, la α-bungarotoxina de las cobras ). [86] [87] Al igual que con los elementos disuasorios de la alimentación vegetal, esta actividad biológica se atribuye a la selección natural, ya que los organismos capaces de matar o paralizar a sus presas y/o defenderse de los depredadores tienen más probabilidades de sobrevivir y reproducirse. [87]
Debido a estas interacciones químicas específicas con sus dianas, los componentes del veneno han demostrado ser herramientas importantes para estudiar los receptores , los canales iónicos y las enzimas. En algunos casos, también han servido como guías en el desarrollo de nuevos fármacos. Por ejemplo, la teprótida, un péptido aislado del veneno de la víbora brasileña Bothrops jararaca , fue una de las principales fuentes de desarrollo de los agentes antihipertensivos cilazapril y captopril . [87] Además, la echistatina, una desintegrina del veneno de la víbora de escamas de sierra Echis carinatus, fue una de las principales fuentes de desarrollo del fármaco antiplaquetario tirofibán . [88]
Además de los animales terrestres y anfibios descritos anteriormente, se han examinado muchos animales marinos en busca de productos naturales farmacológicamente activos, como corales , esponjas , tunicados , caracoles marinos y briozoos que producen sustancias químicas con interesantes actividades analgésicas , antivirales y anticancerígenas . [89] Dos ejemplos desarrollados para uso clínico incluyen la ω- conotoxina (del caracol marino Conus magus ) [90] [85] y la ecteinascidina 743 (del tunicado Ecteinascidia turbinata ). [91] La primera, ω-conotoxina, se utiliza para aliviar el dolor intenso y crónico, [85] [90] mientras que la última, ecteinascidina 743, se utiliza para tratar el sarcoma de tejidos blandos metastásico . [92] Otros productos naturales derivados de animales marinos y que se encuentran bajo investigación como posibles terapias incluyen los agentes antitumorales discodermolida (de la esponja Discodermia dissoluta ), [93] eleuterobina (del coral Erythropodium caribaeorum ) y las briostatinas (del briozoo Bugula neritina ). [93]
Los productos naturales a veces tienen una actividad farmacológica que puede ser beneficiosa terapéuticamente en el tratamiento de enfermedades. [94] [95] [96] Además, se pueden preparar análogos sintéticos de productos naturales con mayor potencia y seguridad y, por lo tanto, los productos naturales se utilizan a menudo como puntos de partida para el descubrimiento de fármacos . Los componentes de los productos naturales han inspirado numerosos esfuerzos de descubrimiento de fármacos que finalmente obtuvieron la aprobación como nuevos fármacos [97] [98]
Una gran cantidad de medicamentos que se recetan actualmente son derivados directamente de productos naturales o están inspirados en ellos. [1] [99] Aproximadamente el 35% del mercado mundial anual de medicamentos proviene de productos naturales o medicamentos relacionados. [100] Esto se desglosa en un 25% de plantas, un 13% de microorganismos y un 3% de fuentes animales. [100]
Entre 1981 y 2019, la FDA aprobó 1.881 nuevas entidades químicas , de las cuales 65 (3,5%) eran productos naturales inalterados, 99 (5,3%) eran medicamentos botánicos de mezcla definida , 178 (9,5%) eran derivados de productos naturales y 164 (8,7%) eran compuestos sintéticos que contenían farmacóforos de productos naturales . En total, esto representa 506 (26,9%) de todos los nuevos medicamentos aprobados. [13] Además, los productos naturales y sus derivados a menudo muestran tasas de éxito más altas en fases posteriores de ensayos clínicos y pueden tener perfiles de toxicidad más bajos en comparación con los compuestos sintéticos. [101]
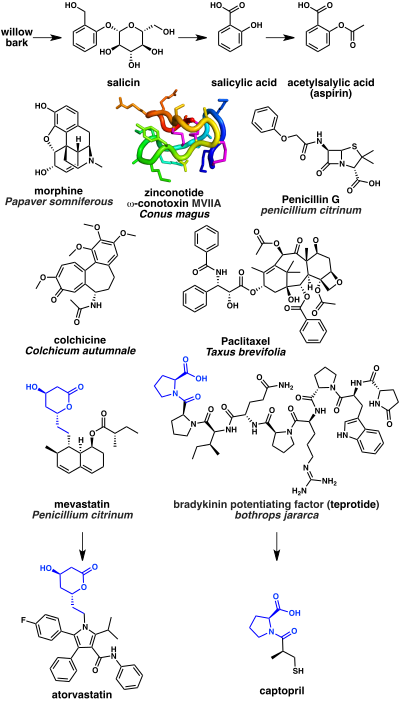
Algunos de los medicamentos más antiguos basados en productos naturales son analgésicos. Se sabe desde la antigüedad que la corteza del sauce tiene propiedades analgésicas. Esto se debe a la presencia del producto natural salicina , que a su vez puede hidrolizarse en ácido salicílico . Un derivado sintético del ácido acetilsalicílico, mejor conocido como aspirina, es un analgésico ampliamente utilizado. Su mecanismo de acción es la inhibición de la enzima ciclooxigenasa (COX). [102] Otro ejemplo notable es el opio, que se extrae del látex de Papaver somniferous (una planta de amapola en flor). El componente narcótico más potente del opio es el alcaloide morfina, que actúa como agonista del receptor opioide . [103] Un ejemplo más reciente es el analgésico ziconotida, bloqueador de los canales de calcio de tipo N , que se basa en una toxina de caracol de cono de péptido cíclico (ω- conotoxina MVIIA) de la especie Conus magus . [104]
Un número significativo de antiinfecciosos se basan en productos naturales. [58] El primer antibiótico descubierto, la penicilina, se aisló del moho Penicillium . La penicilina y las betalactámicas relacionadas actúan inhibiendo la enzima DD -transpeptidasa que necesitan las bacterias para unir el peptidoglicano y formar la pared celular. [105]
Varios fármacos de origen natural actúan sobre la tubulina , un componente del citoesqueleto . Entre ellos se encuentra el inhibidor de la polimerización de la tubulina, la colchicina, aislado del Colchicum autumnale (planta con flores de azafrán de otoño), que se utiliza para tratar la gota . [106] La colchicina se biosintetiza a partir de los aminoácidos fenilalanina y triptófano . El paclitaxel, por el contrario, es un estabilizador de la polimerización de la tubulina y se utiliza como fármaco quimioterapéutico . El paclitaxel se basa en el producto natural terpenoide taxol , que se aísla del Taxus brevifolia (el tejo del Pacífico). [107]
Una clase de fármacos ampliamente utilizados para reducir el colesterol son los inhibidores de la HMG-CoA reductasa , por ejemplo la atorvastatina . Estos se desarrollaron a partir de la mevastatina , un policétido producido por el hongo Penicillium citrinum . [108] Finalmente, una serie de fármacos de productos naturales se utilizan para tratar la hipertensión y la insuficiencia cardíaca congestiva. Estos incluyen el inhibidor de la enzima convertidora de angiotensina captopril . El captopril se basa en el factor potenciador de la bradicinina peptídica aislado del veneno de la víbora brasileña ( Bothrops jararaca ). [109]
Numerosos desafíos limitan el uso de productos naturales para el descubrimiento de fármacos, lo que da como resultado que en el siglo XXI las compañías farmacéuticas prefieran dedicar sus esfuerzos de descubrimiento a la detección de alto rendimiento de compuestos sintéticos puros con plazos más cortos para su refinamiento. [12] [110] Las fuentes de productos naturales suelen ser poco fiables en cuanto a acceso y suministro, tienen una alta probabilidad de duplicación, generan inherentemente preocupaciones de propiedad intelectual sobre la protección de patentes , varían en composición debido a la temporada de abastecimiento o el medio ambiente y son susceptibles a tasas de extinción en aumento . [12] [110]
El recurso biológico para el descubrimiento de fármacos a partir de productos naturales sigue siendo abundante, con pequeños porcentajes de microorganismos, especies de plantas e insectos evaluados por bioactividad. [12] En enormes cantidades, las bacterias y los microorganismos marinos permanecen sin examinar. [111] [112] A partir de 2008, se propuso el campo de la metagenómica para examinar los genes y su función en los microbios del suelo, [112] [113] pero la mayoría de las empresas farmacéuticas no han explotado este recurso por completo, optando en cambio por desarrollar una "síntesis orientada a la diversidad" a partir de bibliotecas de fármacos conocidos o fuentes naturales para compuestos líderes con mayor potencial de bioactividad. [12]

Todos los productos naturales comienzan como mezclas con otros compuestos de la fuente natural, a menudo mezclas muy complejas, de las cuales el producto de interés debe ser aislado y purificado. [110] El aislamiento de un producto natural se refiere, dependiendo del contexto, al aislamiento de cantidades suficientes de materia química pura para la elucidación de la estructura química, la química de derivatización/degradación, las pruebas biológicas y otras necesidades de investigación, [116] [117] [118]
La determinación de la estructura se refiere a los métodos aplicados para determinar la estructura química de un producto natural puro y aislado. Por ejemplo, la estructura química de la penicilina fue determinada por Dorothy Crowfoot Hodgkin en 1945, trabajo por el que posteriormente recibió el Premio Nobel de Química (1964). [119]
La determinación de la estructura moderna a menudo implica una combinación de técnicas analíticas avanzadas. La espectroscopia de resonancia magnética nuclear (RMN) y la cristalografía de rayos X se utilizan comúnmente como herramientas principales para la elucidación de la estructura. La espectrometría de masas en tándem de alta resolución (MS/MS) también desempeña un papel crucial, ya que proporciona información sobre la fórmula molecular y los patrones de fragmentación . Para estructuras complejas, se emplean cada vez más métodos computacionales para ayudar en la determinación de la estructura. Esto puede incluir plataformas de elucidación de estructura asistida por computadora (CASE) y herramientas de predicción de fragmentación in silico. La determinación de la configuración absoluta a menudo se basa en una combinación de datos de RMN ( constantes de acoplamiento y efecto Overhauser nuclear (NOE), métodos de derivatización química (por ejemplo, análisis de ésteres de Mosher ) y técnicas espectroscópicas como el dicroísmo circular vibracional (VCD) y la dispersión rotatoria óptica (ORD). En los casos en que los métodos tradicionales son insuficientes, especialmente para compuestos nuevos con esqueletos moleculares sin precedentes, se utilizan enfoques avanzados de química computacional para predecir y comparar datos espectrales, lo que ayuda a dilucidar la estructura completa, incluida la estereoquímica . [120]
Muchos productos naturales tienen estructuras complejas. La complejidad está determinada por factores como la masa molecular, la disposición de las subestructuras (por ejemplo, grupos funcionales , anillos), el número y la densidad de estos grupos, su estabilidad, los elementos estereoquímicos y las propiedades físicas, así como la novedad de la estructura y los esfuerzos sintéticos previos. [121]
Los productos naturales menos complejos pueden sintetizarse a menudo de forma rentable a partir de ingredientes químicos más simples mediante síntesis total . Sin embargo, no todos los productos naturales son adecuados para la síntesis total. Los más complejos suelen ser poco prácticos para sintetizar a gran escala debido a los altos costos. En estos casos, el aislamiento a partir de fuentes naturales puede ser suficiente si proporciona cantidades adecuadas, como se ha visto con medicamentos como la penicilina, la morfina y el paclitaxel, que se obtuvieron a escala comercial sin una química sintética significativa. [121]
Aislar un producto natural de su fuente puede resultar costoso en términos de tiempo y materiales, y puede afectar la disponibilidad del recurso natural o tener consecuencias ecológicas. Por ejemplo, se estima que para recolectar suficiente paclitaxel para una dosis única de terapia se necesitaría la corteza de un árbol de tejo entero ( Taxus brevifolia ). [122] Además, la cantidad de análogos estructurales disponibles para el análisis de estructura-actividad (SAR) está limitada por la biología del organismo y, por lo tanto, está más allá del control experimental. [123]
Cuando el producto deseado es difícil de obtener o modificar para crear análogos, a veces se puede utilizar un precursor o análogo biosintético de etapa media o tardía para producir el producto final. Este enfoque, llamado semisíntesis o síntesis parcial, implica extraer un intermediario biosintético y convertirlo en el producto final utilizando técnicas de síntesis química convencionales . [123]
Esta estrategia ofrece dos ventajas. En primer lugar, el intermedio puede ser más fácil de extraer y producir cantidades mayores que el producto final. Por ejemplo, el paclitaxel se puede producir extrayendo 10-desacetilbaccatina III de las agujas de T. brevifolia , seguida de una síntesis de cuatro pasos. [124] En segundo lugar, el proceso semisintético permite la creación de análogos del producto final, como se ha visto en el desarrollo de penicilinas semisintéticas de nueva generación . [125]

En general, la síntesis total de productos naturales es una actividad de investigación no comercial, cuyo objetivo es profundizar en la comprensión de la síntesis de estructuras de productos naturales particulares y desarrollar nuevos métodos sintéticos fundamentales. Aun así, tiene una enorme importancia comercial y social. Al proporcionar objetivos sintéticos desafiantes, por ejemplo, ha desempeñado un papel central en el desarrollo del campo de la química orgánica. [129] [130] Antes del desarrollo de los métodos de química analítica en el siglo XX, las estructuras de los productos naturales se afirmaban mediante síntesis total (la llamada "prueba de estructura por síntesis"). [131] Los primeros esfuerzos en la síntesis de productos naturales se dirigieron a sustancias complejas como la cobalamina (vitamina B 12 ), un cofactor esencial en el metabolismo celular . [127] [128]
El examen de productos naturales dimerizados y trimerizados ha demostrado que a menudo está presente un elemento de simetría bilateral. La simetría bilateral se refiere a una molécula o sistema que contiene una identidad de grupo puntual C 2 , C s o C 2v . La simetría C 2 tiende a ser mucho más abundante que otros tipos de simetría bilateral. Este hallazgo arroja luz sobre cómo estos compuestos podrían crearse mecanísticamente, además de proporcionar información sobre las propiedades termodinámicas que hacen que estos compuestos sean más favorables. La teoría funcional de la densidad (DFT), el método Hartree-Fock y los cálculos semiempíricos también muestran cierta favorabilidad para la dimerización en productos naturales debido a la evolución de más energía por enlace que el trímero o tetrámero equivalente. Se propone que esto se debe al impedimento estérico en el núcleo de la molécula, ya que la mayoría de los productos naturales se dimerizan y trimerizan de manera cabeza con cabeza en lugar de cabeza con cola. [132]
Las actividades de investigación y docencia relacionadas con los productos naturales se enmarcan en diversas áreas académicas, entre las que se incluyen la química orgánica, la química medicinal, la farmacognosia, la etnobotánica , la medicina tradicional y la etnofarmacología . Otras áreas biológicas incluyen la biología química , la ecología química , la quimiogenómica , [133] la biología de sistemas , el modelado molecular , la quimiometría y la quimioinformática . [134]
La química de productos naturales es un área distinta de la investigación química que fue importante en el desarrollo y la historia de la química . Aislar e identificar productos naturales ha sido importante para obtener sustancias para la investigación temprana de descubrimiento de fármacos preclínicos, para comprender la medicina tradicional y la etnofarmacología, y para encontrar áreas farmacológicamente útiles del espacio químico . [135] Para lograr esto, se han realizado muchos avances tecnológicos, como la evolución de la tecnología asociada con las separaciones químicas y el desarrollo de métodos modernos en la determinación de la estructura química como la RMN . Los primeros intentos de comprender la biosíntesis de productos naturales, vieron a los químicos emplear primero el radiomarcaje y más recientemente el marcaje de isótopos estables combinado con experimentos de RMN. Además, los productos naturales se preparan por síntesis orgánica , para proporcionar confirmación de su estructura o para dar acceso a mayores cantidades de productos naturales de interés. En este proceso, se ha revisado la estructura de algunos productos naturales, [136] [137] [138] y el desafío de sintetizar productos naturales ha llevado al desarrollo de una nueva metodología sintética, estrategia sintética y tácticas. [139] En este sentido, los productos naturales juegan un papel central en la formación de nuevos químicos orgánicos sintéticos, y son una motivación principal en el desarrollo de nuevas variantes de antiguas reacciones químicas (por ejemplo, la reacción aldólica de Evans ), así como el descubrimiento de reacciones químicas completamente nuevas (por ejemplo, la cis-hidroxilación de Woodward , la epoxidación de Sharpless y las reacciones de acoplamiento cruzado de Suzuki-Miyaura ). [140]



El concepto de productos naturales se remonta a principios del siglo XIX, cuando se sentaron las bases de la química orgánica. La química orgánica se consideraba en ese momento como la química de las sustancias que componen las plantas y los animales. Era una forma relativamente compleja de química y contrastaba marcadamente con la química inorgánica , cuyos principios habían sido establecidos en 1789 por el francés Antoine Lavoisier en su obra Traité Élémentaire de Chimie . [141]
Lavoisier demostró a finales del siglo XVIII que las sustancias orgánicas estaban formadas por un número limitado de elementos: principalmente carbono e hidrógeno, a los que se añadían oxígeno y nitrógeno. Rápidamente se dedicó a aislar estas sustancias, a menudo porque tenían una interesante actividad farmacológica. Las plantas eran la principal fuente de estos compuestos, sobre todo de alcaloides y glicósidos . Desde hacía tiempo se sabía que el opio, una mezcla pegajosa de alcaloides (entre ellos codeína , morfina, noscapina , tebaína y papaverina ) procedente de la adormidera ( Papaver somniferum ), poseía propiedades narcóticas y a la vez psicoactivas. En 1805, el químico alemán Friedrich Sertürner ya había aislado la morfina y en la década de 1870 se descubrió que hirviendo la morfina con anhídrido acético se obtenía una sustancia con un fuerte efecto analgésico: la heroína. [142] En 1815, Eugène Chevreul aisló el colesterol , una sustancia cristalina, del tejido animal que pertenece a la clase de los esteroides, [143] y en 1819 se aisló la estricnina , un alcaloide. [144]
Un segundo paso importante fue la síntesis de compuestos orgánicos. Si bien la síntesis de sustancias inorgánicas se conocía desde hacía mucho tiempo, la creación de sustancias orgánicas era un gran desafío. En 1827, el químico sueco Jöns Jacob Berzelius sostuvo que una fuerza vital o fuerza vital era esencial para sintetizar compuestos orgánicos. Esta idea, conocida como vitalismo , tuvo muchos partidarios hasta bien entrado el siglo XIX, incluso después de la introducción de la teoría atómica . El vitalismo también se alineó con la medicina tradicional, que a menudo consideraba la enfermedad como resultado de desequilibrios en las energías vitales que distinguen la vida de la no vida.
El primer desafío significativo al vitalismo llegó en 1828 cuando el químico alemán Friedrich Wöhler sintetizó urea , un producto natural que se encuentra en la orina , calentando cianato de amonio , una sustancia inorgánica: [145]
Esta reacción demostró que no se necesitaba una fuerza vital para crear sustancias orgánicas. Inicialmente, esta idea se enfrentó al escepticismo, pero ganó aceptación 20 años después, cuando Adolph Wilhelm Hermann Kolbe sintetizó ácido acético a partir de disulfuro de carbono . [146] Desde entonces, la química orgánica se ha convertido en un campo diferenciado centrado en el estudio de los compuestos que contienen carbono, que se encontró que prevalecían en la naturaleza.
El tercer desarrollo clave fue la elucidación de la estructura de las sustancias orgánicas. Si bien la composición elemental de los compuestos orgánicos puros podía determinarse con precisión, sus estructuras moleculares seguían siendo poco claras. Esta cuestión se hizo evidente en una disputa entre Friedrich Wöhler y Justus von Liebig , que estudió sales de plata con composiciones idénticas pero propiedades diferentes. Wöhler examinó el cianato de plata , un compuesto inofensivo, mientras que von Liebig investigó el explosivo fulminato de plata . [147] El análisis elemental mostró que ambas sales tenían las mismas cantidades de plata, carbono, oxígeno y nitrógeno, pero sus propiedades diferían, lo que contradecía la opinión predominante de que la composición por sí sola determinaba las propiedades.
Esta discrepancia fue explicada por la teoría de los isómeros de Berzelius , que proponía que no solo el número y tipo de elementos sino también la disposición de los átomos afecta las propiedades de un compuesto. Esta idea condujo al desarrollo de teorías estructurales, como la teoría radical de Jean-Baptiste Dumas y la teoría de la sustitución de Auguste Laurent . [148] [149] Una teoría estructural definitiva fue propuesta en 1858 por August Kekulé , quien sugirió que el carbono es tetravalente y puede unirse a sí mismo, formando cadenas que se encuentran en productos naturales. [150] [149]
El concepto de producto natural, que inicialmente se basaba en compuestos orgánicos que podían aislarse de las plantas, fue ampliado para incluir material animal a mediados del siglo XIX por el alemán Justus von Liebig . En 1884, Hermann Emil Fischer dirigió su atención al estudio de los carbohidratos y las purinas, trabajo por el que fue galardonado con el Premio Nobel en 1902. También logró fabricar sintéticamente en el laboratorio una variedad de carbohidratos, entre ellos la glucosa y la manosa . Después del descubrimiento de la penicilina por Alexander Fleming en 1928, los hongos y otros microorganismos se agregaron al arsenal de fuentes de productos naturales. [142]
En la década de 1930, se habían identificado y estudiado en profundidad varias clases importantes de productos naturales. Entre los hitos clave en el campo de la investigación de productos naturales se incluyen los siguientes: [142]
Estos estudios pioneros sentaron las bases para nuestra comprensión de la química y la bioquímica de los productos naturales, [157] lo que dio lugar a numerosos premios Nobel de Química y Fisiología o Medicina. El campo de los productos naturales ha seguido evolucionando y las investigaciones recientes se centran en el papel evolutivo y ecológico de estos compuestos. [30]
Notas al pie
Citas
Sustancia química producida por un organismo vivo; término que se utiliza comúnmente en referencia a sustancias químicas que se encuentran en la naturaleza y que tienen efectos farmacológicos distintivos. Dicha sustancia se considera un producto natural incluso si se puede preparar mediante síntesis total.
La definición más simple de un producto natural es una molécula pequeña producida por una fuente biológica.
Los productos naturales incluyen un grupo grande y diverso de sustancias de diversas fuentes. Son producidos por organismos marinos, bacterias, hongos y plantas. El término abarca extractos complejos de estos productores, pero también los compuestos aislados derivados de esos extractos. También incluye vitaminas, minerales y probióticos.
Los productos naturales están representados por una amplia gama de bienes de consumo que siguen creciendo en popularidad cada año. Estos productos incluyen alimentos naturales y orgánicos, suplementos dietéticos, alimentos para mascotas, productos de salud y belleza, productos de limpieza "ecológicos" y más. En general, se consideran productos naturales aquellos formulados sin ingredientes artificiales y que están mínimamente procesados.
son compuestos orgánicos que se forman por los sistemas vivos.
Productos naturales: compuestos naturales que son productos finales del metabolismo secundario; a menudo, son compuestos únicos para organismos particulares o clases de organismos.
: Un compuesto químico único que se produce de forma natural. Este término se utiliza normalmente para referirse a un compuesto orgánico de distribución limitada en la naturaleza (a menudo llamado metabolitos secundarios).
Figura 1. Todos los nuevos fármacos aprobados del 01 de enero de 2018 al 30 de septiembre de 2019; n = 1881. Figura 9. Categorías N/NB/ND y S* del 01 de enero de 2018 al 30 de septiembre de 2019, n = 506.Los productos naturales representan el 100*(506/1881) = 27% de las aprobaciones de nuevos medicamentos desde el 1 de enero de 1981 hasta el 30 de septiembre de 2019. Según la Figura 9, el porcentaje fue de aproximadamente el 10% para el período 2017-2019.
En 1891, siguiendo el trabajo de Stahl sobre la bioquímica de las plantas, Kossel sugirió una distinción entre metabolismo básico y secundario (Stahl 1888).
en consonancia con la visión de Kossel, es que los metabolitos primarios son componentes químicos de los organismos vivos que son vitales para su funcionamiento normal, mientras que los metabolitos secundarios son compuestos que son prescindibles.
metabolitos secundarios se distinguen con mayor precisión por los siguientes criterios: tienen una distribución restringida, se encuentran principalmente en plantas y microorganismos y suelen ser característicos de géneros, especies o cepas individuales; se forman a lo largo de vías especializadas a partir de metabolitos primarios. Los metabolitos primarios, por el contrario, tienen una distribución amplia en todos los seres vivos y están íntimamente involucrados en procesos vitales esenciales.
El tejido adiposo desempeña un papel fundamental en las estrategias de la historia de vida de los mamíferos, ya que actúa como órgano de almacenamiento de alimentos y energía, como fuente de calor y agua y como aislante térmico.
Descubrimiento de fármacos: ¿sigue siendo la madre naturaleza la principal fuente de nuevos fármacos prometedores?