La pseudoefedrina , que se vende bajo la marca Sudafed , entre otras, es un medicamento simpaticomimético que se utiliza como descongestionante para tratar la congestión nasal . [1] [13] [2] También se ha utilizado fuera de etiqueta para ciertas otras indicaciones, como el tratamiento de la presión arterial baja . [14] [15] [16] En dosis más altas, puede producir varios efectos adicionales, incluidos efectos psicoestimulantes , [17] [1] supresores del apetito , [18] y de mejora del rendimiento . [19] [20] En relación con esto, se ha encontrado un uso no médico de la pseudoefedrina. [17] [1] [18] [19] [20] El medicamento se toma por vía oral . [1] [2]
Los efectos secundarios de la pseudoefedrina incluyen insomnio , aumento de la frecuencia cardíaca y aumento de la presión arterial , entre otros. [21] [2] [1] [22] En raras ocasiones, la pseudoefedrina se ha asociado con complicaciones cardiovasculares graves como ataque cardíaco y accidente cerebrovascular hemorrágico . [18] [23] [15] Algunas personas pueden ser más sensibles a sus efectos cardiovasculares . [22] [1] La pseudoefedrina actúa como un agente liberador de norepinefrina , activando indirectamente los receptores adrenérgicos . [24] [2] [25] [1] Como tal, es un simpaticomimético de acción indirecta . [24] [2] [25] [1] La pseudoefedrina cruza significativamente al cerebro , pero tiene cierta selectividad periférica debido a su hidrofilicidad . [25] [26] Químicamente, la pseudoefedrina es una anfetamina sustituida y está estrechamente relacionada con la efedrina , la fenilpropanolamina y la anfetamina . [1] [13] [2] Es el enantiómero (1 S ,2 S )- de la β-hidroxi- N -metilanfetamina . [27]
Junto con la efedrina, la pseudoefedrina se encuentra de forma natural en la efedra , que se ha utilizado durante miles de años en la medicina tradicional china . [13] [28] Se aisló por primera vez de la efedra en 1889. [28] [13] [29] Tras su síntesis en la década de 1920, la pseudoefedrina se introdujo para uso médico como descongestionante. [13] La pseudoefedrina está ampliamente disponible sin receta médica, tanto en preparaciones de un solo fármaco como en combinaciones . [ 30] [22] [13] [2] La disponibilidad de pseudoefedrina se ha restringido a partir de 2005, ya que se puede utilizar para sintetizar metanfetamina . [13] [2] La fenilefrina ha sustituido a la pseudoefedrina en muchos productos descongestionantes orales de venta libre . [2] Sin embargo, la fenilefrina oral parece ser ineficaz como descongestionante. [31] [32]
La pseudoefedrina es un simpaticomimético y es bien conocida por reducir la inflamación de las mucosas nasales, por lo que se utiliza a menudo como descongestionante . Reduce la hiperemia tisular , el edema y la congestión nasal comúnmente asociados con los resfriados o las alergias . Otros efectos beneficiosos pueden incluir el aumento del drenaje de las secreciones de los senos nasales y la apertura de las trompas de Eustaquio obstruidas . La misma acción vasoconstrictora también puede provocar hipertensión , que es un efecto secundario conocido de la pseudoefedrina.
La pseudoefedrina se puede utilizar como descongestionante oral o tópico . Sin embargo, debido a sus propiedades estimulantes , es más probable que la preparación oral cause efectos adversos, incluida la retención urinaria . [33] [34] Según un estudio, la pseudoefedrina puede mostrar eficacia como fármaco antitusivo (supresión de la tos ). [35]
La pseudoefedrina está indicada para el tratamiento de la congestión nasal, la congestión sinusal y la congestión de la trompa de Eustaquio. [36] La pseudoefedrina también está indicada para la rinitis vasomotora y como complemento de otros agentes en el tratamiento óptimo de la rinitis alérgica , el crup , la sinusitis , la otitis media y la traqueobronquitis . [36]
Se sabe que los estimulantes de tipo anfetamínico y otros agentes catecolaminérgicos tienen efectos promotores de la vigilia y se utilizan en el tratamiento de la hipersomnia y la narcolepsia . [37] [38] [39] La pseudoefedrina en dosis terapéuticas no parece mejorar o empeorar la somnolencia diurna, la fatiga diurna o la calidad del sueño en personas con rinitis alérgica . [1] [40] Asimismo, la somnolencia no fue menor en niños con resfriado común tratados con pseudoefedrina para la congestión nasal. [41] En cualquier caso, el insomnio es un efecto secundario conocido de la pseudoefedrina, aunque la incidencia es baja. [21] Además, se ha informado que dosis de pseudoefedrina por encima del rango terapéutico normal producen efectos psicoestimulantes , incluido el insomnio y la reducción de la sensación de fatiga. [17]
Ha habido interés en la pseudoefedrina como un supresor del apetito para el tratamiento de la obesidad . [18] Sin embargo, debido a la falta de datos clínicos y los posibles efectos secundarios cardiovasculares, no se recomienda su uso. [18] Solo existe un único estudio controlado con placebo de pseudoefedrina para la pérdida de peso (120 mg/día de liberación lenta durante 12 semanas) y no encontró diferencias significativas en el peso perdido en comparación con placebo (-4,6 kg frente a -4,5 kg). [18] [42] Esto contrasta con la fenilpropanolamina , que se ha encontrado que es más eficaz para promover la pérdida de peso en comparación con placebo y se ha estudiado y utilizado más ampliamente en el tratamiento de la obesidad. [43] [44] [42]
La pseudoefedrina se ha utilizado de forma limitada en el tratamiento de la intolerancia ortostática , incluida la hipotensión ortostática [14] y el síndrome de taquicardia ortostática postural (POTS). [16] [45] [46] Sin embargo, su eficacia en el tratamiento del POTS es controvertida. [16] [45] La pseudoefedrina también se ha utilizado de forma limitada en el tratamiento de la hipotensión refractaria en unidades de cuidados intensivos . [15] Sin embargo, los datos sobre este uso se limitan a informes de casos y series de casos . [15]
La pseudoefedrina también se utiliza como profilaxis de primera línea para el priapismo recurrente . [47] La erección es en gran medida una respuesta parasimpática , por lo que la acción simpática de la pseudoefedrina puede servir para aliviar esta afección. Sin embargo, los datos sobre este uso son anecdóticos y se ha descrito que su eficacia es variable. [47]
El tratamiento de la incontinencia urinaria es un uso no indicado en la etiqueta para la pseudoefedrina y medicamentos relacionados. [48] [49]
La pseudoefedrina está disponible sin receta en forma de comprimidos orales de liberación inmediata de 30 y 60 mg y de liberación prolongada de 120 y 240 mg en los Estados Unidos . [30] [50] [51] [52]
La pseudoefedrina también está disponible sin receta y con receta en combinación con muchos otros medicamentos, incluidos antihistamínicos ( acrivastina , azatadina , bromfeniramina , cetirizina , clorfeniramina , clemastina , desloratadina , dexbromfeniramina , difenhidramina , fexofenadina , loratadina , triprolidina ), analgésicos ( acetaminofén , codeína , hidrocodona , ibuprofeno , naproxeno ), supresores de la tos ( dextrometorfano ) y expectorantes ( guaifenesina ). [30] [50]
La pseudoefedrina se ha utilizado en forma de sales de clorhidrato y sulfato y en forma de polistirex. [30] El fármaco se ha utilizado en más de 135 formulaciones de venta libre y con receta. [22] Muchas formulaciones de venta con receta que contienen pseudoefedrina se han discontinuado con el tiempo. [30]
La pseudoefedrina está contraindicada en pacientes con diabetes mellitus , enfermedad cardiovascular , hipertensión grave o no controlada , enfermedad coronaria grave , hipertrofia prostática , hipertiroidismo , glaucoma de ángulo cerrado o en mujeres embarazadas . [53] La seguridad y eficacia del uso de descongestionantes nasales en niños no está clara. [54]
Los efectos secundarios comunes con la terapia con pseudoefedrina pueden incluir estimulación del sistema nervioso central (SNC) , insomnio , nerviosismo , inquietud , excitabilidad , mareos y ansiedad . [18] [15] [55] Los efectos secundarios poco frecuentes incluyen taquicardia o palpitaciones . [18] En raras ocasiones, la terapia con pseudoefedrina puede estar asociada con midriasis (pupilas dilatadas), alucinaciones , arritmias , hipertensión , convulsiones y colitis isquémica ; así como reacciones cutáneas graves conocidas como pseudoescarlatina recurrente, dermatitis de contacto sistémica y erupción medicamentosa fija no pigmentada . [18] [56] [53] La pseudoefedrina, particularmente cuando se combina con otros medicamentos, incluidos los narcóticos , también puede desempeñar un papel en la precipitación de episodios de psicosis paranoide . [18] [57] También se ha informado que la pseudoefedrina, entre otros agentes simpaticomiméticos , puede estar asociada con la aparición de accidente cerebrovascular hemorrágico y otras complicaciones cardiovasculares . [18] [23] [15]
Debido a sus efectos simpaticomiméticos, la pseudoefedrina es un vasoconstrictor o agente presor (aumenta la presión arterial ), un cronótropo positivo (aumenta la frecuencia cardíaca ) y un inótropo positivo (aumenta la fuerza de las contracciones cardíacas ). [18] [1] [22] [19] [20] La influencia de la pseudoefedrina en la presión arterial en dosis clínicas es controvertida. [1] [22] Un simpaticomimético y descongestionante estrechamente relacionado, la fenilpropanolamina , fue retirado debido a las asociaciones con un aumento notable de la presión arterial y la incidencia de accidente cerebrovascular hemorrágico. [22] Ha habido preocupación de que la pseudoefedrina también pueda aumentar peligrosamente la presión arterial y, por lo tanto, aumentar el riesgo de accidente cerebrovascular, mientras que otros han sostenido que los riesgos son exagerados. [1] [22] Además de accidente cerebrovascular hemorrágico, también se han reportado raramente infarto de miocardio , vasoespasmo coronario y muerte súbita con compuestos simpaticomiméticos de efedra como pseudoefedrina y efedrina . [18] [15]
Un metaanálisis de 2005 encontró que la pseudoefedrina en dosis recomendadas no tuvo un efecto significativo en la presión arterial sistólica o diastólica en individuos sanos o personas con hipertensión controlada . [1] [22] Se encontró que la presión arterial sistólica aumentó ligeramente en 0,99 mm Hg en promedio y la frecuencia cardíaca aumentó ligeramente en 2,83 lpm en promedio. [1] [22] Por el contrario, no hubo una influencia significativa en la presión arterial diastólica, que aumentó en 0,63 mg Hg. [22] En personas con hipertensión controlada, la hipertensión sistólica aumentó en un grado similar de 1,20 mm Hg. [22] Las preparaciones de liberación inmediata , las dosis más altas, ser hombre y una duración de uso más corta se asociaron con mayores efectos cardiovasculares. [22] Un pequeño subconjunto de individuos con inestabilidad autonómica , tal vez a su vez resultando en una mayor sensibilidad del receptor adrenérgico, puede ser sustancialmente más sensible a los efectos cardiovasculares de los simpaticomiméticos. [22] Después del metanálisis de 2005, una revisión sistemática de 2015 y un metanálisis de 2018 encontraron que la pseudoefedrina en dosis altas (>170 mg) podría aumentar la frecuencia cardíaca y el rendimiento físico con tamaños de efecto mayores que las dosis más bajas. [19] [20]
Una revisión Cochrane de 2007 evaluó los efectos secundarios del uso a corto plazo de pseudoefedrina en dosis recomendadas como descongestionante nasal. [21] Encontró que la pseudoefedrina tenía un pequeño riesgo de insomnio y este fue el único efecto secundario que ocurrió en tasas significativamente diferentes del placebo. [21] El insomnio ocurrió a una tasa del 5% y tuvo una razón de probabilidades (OR) de 6,18. [21] Otros efectos secundarios, incluidos el dolor de cabeza y la hipertensión , ocurrieron a tasas de menos del 4% y no fueron diferentes del placebo. [21]
Se sabe que se desarrolla taquifilaxia con el uso prolongado de pseudoefedrina, especialmente cuando se vuelve a administrar a intervalos cortos. [1] [18]
Hay un informe de caso de síntomas depresivos temporales tras la interrupción y retirada de la pseudoefedrina. [18] [58] Los síntomas de abstinencia incluyeron empeoramiento del estado de ánimo y tristeza , disminución profunda de la energía , empeoramiento de la visión de uno mismo, disminución de la concentración, retraso psicomotor , aumento del apetito y aumento de la necesidad de dormir . [18] [58]
La pseudoefedrina tiene efectos psicoestimulantes en dosis altas y es un reforzador positivo con efectos similares a los de la anfetamina en animales, incluidas ratas y monos. [59] [60] [61] [62] Sin embargo, es sustancialmente menos potente que la metanfetamina o la cocaína . [59] [60] [61]
La dosis diaria total máxima de pseudoefedrina es de 240 mg. [1] La pseudoefedrina puede producir efectos simpaticomiméticos y psicoestimulantes en caso de sobredosis . [1] Estos pueden incluir sedación , apnea , alteración de la concentración, cianosis , coma , colapso circulatorio , insomnio , alucinaciones , temblores , convulsiones , dolor de cabeza , mareos , ansiedad , euforia , tinnitus , visión borrosa , ataxia , dolor en el pecho , taquicardia , palpitaciones , aumento de la presión arterial , disminución de la presión arterial , sed , sudoración , dificultad para orinar , náuseas y vómitos . [1] En los niños, los síntomas han incluido con mayor frecuencia sequedad de boca , dilatación de la pupila , sofocos , fiebre y disfunción gastrointestinal . [1] La pseudoefedrina puede producir efectos tóxicos tanto con el uso de dosis supraterapéuticas como en personas más sensibles a los efectos de los simpaticomiméticos. [1] Se ha informado de un caso de uso indebido del fármaco en dosis masivas de 3000 a 4500 mg (100-150 comprimidos de 30 mg) al día, dosis que este individuo aumentó gradualmente con el tiempo. [1] [63] No se han notificado muertes por uso indebido de pseudoefedrina hasta 2021. [17] Sin embargo, se han notificado muertes con pseudoefedrina en general. [1] [13] [18]
El uso concomitante o reciente (14 días anteriores) de inhibidores de la monoaminooxidasa (IMAO) puede provocar reacciones hipertensivas , incluida una crisis hipertensiva , y debe evitarse. [1] [53] Los estudios clínicos han encontrado una influencia mínima o nula de ciertos IMAO como el IMAO no selectivo débil linezolid y el potente inhibidor selectivo de la MAO-B selegilina (como parche transdérmico ) en la farmacocinética de la pseudoefedrina. [64] [65] [66] [67] Esto concuerda con el hecho de que la pseudoefedrina no es metabolizada por la monoaminooxidasa (MAO). [25] [11] [68] Sin embargo, la pseudoefedrina induce la liberación de norepinefrina , cuyo metabolismo inhiben los IMAO y, como tal, los IMAO aún pueden potenciar los efectos de la pseudoefedrina. [69] [1] [65] No se han encontrado interacciones farmacodinámicas significativas con selegilina, [65] [67] pero linezolid potenció los aumentos de presión arterial con pseudoefedrina. [64] [66] Sin embargo, se consideró que esto no tenía importancia clínica en el caso de linezolid, aunque se observó que algunas personas pueden ser más sensibles a los efectos simpaticomiméticos de la pseudoefedrina y agentes relacionados. [64] [66] La pseudoefedrina está contraindicada con IMAO como fenelzina , tranilcipromina , isocarboxazida y moclobemida debido al potencial de efectos simpaticomiméticos sinérgicos y crisis hipertensivas. [1] [18] También se considera que está contraindicada con linezolid y selegilina ya que algunas personas pueden reaccionar de manera más sensible a la coadministración. [64] [66] [65] [67]
No se recomienda el uso concomitante de pseudoefedrina con otros vasoconstrictores , incluidos los alcaloides del cornezuelo como la ergotamina y la dihidroergotamina , linezolid , oxitocina , efedrina , fenilefrina y bromocriptina , entre otros, debido a la posibilidad de mayores aumentos de la presión arterial y riesgo de accidente cerebrovascular hemorrágico . [1] Los efectos simpaticomiméticos y los riesgos cardiovasculares de la pseudoefedrina también pueden aumentar con los glucósidos digitálicos , los antidepresivos tricíclicos , los supresores del apetito y los anestésicos inhalatorios . [1] Asimismo, pueden producirse mayores efectos simpaticomiméticos de la pseudoefedrina cuando se combina con otros agentes simpaticomiméticos. [18] Se han notificado complicaciones cardiovasculares raras pero graves con la combinación de pseudoefedrina y bupropión . [13] [70] [71] Puede producirse un aumento de la actividad del marcapasos ectópico cuando se utiliza pseudoefedrina concomitantemente con digitálicos . [1] Los efectos antihipertensivos de la metildopa , la guanetidina , la mecamilamina , la reserpina y los alcaloides del veratrum pueden verse reducidos por simpaticomiméticos como la pseudoefedrina. [1] Los betabloqueantes como el labetalol pueden reducir los efectos de la pseudoefedrina. [72] [73]
Los agentes acidificantes urinarios como el ácido ascórbico y el cloruro de amonio pueden aumentar la excreción y, por lo tanto, reducir la exposición a las anfetaminas, incluida la pseudoefedrina, mientras que los agentes alcalinizantes urinarios, incluidos los antiácidos como el bicarbonato de sodio y la acetazolamida, pueden reducir la excreción de estos agentes y, por lo tanto, aumentar la exposición a ellos. [1] [11] [74]
La pseudoefedrina es un agente simpaticomimético que actúa principalmente o exclusivamente induciendo la liberación de norepinefrina . [75] [25] [2] [24] Por lo tanto, es un simpaticomimético de acción indirecta. [75] [25] [2] Algunas fuentes afirman que la pseudoefedrina tiene un mecanismo de acción mixto que consiste en efectos indirectos y directos al unirse a los receptores adrenérgicos y actuar como agonista de los mismos . [1] [15] Sin embargo, la afinidad de la pseudoefedrina por los receptores adrenérgicos se describe como muy baja o insignificante. [75] Los estudios en animales sugieren que los efectos simpaticomiméticos de la pseudoefedrina se deben exclusivamente a la liberación de norepinefrina. [76] [77]
La pseudoefedrina induce la liberación de monoamina in vitro con una CE 50de 224 nM para la noradrenalina y 1.988 nM para la dopamina , mientras que es inactivo para la serotonina . [24] [83] [79] Como tal, es aproximadamente 9 veces selectivo para la inducción de la liberación de noradrenalina sobre la liberación de dopamina. [24] [83] [79] El fármaco tiene una actividad agonista insignificante en los receptores adrenérgicos α 1 y α 2 (K act >10.000 nM). [24] En los receptores adrenérgicos β 1 y β 2 , actúa como un agonista parcial con una afinidad relativamente baja (β 1 = K act = 309 μM, IA= 53%; β 2 = 10 μM; IA = 47%). [84] Fue un antagonista o agonista parcial muy débil del receptor β 3 -adrenérgico (K act = ND ; IA = 7%). [84] Es aproximadamente 30.000 a 40.000 veces menos potente como agonista del receptor β-adrenérgico que el (–)-isoproterenol . [84]
El principal mecanismo de acción de la pseudoefedrina se basa en su acción sobre el sistema adrenérgico. [85] [86] Se cree que la vasoconstricción que produce la pseudoefedrina es principalmente una respuesta del receptor α-adrenérgico. [87] La pseudoefedrina actúa sobre los receptores α- y β 2 -adrenérgicos, para causar vasoconstricción y relajación del músculo liso en los bronquios, respectivamente. [85] [86] Los receptores α-adrenérgicos están ubicados en los músculos que recubren las paredes de los vasos sanguíneos. Cuando estos receptores se activan, los músculos se contraen, lo que hace que los vasos sanguíneos se contraigan (vasoconstricción). Los vasos sanguíneos constreñidos ahora permiten que menos líquido salga de los vasos sanguíneos y entre en la nariz, la garganta y los revestimientos de los senos nasales, lo que resulta en una disminución de la inflamación de las membranas nasales, así como en una disminución de la producción de moco. Así, por constricción de los vasos sanguíneos, principalmente los localizados en las fosas nasales, la pseudoefedrina produce una disminución de los síntomas de congestión nasal. [2] La activación de los receptores β 2 -adrenérgicos produce relajación del músculo liso de los bronquios, [85] provocando dilatación bronquial y disminuyendo a su vez la congestión (aunque no el líquido) y la dificultad respiratoria.
La pseudoefedrina es menos potente como simpaticomimético y psicoestimulante que la efedrina . [1] [55] Estudios clínicos han encontrado que la pseudoefedrina es aproximadamente de 3,5 a 4 veces menos potente que la efedrina como agente simpaticomimético en términos de aumento de la presión arterial y de 3,5 a 7,2 veces o más menos potente como broncodilatador . [55] También se dice que la pseudoefedrina tiene mucho menos efecto central que la efedrina y que es solo un psicoestimulante débil. [25] [55] [2] [75] [62] Los vasos sanguíneos de la nariz son aproximadamente cinco veces más sensibles que el corazón a las acciones de la epinefrina circulante (adrenalina), lo que puede ayudar a explicar cómo la pseudoefedrina en las dosis bajas utilizadas en productos de venta libre puede producir descongestión nasal con efectos mínimos en el corazón. [2] En comparación con la dextroanfetamina , la pseudoefedrina es aproximadamente de 30 a 35 veces menos potente como agente liberador de noradrenalina y de 80 a 350 veces menos potente como agente liberador de dopamina in vitro . [24] [80] [81]
La pseudoefedrina es un inhibidor reversible muy débil de la monoaminooxidasa (MAO) in vitro , incluidas tanto la MAO-A como la MAO-B (K i = 1000–5800 μM). [88] Es mucho menos potente en esta acción que otros agentes como la dextroanfetamina y la moclobemida . [88]
La pseudoefedrina es activa por vía oral y se absorbe fácilmente en el tracto gastrointestinal . [1] [2] Su biodisponibilidad oral es de aproximadamente el 100%. [8] El fármaco alcanza concentraciones máximas después de 1 a 4 horas (media de 1,9 horas) en el caso de la formulación de liberación inmediata y después de 2 a 6 horas en el caso de la formulación de liberación prolongada . [1] [2] El inicio de acción de la pseudoefedrina es de 30 minutos. [1]
La pseudoefedrina, debido a su falta de grupos fenólicos polares , es relativamente lipofílica . [11] Esta es una propiedad que comparte con agentes simpaticomiméticos y descongestionantes relacionados como la efedrina y la fenilpropanolamina . [11] Estos agentes se distribuyen ampliamente por todo el cuerpo y cruzan la barrera hematoencefálica . [11] Sin embargo, se dice que la pseudoefedrina y la fenilpropanolamina cruzan la barrera hematoencefálica solo hasta cierto punto y que la pseudoefedrina tiene una actividad limitada en el sistema nervioso central , lo que sugiere que es parcialmente selectiva periféricamente . [25] [26] La permeabilidad de la barrera hematoencefálica de la pseudoefedrina, la efedrina y la fenilpropanolamina se reduce en comparación con otras anfetaminas debido a la presencia de un grupo hidroxilo en el carbono β que disminuye su lipofilicidad . [26] Como tal, tienen una mayor proporción de efecto psicoestimulante cardiovascular periférico a central. [26] Además de entrar al cerebro, estas sustancias también atraviesan la placenta y entran en la leche materna . [11]
Se ha informado que la unión de la pseudoefedrina a las proteínas plasmáticas es de aproximadamente el 21 al 29 %. [9] [10] Se une a la α1 - glicoproteína ácida (AGP) y a la albúmina (HSA). [9] [10]
La pseudoefedrina no se metaboliza extensamente y está sujeta a un metabolismo mínimo de primer paso con la administración oral. [11] [1] [2] Debido a su grupo metilo en el carbono α (es decir, es una anfetamina ), la pseudoefedrina no es un sustrato para la monoaminooxidasa (MAO) y no es metabolizada por esta enzima . [25] [11] [68] [69] Tampoco es metabolizada por la catecol O -metiltransferasa (COMT). [25] La pseudoefedrina se desmetila en el metabolito norpseudoefedrina en una pequeña medida. [1] [11] De manera similar a la pseudoefedrina, este metabolito es activo y muestra efectos similares a los de la anfetamina . [11] Aproximadamente del 1 al 6% de la pseudoefedrina se metaboliza en el hígado a través de la N -desmetilación para formar norpseudoefedrina. [1]
La pseudoefedrina se excreta principalmente por vía renal en la orina . [1] [11] Su excreción urinaria está muy influenciada por el pH urinario y disminuye cuando la orina es ácida y aumenta cuando es alcalina . [1] [11] [55]
La vida media de eliminación de la pseudoefedrina es en promedio de 5,4 horas [2] y varía de 3 a 16 horas dependiendo del pH urinario. [1] [11] A un pH de 5,6 a 6,0, la vida media de eliminación de la pseudoefedrina fue de 5,2 a 8,0 horas. [11] En un estudio, un pH más ácido de 5,0 resultó en una vida media de 3,0 a 6,4 horas, mientras que un pH más alcalino de 8,0 resultó en una vida media de 9,2 a 16,0 horas. [11] Las sustancias que influyen en la acidez urinaria y se sabe que afectan la excreción de los derivados de la anfetamina incluyen agentes acidificantes urinarios como el ácido ascórbico y el cloruro de amonio , así como agentes alcalinizantes urinarios como la acetazolamida . [74]
La mayor parte de una dosis oral de pseudoefedrina se excreta sin cambios en la orina dentro de las 24 horas posteriores a su administración. [11] Se ha descubierto que este porcentaje varía entre el 43 y el 96 %. [1] [11] [2] La cantidad excretada sin cambios depende del pH urinario, al igual que la vida media del fármaco, ya que una vida media y una duración más prolongadas en el cuerpo permiten que el fármaco tenga más tiempo para metabolizarse. [11]
La duración de la acción de la pseudoefedrina, que depende de su eliminación , es de 4 a 12 horas. [1] [12]
Se ha informado que la pseudoefedrina se acumula en personas con insuficiencia renal . [89] [90] [91]
La pseudoefedrina, también conocida estructuralmente como (1 S ,2 S )-α, N -dimetil-β-hidroxifenetilamina o como (1 S ,2 S )- N -metil-β-hidroxianfetamina, es un derivado sustituido de fenetilamina , anfetamina y β-hidroxianfetamina . [1] [13] [2] Es un diastereómero de la efedrina . [28]
La pseudoefedrina es un compuesto de molécula pequeña con la fórmula molecular C 10 H 15 NO y un peso molecular de 165,23 g/mol. [27] [92] Tiene un log P experimental de 0,89, mientras que sus valores de log P previstos varían de 0,9 a 1,32. [27] [92] [93] El compuesto es relativamente lipofílico , [11] pero también es más hidrofílico que otras anfetaminas. [26] La lipofilicidad de las anfetaminas está estrechamente relacionada con su permeabilidad cerebral. [94] En comparación con la pseudoefedrina, el log P experimental de la metanfetamina es 2,1, [95] el de la anfetamina es 1,8, [96] [95] el de la efedrina es 1,1, [97] el de la fenilpropanolamina es 0,7, [98] el de la fenilefrina es -0,3, [99] y el de la norepinefrina es -1,2. [100] La metanfetamina tiene una alta permeabilidad cerebral, [95] mientras que la fenilefrina y la norepinefrina son drogas periféricamente selectivas . [2] [101] El log P óptimo para la permeabilidad cerebral y la actividad central es de aproximadamente 2,1 (rango 1,5-2,7). [102]
La pseudoefedrina se reduce fácilmente a metanfetamina o se oxida a metcatinona . [1]
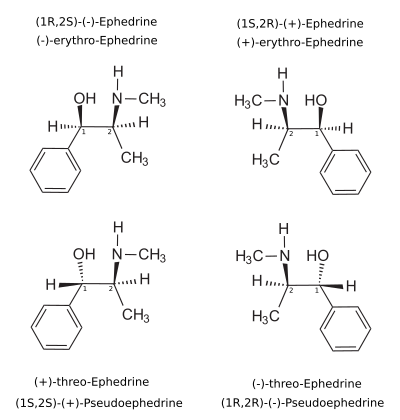
El enantiómero dextrógiro (+)- o d- es (1 S ,2 S )-pseudoefedrina, mientras que la forma levógira (−)- o l- es (1 R ,2 R )-pseudoefedrina.
En el anticuado sistema D/L, la (+)-pseudoefedrina también se conoce como L- pseudoefedrina y la (−)-pseudoefedrina como D- pseudoefedrina (en la proyección de Fisher , el anillo de fenilo se dibuja en la parte inferior). [103] [104]
A menudo se confunden el sistema D/L (con mayúsculas minúsculas ) y el sistema d/l (con minúsculas ). El resultado es que la d-pseudoefedrina dextrógira se denomina erróneamente D- pseudoefedrina y la l-efedrina levógira (el diastereómero) erróneamente L- efedrina.
Los nombres IUPAC de los dos enantiómeros son (1 S ,2 S )-, respectivamente (1 R ,2 R )-2-metilamino-1-fenilpropan-1-ol. Los sinónimos de ambos son psi -efedrina y treo -efedrina.
La pseudoefedrina es la DCIde la forma (+), cuando se utiliza como sustancia farmacéutica. [105]
La pseudoefedrina se puede cuantificar en sangre, plasma u orina para controlar cualquier posible uso para mejorar el rendimiento por parte de los atletas, confirmar un diagnóstico de envenenamiento o ayudar en una investigación médico-legal de muerte. Algunas pruebas de detección de inmunoensayo comerciales dirigidas a las anfetaminas reaccionan de forma cruzada apreciable con la pseudoefedrina, pero las técnicas cromatográficas pueden distinguir fácilmente la pseudoefedrina de otros derivados de la fenetilamina. Las concentraciones de pseudoefedrina en sangre o plasma suelen estar en el rango de 50 a 300 μg/L en personas que toman la droga con fines terapéuticos, de 500 a 3000 μg/L en personas con trastorno por consumo de sustancias que involucra pseudoefedrina o pacientes envenenados, y de 10 a 70 mg/L en casos de sobredosis mortal aguda . [106] [107]
Aunque la pseudoefedrina se encuentra de forma natural como alcaloide en ciertas especies de plantas (por ejemplo, como componente de extractos de la especie Ephedra , también conocida como ma huang , en la que se encuentra junto con otros isómeros de la efedrina ), la mayoría de la pseudoefedrina producida para uso comercial se deriva de la fermentación de la dextrosa por levaduras en presencia de benzaldehído . En este proceso, se añaden cepas especializadas de levadura (normalmente una variedad de Candida utilis o Saccharomyces cerevisiae ) a grandes cubas que contienen agua, dextrosa y la enzima piruvato descarboxilasa (como la que se encuentra en la remolacha y otras plantas). Una vez que la levadura ha comenzado a fermentar la dextrosa, se añade el benzaldehído a las cubas y, en este entorno, la levadura convierte los ingredientes en el precursor l-fenilacetilcarbinol (L-PAC). A continuación, el L-PAC se convierte químicamente en pseudoefedrina mediante aminación reductora . [108]
La mayor parte de la pseudoefedrina es producida por fabricantes farmacéuticos comerciales en India y China, donde las condiciones económicas e industriales favorecen su producción en masa para la exportación. [109]
La pseudoefedrina, junto con la efedrina , se encuentra de forma natural en la efedra . [13] [28] [110] Esta hierba se ha utilizado durante miles de años en la medicina tradicional china . [13] [28] [110] La pseudoefedrina fue aislada y caracterizada por primera vez en 1889 por los químicos alemanes Ladenburg y Oelschlägel, quienes utilizaron una muestra que había sido aislada de Ephedra vulgaris por la corporación farmacéutica Merck de Darmstadt , Alemania. [28] [29] [111] Se sintetizó por primera vez en la década de 1920 en Japón . [13] Posteriormente, la pseudoefedrina se introdujo para uso médico como descongestionante. [13]
Pseudoefedrina es el nombre genérico del medicamento y su DCI.y PROHIBIR, mientras que la pseudoefedrina es su DCFy la pseudoefedrina es su DCIT. [112] [113] [114] [115] El clorhidrato de pseudoefedrina es su USANy BANMen el caso de la sal de clorhidrato ; el sulfato de pseudoefedrina es su USAN en el caso de la sal de sulfato ; el polistirex de pseudoefedrina es su USAN en el caso de la forma polistirex; y el sulfato de d-isoefedrina es su JANen el caso de la sal de sulfato. [112] [113] [114] [115] La pseudoefedrina también se conoce como Ψ-efedrina e isoefedrina . [112] [114]
La siguiente es una lista de medicamentos de consumo que contienen pseudoefedrina o que han cambiado a una alternativa menos regulada como la fenilefrina .
La pseudoefedrina de venta libre se ha utilizado indebidamente como psicoestimulante . [17] Hasta 2021 se han publicado seis informes de casos y una serie de casos de uso indebido de pseudoefedrina. [17] Existe un informe de caso de automedicación con pseudoefedrina en dosis masivas para el tratamiento de la depresión . [17] [63]
La pseudoefedrina se ha utilizado como fármaco para mejorar el rendimiento en el ejercicio y los deportes debido a sus efectos simpaticomiméticos y estimulantes. [19] [20] Debido a estos efectos, la pseudoefedrina puede aumentar la frecuencia cardíaca , elevar la presión arterial , mejorar la energía mental y reducir la fatiga , entre otros efectos que mejoran el rendimiento. [19] [20] [22]
Una revisión sistemática de 2015 encontró que la pseudoefedrina carecía de efectos de mejora del rendimiento en dosis terapéuticas (60-120 mg), pero mejoraba significativamente el rendimiento atlético en dosis supraterapéuticas (≥180 mg). [19] Un metanálisis posterior de 2018 , que incluyó siete estudios adicionales, encontró que la pseudoefedrina tenía un pequeño efecto positivo en la frecuencia cardíaca ( SMD).= 0,43) pero efectos insignificantes en las pruebas de tiempo, las calificaciones de esfuerzo percibido, los niveles de glucosa en sangre y los niveles de lactato en sangre . [20] Sin embargo, los análisis de subgrupos revelaron que los tamaños del efecto fueron mayores para los aumentos de la frecuencia cardíaca y las pruebas de tiempo más rápidas en atletas bien entrenados y participantes más jóvenes, para sesiones de ejercicio más cortas con pseudoefedrina administrada dentro de los 90 minutos anteriores y con dosis más altas de pseudoefedrina. [20] Se estableció una relación dosis-respuesta , con dosis más grandes (>170 mg) mostrando mayores aumentos en la frecuencia cardíaca y pruebas de tiempo más rápidas que con dosis más pequeñas (≤170 mg) ( SMD = 0,85 para la frecuencia cardíaca y SMD = -0,24 para las pruebas de tiempo, respectivamente). [20] En cualquier caso, el metanálisis concluyó que los efectos de mejora del rendimiento de la pseudoefedrina fueron marginales a pequeños y probablemente menores en magnitud que con la cafeína . [20] Es relevante a este respecto que la cafeína es un estimulante permitido en los deportes de competición. [20]
La pseudoefedrina estuvo en la lista de sustancias prohibidas del Comité Olímpico Internacional (COI) hasta 2004, cuando la lista de la Agencia Mundial Antidopaje (AMA) reemplazó a la lista del COI. Aunque inicialmente la AMA sólo controlaba la pseudoefedrina, volvió a la lista de sustancias "prohibidas" el 1 de enero de 2010. [119]
La pseudoefedrina se excreta a través de la orina y la concentración de esta droga en la orina muestra una gran dispersión interindividual; es decir, la misma dosis puede dar lugar a una gran diferencia en la concentración urinaria para diferentes individuos. [120] La pseudoefedrina está aprobada para su uso en dosis de hasta 240 mg por día. En siete sujetos varones sanos, esta dosis produjo un rango de concentración urinaria de 62,8 a 294,4 microgramos por mililitro (μg/mL) con una media ± desviación estándar de 149 ± 72 μg/mL. [121] Por lo tanto, una dosis normal de 240 mg de pseudoefedrina por día puede dar lugar a niveles de concentración urinaria que superen el límite de 150 μg/mL establecido por la AMA para aproximadamente la mitad de todos los usuarios. [122] Además, el estado de hidratación no afecta a la concentración urinaria de pseudoefedrina. [123]
Su pertenencia a la clase de las anfetaminas ha hecho de la pseudoefedrina un precursor químico muy buscado en la fabricación ilícita de metanfetamina y metcatinona . [1] Como resultado de las crecientes restricciones regulatorias a la venta y distribución de pseudoefedrina, las empresas farmacéuticas han reformulado medicamentos para utilizar compuestos alternativos, particularmente fenilefrina , a pesar de que se ha demostrado que su eficacia como descongestionante oral es indistinguible del placebo. [133]
En los Estados Unidos, las leyes federales controlan la venta de productos que contienen pseudoefedrina. [134] [135] [136] Los minoristas en los EE. UU. han creado políticas corporativas que restringen la venta de productos que contienen pseudoefedrina. [137] [138] Sus políticas restringen las ventas al limitar las cantidades de compra y exigir una edad mínima y una identificación con fotografía emitida por el gobierno. [135] [136] Estos requisitos son similares y, a veces, más estrictos que la ley existente. A nivel internacional, la pseudoefedrina está incluida como precursora de la Tabla I en la Convención de las Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Psicotrópicas . [139]

El desvío ilícito de pseudoefedrina en Australia ha provocado cambios significativos en la forma en que se regulan los productos. A partir de 2006 [update], todos los productos que contienen pseudoefedrina han sido reclasificados como "Medicamentos de venta exclusiva para farmacéuticos" (Lista 3) o "Medicamentos de venta exclusiva para farmacéuticos" (Lista 4), según la cantidad de pseudoefedrina que contenga el producto. Un medicamento de venta exclusiva para farmacéuticos sólo puede venderse al público si un farmacéutico participa directamente en la transacción. Estos medicamentos deben conservarse detrás del mostrador, fuera del acceso del público.
También se alienta a los farmacéuticos (y en algunos estados se les exige) a registrar las compras en la base de datos en línea Project STOP. [140]
Como resultado, algunas farmacias ya no tienen Sudafed, la marca común de tabletas de pseudoefedrina para el resfriado y los senos nasales, y optan en su lugar por vender Sudafed PE, un producto de fenilefrina que no ha demostrado ser eficaz en ensayos clínicos. [133] [141] [2]
En Bélgica se encuentran disponibles sin receta varias formulaciones de pseudoefedrina. [142]
Health Canada ha investigado los riesgos y beneficios de la pseudoefedrina y la efedrina / Efedra . Cerca del final del estudio, Health Canada emitió una advertencia en su sitio web indicando que aquellos que son menores de 12 años, o que tienen enfermedades cardíacas y pueden tener accidentes cerebrovasculares, deben evitar tomar pseudoefedrina y efedrina. Además, advirtieron que todos deben evitar tomar efedrina o pseudoefedrina con otros estimulantes como la cafeína . También prohibieron todos los productos que contienen tanto efedrina (o pseudoefedrina) como cafeína. [143]
Los productos cuyo único ingrediente medicinal sea pseudoefedrina deben conservarse detrás del mostrador de la farmacia. Los productos que contengan pseudoefedrina junto con otros ingredientes medicinales pueden exhibirse en los estantes de las tiendas, pero sólo pueden venderse en una farmacia cuando esté presente un farmacéutico. [144] [145]
El gobierno colombiano prohibió el comercio de pseudoefedrina en 2010. [146]
La pseudoefedrina es un medicamento de venta libre en Estonia. [147]
Los medicamentos que contienen pseudoefedrina sólo pueden obtenerse con receta médica en Finlandia. [148] [ verificación fallida ]
Los medicamentos que contienen más de un 10% de pseudoefedrina están prohibidos por la Ley de Control de Estimulantes en Japón. [149]
El 23 de noviembre de 2007, el uso y comercio de pseudoefedrina en México se declaró ilegal, argumentándose que era extremadamente popular como precursor en la síntesis de metanfetamina. [150]
La pseudoefedrina se retiró del mercado en 1989 debido a preocupaciones sobre efectos secundarios cardíacos adversos. [151]
Desde abril de 2024, la pseudoefedrina está clasificada como una droga restringida (solo para farmacias) en la Ley de Uso Indebido de Drogas de 1975 , que permite la compra de medicamentos que contienen pseudoefedrina en una farmacia sin receta médica. [152]
La pseudoefedrina, la efedrina y cualquier producto que contenga estas sustancias, por ejemplo, los medicamentos contra la gripe y el resfriado, se clasificaron por primera vez en octubre de 2004 como drogas controladas de la Clase C Parte III (parcialmente exentas), debido a que son el ingrediente principal de la metanfetamina. [153] Los agentes de aduanas y de policía de Nueva Zelanda siguieron realizando grandes interceptaciones de sustancias precursoras que se creía que estaban destinadas a la producción de metanfetamina . El 9 de octubre de 2009, el Primer Ministro John Key anunció que las tabletas de pseudoefedrina para el resfriado y la gripe se convertirían en medicamentos de venta con receta y se reclasificarían como una droga de la clase B2. [154] La ley fue enmendada por la Ley de Enmienda sobre el Uso Indebido de Drogas de 2010, que se aprobó en agosto de 2011. [155]
El 24 de noviembre de 2023, el gobierno de coalición liderado por el Partido Nacional recientemente formado anunció que se permitiría la venta de medicamentos para el resfriado que contuvieran pseudoefedrina (como parte del acuerdo de coalición entre los partidos Nacional y ACT). [156]
En Turquía, los medicamentos que contienen pseudoefedrina sólo están disponibles con receta médica. [157]
En el Reino Unido, la pseudoefedrina se puede adquirir sin receta médica bajo la supervisión de un farmacéutico calificado, o con receta médica. En 2007, la MHRA reaccionó a las preocupaciones sobre el desvío de efedrina y pseudoefedrina para la fabricación ilícita de metanfetamina introduciendo restricciones voluntarias que limitaban las ventas sin receta médica a una caja que no contuviera más de 720 mg de pseudoefedrina en total por transacción. Estas restricciones se convirtieron en ley en abril de 2008. [158] No se requiere ningún tipo de identificación.
El Congreso de los Estados Unidos ha reconocido que la pseudoefedrina se utiliza en la fabricación ilegal de metanfetamina. En 2005, el Comité de Educación y Fuerza Laboral escuchó testimonios sobre programas educativos y leyes estatales diseñados para frenar esta práctica ilegal. [ cita requerida ]
Los intentos de controlar la venta de la droga se remontan a 1986, cuando los funcionarios federales de la Administración para el Control de Drogas (DEA) redactaron por primera vez una legislación, propuesta posteriormente por el senador Bob Dole , que habría incluido una serie de sustancias químicas utilizadas en la fabricación de drogas ilícitas bajo la Ley de Sustancias Controladas . El proyecto de ley habría exigido que cada transacción que involucrara pseudoefedrina se informara al gobierno, y que todas las importaciones y exportaciones recibieran la aprobación federal. Temiendo que esto limitara el uso legítimo de la droga, los grupos de presión de las asociaciones de fabricación de medicamentos de venta libre intentaron detener el avance de esta legislación y lograron eximir de las regulaciones a todas las sustancias químicas que se habían convertido en un producto final legal, como Sudafed. [159]
Antes de la aprobación de la Ley de Combate a la Epidemia de Metanfetamina de 2005 , las ventas de la droga se regularon cada vez más, ya que los reguladores de la DEA y las compañías farmacéuticas seguían luchando por sus respectivas posiciones. La DEA siguió haciendo mayores progresos en sus intentos de controlar la pseudoefedrina a medida que la producción de metanfetamina se disparaba, convirtiéndose en un problema grave en el oeste de los Estados Unidos. Cuando la pureza disminuyó, también lo hizo el número de personas en rehabilitación y personas ingresadas en salas de emergencia con metanfetamina en sus sistemas. Sin embargo, esta reducción en la pureza generalmente fue de corta duración, ya que los productores de metanfetamina finalmente encontraron una forma de eludir las nuevas regulaciones. [160]
El Congreso aprobó la Ley de Combate a la Epidemia de Metanfetamina de 2005 (CMEA, por sus siglas en inglés) como una enmienda a la renovación de la Ley Patriota de los EE. UU . [135] Firmada como ley por el presidente George W. Bush el 6 de marzo de 2006, [134] la ley modificó el 21 USC § 830, relativo a la venta de productos que contienen pseudoefedrina. La ley disponía de dos fases, la primera que debía implementarse antes del 8 de abril de 2006 y la segunda que debía completarse antes del 30 de septiembre de 2006. La primera fase se ocupaba principalmente de la aplicación de las nuevas restricciones de compra basadas en la cantidad, mientras que la segunda fase abarcaba los requisitos de almacenamiento, formación de los empleados y mantenimiento de registros. [161] Aunque la ley estaba dirigida principalmente a los productos de pseudoefedrina, también se aplica a todos los productos de venta libre que contienen efedrina, pseudoefedrina y fenilpropanolamina, sus sales, isómeros ópticos y sales de isómeros ópticos. [161] La pseudoefedrina se definió como un " producto químico incluido en la lista de sustancias reguladas " en virtud del artículo 802(45(A) del título 21 del Código de los Estados Unidos ). La ley incluía los siguientes requisitos para los comerciantes ("vendedores regulados") que venden dichos productos:
Los requisitos fueron revisados en la Ley de Prevención de la Producción de Metanfetamina de 2008 para exigir que un vendedor regulado de productos químicos incluidos en la lista de sustancias controladas no pueda vender dicho producto a menos que el comprador: [136]
La mayoría de los estados también tienen leyes que regulan la pseudoefedrina. [162] [163] [164]
Los estados de Alabama, Arizona, Arkansas, California, Colorado, Delaware, Florida, Georgia, Hawái (a partir del 1 de mayo de 2009 [update]), Idaho, Illinois, Indiana, Iowa, Kansas, Kentucky, Luisiana (a partir del 15 de agosto de 2009 [update]), Massachusetts, Michigan, Minnesota, Misisipi, Misuri, Montana, Nebraska, [165] Nevada, Nueva Jersey, Carolina del Norte, Ohio, Oklahoma, Oregón, Pensilvania, Dakota del Sur, Tennessee, Texas, Utah, Vermont, Virginia, Washington, Virginia Occidental y Wisconsin tienen leyes que exigen que las farmacias vendan pseudoefedrina "detrás del mostrador". Aunque el fármaco se puede comprar sin receta, los estados pueden limitar la cantidad de unidades vendidas y pueden recopilar información personal de los compradores. [166]
Los estados de Oregón y Misisipi exigían anteriormente una receta médica para la compra de productos que contenían pseudoefedrina. Sin embargo, a partir del 1 de enero de 2022, estas restricciones han sido derogadas. [167] [168] El estado de Oregón redujo el número de incautaciones de laboratorios de metanfetamina de 448 en 2004 (el último año completo antes de la implementación de la ley de prescripción médica únicamente) [169] a un nuevo mínimo de 13 en 2009. [170] La disminución de los incidentes en laboratorios de metanfetamina en Oregón se produjo en gran medida antes de que entrara en vigor la ley de prescripción médica únicamente, según un informe de NAMSDL titulado Pseudoephedrine Prescription Laws in Oregon and Mississippi . [166] El informe postula que la disminución de los incidentes en laboratorios de metanfetamina en ambos estados puede deberse a otros factores: "Los traficantes mexicanos pueden haber contribuido a la disminución de los laboratorios de metanfetamina en Misisipi y Oregón (y los estados circundantes), ya que pudieron proporcionar un amplio suministro de metanfetamina de igual o mayor calidad a precios competitivos". Además, según el informe, se observaron disminuciones similares en los incidentes de laboratorios de metanfetamina en los estados circundantes, y las muertes relacionadas con la metanfetamina en Oregón han aumentado drásticamente desde 2007. Algunos municipios de Missouri han promulgado ordenanzas similares, entre ellos Washington , [171] Union , [172] New Haven , [173] Cape Girardeau [174] y Ozark . [175] Algunas farmacias en Terre Haute, Indiana, también lo hacen. [176]
Otro enfoque para controlar la droga a nivel estatal, impuesto por algunos gobiernos estatales para controlar las compras de sus ciudadanos, es el uso de sistemas de seguimiento electrónico, que requieren la presentación electrónica de información específica del comprador por parte de todos los minoristas que venden pseudoefedrina. Treinta y dos estados exigen ahora que se utilice el National Precursor Log Exchange (NPLEx) para cada compra de pseudoefedrina y efedrina sin receta, y diez de las once cadenas de farmacias más grandes de los EE. UU. contribuyen voluntariamente con todas sus transacciones similares al NPLEx. Estos estados han visto resultados espectaculares en la reducción del número de incautaciones de laboratorios de metanfetamina. Antes de la implementación del sistema en Tennessee en 2005, las incautaciones de laboratorios de metanfetamina totalizaron 1.497 en 2004, pero se redujeron a 955 en 2005 y 589 en 2009. [170] El programa de Kentucky se implementó en todo el estado en 2008 y, desde su implementación en todo el estado, el número de incautaciones de laboratorios ha disminuido significativamente. [170] Oklahoma inicialmente tuvo éxito con su sistema de seguimiento después de su implementación en 2006, ya que el número de incautaciones disminuyó ese año y nuevamente en 2007. Sin embargo, en 2008, las incautaciones comenzaron a aumentar nuevamente y han seguido aumentando en 2009. [170]
Parece que el NPLEx ha tenido éxito al exigir la presentación en tiempo real de las transacciones, lo que permite que las leyes pertinentes se apliquen en el punto de venta. Al crear una base de datos multiestatal y la capacidad de comparar todas las transacciones rápidamente, el NPLEx permite a las farmacias rechazar compras que serían ilegales en función de los límites de gramos, la edad o incluso a los infractores condenados por consumo de metanfetamina en algunos estados. El NPLEx también hace cumplir los límites federales de gramos en todos los estados, lo que era imposible con los sistemas operados por los estados. El acceso a los registros lo tienen únicamente las agencias de aplicación de la ley, a través de un portal seguro en línea. [177]
Se ha estudiado la pseudoefedrina en el tratamiento de los ronquidos . [178] Sin embargo, los datos son inadecuados para respaldar este uso. [178]
Un estudio ha descubierto que la pseudoefedrina puede reducir la producción de leche en mujeres que amamantan . [179] [180] Esto podría deberse a la supresión de la secreción de prolactina . [180] La pseudoefedrina podría ser útil para la supresión de la lactancia . [179] [180]
También es relevante para otras aminas simpaticomiméticas contenidas en remedios de venta libre para la tos y el resfriado como descongestionantes, como la fenilpropanolamina y la pseudoefedrina. Por lo tanto, los inhibidores de la MAO potencian los efectos periféricos de las aminas simpaticomiméticas que actúan indirectamente. Sin embargo, no se suele tener en cuenta que esta potenciación se produce independientemente de si la amina es un sustrato para la MAO. Un grupo α-metilo en la cadena lateral, como en la anfetamina y la efedrina, hace que la amina sea inmune a la desaminación, de modo que no se metabolicen en el intestino. De manera similar, la β-PEA no se desaminaría en el intestino, ya que es un sustrato selectivo para la MAO-B, que no se encuentra en el intestino. Sin embargo, la inhibición de la MAO en las neuronas simpáticas permite que aumente el acervo citoplasmático de noradrenalina. Este acervo es el que liberan las aminas simpaticomiméticas que actúan indirectamente y, por lo tanto, sus respuestas se potencian independientemente de si son desaminadas por la MAO (Youdim y Finberg, 1991).
La metanfetamina actúa de manera similar a la anfetamina, pero con la adición del grupo metilo a la estructura química. Es más lipofílica (valor p de log 2,07, en comparación con 1,76 para la anfetamina),
4
lo que permite un transporte rápido y extenso a través de la barrera hematoencefálica.
19
La lipofilicidad fue el primero de los descriptores que se identificó como importante para la penetración en el SNC. Hansch y Leo54 razonaron que las moléculas altamente lipofílicas se dividirán en el interior lipídico de las membranas y se mantendrán allí. Sin embargo, ClogP se correlaciona bien con LogBBB y el aumento de la lipofilicidad aumenta la penetración en el cerebro. Para varias clases de sustancias activas en el SNC, Hansch y Leo54 descubrieron que la penetración de la barrera hematoencefálica es óptima cuando los valores de LogP están en el rango de 1,5 a 2,7, con un valor medio de 2,1. Un análisis de pequeñas moléculas similares a fármacos sugirió que para una mejor permeabilidad cerebral46 y para una buena permeabilidad intestinal55 los valores de LogD deben ser mayores que 0 y menores que 3. En comparación, el valor medio de ClogP para los fármacos comercializados para el SNC es 2,5, lo que concuerda bien con el rango encontrado por Hansch et al.22
{{cite web}}: CS1 maint: unfit URL (link)