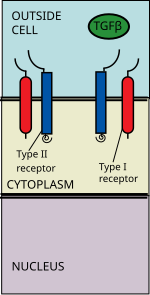
Vía de señalización del TGF-beta
La superfamilia de ligandos TGF beta incluyen: la proteína morfogénica ósea (BMPs), factores de crecimiento y diferenciación (GDFs), la hormona antimulleriana (AMH), Activina, Nodal y el TGFβ.
[6] Las BMP, por su parte, se unen al receptor de la proteína morfogénica ósea 2 (por sus siglas en inglés, BMPR2).
Al igual que las BMPs, las TGF-beta están implicadas en la embriogénesis y la diferenciación celular.
Además están asociadas también a la apoptosis, así como otras funciones celulares.
[12] La proteína «nodal» se une al receptor de la activina A tipo IIB (por sus siglas en inglés, ACVR2B).
[3] Cuándo la unión receptor-ligando ocurre vía acción local, se conoce como efecto paracrino.
El dominio GS del receptor TGF-beta 1 está formado por una serie repetitiva de unos treinta groupos serina y glicina.
[17] El SARA está presente en los endosomas recién sintetizados los cuales, por endocitosis mediada por clatrina, interioriza el complejo receptor.
[19] SARA ahora guía al R-Smad y la orienta de tal manera que el residuo serina presente en su región C-terminal es presentado a la región catalítica del receptor TGF-beta 1.
En esta conformación, el receptor TGF-beta 1 fosforila al residuo serina del R-Smad.
[21] Las proteínas morfogénicas óseas causan la transcripción de mRNA implicado en la osteogenesis, neurogénesis, y especificación del mesodermo ventral.
[23][24] Se unen al BMP impidiendo la unión del ligando a su receptor.
Ambas proteínas se encuentran en el labio dorsal de la especie Xenopus y convierten tejidos especializados al epidermis en tejido neuronal por medio de un proceso llamado neurulación.
La noggina juega un peple clave en el patrón del cartílago y el hueso.
Estas proteínas contienen nueve cisteínas conservadas las cuales pueden formar puentes disulfuros.
[25] La proteína Lefty es un regulador de la TGFβ y está implicada en el patrón axial del animal durante la embriogénesis.
[27] Los antagonistas basados en farmacología también han sido identificados, incluyendo el SB431542, el cual inhibe de manera selectiva al ALK4, ALK5, y ALK7.
Uno de los blancos agua abajo de la señalización TGF β es el GIPC, el cual se une a su dominio PDZ, el cual impide su degradación proteosomal, y posteriormente aumenta la actividad TGFβ.