
Una red alimentaria marina es una red alimentaria de vida marina . En la base de la red alimentaria oceánica se encuentran las algas unicelulares y otros organismos similares a plantas conocidos como fitoplancton . El segundo nivel trófico ( consumidores primarios ) está ocupado por el zooplancton que se alimenta del fitoplancton . Los consumidores de orden superior completan la red. En los últimos años se ha reconocido cada vez más que los microorganismos marinos .
Los hábitats dan lugar a variaciones en las redes alimentarias. Las redes de interacciones tróficas también pueden proporcionar mucha información sobre el funcionamiento de los ecosistemas marinos.
En comparación con los ambientes terrestres, los ambientes marinos tienen pirámides de biomasa que están invertidas en la base. En particular, la biomasa de los consumidores (copépodos, krill, camarones, peces forrajeros) es mayor que la biomasa de los productores primarios . Esto sucede porque los productores primarios del océano son fitoplancton diminuto que crece y se reproduce rápidamente, por lo que una masa pequeña puede tener una tasa rápida de producción primaria . En contraste, muchos productores primarios terrestres importantes, como los bosques maduros , crecen y se reproducen lentamente, por lo que se necesita una masa mucho mayor para lograr la misma tasa de producción primaria. Debido a esta inversión, es el zooplancton el que constituye la mayor parte de la biomasa animal marina .
Las redes alimentarias se construyen a partir de cadenas alimentarias . Todas las formas de vida en el mar tienen el potencial de convertirse en alimento para otra forma de vida. En el océano, una cadena alimentaria generalmente comienza con la energía del sol que alimenta al fitoplancton y sigue un curso como el siguiente:
fitoplancton → zooplancton herbívoro → zooplancton carnívoro → filtrador → vertebrado depredador
El fitoplancton no necesita otros organismos para alimentarse, ya que tiene la capacidad de fabricar su propio alimento directamente a partir del carbono inorgánico, utilizando la luz solar como fuente de energía. Este proceso se llama fotosíntesis y da como resultado que el fitoplancton convierta el carbono natural en protoplasma . Por esta razón, se dice que el fitoplancton es el productor primario en el nivel inferior o primer nivel de la cadena alimentaria marina. Dado que se encuentran en el primer nivel, se dice que tienen un nivel trófico de 1 (del griego trophē, que significa alimento). El fitoplancton luego es consumido en el siguiente nivel trófico de la cadena alimentaria por animales microscópicos llamados zooplancton.
El zooplancton constituye el segundo nivel trófico de la cadena alimentaria e incluye organismos unicelulares microscópicos llamados protozoos , así como pequeños crustáceos , como copépodos y krill , y larvas de peces, calamares, langostas y cangrejos. Los organismos de este nivel pueden considerarse consumidores primarios .
A su vez, el zooplancton herbívoro más pequeño es consumido por zooplancton carnívoros más grandes, como los protozoos depredadores más grandes y el krill , y por peces forrajeros , que son peces pequeños que se alimentan por filtración y forman cardúmenes . Esto constituye el tercer nivel trófico en la cadena alimentaria.
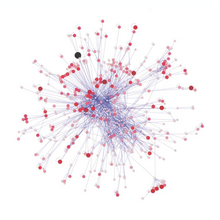
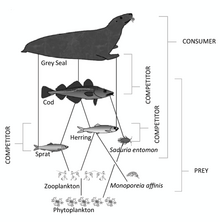
El cuarto nivel trófico está formado por peces depredadores , mamíferos marinos y aves marinas que consumen peces forrajeros, como el pez espada , las focas y los alcatraces .
Los depredadores de ápice, como las orcas , que pueden consumir focas, y los tiburones marrajo , que pueden consumir peces espada, conforman un quinto nivel trófico. Las ballenas barbadas pueden consumir zooplancton y krill directamente, lo que da lugar a una cadena alimentaria con solo tres o cuatro niveles tróficos.
En la práctica, los niveles tróficos no suelen ser números enteros simples porque la misma especie consumidora a menudo se alimenta en más de un nivel trófico. [4] [5] Por ejemplo, un gran vertebrado marino puede comer peces depredadores más pequeños, pero también puede comer animales filtradores; la raya come crustáceos , pero el tiburón martillo come tanto crustáceos como rayas. Los animales también pueden comerse entre sí; el bacalao come bacalaos más pequeños y cangrejos de río , y los cangrejos de río comen larvas de bacalao. Los hábitos alimentarios de un animal juvenil y, en consecuencia, su nivel trófico, pueden cambiar a medida que crece.
El científico pesquero Daniel Pauly establece los valores de los niveles tróficos en uno para los productores primarios y los detritos , dos para los herbívoros y detritívoros (consumidores primarios), tres para los consumidores secundarios, y así sucesivamente. La definición del nivel trófico, TL, para cualquier especie consumidora es [6]
donde es el nivel trófico fraccional de la presa j , y representa la fracción de j en la dieta de i . En el caso de los ecosistemas marinos, el nivel trófico de la mayoría de los peces y otros consumidores marinos toma un valor entre 2,0 y 5,0. El valor superior, 5,0, es inusual, incluso para peces grandes, [7] aunque se da en depredadores de ápice de mamíferos marinos, como osos polares y orcas. [8] Como punto de contraste, los humanos tienen un nivel trófico medio de aproximadamente 2,21, aproximadamente el mismo que un cerdo o una anchoa. [9] [10]
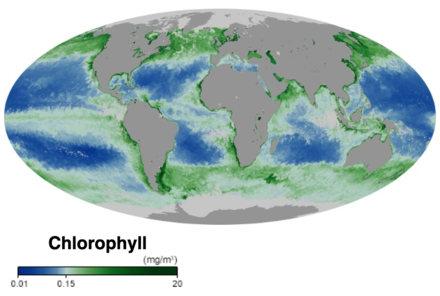
En la base de la red alimentaria oceánica se encuentran las algas unicelulares y otros organismos similares a plantas conocidos como fitoplancton . El fitoplancton es un grupo de autótrofos microscópicos divididos en un conjunto diverso de grupos taxonómicos basados en la morfología , el tamaño y el tipo de pigmento. El fitoplancton marino habita principalmente en aguas superficiales iluminadas por el sol como fotoautótrofos y requiere nutrientes como nitrógeno y fósforo, así como luz solar para fijar carbono y producir oxígeno. Sin embargo, algunos fitoplancton marino habitan en las profundidades marinas, a menudo cerca de respiraderos de aguas profundas , como quimioautótrofos que utilizan fuentes de electrones inorgánicos como sulfuro de hidrógeno , hierro ferroso y amoníaco . [12]
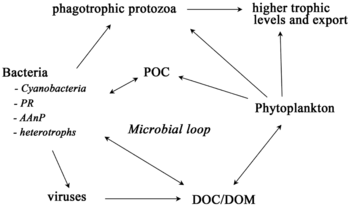
No se puede entender un ecosistema sin conocer cómo su red alimentaria determina el flujo de materiales y energía. El fitoplancton produce biomasa de forma autótrofa al convertir compuestos inorgánicos en orgánicos . De esta manera, el fitoplancton funciona como la base de la red alimentaria marina al sustentar todas las demás formas de vida en el océano. El segundo proceso central en la red alimentaria marina es el circuito microbiano . Este circuito degrada las bacterias y arqueas marinas , remineraliza la materia orgánica e inorgánica y luego recicla los productos ya sea dentro de la red alimentaria pelágica o depositándolos como sedimento marino en el fondo marino. [13]
El fitoplancton marino constituye la base de la red alimentaria marina, representa aproximadamente la mitad de la fijación global de carbono y la producción de oxígeno mediante la fotosíntesis [14] y es un vínculo clave en el ciclo global del carbono. [15] Al igual que las plantas terrestres, el fitoplancton utiliza clorofila y otros pigmentos que captan luz para realizar la fotosíntesis , absorbiendo dióxido de carbono atmosférico para producir azúcares como combustible. La clorofila en el agua cambia la forma en que el agua refleja y absorbe la luz solar, lo que permite a los científicos mapear la cantidad y la ubicación del fitoplancton. Estas mediciones brindan a los científicos información valiosa sobre la salud del entorno oceánico y ayudan a los científicos a estudiar el ciclo del carbono oceánico . [11]
Si el fitoplancton muere antes de ser devorado, desciende a través de la zona eufótica como parte de la nieve marina y se deposita en las profundidades del mar. De esta manera, el fitoplancton secuestra alrededor de 2 mil millones de toneladas de dióxido de carbono en el océano cada año, haciendo que el océano se convierta en un sumidero de dióxido de carbono que contiene aproximadamente el 90% de todo el carbono secuestrado. [16] El océano produce aproximadamente la mitad del oxígeno del mundo y almacena 50 veces más dióxido de carbono que la atmósfera. [17]

Entre el fitoplancton se encuentran miembros de un filo de bacterias llamadas cianobacterias . Las cianobacterias marinas incluyen los organismos fotosintéticos más pequeños conocidos. El más pequeño de todos, Prochlorococcus , tiene solo entre 0,5 y 0,8 micrómetros de diámetro. [18] En términos de números individuales, Prochlorococcus es posiblemente la especie más abundante en la Tierra: un solo mililitro de agua de mar superficial puede contener 100.000 células o más. En todo el mundo se estima que hay varios octillones (10 27 ) de individuos. [19] Prochlorococcus es ubicuo entre 40°N y 40°S y domina en las regiones oligotróficas (pobres en nutrientes) de los océanos. [20] La bacteria representa aproximadamente el 20% del oxígeno en la atmósfera de la Tierra. [21]
En los océanos, la mayor parte de la producción primaria la realizan las algas . Esto contrasta con lo que ocurre en la tierra, donde la mayor parte de la producción primaria la realizan las plantas vasculares . Las algas varían desde células flotantes individuales hasta algas marinas adheridas , mientras que las plantas vasculares están representadas en el océano por grupos como las praderas marinas y los manglares . Los productores más grandes, como las praderas marinas y las algas marinas , se limitan principalmente a la zona litoral y las aguas poco profundas, donde se adhieren al sustrato subyacente y aún se encuentran dentro de la zona fótica . Pero la mayor parte de la producción primaria de las algas la realiza el fitoplancton.
Así, en los ambientes oceánicos, el primer nivel trófico inferior está ocupado principalmente por fitoplancton , organismos microscópicos a la deriva, en su mayoría algas unicelulares , que flotan en el mar. La mayor parte del fitoplancton es demasiado pequeño para ser visto individualmente a simple vista . Pueden aparecer como una decoloración (a menudo verde) del agua cuando están presentes en cantidades suficientemente altas. Dado que aumentan su biomasa principalmente a través de la fotosíntesis, viven en la capa superficial iluminada por el sol ( zona eufótica ) del mar.
Los grupos más importantes del fitoplancton incluyen las diatomeas y los dinoflagelados . Las diatomeas son especialmente importantes en los océanos, donde según algunas estimaciones contribuyen hasta con el 45% de la producción primaria total del océano. [22] Las diatomeas suelen ser microscópicas , aunque algunas especies pueden alcanzar hasta 2 milímetros de longitud.

El segundo nivel trófico ( consumidores primarios ) está ocupado por el zooplancton , que se alimenta del fitoplancton . Junto con el fitoplancton, forman la base de la pirámide alimentaria que sustenta la mayor parte de las grandes zonas de pesca del mundo. Gran parte del zooplancton son animales diminutos que se encuentran con el fitoplancton en las aguas superficiales oceánicas , e incluyen pequeños crustáceos y larvas y alevines de peces (peces recién nacidos). La mayoría del zooplancton se alimenta por filtración y utiliza apéndices para filtrar el fitoplancton en el agua. Algunos zooplancton más grandes también se alimentan de zooplancton más pequeño. Algunos zooplancton pueden saltar un poco para evitar a los depredadores, pero no pueden nadar realmente. Al igual que el fitoplancton, flotan con las corrientes, las mareas y los vientos. El zooplancton puede reproducirse rápidamente, sus poblaciones pueden aumentar hasta un treinta por ciento al día en condiciones favorables. Muchos viven vidas cortas y productivas y alcanzan la madurez rápidamente.
Los oligotricos son un grupo de ciliados que poseen prominentes cilios orales dispuestos como un collar y una solapa. Son muy comunes en las comunidades de plancton marino, encontrándose normalmente en concentraciones de alrededor de uno por mililitro. Son los herbívoros más importantes del mar, el primer eslabón de la cadena alimentaria. [23]
Otros grupos de zooplancton particularmente importantes son los copépodos y el krill . Los copépodos son un grupo de pequeños crustáceos que se encuentran en hábitats oceánicos y de agua dulce . Son la mayor fuente de proteínas en el mar, [24] y son presas importantes para los peces forrajeros. El krill constituye la siguiente fuente más importante de proteínas. El krill es un zooplancton depredador particularmente grande que se alimenta de zooplancton más pequeño. Esto significa que realmente pertenecen al tercer nivel trófico, consumidores secundarios, junto con los peces forrajeros.

Juntos, el fitoplancton y el zooplancton constituyen la mayor parte del plancton del mar. Plancton es el término que se aplica a cualquier pequeño organismo a la deriva que flota en el mar ( del griego planktos = vagabundo o vagabundo). Por definición, los organismos clasificados como plancton son incapaces de nadar contra las corrientes oceánicas; no pueden resistir la corriente ambiental y controlar su posición. En los ambientes oceánicos, los dos primeros niveles tróficos están ocupados principalmente por el plancton . El plancton se puede dividir en productores y consumidores. Los productores son el fitoplancton (del griego phyton = planta) y los consumidores, que se alimentan del fitoplancton, son el zooplancton (del griego zoon = animal).
Las medusas son nadadoras lentas y la mayoría de las especies forman parte del plancton. Tradicionalmente, las medusas han sido vistas como callejones sin salida tróficos. Con planes corporales basados en gran medida en el agua, generalmente se consideró que tenían un impacto limitado en los ecosistemas marinos, atrayendo la atención de depredadores especializados como el pez luna y la tortuga laúd . [26] [25] Esa visión ha sido cuestionada recientemente. Las medusas, y más generalmente el zooplancton gelatinoso que incluye salpas y ctenóforos , son muy diversos, frágiles sin partes duras, difíciles de ver y monitorear, sujetos a rápidos cambios de población y a menudo viven incómodamente lejos de la costa o en las profundidades del océano. Es difícil para los científicos detectar y analizar medusas en los intestinos de los depredadores, ya que se convierten en papilla cuando se comen y se digieren rápidamente. [26] Pero las medusas proliferan en grandes cantidades, y se ha demostrado que forman componentes importantes en las dietas del atún , el pez aguja y el pez espada , así como de varias aves e invertebrados como pulpos , pepinos de mar , cangrejos y anfípodos . [27] [25] "A pesar de su baja densidad energética, la contribución de las medusas a los presupuestos energéticos de los depredadores puede ser mucho mayor de lo que se supone debido a la rápida digestión, los bajos costos de captura, la disponibilidad y la alimentación selectiva de los componentes más ricos en energía. La alimentación de medusas puede hacer que los depredadores marinos sean susceptibles a la ingestión de plásticos". [25]

En 2010, los investigadores descubrieron que las ballenas transportan nutrientes desde las profundidades del océano hasta la superficie mediante un proceso al que denominaron bomba de ballena . [29] Las ballenas se alimentan en niveles más profundos del océano donde se encuentra el krill , pero vuelven regularmente a la superficie para respirar. Allí, las ballenas defecan un líquido rico en nitrógeno y hierro. En lugar de hundirse, el líquido permanece en la superficie, donde el fitoplancton lo consume. En el Golfo de Maine, la bomba de ballena proporciona más nitrógeno que los ríos. [30]

En los últimos años se ha reconocido cada vez más que los microorganismos marinos desempeñan papeles mucho más importantes en los ecosistemas marinos de lo que se creía anteriormente. Los avances en metagenómica brindan a los investigadores la capacidad de revelar diversidades de vida microscópica que antes estaban ocultas, lo que ofrece una lente poderosa para observar el mundo microbiano y el potencial de revolucionar la comprensión del mundo viviente. [32] Las técnicas de análisis dietético con metacodificación de barras se están utilizando para reconstruir redes alimentarias a niveles más altos de resolución taxonómica y están revelando complejidades más profundas en la red de interacciones. [33]
Los microorganismos desempeñan papeles clave en las redes alimentarias marinas. La vía de derivación viral es un mecanismo que impide que la materia orgánica particulada (MOP) microbiana marina migre a niveles tróficos superiores al reciclarla en materia orgánica disuelta (MOD), que puede ser absorbida fácilmente por los microorganismos. [34] La derivación viral ayuda a mantener la diversidad dentro del ecosistema microbiano al impedir que una sola especie de microbio marino domine el microambiente. [35] La MOD reciclada por la vía de derivación viral es comparable a la cantidad generada por las otras fuentes principales de MOD marina. [36]
En general, el carbono orgánico disuelto (COD) se introduce en el ambiente oceánico a partir de la lisis bacteriana, la fuga o exudación de carbono fijado del fitoplancton (por ejemplo, exopolímero mucilaginoso de diatomeas ), la senescencia celular repentina, la alimentación descuidada del zooplancton, la excreción de productos de desecho por animales acuáticos o la descomposición o disolución de partículas orgánicas de plantas terrestres y suelos. [37] Las bacterias en el circuito microbiano descomponen este detrito particulado para utilizar esta materia rica en energía para el crecimiento. Dado que más del 95% de la materia orgánica en los ecosistemas marinos consiste en compuestos poliméricos de alto peso molecular (APM) (por ejemplo, proteínas, polisacáridos, lípidos), solo una pequeña porción de la materia orgánica disuelta total (DOM) es fácilmente utilizable para la mayoría de los organismos marinos en niveles tróficos superiores. Esto significa que el carbono orgánico disuelto no está disponible directamente para la mayoría de los organismos marinos; las bacterias marinas introducen este carbono orgánico en la red alimentaria, lo que resulta en energía adicional disponible para niveles tróficos superiores.
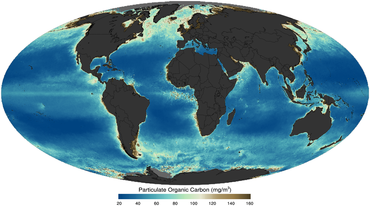
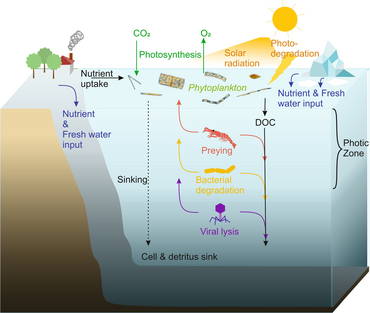
Los virus son las "entidades biológicas más abundantes del planeta", [41] particularmente en los océanos que ocupan más del 70% de la superficie de la Tierra. [41] [42] La constatación en 1989 de que normalmente hay unos 100 virus marinos en cada mililitro de agua de mar [43] dio impulso a la comprensión de su diversidad y su papel en el entorno marino. [42] Ahora se considera que los virus desempeñan papeles clave en los ecosistemas marinos al controlar la dinámica de la comunidad microbiana , el estado metabólico del huésped y el ciclo biogeoquímico a través de la lisis de los huéspedes . [41] [42] [44] [45]
Un virus marino gigante CroV infecta y causa la muerte por lisis del zooflagelado marino Cafeteria roenbergensis . [46] Esto afecta la ecología costera porque Cafeteria roenbergensis se alimenta de bacterias que se encuentran en el agua. Cuando hay un bajo número de Cafeteria roenbergensis debido a infecciones extensas de CroV, las poblaciones bacterianas aumentan exponencialmente. [47] El impacto de CroV en las poblaciones naturales de C. roenbergensis sigue siendo desconocido; sin embargo, se ha descubierto que el virus es muy específico del huésped y no infecta a otros organismos estrechamente relacionados. [48] Cafeteria roenbergensis también está infectada por un segundo virus, el virófago Mavirus , que es un virus satélite , lo que significa que solo puede replicarse en presencia de otro virus específico, en este caso en presencia de CroV. [49] Este virus interfiere con la replicación de CroV, lo que conduce a la supervivencia de las células de C. roenbergensis . Mavirus puede integrarse en el genoma de las células de C. roenbergensis y, por lo tanto, conferir inmunidad a la población. [50]
Los quitridios parásitos pueden transferir material del fitoplancton no comestible de gran tamaño al zooplancton. Las zoosporas de los quitridios son un excelente alimento para el zooplancton en términos de tamaño (2–5 μm de diámetro), forma y calidad nutricional (rica en ácidos grasos poliinsaturados y colesteroles ). Las colonias grandes de fitoplancton hospedante también pueden fragmentarse por infecciones de quitridios y volverse comestibles para el zooplancton. [51]
Los hongos parásitos , así como los hongos saprotróficos , asimilan directamente el carbono orgánico del fitoplancton. Al liberar zoosporas , los hongos establecen un puente entre el enlace trófico y el zooplancton , conocido como microbucle . Al modificar el carbono orgánico particulado y disuelto , pueden afectar a las bacterias y al bucle microbiano . Estos procesos pueden modificar la composición química de la nieve marina y el funcionamiento posterior de la bomba biológica de carbono . [52] [53]
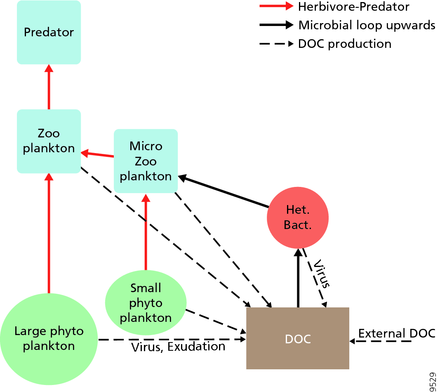
En 1995, Legendre y Rassoulzadagan propusieron para los ecosistemas pelágicos un continuo de vías tróficas con la cadena alimentaria herbívora y el bucle microbiano como miembros finales de la red alimentaria. [55] El miembro final clásico de la cadena alimentaria lineal implica el pastoreo por parte del zooplancton de fitoplancton de mayor tamaño y la posterior depredación del zooplancton por parte de zooplancton de mayor tamaño u otro depredador. En una cadena alimentaria lineal de este tipo, un depredador puede conducir a una alta biomasa de fitoplancton (en un sistema con fitoplancton, herbívoro y un depredador) o a una biomasa reducida de fitoplancton (en un sistema con cuatro niveles). Los cambios en la abundancia de depredadores pueden, por tanto, conducir a cascadas tróficas . [56] El miembro final del bucle microbiano implica no solo al fitoplancton, como recurso basal, sino también al carbono orgánico disuelto . [57] Las bacterias heterotróficas utilizan el carbono orgánico disuelto para su crecimiento y son depredadas por el zooplancton de mayor tamaño. En consecuencia, el carbono orgánico disuelto se transforma, a través de un circuito bacteriano-microzooplancton, en zooplancton. Estas dos vías de procesamiento de carbono de miembros finales están conectadas en múltiples niveles. El fitoplancton pequeño puede ser consumido directamente por el microzooplancton. [54]
Como se ilustra en el diagrama de la derecha, el carbono orgánico disuelto se produce de múltiples maneras y por varios organismos, tanto por productores primarios como por consumidores de carbono orgánico. La liberación de DOC por parte de los productores primarios ocurre pasivamente por fuga y activamente durante el crecimiento desequilibrado durante la limitación de nutrientes. [58] [59] Otra vía directa del fitoplancton al depósito orgánico disuelto implica la lisis viral . [60] Los virus marinos son una de las principales causas de mortalidad del fitoplancton en el océano, particularmente en aguas más cálidas y de baja latitud. La alimentación descuidada por parte de los herbívoros y la digestión incompleta de las presas por parte de los consumidores son otras fuentes de carbono orgánico disuelto. Los microbios heterotróficos utilizan enzimas extracelulares para solubilizar el carbono orgánico particulado y utilizan este y otros recursos de carbono orgánico disuelto para el crecimiento y el mantenimiento. Parte de la producción heterotrófica microbiana es utilizada por el microzooplancton; otra parte de la comunidad heterotrófica está sujeta a una lisis viral intensa y esto provoca la liberación de carbono orgánico disuelto nuevamente. La eficiencia del ciclo microbiano depende de múltiples factores, pero en particular de la importancia relativa de la depredación y la lisis viral en la mortalidad de los microbios heterotróficos. [54]
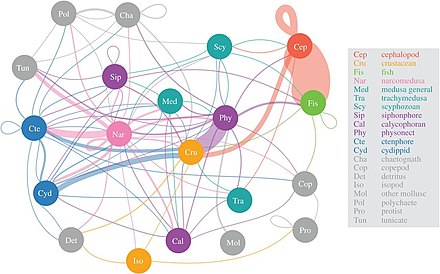
Los científicos están empezando a explorar con más detalle la zona crepuscular, en gran parte desconocida, de la capa mesopelágica , de 200 a 1.000 metros de profundidad. Esta capa es responsable de eliminar alrededor de 4.000 millones de toneladas de dióxido de carbono de la atmósfera cada año. La capa mesopelágica está habitada por la mayor parte de la biomasa de peces marinos . [63]
Según un estudio de 2017, las narcomedusas consumen la mayor diversidad de presas mesopelágicas, seguidas de los sifonóforos fisonectos , los ctenóforos y los cefalópodos . La importancia de la llamada "red de gelatina" apenas está comenzando a entenderse, pero parece que las medusas, los ctenóforos y los sifonóforos pueden ser depredadores clave en las redes alimentarias pelágicas profundas con impactos ecológicos similares a los de los peces depredadores y los calamares. Tradicionalmente, se pensaba que los depredadores gelatinosos eran proveedores ineficaces de vías tróficas marinas, pero parecen tener papeles sustanciales e integrales en las redes alimentarias pelágicas profundas. [64] La migración vertical diaria , un importante mecanismo de transporte activo, permite al mesozooplancton secuestrar dióxido de carbono de la atmósfera, así como satisfacer las necesidades de carbono de otros organismos mesopelágicos. [65]
Un estudio de 2020 informó que para 2050 el calentamiento global podría estar propagándose en las profundidades oceánicas siete veces más rápido que ahora, incluso si se reducen las emisiones de gases de efecto invernadero. El calentamiento en las capas mesopelágicas y más profundas podría tener consecuencias importantes para la red alimentaria de las profundidades oceánicas, ya que las especies oceánicas necesitarán desplazarse para mantenerse a temperaturas de supervivencia. [66] [67]
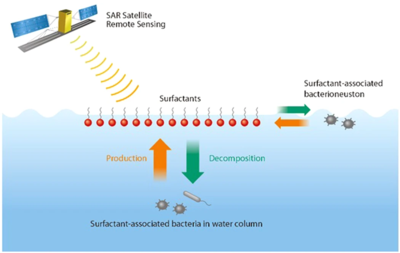
Los hábitats de la superficie del océano se encuentran en la interfaz entre el océano y la atmósfera. El hábitat similar a una biopelícula en la superficie del océano alberga microorganismos que viven en la superficie, comúnmente conocidos como neuston . Esta vasta interfaz aire-agua se encuentra en la intersección de los principales procesos de intercambio aire-agua que abarcan más del 70% de la superficie global. Las bacterias en la microcapa superficial del océano, el llamado bacterioneuston , son de interés debido a aplicaciones prácticas como el intercambio de gases de efecto invernadero entre el aire y el mar, la producción de aerosoles marinos activos para el clima y la teledetección del océano. [71] De interés específico es la producción y degradación de surfactantes (materiales activos en la superficie) a través de procesos bioquímicos microbianos. Las principales fuentes de surfactantes en el océano abierto incluyen el fitoplancton, [72] la escorrentía terrestre y la deposición de la atmósfera. [71]
A diferencia de las floraciones de algas coloreadas, las bacterias asociadas a los surfactantes pueden no ser visibles en las imágenes en color del océano. Tener la capacidad de detectar estas bacterias "invisibles" asociadas a los surfactantes mediante un radar de apertura sintética tiene enormes beneficios en todas las condiciones climáticas, independientemente de las nubes, la niebla o la luz del día. [71] Esto es particularmente importante en vientos muy fuertes, porque estas son las condiciones en las que se producen los intercambios de gases aire-mar y la producción de aerosoles marinos más intensos. Por lo tanto, además de las imágenes satelitales en color, las imágenes satelitales SAR pueden proporcionar información adicional sobre un panorama global de los procesos biofísicos en el límite entre el océano y la atmósfera, los intercambios de gases de efecto invernadero aire-mar y la producción de aerosoles marinos activos para el clima. [71]
Los hábitats del fondo oceánico ( bentónicos ) se encuentran en la interfaz entre el océano y el interior de la Tierra.
Las aguas costeras incluyen las aguas de los estuarios y las de las plataformas continentales . Ocupan alrededor del 8 por ciento de la superficie total del océano [77] y representan aproximadamente la mitad de toda la productividad oceánica. Los nutrientes clave que determinan la eutrofización son el nitrógeno en las aguas costeras y el fósforo en los lagos. Ambos se encuentran en altas concentraciones en el guano (excrementos de aves marinas), que actúa como fertilizante para el océano circundante o un lago adyacente. El ácido úrico es el compuesto nitrogenado dominante y durante su mineralización se producen diferentes formas de nitrógeno. [78]
Los ecosistemas, incluso aquellos con fronteras aparentemente distintas, rara vez funcionan independientemente de otros sistemas adyacentes. [79] Los ecologistas reconocen cada vez más los importantes efectos que el transporte de energía y nutrientes entre ecosistemas tiene sobre las poblaciones y comunidades de plantas y animales. [80] [81] Un ejemplo bien conocido de esto es cómo las aves marinas concentran nutrientes derivados del mar en islas de reproducción en forma de heces (guano) que contienen ≈15–20% de nitrógeno (N), así como 10% de fósforo. [82] [83] [84] Estos nutrientes alteran drásticamente el funcionamiento y la dinámica de los ecosistemas terrestres y pueden sustentar una mayor productividad primaria y secundaria. [85] [86] Sin embargo, aunque muchos estudios han demostrado el enriquecimiento de nitrógeno de los componentes terrestres debido a la deposición de guano en varios grupos taxonómicos, [85] [87] [88] [89] solo unos pocos han estudiado su retroacción en los ecosistemas marinos y la mayoría de estos estudios se restringieron a regiones templadas y aguas con alto contenido de nutrientes. [82] [90] [91] [92] En los trópicos, los arrecifes de coral se pueden encontrar adyacentes a islas con grandes poblaciones de aves marinas reproductoras, y podrían verse potencialmente afectados por el enriquecimiento local de nutrientes debido al transporte de nutrientes derivados de las aves marinas en las aguas circundantes. Los estudios sobre la influencia del guano en los ecosistemas marinos tropicales sugieren que el nitrógeno del guano enriquece el agua de mar y los productores primarios de los arrecifes. [90] [93] [94]
Los corales constructores de arrecifes tienen necesidades esenciales de nitrógeno y, al prosperar en aguas tropicales pobres en nutrientes [95] donde el nitrógeno es un importante nutriente limitante para la productividad primaria, [96] han desarrollado adaptaciones específicas para conservar este elemento. Su establecimiento y mantenimiento se deben en parte a su simbiosis con dinoflagelados unicelulares, Symbiodinium spp. (zooxantelas), que pueden absorber y retener nitrógeno inorgánico disuelto (amonio y nitrato) de las aguas circundantes. [97] [98] [99] Estas zooxantelas también pueden reciclar los desechos animales y posteriormente transferirlos de vuelta al huésped coral en forma de aminoácidos, [100] amonio o urea. [101] Los corales también pueden ingerir partículas de sedimento ricas en nitrógeno [102] [103] y plancton. [104] [105] La eutrofización costera y el exceso de suministro de nutrientes pueden tener fuertes impactos en los corales, lo que lleva a una disminución del crecimiento esquelético, [98] [106] [107] [108] [94]
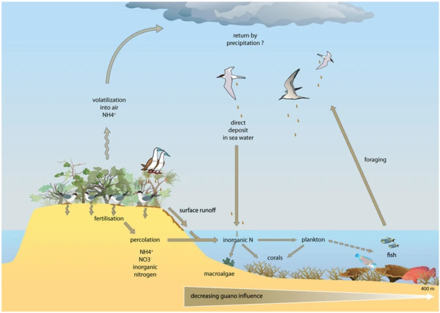
En el diagrama de arriba a la derecha: (1) la amonificación produce NH 3 y NH 4 + y (2) la nitrificación produce NO 3 − por oxidación de NH 4 + . (3) bajo las condiciones alcalinas, típicas de las heces de las aves marinas, el NH 3 se volatiliza rápidamente y se transforma en NH 4 + , (4) que se transporta fuera de la colonia, y a través de la deposición húmeda se exporta a ecosistemas distantes, que son eutrofizados. El ciclo del fósforo es más simple y tiene una movilidad reducida. Este elemento se encuentra en varias formas químicas en el material fecal de las aves marinas, pero el más móvil y biodisponible es el ortofosfato , (5) que puede ser lixiviado por aguas subterráneas o superficiales. [78]
Los códigos de barras de ADN pueden utilizarse para construir estructuras de redes alimentarias con una mejor resolución taxonómica en los nodos de la red. Esto permite una identificación más específica de las especies y una mayor claridad sobre quién se come a quién. "Los códigos de barras de ADN y la información de ADN pueden permitir nuevos enfoques para la construcción de redes de interacción más grandes y superar algunos obstáculos para lograr un tamaño de muestra adecuado". [33]
Un método recientemente aplicado para la identificación de especies es la codificación de barras metabólica del ADN . La identificación de especies a través de la morfología es relativamente difícil y requiere mucho tiempo y experiencia. [119] [120] La codificación de barras metabólica del ADN mediante secuenciación de alto rendimiento permite la asignación taxonómica y, por lo tanto, la identificación de la muestra completa con respecto a los cebadores específicos del grupo elegidos para la amplificación de ADN anterior .
Los sistemas marinos del Ártico y la Antártida tienen estructuras topográficas muy diferentes y, en consecuencia, estructuras de redes alimentarias muy diferentes. [121] Tanto las redes alimentarias pelágicas del Ártico como las de la Antártida tienen flujos de energía característicos controlados en gran medida por unas pocas especies clave. Pero no existe una única red genérica para ninguna de ellas. Las vías alternativas son importantes para la resiliencia y el mantenimiento de los flujos de energía. Sin embargo, estas alternativas más complicadas proporcionan un flujo de energía menor a las especies de niveles tróficos superiores. "La estructura de la red alimentaria puede ser similar en diferentes regiones, pero las especies individuales que dominan los niveles tróficos medios varían en las regiones polares". [122]

La red alimentaria del Ártico es compleja. La pérdida de hielo marino puede afectar a toda la red alimentaria, desde las algas y el plancton hasta los peces y los mamíferos. El impacto del cambio climático en una especie en particular puede repercutir en toda la red alimentaria y afectar a una amplia gama de otros organismos... La disminución del hielo marino no solo está perjudicando a las poblaciones de osos polares al reducir la extensión de su hábitat primario, sino que también las está afectando negativamente a través de efectos en la red alimentaria. La disminución de la duración y la extensión del hielo marino en el Ártico conduce a una disminución de la abundancia de algas de hielo, que prosperan en bolsas de hielo ricas en nutrientes. Estas algas son consumidas por el zooplancton, que a su vez es consumido por el bacalao del Ártico, una fuente importante de alimento para muchos mamíferos marinos, incluidas las focas. Las focas son consumidas por los osos polares. Por lo tanto, la disminución de las algas de hielo puede contribuir a la disminución de las poblaciones de osos polares. [123]
En 2020, los investigadores informaron que las mediciones realizadas durante las últimas dos décadas sobre la producción primaria en el océano Ártico muestran un aumento de casi el 60 % debido a mayores concentraciones de fitoplancton . Plantearon la hipótesis de que están llegando nuevos nutrientes desde otros océanos y sugirieron que esto significa que el océano Ártico podría ser capaz de soportar una mayor producción de nivel trófico y una fijación adicional de carbono en el futuro. [124] [125]



Además de las variadas topografías y a pesar de un clima extremadamente frío, las regiones acuáticas polares están repletas de vida microbiana . Incluso en las regiones subglaciales, la vida celular se ha adaptado a estos entornos extremos donde tal vez haya rastros de microbios primitivos en la Tierra. Como el pastoreo de la macrofauna es limitado en la mayoría de estas regiones polares, los virus están siendo reconocidos por su papel como importantes agentes de mortalidad, influyendo así en el ciclo biogeoquímico de los nutrientes que, a su vez, impactan en la dinámica de la comunidad a escalas estacionales y espaciales. [45]
Los microorganismos están en el corazón de las redes alimentarias del Ártico y la Antártida. Estos entornos polares contienen una amplia gama de comunidades microbianas bacterianas , arqueales y eucariotas que, junto con los virus , son componentes importantes de los ecosistemas polares. [135] [136] [137] Se encuentran en una variedad de hábitats, incluidos lagos subglaciales y agujeros de crioconita , lo que hace que los biomas fríos de estas regiones polares estén repletos de microorganismos metabólicamente diversos y sitios de ciclo biogeoquímico activo. [138] [139] [140] Estos entornos, que cubren aproximadamente una quinta parte de la superficie de la Tierra y que son inhóspitos para la vida humana, albergan comunidades microbianas únicas. [135] [140] [141] La microbiota residente de las dos regiones tiene una similitud de solo un 30%, lo que no es necesariamente sorprendente dada la conectividad limitada de los océanos polares y la diferencia en el suministro de agua dulce, que proviene de los deshielos glaciares y los ríos que drenan en el Océano Austral y el Océano Ártico, respectivamente. [141] La separación no se debe solo a la distancia: la Antártida está rodeada por el Océano Austral, que es impulsado por la fuerte Corriente Circumpolar Antártica , mientras que el Ártico está rodeado de masas de tierra. Estas topografías tan diferentes resultaron del traslado de los dos continentes a las regiones polares opuestas del planeta hace unos 40–25 millones de años. Los datos magnéticos y de gravedad apuntan a la evolución del Ártico, impulsado por las cuencas amerasiática y euroasiática , desde hace 145 a 161 millones de años hasta una región polar fría de agua y hielo rodeada de tierra. [142] [143] [144] La Antártida se formó a partir de la ruptura del supercontinente Gondwana , una masa de tierra rodeada por el Océano Austral. [135] [145] El continente antártico está permanentemente cubierto de hielo glacial , y solo el 0,4% de su superficie comprende tierra expuesta salpicada de lagos y estanques. [45]
Los microbios, tanto procariotas como eucariotas , presentes en estos ambientes son en gran medida diferentes entre los dos polos. [141] [146] Por ejemplo, el 78% de las unidades taxonómicas operativas bacterianas (UTO) de las comunidades de aguas superficiales del Océano Austral y el 70% del Océano Ártico son exclusivas de cada polo. [141] Las regiones polares son variables en el tiempo y el espacio: el análisis de la región V6 del gen de ARNr de subunidad pequeña (SSU) ha dado como resultado alrededor de 400.000 secuencias genéticas y más de 11.000 UTO de 44 muestras polares del Ártico y el Océano Austral. Estas UTO se agrupan por separado para las dos regiones polares y, además, exhiben diferencias significativas solo en las comunidades de bacterioplancton polar de diferentes ambientes (costa y océano abierto) y diferentes estaciones. [141] [45]
Las regiones polares se caracterizan por tener redes alimentarias truncadas, y es probable que el papel de los virus en el funcionamiento de los ecosistemas sea incluso mayor que en otras partes de la red alimentaria marina. Su diversidad aún está relativamente poco explorada, y no se comprende bien cómo afectan a las comunidades polares, [139] en particular en el ciclo de nutrientes. [137] [147] [148] [45]
.jpg/440px-Kelp_Forest_(12801115735).jpg)
El concepto de especie fundacional fue introducido en 1972 por Paul K. Dayton [ 150] , quien lo aplicó a ciertos miembros de las comunidades de invertebrados marinos y algas . A partir de estudios realizados en varios lugares, quedó claro que había un pequeño puñado de especies cuyas actividades tenían un efecto desproporcionado en el resto de la comunidad marina y, por lo tanto, eran clave para la resiliencia de la comunidad. La opinión de Dayton era que centrarse en las especies fundacionales permitiría un enfoque simplificado para comprender más rápidamente cómo reaccionaría una comunidad en su conjunto a las perturbaciones, como la contaminación, en lugar de intentar la tarea extremadamente difícil de rastrear las respuestas de todos los miembros de la comunidad simultáneamente.
Las especies fundadoras son aquellas que tienen un papel dominante en la estructuración de una comunidad ecológica , dando forma a su entorno y definiendo su ecosistema. Dichos ecosistemas suelen recibir el nombre de las especies fundadoras, como las praderas de pastos marinos, los bancos de ostras, los arrecifes de coral, los bosques de algas y los bosques de manglares. [151] Por ejemplo, el mangle rojo es una especie fundadora común en los bosques de manglares. La raíz del manglar proporciona zonas de cría para peces jóvenes, como el pargo . [152] Una especie fundadora puede ocupar cualquier nivel trófico en una red alimentaria, pero tiende a ser productora. [153]
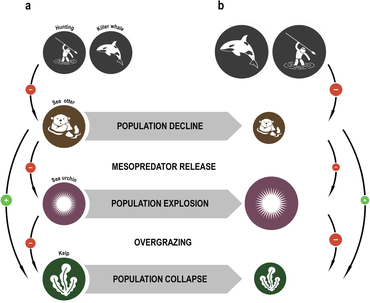
El concepto de especie clave fue introducido en 1969 por el zoólogo Robert T. Paine . [154] [155] Paine desarrolló el concepto para explicar sus observaciones y experimentos sobre las relaciones entre los invertebrados marinos de la zona intermareal (entre las líneas de marea alta y baja), incluyendo las estrellas de mar y los mejillones . Algunas estrellas de mar se alimentan de erizos de mar , mejillones y otros mariscos que no tienen otros depredadores naturales. Si la estrella de mar es eliminada del ecosistema, la población de mejillones explota sin control, expulsando a la mayoría de las otras especies. [156]
Las especies clave son aquellas que tienen efectos importantes, desproporcionados a su número, dentro de las redes alimentarias de los ecosistemas. [157] Un ecosistema puede experimentar un cambio drástico si se elimina una especie clave, aunque esa especie fuera una pequeña parte del ecosistema según las medidas de biomasa o productividad . [158] Las nutrias marinas limitan el daño que los erizos de mar infligen a los bosques de algas . Cuando las nutrias marinas de la costa oeste de América del Norte fueron cazadas comercialmente por su piel, su número cayó a niveles tan bajos que no pudieron controlar la población de erizos de mar. Los erizos, a su vez, pastaron en los bancos de algas tan intensamente que los bosques de algas desaparecieron en gran medida, junto con todas las especies que dependían de ellos. La reintroducción de las nutrias marinas ha permitido restaurar el ecosistema de algas. [159] [160]
Las redes de interacciones tróficas pueden proporcionar mucha información sobre el funcionamiento de los ecosistemas marinos. Además de los hábitos alimentarios, tres características adicionales (movilidad, tamaño y hábitat) de varios organismos pueden complementar esta visión trófica. [161]

Para mantener el funcionamiento adecuado de los ecosistemas, es necesario comprender mejor la sencilla pregunta que formuló Lawton en 1994: ¿Qué hacen las especies en los ecosistemas? [162] Dado que los roles ecológicos y las posiciones en la red alimentaria no son independientes, [163] es necesario plantearse la cuestión de qué tipo de especies ocupan las distintas posiciones en la red. [161] Desde los primeros intentos de identificar especies clave, [164] [165] ha habido un interés en su lugar en las redes alimentarias. [166] [167] Primero se sugirió que eran depredadores superiores, luego también plantas, herbívoros y parásitos. [168] [169] Tanto para la ecología de comunidades como para la biología de la conservación, sería útil saber dónde se encuentran en redes tróficas complejas. [161]
En el diagrama se muestra un ejemplo de este tipo de análisis de redes , basado en datos de una red alimentaria marina. [170] Muestra las relaciones entre las posiciones topológicas de los nodos de la red y los valores de movilidad de los organismos involucrados. Los nodos de la red están codificados por forma según su movilidad y codificados por colores utilizando índices que enfatizan (A) los grupos de abajo hacia arriba (sésiles y derivantes) y (B) los grupos en la parte superior de la red alimentaria. [161]
La importancia relativa de los organismos varía con el tiempo y el espacio, y observar bases de datos grandes puede proporcionar información general sobre el problema. Si diferentes tipos de organismos ocupan diferentes tipos de posiciones en la red, entonces ajustar esto en el modelado de la red alimentaria dará como resultado predicciones más confiables. Se realizaron comparaciones de los índices de centralidad entre sí (la similitud de la centralidad de grado y la centralidad de proximidad , [171] los índices de piedra angular y de piedra angular, [172] y los índices de centralidad versus el nivel trófico (la mayoría de las especies de alta centralidad en niveles tróficos medios) [173] para comprender mejor las posiciones críticamente importantes de los organismos en las redes alimentarias. Extender este interés agregando datos de rasgos a los grupos tróficos ayuda a la interpretación biológica de los resultados. Las relaciones entre los índices de centralidad también se han estudiado para otros tipos de redes, incluidas las redes de hábitat. [174] [175] Con bases de datos grandes y nuevos análisis estadísticos, preguntas como estas pueden volver a investigarse y el conocimiento puede actualizarse. [161]

Las interacciones crípticas, interacciones que están "ocultas a simple vista", ocurren a lo largo de la red alimentaria planctónica marina, pero actualmente los métodos establecidos las pasan por alto en gran medida, lo que significa que la recopilación de datos a gran escala para estas interacciones es limitada. A pesar de esto, la evidencia actual sugiere que algunas de estas interacciones pueden tener impactos perceptibles en la dinámica de la red alimentaria y los resultados del modelo. La incorporación de interacciones crípticas en los modelos es especialmente importante para aquellas interacciones que involucran el transporte de nutrientes o energía. [176]
El diagrama ilustra los flujos de material, las poblaciones y los depósitos moleculares que se ven afectados por cinco interacciones crípticas: mixotrofia , diferencias ontogenéticas y de especies, alimentación cruzada microbiana, auxotrofia y partición celular de carbono. Estas interacciones pueden tener efectos sinérgicos, ya que las regiones de la red alimentaria que afectan se superponen. Por ejemplo, la partición celular de carbono en el fitoplancton puede afectar tanto a los depósitos de materia orgánica aguas abajo utilizados en la alimentación cruzada microbiana e intercambiados en casos de auxotrofia, como a la selección de presas basada en diferencias ontogenéticas y de especies. [176]
Simplificaciones como "el zooplancton consume fitoplancton", "el fitoplancton absorbe nutrientes inorgánicos", "la producción primaria bruta determina la cantidad de carbono disponible para la red alimentaria", etc. han ayudado a los científicos a explicar y modelar interacciones generales en el entorno acuático. Los métodos tradicionales se han centrado en cuantificar y calificar estas generalizaciones, pero los rápidos avances en genómica, límites de detección de sensores, métodos experimentales y otras tecnologías en los últimos años han demostrado que la generalización de interacciones dentro de la comunidad del plancton puede ser demasiado simple. Estas mejoras en la tecnología han puesto de manifiesto una serie de interacciones que parecen crípticas porque los esfuerzos de muestreo masivo y los métodos experimentales están sesgados en su contra. [176]
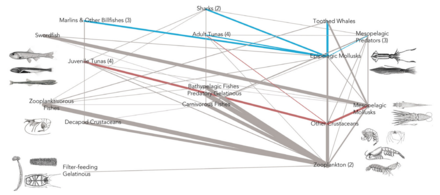
Las redes alimentarias proporcionan un marco dentro del cual se puede organizar una red compleja de interacciones depredador-presa. Un modelo de red alimentaria es una red de cadenas alimentarias . Cada cadena alimentaria comienza con un productor primario o autótrofo , un organismo, como un alga o una planta, que es capaz de fabricar su propio alimento. El siguiente en la cadena es un organismo que se alimenta del productor primario, y la cadena continúa de esta manera como una serie de depredadores sucesivos. Los organismos en cada cadena se agrupan en niveles tróficos , en función de cuántos eslabones se eliminan de los productores primarios. La longitud de la cadena, o nivel trófico, es una medida del número de especies encontradas a medida que la energía o los nutrientes se mueven de las plantas a los depredadores superiores. [179] La energía alimentaria fluye de un organismo al siguiente y al siguiente y así sucesivamente, con algo de energía perdiéndose en cada nivel. En un nivel trófico dado puede haber una especie o un grupo de especies con los mismos depredadores y presas. [180]
En 1927, Charles Elton publicó una síntesis influyente sobre el uso de las redes alimentarias, que resultó en que se convirtieran en un concepto central en ecología. [181] En 1966, el interés en las redes alimentarias aumentó después del estudio experimental y descriptivo de Robert Paine de las costas intermareales, sugiriendo que la complejidad de la red alimentaria era clave para mantener la diversidad de especies y la estabilidad ecológica. [182] Muchos ecólogos teóricos, incluidos Robert May y Stuart Pimm , se sintieron impulsados por este descubrimiento y otros a examinar las propiedades matemáticas de las redes alimentarias. Según sus análisis, las redes alimentarias complejas deberían ser menos estables que las redes alimentarias simples. [183] : 75–77 [184] : 64 La aparente paradoja entre la complejidad de las redes alimentarias observadas en la naturaleza y la fragilidad matemática de los modelos de redes alimentarias es actualmente un área de intenso estudio y debate. La paradoja puede deberse en parte a diferencias conceptuales entre la persistencia de una red alimentaria y la estabilidad equilibrada de una red alimentaria. [183] [184]
Una cascada trófica puede ocurrir en una red alimentaria si se suprime un nivel trófico en la red.
Por ejemplo, puede producirse una cascada descendente si los depredadores son lo suficientemente eficaces en la depredación como para reducir la abundancia o alterar el comportamiento de sus presas , liberando así de la depredación al siguiente nivel trófico inferior. Una cascada descendente es una cascada trófica en la que el principal consumidor/depredador controla la población de consumidores primarios . A su vez, la población de productores primarios prospera. La eliminación del principal depredador puede alterar la dinámica de la red alimentaria. En este caso, los consumidores primarios sobrepoblarían y explotarían a los productores primarios. Con el tiempo, no habría suficientes productores primarios para sostener la población de consumidores. La estabilidad de la red alimentaria descendente depende de la competencia y la depredación en los niveles tróficos superiores. Las especies invasoras también pueden alterar esta cascada eliminando o convirtiéndose en un depredador superior. Esta interacción puede no ser siempre negativa. Los estudios han demostrado que ciertas especies invasoras han comenzado a cambiar las cascadas y, como consecuencia, se ha reparado la degradación del ecosistema. [185] [186] Un ejemplo de una cascada en un ecosistema complejo de océano abierto ocurrió en el noroeste del Atlántico durante los años 1980 y 1990. La eliminación del bacalao del Atlántico ( Gadus morhua ) y otros peces de fondo por la sobrepesca sostenida resultó en aumentos en la abundancia de las especies presa para estos peces de fondo, particularmente peces forrajeros más pequeños e invertebrados como el cangrejo de las nieves del norte ( Chionoecetes opilio ) y el camarón del norte ( Pandalus borealis ). La mayor abundancia de estas especies presa alteró la comunidad de zooplancton que sirve de alimento para peces e invertebrados más pequeños como un efecto indirecto. [187] Las cascadas de arriba hacia abajo pueden ser importantes para comprender los efectos en cadena de la eliminación de los depredadores superiores de las redes alimentarias, como los humanos han hecho en muchos lugares a través de la caza y la pesca .
En una cascada de abajo hacia arriba, la población de productores primarios siempre controlará el aumento o la disminución de la energía en los niveles tróficos superiores. Los productores primarios son las plantas, el fitoplancton y el zooplancton que requieren la fotosíntesis. Aunque la luz es importante, las poblaciones de productores primarios se ven alteradas por la cantidad de nutrientes en el sistema. Esta red alimentaria depende de la disponibilidad y la limitación de los recursos. Todas las poblaciones experimentarán crecimiento si inicialmente hay una gran cantidad de nutrientes. [188] [189]
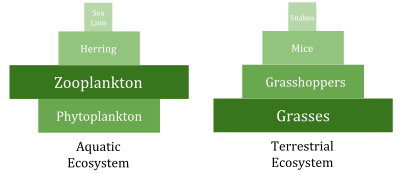
Los ambientes marinos pueden tener inversiones en sus pirámides de biomasa. En particular, la biomasa de los consumidores (copépodos, krill, camarones, peces forrajeros) es generalmente mayor que la biomasa de los productores primarios. Debido a esta inversión, es el zooplancton el que constituye la mayor parte de la biomasa animal marina . Como consumidores primarios , el zooplancton es el vínculo crucial entre los productores primarios (principalmente fitoplancton) y el resto de la red alimentaria marina ( consumidores secundarios ); [191] los productores primarios del océano son en su mayoría fitoplancton diminuto que tiene rasgos de r-estratega de crecimiento y reproducción rápida, por lo que una masa pequeña puede tener una tasa rápida de producción primaria.
Por el contrario, muchos productores primarios terrestres, como los bosques maduros, tienen rasgos de estratega K de crecimiento y reproducción lentos, por lo que se necesita una masa mucho mayor para lograr la misma tasa de producción primaria. La tasa de producción dividida por la cantidad promedio de biomasa que la logra se conoce como la relación Producción/Biomasa (P/B) de un organismo. [192] La producción se mide en términos de la cantidad de movimiento de masa o energía por área por unidad de tiempo. En contraste, la medición de biomasa se realiza en unidades de masa por unidad de área o volumen. La relación P/B utiliza unidades de tiempo inversas (ejemplo: 1/mes). Esta relación permite una estimación de la cantidad de flujo de energía en comparación con la cantidad de biomasa en un nivel trófico dado, lo que permite realizar demarcaciones entre niveles tróficos. La relación P/B disminuye más comúnmente a medida que aumenta el nivel trófico y el tamaño del organismo, y los organismos pequeños y efímeros contienen una relación P/B más alta que los grandes y duraderos.
Ejemplos: El pino longevo puede vivir miles de años y tiene una relación producción/biomasa muy baja. La cianobacteria Prochlorococcus vive unas 24 horas y tiene una relación producción/biomasa muy alta.
En los océanos, la mayor parte de la producción primaria la realizan las algas , a diferencia de lo que ocurre en la tierra, donde la mayor parte de la producción primaria la realizan las plantas vasculares .

Los productores acuáticos, como las algas planctónicas o las plantas acuáticas, carecen de la gran acumulación de crecimiento secundario que existe en los árboles leñosos de los ecosistemas terrestres. Sin embargo, son capaces de reproducirse lo suficientemente rápido como para soportar una mayor biomasa de herbívoros. Esto invierte la pirámide. Los consumidores primarios tienen una vida más larga y tasas de crecimiento más lentas que acumulan más biomasa que los productores que consumen. El fitoplancton vive solo unos días, mientras que el zooplancton que se alimenta del fitoplancton vive varias semanas y los peces que se alimentan del zooplancton viven varios años consecutivos. [195] Los depredadores acuáticos también tienden a tener una tasa de mortalidad menor que los consumidores más pequeños, lo que contribuye al patrón piramidal invertido. La estructura de la población, las tasas de migración y el refugio ambiental para las presas son otras posibles causas de las pirámides con biomasa invertida. Las pirámides de energía , sin embargo, siempre tendrán una forma de pirámide vertical si se incluyen todas las fuentes de energía alimentaria, ya que esto está dictado por la segunda ley de la termodinámica ". [196] [197]
La mayor parte de la materia orgánica producida se consume y se respira finalmente para formar carbono inorgánico . La tasa a la que la materia orgánica se conserva mediante el entierro mediante la acumulación de sedimentos es de solo entre 0,2 y 0,4 mil millones de toneladas por año, lo que representa una fracción muy pequeña de la producción total. [54] La producción mundial de fitoplancton es de aproximadamente 50 mil millones de toneladas por año y la biomasa de fitoplancton es de aproximadamente mil millones de toneladas, lo que implica un tiempo de renovación de una semana. Los macrófitos marinos tienen una biomasa global similar pero una producción de solo mil millones de toneladas por año, lo que implica un tiempo de renovación de un año. [198] Estas altas tasas de renovación (en comparación con la renovación global de la vegetación terrestre de una a dos décadas) [193] implican no solo una producción constante, sino también un consumo eficiente de materia orgánica. Existen múltiples vías de pérdida de materia orgánica (respiración por autótrofos y heterótrofos, pastoreo, lisis viral, ruta detrítica), pero todas finalmente resultan en respiración y liberación de carbono inorgánico. [54]


Los pterópodos y las estrellas de mar forman la base de las redes alimentarias del Ártico y ambas sufren graves daños por la acidificación. Las conchas de los pterópodos se disuelven con el aumento de la acidificación y las estrellas de mar pierden masa muscular cuando vuelven a crecer los apéndices. [200] Además, los huevos de las estrellas de mar mueren en unos pocos días cuando se exponen a las condiciones esperadas resultantes de la acidificación del Ártico. [201] La acidificación amenaza con destruir las redes alimentarias del Ártico desde la base hacia arriba. Las aguas del Ártico están cambiando rápidamente y están en un proceso avanzado de subsaturación con aragonito. [202] Las redes alimentarias del Ártico se consideran simples, lo que significa que hay pocos pasos en la cadena alimentaria desde los organismos pequeños hasta los depredadores más grandes. Por ejemplo, los pterópodos son "una presa clave de una serie de depredadores superiores: plancton de mayor tamaño, peces, aves marinas, ballenas". [203]
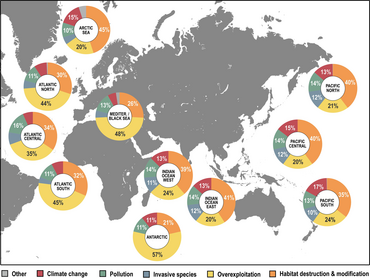
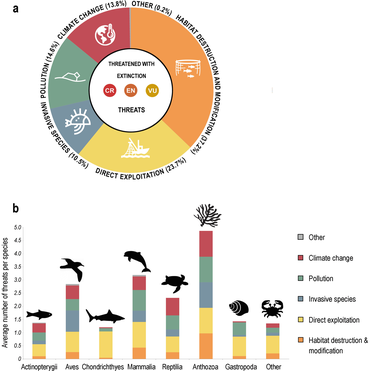
Los ecosistemas oceánicos son más sensibles al cambio climático que cualquier otro lugar de la Tierra. Esto se debe al aumento de las temperaturas y a la acidificación de los océanos. Con el aumento de las temperaturas oceánicas, se prevé que las especies de peces se desplazarán de sus áreas de distribución conocidas y se localizarán en nuevas zonas. Durante este cambio, el número de especies dentro de cada especie disminuirá significativamente. Actualmente, existen muchas relaciones entre depredadores y presas, en las que dependen unos de otros para sobrevivir. [204] Con un cambio en la ubicación de las especies, las relaciones/interacciones depredador-presa se verán muy afectadas. Todavía se están realizando estudios para comprender cómo afectarán estos cambios a la dinámica de la red alimentaria.
Mediante el uso de modelos, los científicos pueden analizar las interacciones tróficas en las que prosperan ciertas especies y debido a otras especies que también se encuentran en estas áreas. A través de modelos recientes, se ve que muchas de las especies marinas más grandes terminarán cambiando sus rangos a un ritmo más lento de lo que sugiere el cambio climático. Esto afectaría aún más la relación depredador-presa. Como las especies y organismos más pequeños tienen más probabilidades de verse influenciados por el calentamiento de los océanos y moverse antes que los mamíferos más grandes. [204] Se ve que estos depredadores permanecen más tiempo en sus rangos históricos antes de moverse debido al movimiento de las especies más pequeñas. Con "nuevas" especies entrando en el espacio de los mamíferos más grandes, la ecología cambia y hay más presas para alimentarse. [204] Las especies más pequeñas terminarían teniendo un rango más pequeño, mientras que los mamíferos más grandes habrían ampliado su rango. La dinámica cambiante tendrá grandes efectos en todas las especies dentro del océano y dará como resultado muchos más cambios que afectarán a todo nuestro ecosistema. Con el movimiento en donde los depredadores pueden encontrar presas dentro del océano, también afectará a la industria pesquera. [205] Si bien los pescadores actualmente saben dónde se encuentran determinadas especies de peces, a medida que se produzca el cambio será más difícil determinar dónde pasan su tiempo, lo que les costará más dinero ya que podrían tener que viajar más lejos. [206] Como resultado, esto podría afectar las regulaciones pesqueras actuales establecidas para ciertas áreas con el movimiento de estas poblaciones de peces.
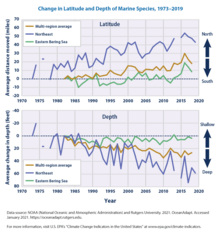
A través de una encuesta realizada en la Universidad de Princeton, los investigadores descubrieron que las especies marinas se mueven constantemente al ritmo de la "velocidad climática" o la velocidad y dirección en la que se mueven. Al analizar los datos de 1968 a 2011, se descubrió que el 70 por ciento de los cambios en las profundidades de los animales y el 74 por ciento de los cambios en la latitud estaban correlacionados con fluctuaciones a escala regional en la temperatura del océano. [209] Estos movimientos están haciendo que las especies se alejen entre 4,5 y 40 millas por década del ecuador. Con la ayuda de modelos, las regiones pueden predecir dónde pueden terminar las especies. Los modelos tendrán que adaptarse a los cambios a medida que se aprenda más sobre cómo el clima está afectando a las especies.
"Nuestros resultados muestran cómo el cambio climático futuro puede debilitar potencialmente las redes alimentarias marinas a través de un flujo de energía reducido a niveles tróficos más altos y un cambio hacia un sistema más basado en detritos, lo que conduce a la simplificación de la red alimentaria y a una dinámica alterada entre productores y consumidores, ambos con implicaciones importantes para la estructuración de las comunidades bentónicas". [210] [211]
"... el aumento de las temperaturas reduce el flujo vital de energía desde los productores primarios de alimentos en la base (por ejemplo, las algas), a los consumidores intermedios (herbívoros), a los depredadores en la parte superior de las redes alimentarias marinas. Esas perturbaciones en la transferencia de energía pueden conducir potencialmente a una disminución de la disponibilidad de alimentos para los depredadores superiores, lo que a su vez, puede producir impactos negativos para muchas especies marinas dentro de esas redes alimentarias... "Si bien el cambio climático aumentó la productividad de las plantas, esto se debió principalmente a una expansión de las cianobacterias (pequeñas algas verdeazuladas)", dijo el Sr. Ullah. "Sin embargo, este aumento de la productividad primaria no sustenta las redes alimentarias, porque estas cianobacterias son en gran parte desagradables al paladar y no son consumidas por los herbívoros. Comprender cómo funcionan los ecosistemas bajo los efectos del calentamiento global es un desafío para la investigación ecológica. La mayoría de las investigaciones sobre el calentamiento de los océanos implican experimentos simplificados y de corto plazo basados en una o unas pocas especies". [211]
{{cite web}}: CS1 maint: multiple names: authors list (link)