La tabla periódica , también conocida como tabla periódica de los elementos , es una disposición ordenada de los elementos químicos en filas (" períodos ") y columnas (" grupos "). Es un icono de la química y se utiliza ampliamente en física y otras ciencias. Es una representación de la ley periódica , que establece que cuando los elementos se organizan en orden de sus números atómicos es evidente una recurrencia aproximada de sus propiedades . La tabla está dividida en cuatro áreas aproximadamente rectangulares llamadas bloques . Los elementos del mismo grupo tienden a mostrar características químicas similares.
Las tendencias verticales, horizontales y diagonales caracterizan la tabla periódica. El carácter metálico aumenta al descender en un grupo y de derecha a izquierda a lo largo de un período. El carácter no metálico aumenta al descender desde la parte inferior izquierda de la tabla periódica hasta la parte superior derecha.
La primera tabla periódica que llegó a ser generalmente aceptada fue la del químico ruso Dmitri Mendeleev en 1869; formuló la ley periódica como una dependencia de las propiedades químicas de la masa atómica . Como no se conocían todos los elementos en ese momento, había lagunas en su tabla periódica, y Mendeleev utilizó con éxito la ley periódica para predecir algunas propiedades de algunos de los elementos faltantes . La ley periódica fue reconocida como un descubrimiento fundamental a fines del siglo XIX. Se explicó a principios del siglo XX, con el descubrimiento de los números atómicos y el trabajo pionero asociado en mecánica cuántica , ambas ideas sirvieron para iluminar la estructura interna del átomo. Una forma reconociblemente moderna de la tabla se alcanzó en 1945 con el descubrimiento de Glenn T. Seaborg de que los actínidos eran de hecho elementos del bloque f en lugar del bloque d. La tabla periódica y la ley son ahora una parte central e indispensable de la química moderna.
La tabla periódica continúa evolucionando con el progreso de la ciencia. En la naturaleza, solo existen elementos hasta el número atómico 94; [a] para ir más allá, fue necesario sintetizar nuevos elementos en el laboratorio. En 2010, se conocieron los primeros 118 elementos, completando así las primeras siete filas de la tabla; [1] sin embargo, aún se necesita la caracterización química de los elementos más pesados para confirmar que sus propiedades coinciden con sus posiciones. Nuevos descubrimientos extenderán la tabla más allá de estas siete filas , aunque aún no se sabe cuántos elementos más son posibles; además, los cálculos teóricos sugieren que esta región desconocida no seguirá los patrones de la parte conocida de la tabla. También continúa cierta discusión científica sobre si algunos elementos están correctamente posicionados en la tabla actual. Existen muchas representaciones alternativas de la ley periódica, y existe cierta discusión sobre si existe una forma óptima de la tabla periódica.

Cada elemento químico tiene un número atómico único ( Z — por "Zahl", en alemán "número") que representa el número de protones en su núcleo . [4] Por lo tanto, cada número atómico distinto corresponde a una clase de átomo: estas clases se denominan elementos químicos . [5] Los elementos químicos son lo que la tabla periódica clasifica y organiza. El hidrógeno es el elemento con número atómico 1; el helio , número atómico 2; el litio , número atómico 3; y así sucesivamente. Cada uno de estos nombres se puede abreviar con un símbolo químico de una o dos letras ; los del hidrógeno, el helio y el litio son respectivamente H, He y Li. [6] Los neutrones no afectan la identidad química del átomo, pero sí su peso. Los átomos con el mismo número de protones pero diferente número de neutrones se denominan isótopos del mismo elemento químico. [6] Los elementos naturales suelen presentarse como mezclas de diferentes isótopos; Dado que cada isótopo suele presentarse con una abundancia característica, los elementos naturales tienen pesos atómicos bien definidos , definidos como la masa promedio de un átomo natural de ese elemento. [7] Todos los elementos tienen múltiples isótopos , variantes con el mismo número de protones pero diferentes números de neutrones . Por ejemplo, el carbono tiene tres isótopos naturales: todos sus átomos tienen seis protones y la mayoría también tienen seis neutrones, pero aproximadamente el uno por ciento tiene siete neutrones y una fracción muy pequeña tiene ocho neutrones. Los isótopos nunca se separan en la tabla periódica; siempre se agrupan bajo un solo elemento. Cuando se muestra la masa atómica, generalmente es el promedio ponderado de los isótopos naturales; pero si ningún isótopo se presenta de forma natural en cantidades significativas, generalmente aparece la masa del isótopo más estable, a menudo entre paréntesis. [8]
En la tabla periódica estándar, los elementos se enumeran en orden creciente de número atómico. Una nueva fila ( período ) comienza cuando una nueva capa electrónica tiene su primer electrón . Las columnas ( grupos ) están determinadas por la configuración electrónica del átomo; los elementos con el mismo número de electrones en una subcapa particular caen en las mismas columnas (por ejemplo, oxígeno , azufre y selenio están en la misma columna porque todos tienen cuatro electrones en la subcapa p más externa). Los elementos con propiedades químicas similares generalmente caen en el mismo grupo en la tabla periódica, aunque en el bloque f, y en cierto sentido en el bloque d, los elementos en el mismo período tienden a tener propiedades similares también. Por lo tanto, es relativamente fácil predecir las propiedades químicas de un elemento si uno conoce las propiedades de los elementos que lo rodean. [9]
Hoy en día, se conocen 118 elementos, de los cuales los primeros 94 se sabe que se producen de forma natural en la Tierra en la actualidad. [10] [a] Los 24 restantes, desde el americio hasta el oganesón (95-118), solo se producen cuando se sintetizan en laboratorios. De los 94 elementos naturales, 83 son primordiales y 11 se producen solo en cadenas de desintegración de elementos primordiales. Algunos de estos últimos son tan raros que no se descubrieron en la naturaleza, sino que se sintetizaron en el laboratorio antes de que se determinara que existen en la naturaleza después de todo: tecnecio (elemento 43), prometio (elemento 61), astato (elemento 85), neptunio (elemento 93) y plutonio (elemento 94). [12] Nunca se ha observado ningún elemento más pesado que el einstenio (elemento 99) en cantidades macroscópicas en su forma pura, ni tampoco el astato ; El francio (elemento 87) sólo ha sido fotografiado en forma de luz emitida desde cantidades microscópicas (300.000 átomos). [14] De los 94 elementos naturales, ochenta tienen un isótopo estable y uno más ( bismuto ) tiene un isótopo casi estable (con una vida media de 2,01×10 19 años, más de mil millones de veces la edad del universo ). [15] [b] Dos más, el torio y el uranio , tienen isótopos que experimentan desintegración radiactiva con una vida media comparable a la edad de la Tierra . Los elementos estables más el bismuto, el torio y el uranio conforman los 83 elementos primordiales que sobrevivieron a la formación de la Tierra. [c] Los once elementos naturales restantes se desintegran con la suficiente rapidez como para que su continua aparición de trazas se base principalmente en su constante regeneración como productos intermedios de la desintegración del torio y el uranio. [d] Los 24 elementos artificiales conocidos son radiactivos. [6]
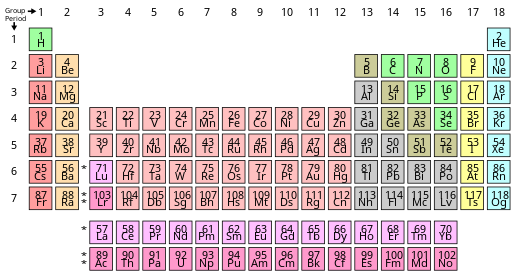
Según una convención de nomenclatura internacional, los grupos se numeran numéricamente del 1 al 18 desde la columna más a la izquierda (los metales alcalinos) hasta la columna más a la derecha (los gases nobles). Los grupos del bloque f se ignoran en esta numeración. [22] Los grupos también pueden nombrarse por su primer elemento, p. ej., el "grupo del escandio" para el grupo 3. [22] Anteriormente, los grupos se conocían con números romanos . En los Estados Unidos , los números romanos iban seguidos de una "A" si el grupo estaba en el bloque s o p , o de una "B" si el grupo estaba en el bloque d . Los números romanos utilizados corresponden al último dígito de la convención de nomenclatura actual (p. ej., los elementos del grupo 4 eran el grupo IVB y los elementos del grupo 14 eran el grupo IVA). En Europa , la rotulación era similar, excepto que se utilizaba "A" para los grupos 1 a 7, y "B" para los grupos 11 a 17. Además, los grupos 8, 9 y 10 solían tratarse como un grupo de tamaño triple, conocido colectivamente en ambas notaciones como grupo VIII. En 1988, se puso en uso el nuevo sistema de nombres de la IUPAC (Unión Internacional de Química Pura y Aplicada) (1–18), y los antiguos nombres de los grupos (I–VIII) quedaron obsoletos. [23]
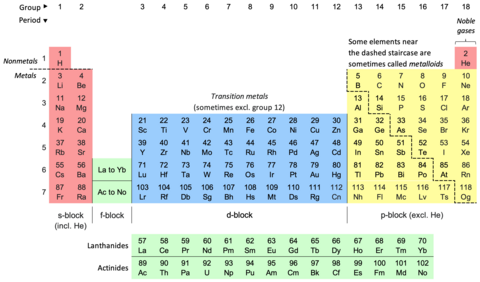
32 columnas
18 columnas
Por razones de espacio, [30] [31] la tabla periódica se presenta comúnmente con los elementos del bloque f recortados y ubicados como una parte distinta debajo del cuerpo principal. [32] [30] [23] Esto reduce el número de columnas de elementos de 32 a 18. [30]
Ambas formas representan la misma tabla periódica. [6] La forma con el bloque f incluido en el cuerpo principal a veces se llama la forma de 32 columnas [6] o larga; [33] la forma con el bloque f cortado la forma de 18 columnas [6] o media-larga. [33] La forma de 32 columnas tiene la ventaja de mostrar todos los elementos en su secuencia correcta, pero tiene la desventaja de requerir más espacio. [34] La forma elegida es una elección editorial y no implica ningún cambio en la afirmación o declaración científica. Por ejemplo, al discutir la composición del grupo 3 , las opciones se pueden mostrar por igual (sin prejuicios) en ambas formas. [35]
Las tablas periódicas suelen mostrar al menos los símbolos de los elementos; muchas también proporcionan información complementaria sobre los elementos, ya sea mediante códigos de colores o como datos en las celdas. La tabla anterior muestra los nombres y números atómicos de los elementos, y también sus bloques, ocurrencias naturales y pesos atómicos estándar . Para los elementos de vida corta sin pesos atómicos estándar, se utiliza en su lugar el número másico del isótopo conocido más estable. Otras tablas pueden incluir propiedades como el estado de la materia, los puntos de fusión y ebullición, las densidades, así como proporcionar diferentes clasificaciones de los elementos. [e]
La tabla periódica es una descripción gráfica de la ley periódica, [36] que establece que las propiedades y estructuras atómicas de los elementos químicos son una función periódica de su número atómico . [37] Los elementos se colocan en la tabla periódica de acuerdo con sus configuraciones electrónicas , [38] cuyas recurrencias periódicas explican las tendencias en las propiedades a lo largo de la tabla periódica. [39]
Un electrón puede ser considerado como habitante de un orbital atómico , que caracteriza la probabilidad de que pueda ser encontrado en cualquier región particular alrededor del átomo. Sus energías están cuantizadas , es decir que solo pueden tomar valores discretos. Además, los electrones obedecen al principio de exclusión de Pauli : diferentes electrones siempre deben estar en diferentes estados. Esto permite la clasificación de los posibles estados que un electrón puede tomar en varios niveles de energía conocidos como capas, divididos en subcapas individuales, que contienen cada uno uno o más orbitales. Cada orbital puede contener hasta dos electrones: se distinguen por una cantidad conocida como espín , convencionalmente etiquetado como "arriba" o "abajo". [40] [f] En un átomo frío (uno en su estado fundamental), los electrones se organizan de tal manera que la energía total que tienen se minimiza al ocupar los orbitales de menor energía disponibles. [42] Solo los electrones más externos (los llamados electrones de valencia ) tienen suficiente energía para liberarse del núcleo y participar en reacciones químicas con otros átomos. Los demás se denominan electrones centrales . [43]
Se conocen elementos que tienen ocupadas hasta las primeras siete capas. La primera capa contiene solo un orbital, un orbital esférico s. Como está en la primera capa, se lo llama orbital 1s. Puede albergar hasta dos electrones. La segunda capa contiene de manera similar un orbital 2s y también tres orbitales 2p con forma de mancuerna, por lo que puede albergar hasta ocho electrones (2×1 + 2×3 = 8). La tercera capa contiene un orbital 3s, tres orbitales 3p y cinco orbitales 3d, y por lo tanto tiene una capacidad de 2×1 + 2×3 + 2×5 = 18. La cuarta capa contiene un orbital 4s, tres orbitales 4p, cinco orbitales 4d y siete orbitales 4f, lo que conduce a una capacidad de 2×1 + 2×3 + 2×5 + 2×7 = 32. [30] Las capas superiores contienen más tipos de orbitales que continúan el patrón, pero dichos tipos de orbitales no se llenan en los estados fundamentales de los elementos conocidos. [45] Los tipos de subcapa se caracterizan por los números cuánticos . Cuatro números describen completamente un orbital en un átomo: el número cuántico principal n , el número cuántico azimutal ℓ (el tipo de orbital), el número cuántico magnético orbital m ℓ y el número cuántico magnético de espín m s . [39]

La secuencia en la que se llenan las subcapas viene dada en la mayoría de los casos por el principio de Aufbau , también conocido como regla de Madelung o de Klechkovsky (en honor a Erwin Madelung y Vsevolod Klechkovsky respectivamente). Esta regla fue observada empíricamente por primera vez por Madelung, y Klechkovsky y autores posteriores le dieron una justificación teórica. [46] [47] [48] [49] [g] Las capas se superponen en energías, y la regla de Madelung especifica la secuencia de llenado de acuerdo con: [47]
Aquí el signo ≪ significa "mucho menor que" en oposición a < que significa simplemente "menor que". [47] Dicho de otra manera, los electrones entran en los orbitales en orden creciente de n + ℓ, y si hay dos orbitales disponibles con el mismo valor de n + ℓ, el que tenga el menor valor de n se ocupa primero. [45] [49] En general, los orbitales con el mismo valor de n + ℓ son similares en energía, pero en el caso de los orbitales s (con ℓ = 0), los efectos cuánticos aumentan su energía para acercarse a la del siguiente grupo n + ℓ. Por lo tanto, la tabla periódica suele dibujarse de modo que comience cada fila (a menudo llamada período) con el llenado de un nuevo orbital s, que corresponde al comienzo de una nueva capa. [47] [48] [30] Por lo tanto, con la excepción de la primera fila, la longitud de cada período aparece dos veces: [47]
Las superposiciones se acercan bastante en el punto donde los orbitales d entran en escena, [50] y el orden puede cambiar ligeramente con el número atómico [51] y la carga atómica. [52] [h]
Partiendo del átomo más simple, esto nos permite construir la tabla periódica de uno en uno en orden de número atómico, considerando los casos de átomos individuales. En el hidrógeno , hay un solo electrón, que debe ir en el orbital de menor energía 1s. Esta configuración electrónica se escribe 1s 1 , donde el superíndice indica el número de electrones en la subcapa. El helio agrega un segundo electrón, que también va en 1s, llenando completamente la primera capa y dando la configuración 1s 2 . [39] [58] [i]
A partir del tercer elemento, el litio , la primera capa está llena, por lo que su tercer electrón ocupa un orbital 2s, dando una configuración 1s 2 2s 1. El electrón 2s es el único electrón de valencia del litio, ya que la subcapa 1s ahora está demasiado fuertemente unida al núcleo para participar en el enlace químico con otros átomos: una capa de este tipo se llama " capa central ". La subcapa 1s es una capa central para todos los elementos desde el litio en adelante. La subcapa 2s se completa con el siguiente elemento, el berilio (1s 2 2s 2 ). Luego, los siguientes elementos proceden a llenar la subcapa 2p. El boro (1s 2 2s 2 2p 1 ) coloca su nuevo electrón en un orbital 2p; el carbono (1s 2 2s 2 2p 2 ) llena un segundo orbital 2p; y con el nitrógeno (1s 2 2s 2 2p 3 ) los tres orbitales 2p quedan ocupados individualmente. Esto es coherente con la regla de Hund , que establece que los átomos suelen preferir ocupar individualmente cada orbital del mismo tipo antes de llenarlos con el segundo electrón. El oxígeno (1s 2 2s 2 2p 4 ), el flúor (1s 2 2s 2 2p 5 ) y el neón (1s 2 2s 2 2p 6 ) completan entonces los orbitales 2p ya ocupados individualmente; el último de estos llena por completo la segunda capa. [39] [58]
A partir del elemento 11, el sodio , la segunda capa está llena, lo que hace que la segunda capa sea una capa central para este y todos los elementos más pesados. El undécimo electrón comienza el llenado de la tercera capa al ocupar un orbital 3s, lo que da una configuración de 1s 2 2s 2 2p 6 3s 1 para el sodio. Esta configuración se abrevia [Ne] 3s 1 , donde [Ne] representa la configuración del neón. El magnesio ([Ne] 3s 2 ) termina este orbital 3s, y los siguientes seis elementos aluminio , silicio , fósforo , azufre , cloro y argón llenan los tres orbitales 3p ([Ne] 3s 2 3p 1 a [Ne] 3s 2 3p 6 ). [39] [58] Esto crea una serie análoga en la que las estructuras de la capa externa del sodio al argón son análogas a las del litio al neón, y es la base de la periodicidad de las propiedades químicas que ilustra la tabla periódica: [39] a intervalos regulares pero cambiantes de números atómicos, las propiedades de los elementos químicos se repiten aproximadamente. [36]
Los primeros dieciocho elementos pueden, por tanto, organizarse como el comienzo de una tabla periódica. Los elementos de la misma columna tienen el mismo número de electrones de valencia y tienen configuraciones electrónicas de valencia análogas: estas columnas se denominan grupos. La única excepción es el helio, que tiene dos electrones de valencia como el berilio y el magnesio, pero que normalmente se coloca en la columna del neón y el argón para enfatizar que su capa exterior está llena. (Algunos autores contemporáneos cuestionan incluso esta única excepción, prefiriendo seguir consistentemente las configuraciones de valencia y colocar el helio sobre el berilio). Hay ocho columnas en este fragmento de la tabla periódica, que corresponden a un máximo de ocho electrones de la capa exterior. [32] Un período comienza cuando una nueva capa comienza a llenarse. [30] Finalmente, el color ilustra los bloques : los elementos en el bloque s (de color rojo) están llenando orbitales s, mientras que los del bloque p (de color amarillo) están llenando orbitales p. [30]
Comenzando la siguiente fila, para el potasio y el calcio la subcapa 4s es la más baja en energía, y por lo tanto la llenan. [39] [58] El potasio agrega un electrón a la capa 4s ([Ar] 4s 1 ), y luego el calcio la completa ([Ar] 4s 2 ). Sin embargo, comenzando desde el escandio ([Ar] 3d 1 4s 2 ) la subcapa 3d se convierte en la siguiente más alta en energía. Las subcapas 4s y 3d tienen aproximadamente la misma energía y compiten por llenar los electrones, por lo que la ocupación no es del todo consistente llenar los orbitales 3d uno a la vez. El orden preciso de energía de 3d y 4s cambia a lo largo de la fila, y también cambia dependiendo de cuántos electrones se eliminan del átomo. Por ejemplo, debido a la repulsión entre los electrones 3d y los 4s, en el cromo el nivel de energía 4s se vuelve ligeramente más alto que el 3d, y por lo tanto se vuelve más rentable para un átomo de cromo tener una configuración [Ar] 3d 5 4s 1 que una [Ar] 3d 4 4s 2 . Una anomalía similar ocurre en el cobre , cuyo átomo tiene una configuración [Ar] 3d 10 4s 1 en lugar de la esperada [Ar] 3d 9 4s 2 . [39] Estas son violaciones de la regla de Madelung. Tales anomalías, sin embargo, no tienen ningún significado químico: [52] la mayor parte de la química no trata de átomos gaseosos aislados, [60] y las diversas configuraciones son tan cercanas en energía entre sí [50] que la presencia de un átomo cercano puede cambiar el equilibrio. [39] Por lo tanto, la tabla periódica las ignora y solo considera configuraciones idealizadas. [38]
En el cinc ([Ar] 3d 10 4s 2 ), los orbitales 3d están completamente llenos con un total de diez electrones. [39] [58] A continuación vienen los orbitales 4p, completando la fila, que se llenan progresivamente desde el galio ([Ar] 3d 10 4s 2 4p 1 ) hasta el criptón ([Ar] 3d 10 4s 2 4p 6 ), de manera análoga a los elementos del bloque p anteriores. [39] [58] A partir del galio, los orbitales 3d forman parte del núcleo electrónico y ya no participan en la química. [57] Los elementos del bloque s y p, que llenan sus capas externas, se denominan elementos del grupo principal ; los elementos del bloque d (de color azul a continuación), que llenan una capa interna, se denominan elementos de transición (o metales de transición, ya que todos son metales). [61]
Los siguientes dieciocho elementos llenan los orbitales 5s ( rubidio y estroncio ), luego los 4d ( del itrio al cadmio , nuevamente con algunas anomalías en el camino) y luego los 5p ( del indio al xenón ). [30] [58] Nuevamente, desde el indio en adelante, los orbitales 4d están en el núcleo. [58] [62] Por lo tanto, la quinta fila tiene la misma estructura que la cuarta. [30]
La sexta fila de la tabla comienza igualmente con dos elementos del bloque s: cesio y bario . [58] Después de esto, comienzan a aparecer los primeros elementos del bloque f (coloreados en verde a continuación), comenzando con el lantano . A veces se los denomina elementos de transición interna. [61] Como ahora no solo hay subcapas 4f sino también 5d y 6s a energías similares, la competencia se produce una vez más con muchas configuraciones irregulares; [50] esto resultó en cierta disputa sobre dónde exactamente se supone que comienza el bloque f, pero la mayoría de los que estudian el tema están de acuerdo en que comienza en el lantano de acuerdo con el principio de Aufbau. [27] Aunque el lantano no llena por sí mismo la subcapa 4f como un solo átomo, debido a la repulsión entre electrones, [52] sus orbitales 4f son lo suficientemente bajos en energía como para participar en la química. [63] [53] [64] En el iterbio , los siete orbitales 4f están completamente llenos con catorce electrones; A continuación, sigue una serie de diez elementos de transición ( del lutecio al mercurio ), [58] [65] [66] [67] y, finalmente, seis elementos del grupo principal ( del talio al radón ) completan el período. [58] [68] A partir del lutecio, los orbitales 4f están en el núcleo, [58] [64] y a partir del talio, también los orbitales 5d. [58] [57] [69]
La séptima fila es análoga a la sexta fila: 7s llena ( francio y radio ), luego 5f ( actinio a nobelio ), luego 6d ( lawrencio a copernicio ), y finalmente 7p ( nihonio a oganesón ). [58] A partir del lawrencio, los orbitales 5f están en el núcleo, [58] y probablemente los orbitales 6d se unen al núcleo a partir del nihonio. [58] [70] [j] Nuevamente hay algunas anomalías en el camino: [30] por ejemplo, como átomos individuales, ni el actinio ni el torio llenan realmente la subcapa 5f, y el lawrencio no llena la capa 6d, pero todas estas subcapas aún pueden llenarse en entornos químicos. [72] [73] [74] Durante mucho tiempo, la séptima fila estuvo incompleta ya que la mayoría de sus elementos no ocurren en la naturaleza. Los elementos que faltaban más allá del uranio comenzaron a sintetizarse en el laboratorio en 1940, cuando se fabricó el neptunio. [75] (Sin embargo, el primer elemento que se descubrió por síntesis en lugar de en la naturaleza fue el tecnecio en 1937.) La fila se completó con la síntesis de tenesina en 2010 [76] (el último elemento, oganesón, ya se había fabricado en 2002), [77] y los últimos elementos de esta séptima fila recibieron nombres en 2016. [78]
Esto completa la tabla periódica moderna, con las siete filas completamente llenas hasta su capacidad máxima. [78]
La siguiente tabla muestra la configuración electrónica de un átomo neutro en fase gaseosa de cada elemento. Diferentes configuraciones pueden ser favorecidas en diferentes entornos químicos. [52] Los elementos del grupo principal tienen configuraciones electrónicas completamente regulares; los elementos de transición y transición interna muestran veinte irregularidades debido a la competencia antes mencionada entre subcapas cercanas en nivel de energía. Para los últimos diez elementos (109–118), faltan datos experimentales [79] y, por lo tanto, se han mostrado en su lugar configuraciones calculadas. [80] Las subcapas completamente llenas se han sombreado.
Aunque la tabla periódica moderna es estándar hoy en día, la colocación de los elementos del período 1 hidrógeno y helio sigue siendo un tema abierto en discusión, y se pueden encontrar algunas variaciones. [57] [81] Siguiendo sus respectivas configuraciones electrónicas s 1 y s 2 , el hidrógeno se colocaría en el grupo 1, y el helio se colocaría en el grupo 2. [57] La colocación del hidrógeno en el grupo 1 es común, pero el helio casi siempre se coloca en el grupo 18 con los otros gases nobles. [6] El debate tiene que ver con entendimientos conflictivos de hasta qué punto las propiedades químicas o electrónicas deben decidir la colocación en la tabla periódica. [81]
Al igual que los metales del grupo 1, el hidrógeno tiene un electrón en su capa más externa [82] y normalmente pierde su único electrón en reacciones químicas. [83] El hidrógeno tiene algunas propiedades químicas similares a las de los metales, siendo capaz de desplazar algunos metales de sus sales . [83] Pero forma un gas no metálico diatómico en condiciones estándar, a diferencia de los metales alcalinos que son metales sólidos reactivos. Esto y la formación de hidruros por parte del hidrógeno , en los que gana un electrón, lo acerca a las propiedades de los halógenos que hacen lo mismo [83] (aunque es más raro que el hidrógeno forme H − que H + ). [84] Además, los dos halógenos más ligeros ( flúor y cloro ) son gaseosos como el hidrógeno en condiciones estándar. [83] Algunas propiedades del hidrógeno no se ajustan bien a ninguno de los grupos: el hidrógeno no es ni muy oxidante ni muy reductor y no es reactivo con el agua. [84] El hidrógeno tiene propiedades que corresponden tanto a las de los metales alcalinos como a las de los halógenos, pero no coincide perfectamente con ninguno de los dos grupos, y por lo tanto es difícil de ubicar por su química. [83] Por lo tanto, mientras que la colocación electrónica del hidrógeno en el grupo 1 predomina, algunas disposiciones más raras muestran hidrógeno en el grupo 17, [85] duplican el hidrógeno en los grupos 1 y 17, [86] [87] o lo hacen flotar por separado de todos los grupos. [87] [88] [57] Esta última opción, sin embargo, ha sido criticada por el químico y filósofo de la ciencia Eric Scerri con el argumento de que parece implicar que el hidrógeno está por encima de la ley periódica en conjunto, a diferencia de todos los demás elementos. [89]
El helio es el único elemento que ocupa rutinariamente una posición en la tabla periódica que no es consistente con su estructura electrónica. Tiene dos electrones en su capa más externa, mientras que los otros gases nobles tienen ocho; y es un elemento del bloque s, mientras que todos los demás gases nobles son elementos del bloque p. Sin embargo, no es reactivo en condiciones estándar y tiene una capa externa completa: estas propiedades son como los gases nobles en el grupo 18, pero en absoluto como los metales alcalinotérreos reactivos del grupo 2. Por estas razones, el helio se coloca casi universalmente en el grupo 18 [6], con el que sus propiedades coinciden mejor; [57] una propuesta para mover el helio al grupo 2 fue rechazada por la IUPAC en 1988 por estas razones. [23] No obstante, el helio todavía se coloca ocasionalmente en el grupo 2 hoy en día, [90] y algunas de sus propiedades físicas y químicas son más cercanas a los elementos del grupo 2 y apoyan la colocación electrónica. [82] [57] El helio sólido cristaliza en una estructura compacta hexagonal , que coincide con el berilio y el magnesio del grupo 2, pero no con los otros gases nobles del grupo 18. [91] Los recientes desarrollos teóricos en la química de los gases nobles, en los que se espera que el helio muestre una inercia ligeramente menor que el neón y que forme (HeO)(LiF) 2 con una estructura similar al compuesto análogo de berilio (pero sin ningún análogo de neón esperado), han dado lugar a que más químicos defiendan la colocación del helio en el grupo 2. Esto se relaciona con el argumento electrónico, ya que la razón de la mayor inercia del neón es la repulsión de su capa p llena de la que carece el helio, aunque de manera realista es poco probable que las moléculas que contienen helio sean estables fuera de condiciones de temperatura extremadamente baja (alrededor de 10 K ). [92] [93] [94] [95]
La anomalía de la primera fila de la tabla periódica también se ha citado para apoyar el traslado del helio al grupo 2. Surge porque el primer orbital de cualquier tipo es inusualmente pequeño, ya que a diferencia de sus análogos superiores, no experimenta repulsión interelectrónica de un orbital más pequeño del mismo tipo. Esto hace que la primera fila de elementos en cada bloque sea inusualmente pequeña, y dichos elementos tienden a exhibir tipos característicos de anomalías para su grupo. Algunos químicos que abogan por el reposicionamiento del helio han señalado que el helio exhibe estas anomalías si se coloca en el grupo 2, pero no si se coloca en el grupo 18: por otro lado, el neón, que sería el primer elemento del grupo 18 si se eliminara el helio de ese lugar, sí exhibe esas anomalías. [92] Luego se argumenta que la relación entre el helio y el berilio se asemeja a la que existe entre el hidrógeno y el litio, una colocación que es mucho más comúnmente aceptada. [93] Por ejemplo, debido a esta tendencia en los tamaños de los orbitales, se observa una gran diferencia en los radios atómicos entre el primer y el segundo miembro de cada grupo principal en los grupos 1 y 13-17: existe entre el neón y el argón, y entre el helio y el berilio, pero no entre el helio y el neón. Esto afecta de manera similar a los puntos de ebullición y solubilidades de los gases nobles en agua, donde el helio está demasiado cerca del neón, y la gran diferencia característica entre los dos primeros elementos de un grupo aparece solo entre el neón y el argón. Mover el helio al grupo 2 hace que esta tendencia sea consistente también en los grupos 2 y 18, al hacer que el helio sea el primer elemento del grupo 2 y el neón el primer elemento del grupo 18: ambos exhiben las propiedades características de un primer elemento kainosimétrico de un grupo. [96] [97] No obstante, la ubicación del helio en el grupo 18 sigue siendo casi universal debido a su extrema inercia. [98] Además, rara vez se encuentran tablas que hagan flotar tanto el hidrógeno como el helio fuera de todos los grupos. [88] [57] [58]
En muchas tablas periódicas, el bloque f se desplaza un elemento hacia la derecha, de modo que el lantano y el actinio se convierten en elementos del bloque d en el grupo 3, y Ce–Lu y Th–Lr forman el bloque f. Por lo tanto, el bloque d se divide en dos partes muy desiguales. Esto es un remanente de mediciones tempranas erróneas de configuraciones electrónicas; las mediciones modernas son más consistentes con la forma con lutecio y laurencio en el grupo 3, y con La–Yb y Ac–No como bloque f. [25] [99]
La capa 4f está completamente llena en el iterbio, y por esa razón Lev Landau y Evgeny Lifshitz en 1948 consideraron incorrecto agrupar al lutecio como un elemento del bloque f. [26] Todavía no dieron el paso de eliminar también al lantano del bloque d, pero Jun Kondō se dio cuenta en 1963 de que la superconductividad a baja temperatura del lantano implicaba la actividad de su capa 4f. [100] En 1965, David C. Hamilton relacionó esta observación con su posición en la tabla periódica y argumentó que el bloque f debería estar compuesto por los elementos La–Yb y Ac–No. [63] Desde entonces, la evidencia física, química y electrónica ha apoyado esta asignación. [25] [23] [99] La cuestión fue traída a la atención de todos por William B. Jensen en 1982, [25] y la reasignación del lutecio y el lawrencio al grupo 3 fue apoyada por informes de la IUPAC que datan de 1988 (cuando se recomendaron los números de grupo 1-18) [23] y 2021. [24] No obstante, la variación todavía existe porque la mayoría de los escritores de libros de texto no son conscientes del problema. [25]
A veces se puede encontrar una tercera forma en la que los espacios debajo del itrio en el grupo 3 se dejan vacíos, como la tabla que aparece en el sitio web de la IUPAC, [6] pero esto crea una inconsistencia con la mecánica cuántica al hacer que el bloque f tenga 15 elementos de ancho (La–Lu y Ac–Lr) aunque solo 14 electrones pueden caber en una subcapa f. [24] Además, existe cierta confusión en la literatura sobre qué elementos se implica que están en el grupo 3. [24] [33] [101] [102] [103] Si bien el informe de la IUPAC de 2021 señaló que los bloques f de 15 elementos de ancho son apoyados por algunos profesionales de una rama especializada de la mecánica cuántica relativista que se centra en las propiedades de los elementos superpesados , la opinión del proyecto fue que tales preocupaciones dependientes del interés no deberían tener ninguna relación con la forma en que se presenta la tabla periódica a "la comunidad química y científica en general". [24] Otros autores que se centraron en los elementos superpesados aclararon desde entonces que la "entrada 15 del bloque f representa la primera ranura del bloque d que se deja vacante para indicar el lugar de las inserciones del bloque f", lo que implicaría que esta forma todavía tiene lutecio y lawrencio (las entradas 15 en cuestión) como elementos del bloque d en el grupo 3. [104] De hecho, cuando las publicaciones de la IUPAC amplían la tabla a 32 columnas, lo dejan claro y colocan el lutecio y el lawrencio bajo el itrio en el grupo 3. [105] [106]
En la literatura se pueden encontrar varios argumentos a favor de Sc-Y-La-Ac, [107] [108] pero han sido cuestionados por ser lógicamente inconsistentes. [27] [28] [29] Por ejemplo, se ha argumentado que el lantano y el actinio no pueden ser elementos del bloque f porque como átomos individuales en fase gaseosa, no han comenzado a llenar las subcapas f. [109] Pero lo mismo es cierto del torio, que nunca se discute como un elemento del bloque f, [24] [25] y este argumento pasa por alto el problema en el otro extremo: que las capas f completan el llenado en iterbio y nobelio, coincidiendo con la forma Sc-Y-Lu-Lr, y no en lutecio y lawrencio como lo tendría la forma Sc-Y-La-Ac. [110] No sólo estas configuraciones excepcionales son minoritarias, [110] sino que además nunca se han considerado relevantes para posicionar otros elementos en la tabla periódica: en los átomos gaseosos, las capas d completan su llenado en cobre, paladio y oro, pero los químicos aceptan universalmente que estas configuraciones son excepcionales y que el bloque d realmente termina de acuerdo con la regla de Madelung en zinc, cadmio y mercurio. [33] El hecho relevante para la colocación [38] [65] es que el lantano y el actinio (como el torio) tienen orbitales f de valencia que pueden ocuparse en entornos químicos, mientras que el lutecio y el lawrencio no: [58] [111] [74] sus capas f están en el núcleo y no pueden usarse para reacciones químicas. [64] [112] Por lo tanto, la relación entre el itrio y el lantano es sólo una relación secundaria entre elementos con el mismo número de electrones de valencia pero diferentes tipos de orbitales de valencia, como la que existe entre el cromo y el uranio; mientras que la relación entre el itrio y el lutecio es primaria, ya que comparten tanto el número de electrones de valencia como el tipo de orbital de valencia. [58]
Como las reacciones químicas involucran a los electrones de valencia, [32] se puede esperar que los elementos con configuraciones electrónicas externas similares reaccionen de manera similar y formen compuestos con proporciones similares de elementos en ellos. [113] Estos elementos se colocan en el mismo grupo y, por lo tanto, tienden a existir similitudes y tendencias claras en el comportamiento químico a medida que se avanza hacia abajo en un grupo. [114] Como las configuraciones análogas ocurren a intervalos regulares, las propiedades de los elementos exhiben recurrencias periódicas, de ahí el nombre de la tabla periódica y la ley periódica. Estas recurrencias periódicas se notaron mucho antes de que se desarrollara la teoría subyacente que las explica. [115] [116]
Históricamente, el tamaño físico de los átomos era desconocido hasta principios del siglo XX. La primera estimación calculada del radio atómico del hidrógeno fue publicada por el físico Arthur Haas en 1910 con un margen de un orden de magnitud (un factor de 10) del valor aceptado, el radio de Bohr (~0,529 Å). En su modelo, Haas utilizó una configuración de un solo electrón basada en el modelo atómico clásico propuesto por JJ Thomson en 1904, a menudo llamado el modelo del pudín de pasas . [117]
Los radios atómicos (el tamaño de los átomos) dependen del tamaño de sus orbitales más externos. [96] Generalmente disminuyen al ir de izquierda a derecha a lo largo de los elementos del grupo principal, porque la carga nuclear aumenta pero los electrones externos todavía están en la misma capa. Sin embargo, al bajar por una columna, los radios generalmente aumentan, porque los electrones más externos están en capas superiores que, por lo tanto, están más alejadas del núcleo. [32] [118] La primera fila de cada bloque es anormalmente pequeña, debido a un efecto llamado kainosimetría o repulsión primogénica: [119] las subcapas 1s, 2p, 3d y 4f no tienen análogos internos. Por ejemplo, los orbitales 2p no experimentan una fuerte repulsión de los orbitales 1s y 2s, que tienen distribuciones de carga angular bastante diferentes y, por lo tanto, no son muy grandes; pero los orbitales 3p experimentan una fuerte repulsión de los orbitales 2p, que tienen distribuciones de carga angular similares. Por lo tanto, las subcapas superiores s, p, d y f experimentan una fuerte repulsión de sus análogos internos, que tienen aproximadamente la misma distribución angular de carga, y deben expandirse para evitar esto. Esto hace que surjan diferencias significativas entre los elementos 2p pequeños, que prefieren el enlace múltiple , y los elementos 3p y p superiores, que no lo hacen. [96] Surgen anomalías similares para los elementos 1s, 2p, 3d, 4f y el hipotético 5g: [120] el grado de esta anomalía de primera fila es más alto para el bloque s, es moderado para el bloque p y es menos pronunciado para los bloques d y f. [121]
En los elementos de transición, se está llenando una capa interna, pero el tamaño del átomo aún está determinado por los electrones externos. La creciente carga nuclear a lo largo de la serie y el mayor número de electrones internos para protección se compensan entre sí, por lo que la disminución del radio es menor. [118] Los átomos 4p y 5d, que aparecen inmediatamente después de que se introdujeran por primera vez nuevos tipos de series de transición, son más pequeños de lo que se hubiera esperado, [122] porque las subcapas 3d y 4f agregadas en el núcleo proporcionan solo un blindaje incompleto de la carga nuclear para los electrones externos. Por lo tanto, por ejemplo, los átomos de galio son ligeramente más pequeños que los átomos de aluminio. [96] Junto con la kainosimetría, esto da como resultado una diferencia par-impar entre los períodos (excepto en el bloque s) [k] que a veces se conoce como periodicidad secundaria: los elementos en períodos pares tienen radios atómicos más pequeños y prefieren perder menos electrones, mientras que los elementos en períodos impares (excepto el primero) difieren en la dirección opuesta. Así, por ejemplo, muchas propiedades en el bloque p muestran una tendencia en zigzag en lugar de una tendencia suave a lo largo del grupo. Por ejemplo, el fósforo y el antimonio en los períodos impares del grupo 15 alcanzan fácilmente el estado de oxidación +5, mientras que el nitrógeno, el arsénico y el bismuto en los períodos pares prefieren permanecer en +3. [121] [123] Una situación similar se da para el bloque d, donde los átomos de lutecio a tungsteno son ligeramente más pequeños que los átomos de itrio a molibdeno respectivamente. [124] [125]

Los átomos de talio y plomo tienen aproximadamente el mismo tamaño que los átomos de indio y estaño respectivamente, pero desde el bismuto hasta el radón los átomos 6p son más grandes que los átomos 5p análogos. Esto sucede porque cuando los núcleos atómicos se cargan mucho, se necesita la relatividad especial para medir el efecto del núcleo en la nube de electrones. Estos efectos relativistas dan como resultado que los elementos pesados tengan propiedades cada vez más diferentes en comparación con sus homólogos más ligeros en la tabla periódica. La interacción espín-órbita divide la subcapa p: un orbital p se estabiliza y se encoge relativistamente (rellena el talio y el plomo), pero los otros dos (rellenan el bismuto a través del radón) se desestabilizan y se expanden relativistamente. [96] Los efectos relativistas también explican por qué el oro es dorado y el mercurio es un líquido a temperatura ambiente. [126] [127] Se espera que se vuelvan muy fuertes a fines del séptimo período, lo que potencialmente conduce a un colapso de la periodicidad. [128] Las configuraciones electrónicas sólo se conocen claramente hasta el elemento 108 ( hassio ), y la química experimental más allá de 108 sólo se ha realizado para 112 ( copernicio ), 113 ( nihonio ) y 114 ( flerovio ), por lo que la caracterización química de los elementos más pesados sigue siendo un tema de investigación actual. [129]
La tendencia a que los radios atómicos disminuyan de izquierda a derecha también está presente en los radios iónicos , aunque es más difícil de examinar porque los iones más comunes de elementos consecutivos normalmente difieren en carga. Los iones con la misma configuración electrónica disminuyen de tamaño a medida que aumenta su número atómico, debido a la mayor atracción del núcleo con carga más positiva: así, por ejemplo, los radios iónicos disminuyen en la serie Se 2− , Br − , Rb + , Sr 2+ , Y 3+ , Zr 4+ , Nb 5+ , Mo 6+ , Tc 7+ . Los iones del mismo elemento se hacen más pequeños a medida que se eliminan más electrones, porque la atracción del núcleo comienza a superar la repulsión entre electrones que hace que las nubes de electrones se expandan: así, por ejemplo, los radios iónicos disminuyen en la serie V 2+ , V 3+ , V 4+ , V 5+ . [130]

La primera energía de ionización de un átomo es la energía necesaria para extraerle un electrón. Esta varía con el radio atómico: la energía de ionización aumenta de izquierda a derecha y de abajo a arriba, porque los electrones que están más cerca del núcleo están más fuertemente sujetos y son más difíciles de extraer. La energía de ionización se minimiza en el primer elemento de cada período (el hidrógeno y los metales alcalinos ) y luego generalmente aumenta hasta llegar al gas noble en el borde derecho del período. [32] Hay algunas excepciones a esta tendencia, como el oxígeno, donde el electrón que se extrae está emparejado y, por lo tanto, la repulsión interelectrónica hace que sea más fácil de extraer de lo esperado. [131]
En las series de transición, los electrones externos se pierden preferentemente aunque los orbitales internos se estén llenando. Por ejemplo, en la serie 3d, los electrones 4s se pierden primero aunque los orbitales 3d se estén llenando. El efecto de protección de añadir un electrón 3d extra aproximadamente compensa el aumento de la carga nuclear y, por lo tanto, las energías de ionización se mantienen casi constantes, aunque hay un pequeño aumento especialmente al final de cada serie de transición. [132]
Como los átomos de metal tienden a perder electrones en las reacciones químicas, la energía de ionización generalmente está correlacionada con la reactividad química, aunque también hay otros factores involucrados. [132]
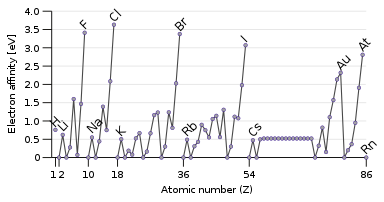
La propiedad opuesta a la energía de ionización es la afinidad electrónica , que es la energía liberada cuando se añade un electrón al átomo. [133] Un electrón que pasa por el átomo será atraído más fácilmente si siente la atracción del núcleo con más fuerza, y especialmente si hay un orbital externo parcialmente lleno disponible que pueda acomodarlo. Por lo tanto, la afinidad electrónica tiende a aumentar de abajo hacia arriba y de izquierda a derecha. La excepción es la última columna, los gases nobles, que tienen una capa completa y no tienen espacio para otro electrón. Esto da a los halógenos en la penúltima columna las afinidades electrónicas más altas. [32]
Algunos átomos, como los gases nobles, no tienen afinidad electrónica: no pueden formar aniones estables en fase gaseosa. [134] (Pueden formar resonancias metaestables si el electrón entrante llega con suficiente energía cinética, pero estas inevitablemente y rápidamente se autodesprenden : por ejemplo, la vida útil del nivel He − de mayor duración es de unos 359 microsegundos.) [135] Los gases nobles, que tienen altas energías de ionización y ninguna afinidad electrónica, tienen poca inclinación a ganar o perder electrones y generalmente no son reactivos. [32]
Existen algunas excepciones a esta tendencia: el oxígeno y el flúor tienen afinidades electrónicas más bajas que sus homólogos más pesados, el azufre y el cloro, porque son átomos pequeños y, por lo tanto, el electrón recién añadido experimentaría una repulsión significativa por parte de los ya presentes. En el caso de los elementos no metálicos, la afinidad electrónica también se correlaciona de algún modo con la reactividad, pero no de manera perfecta, ya que intervienen otros factores. Por ejemplo, el flúor tiene una afinidad electrónica más baja que el cloro (debido a la extrema repulsión interelectrónica por el átomo de flúor, que es muy pequeño), pero es más reactivo. [133]
La valencia de un elemento puede definirse como el número de átomos de hidrógeno que pueden combinarse con él para formar un hidruro binario simple, o como el doble del número de átomos de oxígeno que pueden combinarse con él para formar un óxido binario simple (es decir, no un peróxido o un superóxido ). [110] Las valencias de los elementos del grupo principal están directamente relacionadas con el número de grupo: los hidruros en los grupos principales 1-2 y 13-17 siguen las fórmulas MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 y finalmente MH. Los óxidos más altos, en cambio, aumentan en valencia, siguiendo las fórmulas M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . [l] Hoy en día, la noción de valencia se ha ampliado con la de estado de oxidación , que es la carga formal que queda en un elemento cuando todos los demás elementos de un compuesto se han eliminado como sus iones. [113]
La configuración electrónica sugiere una explicación fácil a partir del número de electrones disponibles para el enlace; [113] de hecho, el número de electrones de valencia comienza en 1 en el grupo 1, y luego aumenta hacia el lado derecho de la tabla periódica, restableciéndose solo en 3 cuando comienza cada nuevo bloque. Así, en el período 6, Cs–Ba tiene 1–2 electrones de valencia; La–Yb tiene 3–16; Lu–Hg tiene 3–12; y Tl–Rn tiene 3–8. [112] Sin embargo, hacia el lado derecho de los bloques d y f, el máximo teórico correspondiente al uso de todos los electrones de valencia no se puede lograr en absoluto; [136] la misma situación afecta al oxígeno, flúor y los gases nobles ligeros hasta el criptón. [137]
Una explicación completa requiere considerar la energía que se liberaría al formar compuestos con diferentes valencias en lugar de simplemente considerar las configuraciones electrónicas por sí solas. [138] Por ejemplo, el magnesio forma cationes Mg 2+ en lugar de Mg + cuando se disuelve en agua, porque este último se desproporcionaría espontáneamente en cationes Mg 0 y Mg 2+ . Esto se debe a que la entalpía de hidratación (rodeando el catión con moléculas de agua) aumenta en magnitud con la carga y el radio del ion. En Mg + , el orbital más externo (que determina el radio iónico) sigue siendo 3s, por lo que la entalpía de hidratación es pequeña e insuficiente para compensar la energía requerida para eliminar el electrón; pero ionizar nuevamente a Mg 2+ descubre la subcapa 2p del núcleo, lo que hace que la entalpía de hidratación sea lo suficientemente grande como para permitir que se formen compuestos de magnesio (II). Por razones similares, los estados de oxidación comunes de los elementos más pesados del bloque p (donde los electrones ns se vuelven más bajos en energía que los np) tienden a variar en pasos de 2, porque eso es necesario para descubrir una subcapa interna y disminuir el radio iónico (por ejemplo, Tl + descubre 6s, y Tl 3+ descubre 5d, por lo que una vez que el talio pierde dos electrones, tiende a perder también el tercero). Se pueden utilizar argumentos análogos basados en la hibridación orbital para los elementos del bloque p menos electronegativos. [139] [m]
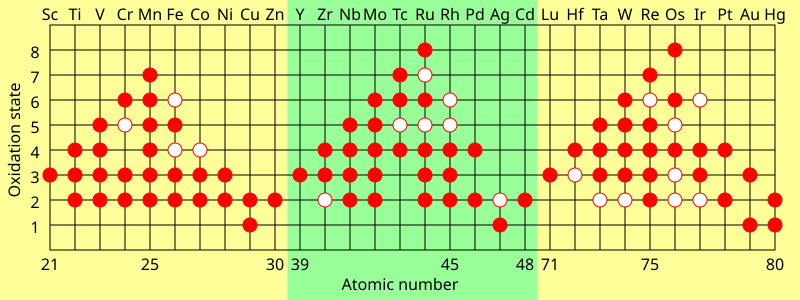
Para los metales de transición, los estados de oxidación comunes son casi siempre al menos +2 por razones similares (descubrir la siguiente subcapa); esto se mantiene incluso para los metales con configuraciones anómalas d x+1 s 1 o d x+2 s 0 (excepto para la plata ), porque la repulsión entre electrones d significa que el movimiento del segundo electrón de la subcapa s a la d no cambia apreciablemente su energía de ionización. [141] Debido a que ionizar aún más los metales de transición no descubre ninguna nueva subcapa interna, sus estados de oxidación tienden a variar en pasos de 1. [139] Los lantánidos y actínidos tardíos generalmente muestran un estado de oxidación estable +3, eliminando los electrones s externos y luego (generalmente) un electrón de los orbitales (n−2)f, que son similares en energía a ns. [142] Los estados de oxidación comunes y máximos de los elementos del bloque d y f tienden a depender de las energías de ionización. A medida que la diferencia de energía entre los orbitales (n−1)d y ns aumenta a lo largo de cada serie de transición, se vuelve menos favorable energéticamente ionizar más electrones. Por lo tanto, los grupos de metales de transición temprana tienden a preferir estados de oxidación más altos, pero el estado de oxidación +2 se vuelve más estable para los grupos de metales de transición tardía. El estado de oxidación formal más alto aumenta así de +3 al comienzo de cada fila del bloque d, a +7 o +8 en el medio (por ejemplo, OsO 4 ), y luego disminuye a +2 al final. [141] Los lantánidos y los actínidos tardíos suelen tener altas energías de cuarta ionización y, por lo tanto, rara vez superan el estado de oxidación +3, mientras que los actínidos tempranos tienen bajas energías de cuarta ionización y, por lo tanto, por ejemplo, el neptunio y el plutonio pueden alcanzar +7. [110] [141] [142] Los últimos actínidos van más lejos que los lantánidos hacia estados de oxidación bajos: el mendelevio se reduce más fácilmente al estado +2 que el tulio o incluso el europio (el lantánido con el estado +2 más estable, debido a su capa f medio llena), y el nobelio favorece directamente al +2 sobre el +3, en contraste con el iterbio. [54]
Como los elementos del mismo grupo comparten las mismas configuraciones de valencia, suelen exhibir un comportamiento químico similar. Por ejemplo, los metales alcalinos del primer grupo tienen todos un electrón de valencia y forman una clase muy homogénea de elementos: todos son metales blandos y reactivos. Sin embargo, hay muchos factores involucrados y los grupos a menudo pueden ser bastante heterogéneos. Por ejemplo, el hidrógeno también tiene un electrón de valencia y está en el mismo grupo que los metales alcalinos, pero su comportamiento químico es bastante diferente. Los elementos estables del grupo 14 comprenden un no metal ( carbono ), dos semiconductores ( silicio y germanio ) y dos metales ( estaño y plomo ); no obstante, están unidos por tener cuatro electrones de valencia. [143] Esto a menudo conduce a similitudes en los estados de oxidación máximos y mínimos (por ejemplo, el azufre y el selenio en el grupo 16 tienen ambos un estado de oxidación máximo +6, como en SO 3 y SeO 3 , y un estado de oxidación mínimo −2, como en sulfuros y seleniuros ); pero no siempre (por ejemplo, no se sabe que el oxígeno forme el estado de oxidación +6, a pesar de estar en el mismo grupo que el azufre y el selenio). [58]

Otra propiedad importante de los elementos es su electronegatividad . Los átomos pueden formar enlaces covalentes entre sí compartiendo electrones en pares, creando una superposición de orbitales de valencia. El grado en que cada átomo atrae el par de electrones compartido depende de la electronegatividad del átomo [144] , la tendencia de un átomo a ganar o perder electrones. [32] El átomo más electronegativo tenderá a atraer más al par de electrones, y el menos electronegativo (o más electropositivo) lo atraerá menos. En casos extremos, se puede pensar que el electrón ha pasado completamente del átomo más electropositivo al más electronegativo, aunque esto es una simplificación. El enlace une entonces dos iones, uno positivo (que ha cedido el electrón) y uno negativo (que lo ha aceptado), y se denomina enlace iónico . [32]
La electronegatividad depende de la fuerza con la que el núcleo puede atraer un par de electrones, por lo que muestra una variación similar a las otras propiedades ya analizadas: la electronegatividad tiende a disminuir de arriba hacia abajo y a aumentar de izquierda a derecha. Los metales alcalinos y alcalinotérreos se encuentran entre los elementos más electropositivos, mientras que los calcógenos, los halógenos y los gases nobles se encuentran entre los más electronegativos. [144]
La electronegatividad se mide generalmente en la escala de Pauling, en la que al átomo reactivo más electronegativo ( flúor ) se le asigna una electronegatividad de 4,0, y al átomo menos electronegativo ( cesio ) se le asigna una electronegatividad de 0,79. [32] De hecho, el neón es el elemento más electronegativo, pero la escala de Pauling no puede medir su electronegatividad porque no forma enlaces covalentes con la mayoría de los elementos. [145]
La electronegatividad de un elemento varía con la identidad y el número de átomos a los que está unido, así como con la cantidad de electrones que ya ha perdido: un átomo se vuelve más electronegativo cuando ha perdido más electrones. [144] Esto a veces hace una gran diferencia: el plomo en el estado de oxidación +2 tiene una electronegatividad de 1,87 en la escala de Pauling, mientras que el plomo en el estado de oxidación +4 tiene una electronegatividad de 2,33. [146]

Una sustancia simple es una sustancia formada por átomos de un elemento químico. Las sustancias simples de los átomos más electronegativos tienden a compartir electrones (formar enlaces covalentes) entre sí. Forman moléculas pequeñas (como el hidrógeno o el oxígeno, cuyos átomos se unen en pares) o estructuras gigantes que se extienden indefinidamente (como el carbono o el silicio). Los gases nobles simplemente permanecen como átomos individuales, ya que ya tienen una capa completa. [32] Las sustancias compuestas por moléculas discretas o átomos individuales se mantienen juntas por fuerzas de atracción más débiles entre las moléculas, como la fuerza de dispersión de London : a medida que los electrones se mueven dentro de las moléculas, crean desequilibrios momentáneos de carga eléctrica, que inducen desequilibrios similares en las moléculas cercanas y crean movimientos sincronizados de electrones a través de muchas moléculas vecinas. [148]

Los átomos más electropositivos, sin embargo, tienden a perder electrones, creando un "mar" de electrones que envuelven cationes. [32] Los orbitales externos de un átomo se superponen para compartir electrones con todos sus vecinos, creando una estructura gigante de orbitales moleculares que se extienden por todos los átomos. [149] Este "mar" cargado negativamente atrae a todos los iones y los mantiene juntos en un enlace metálico . Los elementos que forman tales enlaces a menudo se denominan metales ; los que no lo hacen a menudo se denominan no metales . [32] Algunos elementos pueden formar múltiples sustancias simples con diferentes estructuras: estas se denominan alótropos . Por ejemplo, el diamante y el grafito son dos alótropos del carbono. [143] [n]
La metalicidad de un elemento se puede predecir a partir de las propiedades electrónicas. Cuando los orbitales atómicos se superponen durante el enlace metálico o covalente, crean orbitales moleculares enlazantes y antienlazantes de igual capacidad, siendo los orbitales antienlazantes de mayor energía. El carácter de enlace neto se produce cuando hay más electrones en los orbitales enlazantes que en los orbitales antienlazantes. Por tanto, el enlace metálico es posible cuando el número de electrones deslocalizados por cada átomo es inferior al doble del número de orbitales que contribuyen al solapamiento. Esta es la situación de los elementos de los grupos 1 a 13; también tienen muy pocos electrones de valencia para formar estructuras covalentes gigantes en las que todos los átomos ocupan posiciones equivalentes, por lo que casi todos se metalizan. Las excepciones son el hidrógeno y el boro, que tienen una energía de ionización demasiado alta. El hidrógeno forma así una molécula covalente H2 y el boro forma una estructura covalente gigante basada en cúmulos icosaédricos B12 . En un metal, los orbitales de enlace y antienlace tienen energías superpuestas, lo que crea una única banda a través de la cual los electrones pueden fluir libremente, lo que permite la conducción eléctrica. [151]
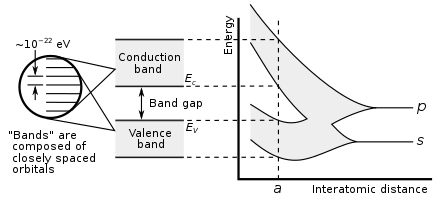
En el grupo 14, se hacen posibles tanto los enlaces metálicos como los covalentes. En un cristal de diamante, los enlaces covalentes entre átomos de carbono son fuertes, porque tienen un radio atómico pequeño y, por lo tanto, el núcleo tiene más capacidad de retención de los electrones. Por lo tanto, los orbitales de enlace que resultan son mucho más bajos en energía que los orbitales antienlazantes, y no hay superposición, por lo que la conducción eléctrica se vuelve imposible: el carbono es un no metal. Sin embargo, el enlace covalente se vuelve más débil para átomos más grandes y la brecha de energía entre los orbitales de enlace y antienlazante disminuye. Por lo tanto, el silicio y el germanio tienen brechas de banda más pequeñas y son semiconductores en condiciones ambientales: los electrones pueden cruzar la brecha cuando se excitan térmicamente. (El boro también es un semiconductor en condiciones ambientales). La brecha de banda desaparece en el estaño, por lo que el estaño y el plomo se convierten en metales. [151] A medida que aumenta la temperatura, todos los no metales desarrollan algunas propiedades semiconductoras, en mayor o menor medida dependiendo del tamaño de la brecha de banda. Así, los metales y los no metales pueden distinguirse por la dependencia de la temperatura de su conductividad eléctrica: la conductividad de un metal disminuye a medida que aumenta la temperatura (porque el movimiento térmico hace que sea más difícil que los electrones fluyan libremente), mientras que la conductividad de un no metal aumenta (ya que más electrones pueden ser excitados para cruzar el espacio). [152]
Los elementos de los grupos 15 a 17 tienen demasiados electrones para formar moléculas covalentes gigantes que se extiendan en las tres dimensiones. Para los elementos más ligeros, los enlaces en las moléculas diatómicas pequeñas son tan fuertes que una fase condensada es desfavorable: así, el nitrógeno (N 2 ), el oxígeno (O 2 ), el fósforo blanco y el arsénico amarillo (P 4 y As 4 ), el azufre y el selenio rojo (S 8 y Se 8 ), y los halógenos estables (F 2 , Cl 2 , Br 2 e I 2 ) forman fácilmente moléculas covalentes con pocos átomos. Los más pesados tienden a formar cadenas largas (por ejemplo, fósforo rojo, selenio gris, telurio) o estructuras en capas (por ejemplo, carbono como grafito, fósforo negro, arsénico gris, antimonio, bismuto) que solo se extienden en una o dos dimensiones en lugar de tres. Ambos tipos de estructuras se pueden encontrar como alótropos del fósforo, el arsénico y el selenio, aunque los alótropos de cadena larga son más estables en los tres. Como estas estructuras no utilizan todos sus orbitales para la unión, terminan con bandas enlazantes, no enlazantes y antienlazantes en orden de energía creciente. De manera similar al grupo 14, las brechas de banda se reducen para los elementos más pesados y se hace posible el libre movimiento de electrones entre las cadenas o capas. Así, por ejemplo, el fósforo negro, el arsénico negro, el selenio gris, el telurio y el yodo son semiconductores; el arsénico gris, el antimonio y el bismuto son semimetales (que exhiben conducción cuasimetálica, con una superposición de bandas muy pequeña); y el polonio y probablemente el astato son verdaderos metales. [151] Finalmente, los elementos naturales del grupo 18 permanecen todos como átomos individuales. [151] [o]
La línea divisoria entre metales y no metales es aproximadamente diagonal desde la parte superior izquierda a la inferior derecha, con la serie de transición apareciendo a la izquierda de esta diagonal (ya que tienen muchos orbitales disponibles para superponerse). Esto es esperable, ya que la metalicidad tiende a estar correlacionada con la electropositividad y la disposición a perder electrones, que aumenta de derecha a izquierda y de arriba a abajo. Por lo tanto, los metales superan en gran medida a los no metales. Los elementos cerca de la línea divisoria son difíciles de clasificar: tienden a tener propiedades que son intermedias entre las de los metales y los no metales, y pueden tener algunas propiedades características de ambos. A menudo se los denomina semimetales o metaloides . [32] El término "semimetal" utilizado en este sentido no debe confundirse con su sentido físico estricto que tiene que ver con la estructura de bandas: el bismuto es físicamente un semimetal, pero los químicos generalmente lo consideran un metal. [154]
La siguiente tabla considera los alótropos más estables en condiciones estándar. Los elementos coloreados en amarillo forman sustancias simples que están bien caracterizadas por enlaces metálicos. Los elementos coloreados en azul claro forman estructuras covalentes en red gigantes, mientras que los coloreados en azul oscuro forman pequeñas moléculas unidas covalentemente que se mantienen unidas por fuerzas de van der Waals más débiles . Los gases nobles están coloreados en violeta: sus moléculas son átomos individuales y no se produce ningún enlace covalente. Las celdas en gris son para elementos que no se han preparado en cantidades suficientes para que sus alótropos más estables se hayan caracterizado de esta manera. Las consideraciones teóricas y la evidencia experimental actual sugieren que todos esos elementos se metalizarían si pudieran formar fases condensadas, [151] excepto quizás el oganesón. [155] [p]
MetálicoRed covalenteCovalente molecularÁtomos individualesDesconocidoEl color de fondo muestra los enlaces de sustancias simples en la tabla periódica. Si hay varios, se considera el alótropo más estable.
Generalmente, los metales son brillantes y densos. [32] Suelen tener puntos de fusión y ebullición altos debido a la fuerza del enlace metálico, y a menudo son maleables y dúctiles (fácilmente estirables y moldeables) porque los átomos pueden moverse entre sí sin romper el enlace metálico. [165] Conducen electricidad porque sus electrones son libres de moverse en las tres dimensiones. De manera similar, conducen calor, que es transferido por los electrones como energía cinética adicional : se mueven más rápido. Estas propiedades persisten en el estado líquido, ya que aunque la estructura cristalina se destruye al fundirse, los átomos aún se tocan y el enlace metálico persiste, aunque se debilita. [165] Los metales tienden a ser reactivos hacia los no metales. [32] Se pueden encontrar algunas excepciones a estas generalizaciones: por ejemplo, el berilio, el cromo, [84] el manganeso, [166] el antimonio, [167] el bismuto, [168] y el uranio son frágiles (no es una lista exhaustiva); [84] El cromo es extremadamente duro; [169] El galio, el rubidio, el cesio y el mercurio son líquidos a temperatura ambiente o cerca de ella; [q] Y los metales nobles como el oro son químicamente muy inertes. [170] [171]
Los no metales presentan diferentes propiedades. Los que forman cristales covalentes gigantes presentan puntos de fusión y ebullición elevados, ya que se necesita una energía considerable para superar los fuertes enlaces covalentes. Los que forman moléculas discretas se mantienen unidos principalmente por fuerzas de dispersión, que se superan más fácilmente; por lo tanto, tienden a tener puntos de fusión y ebullición más bajos, [172] y muchos son líquidos o gases a temperatura ambiente. [32] Los no metales a menudo tienen un aspecto opaco. Tienden a ser reactivos con los metales, excepto los gases nobles, que son inertes con la mayoría de las sustancias. [32] Son frágiles cuando están sólidos ya que sus átomos se mantienen firmemente en su lugar. Son menos densos y conducen mal la electricidad, [32] porque no hay electrones móviles. [173] Cerca del límite, las brechas de banda son pequeñas y, por lo tanto, muchos elementos en esa región son semiconductores, como el silicio, el germanio, [173] y el telurio. [151] El selenio tiene un alótropo gris semiconductor y un alótropo rojo aislante; El arsénico tiene un alótropo gris metálico, un alótropo negro semiconductor y un alótropo amarillo aislante (aunque este último es inestable en condiciones ambientales). [152] Nuevamente hay excepciones; por ejemplo, el diamante tiene la conductividad térmica más alta de todos los materiales conocidos, mayor que cualquier metal. [174]
Es común designar una clase de metaloides que se extiende a ambos lados del límite entre metales y no metales, ya que los elementos en esa región son intermedios en propiedades físicas y químicas. [32] Sin embargo, no existe consenso en la literatura sobre qué elementos exactamente deberían designarse de esa manera. Cuando se utiliza dicha categoría, casi siempre se incluyen el silicio, el germanio, el arsénico y el telurio, y generalmente el boro y el antimonio; pero la mayoría de las fuentes también incluyen otros elementos, sin acuerdo sobre qué elementos adicionales deberían agregarse, y algunas otras eliminan de esta lista en su lugar. [r] Por ejemplo, a diferencia de todos los demás elementos generalmente considerados metaloides o no metales, la única forma estable del antimonio tiene conductividad metálica. Además, el elemento se parece al bismuto y, de manera más general, a los otros metales del bloque p en su comportamiento físico y químico. Sobre esta base, algunos autores han argumentado que se clasifica mejor como metal que como metaloide. [84] [179] [152] Por otra parte, el selenio tiene algunas propiedades semiconductoras en su forma más estable (aunque también tiene alótropos aislantes) y se ha argumentado que debería ser considerado un metaloide [179] – aunque esta situación también es válida para el fósforo, [152] que es una inclusión mucho más rara entre los metaloides. [r]
Existen otras relaciones a lo largo de la tabla periódica entre elementos que no están en el mismo grupo, como las relaciones diagonales entre elementos que están diagonalmente adyacentes (por ejemplo, litio y magnesio). [121] También se pueden encontrar algunas similitudes entre los grupos principales y los grupos de metales de transición, o entre los primeros actínidos y los primeros metales de transición, cuando los elementos tienen el mismo número de electrones de valencia. Así, el uranio se parece un poco al cromo y al tungsteno en el grupo 6, [121] ya que los tres tienen seis electrones de valencia. [180] Las relaciones entre elementos con el mismo número de electrones de valencia pero diferentes tipos de orbitales de valencia se han denominado relaciones secundarias o isodonor: normalmente tienen los mismos estados de oxidación máxima, pero no los mismos estados de oxidación mínima. Por ejemplo, el cloro y el manganeso tienen ambos +7 como su estado de oxidación máximo (p. ej. Cl 2 O 7 y Mn 2 O 7 ), pero sus respectivos estados de oxidación mínimos son −1 (p. ej. HCl ) y −3 (K 2 [Mn(CO) 4 ]). Los elementos con el mismo número de vacantes de valencia pero diferentes números de electrones de valencia están relacionados por una relación terciaria o isoaceptora: generalmente tienen estados de oxidación mínimos pero no máximos similares. Por ejemplo, el hidrógeno y el cloro tienen ambos −1 como su estado de oxidación mínimo (en hidruros y cloruros ), pero el estado de oxidación máximo del hidrógeno es +1 (p. ej. H 2 O ) mientras que el del cloro es +7. [58]
Muchas otras propiedades físicas de los elementos presentan variaciones periódicas de acuerdo con la ley periódica, como los puntos de fusión , los puntos de ebullición , los calores de fusión , los calores de vaporización , la energía de atomización , etc. Aparecen variaciones periódicas similares para los compuestos de los elementos, que se pueden observar comparando hidruros, óxidos, sulfuros, haluros, etc. [144] Las propiedades químicas son más difíciles de describir cuantitativamente, pero también presentan sus propias periodicidades. Los ejemplos incluyen la variación en las propiedades ácidas y básicas de los elementos y sus compuestos, las estabilidades de los compuestos y los métodos de aislamiento de los elementos. [113] La periodicidad se utiliza y se ha utilizado ampliamente para predecir las propiedades de nuevos elementos y nuevos compuestos desconocidos, y es fundamental para la química moderna. [181]
En la literatura se han utilizado muchos términos para describir conjuntos de elementos que se comportan de manera similar. Los nombres de los grupos metal alcalino , metal alcalinotérreo , triel , tetrel , pnicógeno , calcógeno , halógeno y gas noble son reconocidos por la IUPAC; los otros grupos pueden ser referidos por su número o por su primer elemento (por ejemplo, el grupo 6 es el grupo del cromo). [22] [182] Algunos dividen los elementos del bloque p de los grupos 13 a 16 por metalicidad, [177] [175] aunque no existe una definición de la IUPAC ni un consenso preciso sobre exactamente qué elementos deben considerarse metales, no metales o semimetales (a veces llamados metaloides). [177] [175] [22] Tampoco hay un consenso sobre cómo deben llamarse los metales que suceden a los metales de transición, y entre las posibilidades que se han utilizado se encuentran metal postransicional y metal pobre . Algunas monografías avanzadas excluyen los elementos del grupo 12 de los metales de transición debido a que sus propiedades químicas a veces son bastante diferentes, pero esta no es una práctica universal [183] y la IUPAC actualmente no la menciona como permitida en sus Principios de nomenclatura química . [184]
Los lantánidos se consideran los elementos La–Lu, que son todos muy similares entre sí: históricamente incluían solo Ce–Lu, pero el lantano pasó a incluirse por uso común. [22] Los elementos de tierras raras (o metales de tierras raras) agregan escandio e itrio a los lantánidos. [22] Análogamente, los actínidos se consideran los elementos Ac–Lr (históricamente Th–Lr), [22] aunque la variación de propiedades en este conjunto es mucho mayor que dentro de los lantánidos. [52] La IUPAC recomienda los nombres lantánoides y actinoides para evitar ambigüedad, ya que el sufijo -uro generalmente denota un ion negativo; sin embargo, los lantánidos y actínidos siguen siendo comunes. [22] Con el creciente reconocimiento del lutecio y el lawrencio como elementos del bloque d, algunos autores comenzaron a definir los lantánidos como La–Yb y los actínidos como Ac–No, coincidiendo con el bloque f. [57] [25] [185] [186] [187] [188] Los transactínidos o elementos superpesados son los elementos de vida corta más allá de los actínidos, comenzando en el lawrencio o el rutherfordio (dependiendo de dónde se toman los actínidos para terminar). [188] [189] [190] [191] [192]
Existen muchas más categorizaciones que se utilizan según ciertas disciplinas. En astrofísica, un metal se define como cualquier elemento con un número atómico mayor que 2, es decir, cualquier elemento excepto hidrógeno y helio. [193] El término "semimetal" tiene una definición diferente en física que en química: el bismuto es un semimetal según las definiciones físicas, pero los químicos generalmente lo consideran un metal. [194] Unos pocos términos se utilizan ampliamente, pero sin ninguna definición muy formal, como " metal pesado ", al que se le ha dado una gama tan amplia de definiciones que ha sido criticado por "efectivamente carente de sentido". [195]
El alcance de los términos varía significativamente entre los autores. Por ejemplo, según la IUPAC, los gases nobles se extienden para incluir a todo el grupo, incluido el elemento superpesado muy radiactivo oganesón. [196] Sin embargo, entre quienes se especializan en los elementos superpesados, esto no se hace a menudo: en este caso, "gas noble" se suele entender como el comportamiento no reactivo de los elementos más ligeros del grupo. Dado que los cálculos generalmente predicen que el oganesón no debería ser particularmente inerte debido a los efectos relativistas, y puede que ni siquiera sea un gas a temperatura ambiente si se pudiera producir en masa, su condición de gas noble a menudo se cuestiona en este contexto. [197] Además, a veces se encuentran variaciones nacionales: en Japón, los metales alcalinotérreos a menudo no incluyen el berilio y el magnesio, ya que su comportamiento es diferente al de los metales más pesados del grupo 2. [198]

En 1817, el físico alemán Johann Wolfgang Döbereiner comenzó a formular uno de los primeros intentos de clasificar los elementos. [199] En 1829, descubrió que podía formar algunos de los elementos en grupos de tres, con los miembros de cada grupo teniendo propiedades relacionadas. Llamó a estos grupos tríadas . [200] [201] El cloro, el bromo y el yodo formaban una tríada; al igual que el calcio, el estroncio y el bario; el litio, el sodio y el potasio; y el azufre, el selenio y el telurio. Hoy en día, todas estas tríadas forman parte de los grupos modernos: los halógenos, los metales alcalinotérreos, los metales alcalinos y los calcógenos. [202] Varios químicos continuaron su trabajo y pudieron identificar cada vez más relaciones entre pequeños grupos de elementos. Sin embargo, no pudieron construir un esquema que los abarcara a todos. [203]

En febrero de 1863, John Newlands publicó una carta en Chemical News sobre la periodicidad de los elementos químicos. [204] En 1864, Newlands publicó un artículo en Chemical News en el que mostraba que si los elementos se organizan según su peso atómico, los que tienen números consecutivos con frecuencia pertenecen al mismo grupo o ocupan posiciones similares en grupos diferentes, y señaló que cada octavo elemento a partir de uno dado es en esta disposición una especie de repetición del primero, como la octava nota de una octava en la música (La ley de las octavas). [204] Sin embargo, la formulación de Newlands sólo funcionaba bien para los elementos del grupo principal y encontró serios problemas con los demás. [58]
El químico alemán Lothar Meyer observó las secuencias de propiedades químicas y físicas similares repetidas a intervalos periódicos. Según él, si los pesos atómicos se trazaban como ordenadas (es decir, verticalmente) y los volúmenes atómicos como abscisas (es decir, horizontalmente) —la curva obtenía una serie de máximos y mínimos— los elementos más electropositivos aparecerían en los picos de la curva en el orden de sus pesos atómicos. En 1864 se publicó un libro suyo; contenía una versión temprana de la tabla periódica que contenía 28 elementos y clasificaba los elementos en seis familias por su valencia —por primera vez, los elementos se habían agrupado según su valencia—. Los trabajos sobre la organización de los elementos por peso atómico se habían visto obstaculizados hasta entonces por mediciones inexactas de los pesos atómicos. [205] En 1868 revisó su tabla, pero esta revisión se publicó como borrador solo después de su muerte. [206]

El avance definitivo vino del químico ruso Dmitri Mendeleev . Aunque otros químicos (incluido Meyer) habían encontrado otras versiones del sistema periódico aproximadamente al mismo tiempo, Mendeleev fue el más dedicado a desarrollar y defender su sistema, y fue su sistema el que más afectó a la comunidad científica. [207] El 17 de febrero de 1869 (1 de marzo de 1869 en el calendario gregoriano), Mendeleev comenzó a ordenar los elementos y a compararlos por sus pesos atómicos. Comenzó con unos pocos elementos y, a lo largo del día, su sistema creció hasta abarcar la mayoría de los elementos conocidos. Después de encontrar una disposición consistente, su tabla impresa apareció en mayo de 1869 en la revista de la Sociedad Química Rusa. [208] Cuando los elementos no parecían encajar en el sistema, predijo audazmente que las valencias o los pesos atómicos se habían medido incorrectamente, o que faltaba un elemento aún por descubrir. [58] En 1871, Mendeleev publicó un extenso artículo, que incluía una versión actualizada de su tabla, en el que hacía explícitas sus predicciones sobre los elementos desconocidos. Mendeleev predijo en detalle las propiedades de tres de estos elementos desconocidos: como les faltaban homólogos más pesados del boro, el aluminio y el silicio, los llamó eka-boro, eka-aluminio y eka-silicio ("eka" significa "uno" en sánscrito). [208] [209] : 45

En 1875, el químico francés Paul-Émile Lecoq de Boisbaudran , trabajando sin conocimiento de la predicción de Mendeléyev, descubrió un nuevo elemento en una muestra del mineral esfalrita , y lo llamó galio. Aisló el elemento y comenzó a determinar sus propiedades. Mendeléyev, al leer la publicación de De Boisbaudran, envió una carta afirmando que el galio era su predicción del eka-aluminio. Aunque Lecoq de Boisbaudran se mostró inicialmente escéptico y sospechó que Mendeléyev estaba tratando de tomar crédito por su descubrimiento, más tarde admitió que Mendeléyev estaba en lo cierto. [210] En 1879, el químico sueco Lars Fredrik Nilson descubrió un nuevo elemento, al que llamó escandio: resultó ser eka-boro. El eka-silicio fue encontrado en 1886 por el químico alemán Clemens Winkler , quien lo llamó germanio. Las propiedades del galio, el escandio y el germanio coincidían con las que Mendeleev había predicho. [211] En 1889, Mendeleev señaló en la Conferencia Faraday en la Royal Institution de Londres que no esperaba vivir lo suficiente "para mencionar su descubrimiento a la Sociedad Química de Gran Bretaña como una confirmación de la exactitud y generalidad de la ley periódica". [212] Incluso el descubrimiento de los gases nobles a finales del siglo XIX, que Mendeleev no había predicho, encajaba perfectamente en su esquema como octavo grupo principal. [213]
Sin embargo, Mendeleev tuvo algunos problemas para encajar los lantánidos conocidos en su esquema, ya que no mostraban el cambio periódico de valencias que sí presentaban los otros elementos. Después de mucha investigación, el químico checo Bohuslav Brauner sugirió en 1902 que los lantánidos podían colocarse todos juntos en un grupo en la tabla periódica. Lo llamó la "hipótesis del asteroide" como una analogía astronómica: así como hay un cinturón de asteroides en lugar de un solo planeta entre Marte y Júpiter, se pensaba que el lugar debajo del itrio estaba ocupado por todos los lantánidos en lugar de un solo elemento. [33]

Después de que se investigara la estructura interna del átomo, el físico aficionado holandés Antonius van den Broek propuso en 1913 que la carga nuclear determinaba la colocación de los elementos en la tabla periódica. [214] [215] El físico neozelandés Ernest Rutherford acuñó el término "número atómico" para esta carga nuclear. [216] En el artículo publicado de van den Broek, ilustró la primera tabla periódica electrónica que mostraba los elementos ordenados según el número de sus electrones. [217] Rutherford confirmó en su artículo de 1914 que Bohr había aceptado la opinión de van den Broek. [218]
.jpg/440px-Henry_Moseley_(1887-1915).jpg)
El mismo año, el físico inglés Henry Moseley, usando espectroscopia de rayos X, confirmó experimentalmente la propuesta de van den Broek. Moseley determinó el valor de la carga nuclear de cada elemento, desde el aluminio hasta el oro , y demostró que el ordenamiento de Mendeleev en realidad coloca los elementos en orden secuencial por carga nuclear. [219] La carga nuclear es idéntica al conteo de protones y determina el valor del número atómico ( Z ) de cada elemento. El uso del número atómico proporciona una secuencia definitiva, basada en números enteros, para los elementos. La investigación de Moseley resolvió inmediatamente las discrepancias entre el peso atómico y las propiedades químicas; estos eran casos como el telurio y el yodo, donde el número atómico aumenta pero el peso atómico disminuye. [214] Aunque Moseley murió pronto en la Primera Guerra Mundial, el físico sueco Manne Siegbahn continuó su trabajo hasta el uranio y estableció que era el elemento con el número atómico más alto conocido en ese momento (92). [220] Con base en la investigación de Moseley y Siegbahn, también se supo qué números atómicos correspondían a los elementos faltantes aún por encontrar: 43, 61, 72, 75, 85 y 87. [214] (De hecho, el elemento 75 ya había sido encontrado por el químico japonés Masataka Ogawa en 1908 y llamado nipponium , pero erróneamente lo asignó como elemento 43 en lugar de 75 y, por lo tanto, su descubrimiento no fue generalmente reconocido hasta más tarde. El descubrimiento contemporáneo aceptado del elemento 75 llegó en 1925, cuando Walter Noddack , Ida Tacke y Otto Berg lo redescubrieron independientemente y le dieron su nombre actual, renio ). [221]
El nacimiento de la física atómica también aclaró la situación de los isótopos . En las cadenas de desintegración de los elementos radiactivos primordiales torio y uranio, pronto se hizo evidente que había muchos elementos aparentemente nuevos que tenían pesos atómicos diferentes pero exactamente las mismas propiedades químicas. En 1913, Frederick Soddy acuñó el término "isótopo" para describir esta situación, y consideró que los isótopos eran simplemente formas diferentes del mismo elemento químico. Esto aclaró además discrepancias como el telurio y el yodo: la composición isotópica natural del telurio está ponderada hacia isótopos más pesados que los del yodo, pero el telurio tiene un número atómico menor. [222]
El físico danés Niels Bohr aplicó la idea de cuantificación de Max Planck al átomo. Llegó a la conclusión de que los niveles de energía de los electrones estaban cuantificados: solo se permitía un conjunto discreto de estados de energía estables. Bohr intentó entonces comprender la periodicidad a través de las configuraciones electrónicas, suponiendo en 1913 que los electrones internos deberían ser los responsables de las propiedades químicas del elemento. [223] [224] En 1913, produjo la primera tabla periódica electrónica basada en un átomo cuántico. [225]
En 1913, Bohr llamó a sus capas de electrones "anillos": en la época de su modelo planetario no existían orbitales atómicos dentro de las capas. Bohr explica en la Parte 3 de su famoso artículo de 1913 que el máximo de electrones en una capa es ocho, escribiendo: "Vemos, además, que un anillo de n electrones no puede girar en un solo anillo alrededor de un núcleo de carga ne a menos que n < 8". Para átomos más pequeños, las capas de electrones se llenarían de la siguiente manera: "los anillos de electrones solo se unirán si contienen el mismo número de electrones; y que, en consecuencia, el número de electrones en los anillos internos solo será 2, 4, 8". Sin embargo, en átomos más grandes, la capa más interna contendría ocho electrones: "por otro lado, el sistema periódico de los elementos sugiere firmemente que ya en el neón N = 10 se producirá un anillo interno de ocho electrones". Las configuraciones electrónicas propuestas para los átomos (mostradas a la derecha) en su mayoría no concuerdan con las que ahora se conocen. [226] [227] Se mejoraron aún más después de que el trabajo de Arnold Sommerfeld y Edmund Stoner descubriera más números cuánticos. [222]
El primero en ampliar y corregir sistemáticamente los potenciales químicos de la teoría atómica de Bohr fue Walther Kossel en 1914 y 1916. Kossel explicó que en la tabla periódica se crearían nuevos elementos a medida que se añadieran electrones a la capa exterior. En el artículo de Kossel, escribe: "Esto lleva a la conclusión de que los electrones, que se añaden más, deben colocarse en anillos o capas concéntricas, en cada una de las cuales ... sólo debe disponerse un cierto número de electrones, es decir, ocho en nuestro caso. Tan pronto como se completa un anillo o capa, debe comenzarse uno nuevo para el siguiente elemento; el número de electrones, que son más fácilmente accesibles y se encuentran en la periferia más externa, aumenta de nuevo de un elemento a otro y, por lo tanto, en la formación de cada nueva capa se repite la periodicidad química". [228] [229]
En un artículo de 1919, Irving Langmuir postuló la existencia de "celdas" que ahora llamamos orbitales, que solo podían contener dos electrones cada una, y que estaban dispuestas en "capas equidistantes" que ahora llamamos capas. Hizo una excepción: la primera capa solo contenía dos electrones. [230] El químico Charles Rugeley Bury sugirió en 1921 que ocho y dieciocho electrones en una capa forman configuraciones estables. Bury propuso que las configuraciones electrónicas en elementos de transición dependían de los electrones de valencia en su capa exterior. [231] Introdujo la palabra transición para describir los elementos ahora conocidos como metales de transición o elementos de transición. [232] La teoría de Bohr fue reivindicada por el descubrimiento del elemento 72: Georges Urbain afirmó haberlo descubierto como el elemento de tierras raras celtio , pero Bury y Bohr habían predicho que el elemento 72 no podía ser un elemento de tierras raras y tenía que ser un homólogo del circonio . Dirk Coster y Georg von Hevesy buscaron el elemento en minerales de circonio y encontraron el elemento 72, al que llamaron hafnio en honor a la ciudad natal de Bohr, Copenhague ( Hafnia en latín). [233] [234] El celtio de Urbain resultó ser simplemente lutecio purificado (elemento 71). [235] El hafnio y el renio se convirtieron así en los últimos elementos estables que se descubrieron. [222]
Impulsado por Bohr, Wolfgang Pauli abordó el problema de las configuraciones electrónicas en 1923. Pauli amplió el esquema de Bohr para utilizar cuatro números cuánticos y formuló su principio de exclusión que establecía que no había dos electrones que pudieran tener los mismos cuatro números cuánticos. Esto explicaba las longitudes de los períodos en la tabla periódica (2, 8, 18 y 32), que correspondían al número de electrones que cada capa podía ocupar. [236] En 1925, Friedrich Hund llegó a configuraciones cercanas a las modernas. [237] Como resultado de estos avances, la periodicidad pasó a basarse en el número de electrones químicamente activos o de valencia en lugar de en las valencias de los elementos. [58] El principio de Aufbau que describe las configuraciones electrónicas de los elementos fue observado empíricamente por primera vez por Erwin Madelung en 1926, [45] aunque el primero en publicarlo fue Vladimir Karapetoff en 1930. [238] [239] En 1961, Vsevolod Klechkovsky derivó la primera parte de la regla de Madelung (que los orbitales se llenan en orden creciente de n + ℓ) del modelo de Thomas-Fermi ; [240] la regla completa fue derivada de un potencial similar en 1971 por Yury N. Demkov y Valentin N. Ostrovsky. [241] [s]

La teoría cuántica aclaró que los metales de transición y los lantánidos forman sus propios grupos separados, transicionales entre los grupos principales, aunque algunos químicos ya habían propuesto tablas que los mostraban de esta manera antes de esa fecha: el químico inglés Henry Bassett lo hizo en 1892, el químico danés Julius Thomsen en 1895 y el químico suizo Alfred Werner en 1905. Bohr utilizó la forma de Thomsen en su discurso del Nobel de 1922; la forma de Werner es muy similar a la forma moderna de 32 columnas. En particular, esta suplantó la hipótesis asteroidal de Brauner. [33]
La posición exacta de los lantánidos, y por lo tanto la composición del grupo 3 , permaneció en disputa durante décadas más porque sus configuraciones electrónicas inicialmente se midieron incorrectamente. [25] [92] Por razones químicas, Bassett, Werner y Bury agruparon el escandio y el itrio con el lutecio en lugar del lantano (los dos primeros dejaron un espacio vacío debajo del itrio ya que el lutecio aún no se había descubierto). [33] [231] Hund asumió en 1927 que todos los átomos de lantánidos tenían configuración [Xe]4f 0−14 5d 1 6s 2 , debido a su trivalencia predominante. Ahora se sabe que la relación entre la química y la configuración electrónica es más complicada que eso. [t] [54] La evidencia espectroscópica temprana pareció confirmar estas configuraciones, y por lo tanto la tabla periódica se estructuró para tener el grupo 3 como escandio, itrio, lantano y actinio, con catorce elementos f rompiendo el bloque d entre el lantano y el hafnio. [25] Pero más tarde se descubrió que esto solo es cierto para cuatro de los quince lantánidos (lantano, cerio, gadolinio y lutecio), y que los otros átomos de lantánidos no tienen un electrón d. En particular, el iterbio completa la capa 4f y, por lo tanto, los físicos soviéticos Lev Landau y Evgeny Lifshitz notaron en 1948 que el lutecio se considera correctamente como un elemento del bloque d en lugar de un elemento del bloque f; [26] que el lantano en masa es un metal f fue sugerido por primera vez por Jun Kondō en 1963, sobre la base de su superconductividad a baja temperatura . [100] Esto aclaró la importancia de observar los estados excitados de baja altitud de los átomos que pueden desempeñar un papel en los entornos químicos al clasificar los elementos por bloque y posicionarlos en la tabla. [63] [65] [25] Muchos autores posteriormente redescubrieron esta corrección basándose en preocupaciones físicas, químicas y electrónicas y la aplicaron a todos los elementos relevantes, haciendo así que el grupo 3 contuviera escandio, itrio, lutecio y lawrencio [63] [23] [92] y teniendo lantano a iterbio y actinio a nobelio como las filas del bloque f: [63] [23] esta versión corregida logra consistencia con la regla de Madelung y reivindica la ubicación química inicial de Bassett, Werner y Bury. [33]
En 1988, la IUPAC publicó un informe que respaldaba esta composición del grupo 3, [23] una decisión que se reafirmó en 2021. [24] Todavía se pueden encontrar variaciones en los libros de texto sobre la composición del grupo 3, [35] y todavía hoy se publican algunos argumentos en contra de este formato, [27] pero los químicos y físicos que han considerado el asunto coinciden en gran medida en que el grupo 3 contiene escandio, itrio, lutecio y lawrencio y cuestionan los contraargumentos por ser inconsistentes. [27]

En 1936, el conjunto de elementos faltantes, desde el hidrógeno hasta el uranio, se había reducido a cuatro: los elementos 43, 61, 85 y 87 seguían faltando. El elemento 43 se convirtió finalmente en el primer elemento en sintetizarse artificialmente a través de reacciones nucleares en lugar de descubrirse en la naturaleza. Fue descubierto en 1937 por los químicos italianos Emilio Segrè y Carlo Perrier , quienes llamaron a su descubrimiento tecnecio , por la palabra griega para "artificial". [242] Los elementos 61 ( prometio ) y 85 ( astatino ) también se produjeron artificialmente en 1945 y 1940 respectivamente; El elemento 87 ( francio ) se convirtió en el último elemento en ser descubierto en la naturaleza, por la química francesa Marguerite Perey en 1939. [243] [u] Los elementos más allá del uranio también fueron descubiertos artificialmente, comenzando con el descubrimiento del neptunio por Edwin McMillan y Philip Abelson en 1940 (mediante el bombardeo de uranio con neutrones). [75] Glenn T. Seaborg y su equipo en el Laboratorio Nacional Lawrence Berkeley (LBNL) continuaron descubriendo elementos transuránicos, comenzando con el plutonio en 1941, y descubrieron que, contrariamente al pensamiento anterior, los elementos a partir del actinio eran congéneres de los lantánidos en lugar de metales de transición. [244] Bassett (1892), Werner (1905) y el ingeniero francés Charles Janet (1928) habían sugerido esto previamente, pero sus ideas no recibieron entonces una aceptación general. [33] Seaborg los llamó así actínidos. [244] Los elementos hasta el 101 (llamado mendelevio en honor a Mendeléyev) fueron sintetizados hasta 1955, ya sea mediante irradiación de neutrones o partículas alfa, o en explosiones nucleares en los casos del 99 (einstenio) y el 100 (fermio). [75]
En los años 1960 y 1970 surgió una importante controversia con los elementos 102 a 106, a medida que surgía la competencia entre el equipo LBNL (ahora dirigido por Albert Ghiorso ) y un equipo de científicos soviéticos del Instituto Conjunto de Investigación Nuclear (JINR) dirigido por Georgy Flyorov . Cada equipo reivindicó el descubrimiento y, en algunos casos, cada uno propuso su propio nombre para el elemento, lo que creó una controversia sobre la denominación de los elementos que duró décadas. Estos elementos se crearon mediante el bombardeo de actínidos con iones ligeros. [245] La IUPAC adoptó al principio un enfoque de no intervención, prefiriendo esperar y ver si se llegaba a un consenso. Pero como también era el apogeo de la Guerra Fría , quedó claro que esto no sucedería. Como tal, la IUPAC y la Unión Internacional de Física Pura y Aplicada (IUPAP) crearon un Grupo de Trabajo sobre Transfermio (TWG, siendo el fermio el elemento 100) en 1985 para establecer criterios para el descubrimiento, [246] que se publicaron en 1991. [247] Después de alguna controversia adicional, estos elementos recibieron sus nombres finales en 1997, incluido seaborgio (106) en honor a Seaborg. [248]

Los criterios del TWG se utilizaron para arbitrar posteriores reclamaciones de descubrimiento de elementos de LBNL y JINR, así como de institutos de investigación en Alemania ( GSI ) y Japón ( Riken ). [249] Actualmente, la consideración de las reclamaciones de descubrimiento es realizada por un Grupo de Trabajo Conjunto IUPAC/IUPAP . Después de que se asignó la prioridad, los elementos se agregaron oficialmente a la tabla periódica y se invitó a los descubridores a proponer sus nombres. [6] Para 2016, esto había ocurrido para todos los elementos hasta 118, completando así las primeras siete filas de la tabla periódica. [6] [250] Los descubrimientos de elementos más allá del 106 fueron posibles gracias a las técnicas ideadas por Yuri Oganessian en el JINR: la fusión fría (bombardeo de plomo y bismuto por iones pesados) hizo posible los descubrimientos de los elementos 107 a 112 en GSI y 113 en Riken entre 1981 y 2004, y dirigió al equipo del JINR (en colaboración con científicos estadounidenses) para descubrir los elementos 114 a 118 utilizando fusión caliente (bombardeo de actínidos por iones de calcio) entre 1998 y 2010. [251] [252] El elemento más pesado conocido, oganesón (118), recibe su nombre en honor a Oganessian. El elemento 114 se llama flerovio en honor a su predecesor y mentor Flyorov. [252]
Para celebrar el 150 aniversario de la tabla periódica, las Naciones Unidas declararon el año 2019 como el Año Internacional de la Tabla Periódica, celebrando "uno de los logros más significativos de la ciencia". [253] Los criterios de descubrimiento establecidos por el TWG se actualizaron en 2020 en respuesta a un progreso experimental y teórico que no se había previsto en 1991. [254] Hoy en día, la tabla periódica es uno de los íconos más reconocibles de la química. [81] La IUPAC está involucrada hoy en día en muchos procesos relacionados con la tabla periódica: el reconocimiento y la denominación de nuevos elementos, la recomendación de números de grupo y nombres colectivos, y la actualización de los pesos atómicos. [6]

Los elementos nombrados más recientemente – nihonium (113), moscovium (115), tennessine (117) y oganesson (118) – completaron la séptima fila de la tabla periódica. [6] Los elementos futuros tendrían que comenzar una octava fila . Estos elementos pueden ser referidos ya sea por sus números atómicos (por ejemplo, " elemento 164 "), o por los nombres sistemáticos de elementos de la IUPAC adoptados en 1978, que se relacionan directamente con los números atómicos (por ejemplo, "unhexquadium" para el elemento 164, derivado del latín unus "uno", griego hexa "seis", latín quadra "cuatro", y el sufijo tradicional -ium para elementos metálicos). [6] Todos los intentos de sintetizar tales elementos han fracasado hasta ahora. Un intento de fabricar el elemento 119 ha estado en curso desde 2018 en el instituto de investigación Riken en Japón. El LBNL en los Estados Unidos, el JINR en Rusia y el Centro de Investigación de Iones Pesados de Lanzhou (HIRFL) en China también planean hacer sus propios intentos de sintetizar los primeros elementos del período 8. [257] [258] [259] [260] [261] [262]
Si el octavo período siguiera el patrón establecido por los períodos anteriores, entonces contendría cincuenta elementos, llenando las subcapas 8s, 5g, 6f, 7d y finalmente 8p en ese orden. Pero en este punto, los efectos relativistas deberían dar como resultado desviaciones significativas de la regla de Madelung. Se han sugerido varios modelos diferentes para las configuraciones de los elementos del octavo período, así como para mostrar los resultados en una tabla periódica. Todos coinciden en que el octavo período debería comenzar como los anteriores con dos elementos 8s, 119 y 120. Sin embargo, después de eso, las superposiciones energéticas masivas entre las subcapas 5g, 6f, 7d y 8p significan que todas comienzan a llenarse juntas, y no está claro cómo separar las series específicas 5g y 6f. [59] [263] [264] [265] [266] Los elementos 121 a 156 no encajan bien como análogos químicos de ningún grupo anterior en las partes anteriores de la tabla, [128] aunque a veces se han colocado como 5g, 6f y otras series para reflejar formalmente sus configuraciones electrónicas. [128] Eric Scerri ha planteado la cuestión de si una tabla periódica extendida debería tener en cuenta el fracaso de la regla de Madelung en esta región, o si tales excepciones deberían ignorarse. [263] La estructura de capas también puede ser bastante formal en este punto: ya se espera que la distribución de electrones en un átomo de oganesón sea bastante uniforme, sin una estructura de capas discernible. [267]
La situación de los elementos 157 a 172 debería volver a la normalidad y ser más reminiscente de las filas anteriores. [256] Las capas p pesadas están divididas por la interacción espín-órbita : un orbital p (p 1/2 ) está más estabilizado y los otros dos (p 3/2 ) están desestabilizados. (Estos cambios en los números cuánticos ocurren para todos los tipos de capas, pero marca la mayor diferencia en el orden de las capas p). Es probable que para el elemento 157, las capas 8s y 8p 1/2 llenas con cuatro electrones en total se hayan hundido en el núcleo. Más allá del núcleo, los siguientes orbitales son 7d y 9s a energías similares, seguidos por 9p 1/2 y 8p 3/2 a energías similares, y luego un gran espacio. [256] Por lo tanto, los orbitales 9s y 9p 1/2 en esencia reemplazan a los 8s y 8p 1/2 , haciendo que los elementos 157-172 sean probablemente químicamente análogos a los grupos 3-18: por ejemplo, el elemento 164 aparecería dos lugares debajo del plomo en el grupo 14 bajo el patrón usual, pero se calcula que es muy análogo al paladio en el grupo 10. [54] [265] [59] [255] [128] Por lo tanto, se necesitan cincuenta y cuatro elementos en lugar de cincuenta para llegar al siguiente elemento noble después del 118. [268] Sin embargo, mientras que estas conclusiones sobre la química de los elementos 157 a 172 son generalmente aceptadas por los modelos, [128] [59] hay desacuerdo sobre si la tabla periódica debe dibujarse para reflejar analogías químicas, o si debe reflejar probables configuraciones electrónicas formales, que deberían ser bastante diferentes de períodos anteriores y no son aceptadas entre las fuentes. La discusión sobre el formato de la octava fila continúa. [59] [265] [266] [104]
Más allá del elemento 172, el cálculo se complica porque el nivel de energía del electrón 1s se vuelve imaginario. Esta situación tiene una interpretación física y no plantea en sí misma un límite electrónico a la tabla periódica, pero la forma correcta de incorporar dichos estados en los cálculos multielectrónicos sigue siendo un problema abierto. Esto debería resolverse para continuar calculando la estructura de la tabla periódica más allá de este punto. [269]
La estabilidad nuclear probablemente resulte ser un factor decisivo que limite el número de elementos posibles. Depende del equilibrio entre la repulsión eléctrica entre protones y la fuerza fuerte que une a protones y neutrones. [270] Los protones y neutrones están dispuestos en capas , al igual que los electrones, y por lo tanto una capa cerrada puede aumentar significativamente la estabilidad: los núcleos superpesados conocidos existen debido a tal cierre de capa, probablemente alrededor de 114-126 protones y 184 neutrones. [269] Probablemente estén cerca de una isla de estabilidad predicha , donde los nucleidos superpesados deberían tener una vida más larga de lo esperado: las predicciones para los nucleidos de vida más larga en la isla varían desde microsegundos a millones de años. [104] [271] [272] No obstante, debe notarse que estas son esencialmente extrapolaciones en una parte desconocida del gráfico de nucleidos, y las incertidumbres sistemáticas del modelo deben tenerse en cuenta. [104]
A medida que se pasan las capas cerradas, el efecto estabilizador debería desaparecer: [273] por lo tanto, se espera que los nucleidos superpesados con más de 184 neutrones tengan vidas mucho más cortas, fisionándose espontáneamente en 10 −15 segundos. Si esto es así, entonces no tendría sentido considerarlos elementos químicos: la IUPAC define que un elemento existe solo si el núcleo vive más de 10 −14 segundos, el tiempo necesario para que acumule una nube de electrones. No obstante, las estimaciones teóricas de las vidas medias dependen mucho del modelo y varían en muchos órdenes de magnitud. [269] Se predice que la repulsión extrema entre protones dará como resultado topologías nucleares exóticas, con burbujas, anillos y toros esperados: esto complica aún más la extrapolación. [104] No está claro si existen cierres de capas más alejados, debido a una esperada difuminación de capas nucleares distintas (como ya se espera para las capas de electrones en oganesson). [273] Además, incluso si existen cierres de capas posteriores, no está claro si permitirían la existencia de elementos tan pesados. [274] [275] [276] [177] Como tal, puede ser que la tabla periódica prácticamente termine alrededor del elemento 120, ya que los elementos se vuelven demasiado efímeros para observarlos, y luego demasiado efímeros para tener química; la era del descubrimiento de nuevos elementos estaría así cerca de su fin. [177] [277] Si existe otro cierre de capa de protones más allá de 126, entonces probablemente ocurra alrededor de 164; [274] por lo tanto, la región donde falla la periodicidad coincide más o menos con la región de inestabilidad entre los cierres de capa. [128]
Como alternativa, la materia de quarks puede volverse estable en números de masa altos, en los que el núcleo está compuesto de quarks que fluyen libremente hacia arriba y hacia abajo en lugar de unirlos en protones y neutrones; esto crearía un continente de estabilidad en lugar de una isla. [278] [279] Otros efectos pueden entrar en juego: por ejemplo, en elementos muy pesados, es probable que los electrones 1s pasen una cantidad significativa de tiempo tan cerca del núcleo que en realidad estén dentro de él, lo que los haría vulnerables a la captura de electrones . [280]
Incluso si los elementos de la octava fila pueden existir, es probable que producirlos sea difícil, y debería volverse aún más difícil a medida que aumenta el número atómico. [281] Aunque se espera que los elementos 119 y 120 de la octava fila sean alcanzables con los medios actuales, se espera que los elementos más allá de ellos requieran nueva tecnología, [282] si es que se pueden producir. [283] Caracterizar experimentalmente estos elementos químicamente también plantearía un gran desafío. [257]
La ley periódica puede representarse de múltiples maneras, de las cuales la tabla periódica estándar es solo una. [284] En los 100 años posteriores a la aparición de la tabla de Mendeleev en 1869, Edward G. Mazurs había recopilado aproximadamente 700 versiones publicadas diferentes de la tabla periódica. [180] [285] Muchas formas conservan la estructura rectangular, incluida la tabla periódica de pasos a la izquierda de Charles Janet (en la imagen de abajo) y la forma modernizada del diseño original de 8 columnas de Mendeleev que todavía es común en Rusia. Otros formatos de tabla periódica han sido moldeados de manera mucho más exótica, como espirales ( la de Otto Theodor Benfey en la imagen de la derecha), círculos y triángulos. [286]
A menudo se desarrollan tablas periódicas alternativas para resaltar o enfatizar las propiedades químicas o físicas de los elementos que no son tan evidentes en las tablas periódicas tradicionales, y hay otras que se inclinan más hacia el énfasis en la química o la física en cada extremo. [287] La forma estándar, que sigue siendo por lejos la más común, está en algún lugar en el medio. [287]
Las muchas formas diferentes de la tabla periódica han dado lugar a las preguntas de si existe una forma óptima o definitiva de la tabla periódica y, de ser así, cuál podría ser. Actualmente no hay respuestas de consenso para ninguna de las preguntas. [288] [287] La tabla de pasos a la izquierda de Janet se está discutiendo cada vez más como candidata a ser la forma óptima o más fundamental; Scerri ha escrito en apoyo de ella, ya que aclara la naturaleza del helio como un elemento del bloque s, aumenta la regularidad al tener todas las longitudes de período repetidas, sigue fielmente la regla de Madelung al hacer que cada período corresponda a un valor de n + ℓ , [g] y regulariza las tríadas de números atómicos y la tendencia de anomalía de la primera fila. Si bien señala que la ubicación del helio sobre los metales alcalinotérreos puede considerarse una desventaja desde una perspectiva química, lo contrarresta apelando a la anomalía de la primera fila, señalando que la tabla periódica "se reduce fundamentalmente a la mecánica cuántica" y que se ocupa de "elementos abstractos" y, por lo tanto, de propiedades atómicas en lugar de propiedades macroscópicas. [294]
En el grupo 15 de la tabla periódica, como en los dos grupos vecinos, el carácter metálico aumenta a medida que se desciende. Más específicamente, hay una transición desde un elemento puramente no metálico (N) a través de elementos con modificaciones no metálicas y metálicas hasta elementos puramente metálicos (Sb, Bi). Este capítulo aborda los dos elementos, además del nitrógeno, que son claramente no metálicos en condiciones estándar: el fósforo y el arsénico. Sin embargo, la química del arsénico solo se describe brevemente, ya que muchos de los compuestos de arsénico se parecen a las especies de fósforo correspondientes.
Los elementos superpesados (
Z
> 102) se encuentran en los límites de masa y carga.
「12.アルカリ土類金属」の範囲についても,△を含めれば,すべての教科書で提案が考慮されている。歴史的には第4 周期のカルシウム以下を指していた用語だったが,「周期表の2 族に対応する用語とする」というIUPAC の勧告1)に従うのは現在では自然な流れだろう.
El primer uso del término "transición" en su sentido electrónico moderno parece deberse al químico británico CRBury, quien utilizó el término por primera vez en su artículo de 1921 sobre la estructura electrónica de los átomos y la tabla periódica