El plutonio es un elemento químico ; tiene símbolo Pu y número atómico 94. Es un metal actínido de apariencia gris plateada que se empaña cuando se expone al aire y forma una capa opaca cuando se oxida . El elemento normalmente presenta seis alótropos y cuatro estados de oxidación . Reacciona con carbono , halógenos , nitrógeno , silicio e hidrógeno . Cuando se expone al aire húmedo, forma óxidos e hidruros que pueden expandir la muestra hasta un 70% en volumen, que a su vez se desprende en forma de polvo pirofórico . Es radiactivo y puede acumularse en los huesos , lo que hace peligrosa la manipulación del plutonio.
El plutonio se produjo y aisló sintéticamente por primera vez a finales de 1940 y principios de 1941, mediante un bombardeo de deuterón de uranio-238 en el ciclotrón de 1,5 metros (60 pulgadas) de la Universidad de California, Berkeley . Primero, se sintetizó neptunio-238 ( vida media de 2,1 días), que posteriormente sufrió desintegración beta para formar el nuevo elemento con número atómico 94 y peso atómico 238 (vida media de 88 años). Dado que uranio recibió el nombre del planeta Urano y neptunio del planeta Neptuno , el elemento 94 recibió el nombre de Plutón , que en ese momento también se consideraba un planeta. El secreto de la guerra impidió que el equipo de la Universidad de California publicara su descubrimiento hasta 1948.
El plutonio es el elemento con mayor número atómico que se sabe que se encuentra en la naturaleza. En los depósitos naturales de uranio-238 surgen trazas cuando el uranio-238 captura los neutrones emitidos por la desintegración de otros átomos de uranio-238. El isótopo pesado plutonio-244 tiene una vida media lo suficientemente larga como para que cantidades extremas de trazas deberían haber sobrevivido primordialmente (desde la formación de la Tierra) hasta el presente, pero hasta ahora los experimentos aún no han sido lo suficientemente sensibles para detectarlo.
Tanto el plutonio-239 como el plutonio-241 son fisibles , lo que significa que pueden sostener una reacción nuclear en cadena , lo que lleva a aplicaciones en armas nucleares y reactores nucleares . El plutonio-240 exhibe una alta tasa de fisión espontánea , lo que aumenta el flujo de neutrones de cualquier muestra que lo contenga. La presencia de plutonio-240 limita la utilizabilidad de una muestra de plutonio para armas o su calidad como combustible para reactores, y el porcentaje de plutonio-240 determina su grado ( grado para armas , grado para combustible o grado para reactor). El plutonio-238 tiene una vida media de 87,7 años y emite partículas alfa . Es una fuente de calor en los generadores termoeléctricos de radioisótopos , que se utilizan para alimentar algunas naves espaciales . Los isótopos de plutonio son caros e incómodos de separar, por lo que determinados isótopos suelen fabricarse en reactores especializados.
Producir plutonio en cantidades útiles por primera vez fue una parte importante del Proyecto Manhattan durante la Segunda Guerra Mundial que desarrolló las primeras bombas atómicas. Las bombas Fat Man utilizadas en la prueba nuclear Trinity en julio de 1945 y en el bombardeo de Nagasaki en agosto de 1945 tenían núcleos de plutonio . Los experimentos de radiación humana que estudiaban el plutonio se llevaron a cabo sin consentimiento informado , y después de la guerra se produjeron varios accidentes de criticidad , algunos letales. La eliminación de residuos de plutonio de las centrales nucleares y de las armas nucleares desmanteladas construidas durante la Guerra Fría es una preocupación medioambiental y de proliferación nuclear . Otras fuentes de plutonio en el medio ambiente son las consecuencias de numerosos ensayos nucleares en la superficie, que ahora están prohibidos .
El plutonio, como la mayoría de los metales, tiene al principio un aspecto plateado brillante, muy parecido al níquel , pero se oxida muy rápidamente hasta adquirir un color gris opaco, aunque también se informa de color amarillo y verde oliva. [4] [5] A temperatura ambiente, el plutonio se encuentra en su forma α ( alfa ) . Esta, la forma estructural más común del elemento ( alótropo ), es tan dura y quebradiza como el hierro fundido gris , a menos que se alee con otros metales para hacerlo blando y dúctil. A diferencia de la mayoría de los metales, no es buen conductor del calor ni de la electricidad . Tiene un punto de fusión bajo (640 °C, 1184 °F) y un punto de ebullición inusualmente alto (3228 °C, 5842 °F). [4] Esto da un amplio rango de temperaturas (más de 2.500 kelvin de ancho) en las que el plutonio es líquido, pero este rango no es el mayor entre todos los actínidos ni entre todos los metales. [6] El bajo punto de fusión y la reactividad del metal nativo en comparación con el óxido hacen que los óxidos de plutonio sean una forma preferida para aplicaciones como el combustible de reactores de fisión nuclear ( combustible MOX ).
La desintegración alfa , la liberación de un núcleo de helio de alta energía , es la forma más común de desintegración radiactiva del plutonio. [7] Una masa de 5 kg de 239 Pu contiene aproximadamente12,5 × 10 24 átomos. Con una vida media de 24.100 años, aproximadamente11,5 × 10 12 de sus átomos se desintegran cada segundo emitiendo una partícula alfa de 5,157 MeV . Esto equivale a 9,68 vatios de potencia. El calor producido por la desaceleración de estas partículas alfa lo calienta al tacto. [8] [9] 238
Debido a su vida media mucho más corta, el Pu se calienta a temperaturas mucho más altas y brilla al rojo vivo con la radiación del cuerpo negro si se deja sin calentamiento o enfriamiento externo. Este calor se ha utilizado en generadores termoeléctricos de radioisótopos (ver más abajo).
La resistividad es una medida de la fuerza con la que un material se opone al flujo de corriente eléctrica . La resistividad del plutonio a temperatura ambiente es muy alta para un metal y aumenta aún más a temperaturas más bajas, lo cual es inusual para los metales. [10] Esta tendencia continúa hasta 100 K , por debajo del cual la resistividad disminuye rápidamente para muestras frescas. [10] Luego, la resistividad comienza a aumentar con el tiempo alrededor de 20 K debido al daño por radiación, con la velocidad dictada por la composición isotópica de la muestra. [10]
Debido a la autoirradiación, una muestra de plutonio se fatiga en toda su estructura cristalina, lo que significa que la disposición ordenada de sus átomos se ve alterada por la radiación con el tiempo. [11] La autoirradiación también puede conducir al recocido , que contrarresta algunos de los efectos de la fatiga cuando la temperatura aumenta por encima de 100 K. [12]
A diferencia de la mayoría de los materiales, el plutonio aumenta su densidad cuando se funde, en un 2,5%, pero el metal líquido muestra una disminución lineal de su densidad con la temperatura. [10] Cerca del punto de fusión, el plutonio líquido tiene una viscosidad y tensión superficial muy altas en comparación con otros metales. [11]
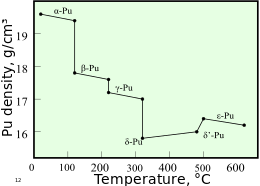
El plutonio normalmente tiene seis alótropos y forma un séptimo (zeta, ζ) a alta temperatura dentro de un rango de presión limitado. [13] Estos alótropos, que son diferentes modificaciones estructurales o formas de un elemento, tienen energías internas muy similares pero densidades y estructuras cristalinas que varían significativamente . Esto hace que el plutonio sea muy sensible a los cambios de temperatura, presión o química, y permite cambios dramáticos de volumen después de transiciones de fase de una forma alotrópica a otra. [11] Las densidades de los diferentes alótropos varían de 16,00 g/cm 3 a 19,86 g/cm 3 . [14]
La presencia de tantos alótropos hace que el mecanizado del plutonio sea muy difícil, ya que cambia de estado muy fácilmente. Por ejemplo, la forma α existe a temperatura ambiente en el plutonio puro. Tiene características de mecanizado similares al hierro fundido , pero cambia a la forma plástica y maleable β ( beta ) a temperaturas ligeramente más altas. [15] Las razones del complicado diagrama de fases no se comprenden del todo. La forma α tiene una estructura monoclínica de baja simetría , de ahí su fragilidad, resistencia, compresibilidad y mala conductividad térmica. [13]
El plutonio en forma δ ( delta ) normalmente existe en el rango de 310 °C a 452 °C, pero es estable a temperatura ambiente cuando se alea con un pequeño porcentaje de galio , aluminio o cerio , lo que mejora la trabajabilidad y permite soldarlo . [15] La forma δ tiene un carácter metálico más típico y es aproximadamente tan fuerte y maleable como el aluminio. [13] En las armas de fisión, las ondas de choque explosivas utilizadas para comprimir un núcleo de plutonio también provocarán una transición del plutonio habitual en fase δ a la forma α más densa, lo que ayudará significativamente a lograr la supercriticidad . [ cita necesaria ] La fase ε, el alótropo sólido de temperatura más alta, exhibe una autodifusión atómica anormalmente alta en comparación con otros elementos. [11]

El plutonio es un metal actínido radiactivo cuyo isótopo , el plutonio-239 , es uno de los tres isótopos fisibles primarios ( el uranio-233 y el uranio-235 son los otros dos); El plutonio-241 también es altamente fisible. Para ser considerado fisible, el núcleo atómico de un isótopo debe poder romperse o fisionarse cuando lo golpea un neutrón de movimiento lento y liberar suficientes neutrones adicionales para sostener la reacción nuclear en cadena dividiendo más núcleos. [dieciséis]
El plutonio-239 puro puede tener un factor de multiplicación (keff ) mayor que uno, lo que significa que si el metal está presente en cantidad suficiente y con una geometría apropiada (por ejemplo, una esfera de tamaño suficiente), puede formar una masa crítica . [17] Durante la fisión, una fracción de la energía de enlace nuclear , que mantiene unido un núcleo, se libera como una gran cantidad de energía electromagnética y cinética (gran parte de esta última se convierte rápidamente en energía térmica). La fisión de un kilogramo de plutonio-239 puede producir una explosión equivalente a 21.000 toneladas de TNT (88.000 GJ ). Es esta energía la que hace que el plutonio-239 sea útil en armas y reactores nucleares . [8]
La presencia del isótopo plutonio-240 en una muestra limita su potencial de bomba nuclear, ya que el plutonio-240 tiene una tasa de fisión espontánea relativamente alta (~440 fisiones por segundo por gramo, más de 1000 neutrones por segundo por gramo), [18] elevando los niveles de neutrones de fondo y aumentando así el riesgo de predetonación . [19] El plutonio se identifica como apto para armas , combustible o reactor según el porcentaje de plutonio-240 que contiene. El plutonio apto para armas contiene menos del 7% de plutonio-240. El plutonio de calidad combustible contiene entre un 7% y menos del 19%, y el plutonio-240 de calidad de reactor de potencia contiene un 19% o más. El plutonio supergrado , con menos del 4% de plutonio-240, se utiliza en las armas de la Marina de los EE. UU . almacenadas cerca de las tripulaciones de barcos y submarinos, debido a su menor radiactividad. [20] El isótopo plutonio-238 no es fisible, pero puede sufrir fisión nuclear fácilmente con neutrones rápidos y desintegración alfa. [8] Todos los isótopos de plutonio pueden "generarse" en material fisionable con una o más absorciones de neutrones , seguidas o no de desintegración beta . Esto convierte a los isótopos no fisibles del plutonio en un material fértil .
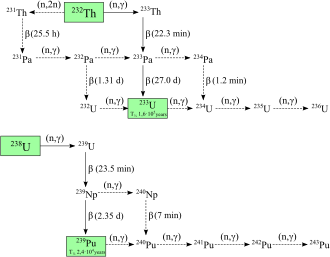
Se han caracterizado veinte isótopos radiactivos de plutonio. Los más longevos son el plutonio-244, con una vida media de 80,8 millones de años, el plutonio-242, con una vida media de 373.300 años, y el plutonio-239, con una vida media de 24.110 años. Todos los isótopos radiactivos restantes tienen vidas medias inferiores a 7.000 años. Este elemento también tiene ocho estados metaestables , aunque todos tienen vidas medias inferiores a un segundo. [7] Se ha encontrado plutonio-244 en el espacio interestelar [21] y tiene la vida media más larga de cualquier radioisótopo no primordial.
Los isótopos conocidos del plutonio varían en número de masa de 228 a 247. Los modos primarios de desintegración de los isótopos con números de masa inferiores al isótopo más estable, el plutonio-244, son la fisión espontánea y la emisión alfa , formando principalmente uranio (92 protones ) y neptunio. (93 protones) como productos de desintegración (sin tener en cuenta la amplia gama de núcleos hijos creados por procesos de fisión). El modo de desintegración principal de los isótopos con números de masa superiores al plutonio-244 es la emisión beta , formando principalmente isótopos de americio (95 protones) como productos de desintegración. El plutonio-241 es el isótopo principal de la serie de desintegración del neptunio , y se descompone en americio-241 mediante emisión beta. [7] [22]
El plutonio-238 y 239 son los isótopos más sintetizados. [8] El plutonio-239 se sintetiza mediante la siguiente reacción utilizando uranio (U) y neutrones (n) mediante desintegración beta (β − ) con neptunio (Np) como intermediario: [23]
Los neutrones de la fisión del uranio-235 son capturados por núcleos de uranio-238 para formar uranio-239; una desintegración beta convierte un neutrón en un protón para formar neptunio-239 (vida media de 2,36 días) y otra desintegración beta forma plutonio-239. [24] Egon Bretscher, trabajando en el proyecto británico Tube Alloys, predijo teóricamente esta reacción en 1940. [25]
El plutonio-238 se sintetiza bombardeando uranio-238 con deuterones (D, los núcleos del hidrógeno pesado ) en la siguiente reacción: [26]
En este proceso, un deuterón que choca con uranio-238 produce dos neutrones y neptunio-238, que se desintegra espontáneamente emitiendo partículas beta negativas para formar plutonio-238. [27] El plutonio-238 también puede producirse mediante irradiación de neutrones de neptunio-237 . [28]
Los isótopos de plutonio sufren desintegración radiactiva, lo que produce calor de desintegración . Diferentes isótopos producen diferentes cantidades de calor por masa. El calor de desintegración generalmente se indica como vatio/kilogramo o milivatio/gramo. En piezas más grandes de plutonio (por ejemplo, un foso de arma) y con una eliminación inadecuada del calor, el autocalentamiento resultante puede ser significativo.

A temperatura ambiente, el plutonio puro es de color plateado, pero se empaña cuando se oxida. [30] El elemento muestra cuatro estados de oxidación iónicos comunes en solución acuosa y uno raro: [14]
El color que muestran las soluciones de plutonio depende tanto del estado de oxidación como de la naturaleza del anión ácido . [32] Es el anión ácido el que influye en el grado de complejación (cómo se conectan los átomos a un átomo central) de las especies de plutonio. Además, el estado de oxidación formal +2 del plutonio se conoce en el complejo [K(2.2.2-criptando)] [Pu II Cp″ 3 ], Cp″ = C 5 H 3 (SiMe 3 ) 2 . [33]
También es posible un estado de oxidación +8 en el tetróxido volátil PuO.
4. [34] Aunque se descompone fácilmente mediante un mecanismo de reducción similar al FeO
4, PuO
4Puede estabilizarse en soluciones alcalinas y cloroformo . [35] [34]
El plutonio metálico se produce haciendo reaccionar tetrafluoruro de plutonio con bario , calcio o litio a 1200 °C. [36] El plutonio metálico es atacado por ácidos , oxígeno y vapor, pero no por álcalis , y se disuelve fácilmente en ácidos clorhídrico , yodhídrico y perclórico concentrados . [37] El metal fundido debe mantenerse al vacío o en una atmósfera inerte para evitar la reacción con el aire. [15] A 135 °C, el metal se encenderá en el aire y explotará si se coloca en tetracloruro de carbono . [38]

El plutonio es un metal reactivo. En aire húmedo o argón húmedo , el metal se oxida rápidamente, produciendo una mezcla de óxidos e hidruros . [4] Si el metal se expone el tiempo suficiente a una cantidad limitada de vapor de agua, se forma una capa superficial en polvo de PuO 2 . [4] También se forma hidruro de plutonio , pero un exceso de vapor de agua forma sólo PuO 2 . [37]
El plutonio muestra velocidades de reacción enormes y reversibles con hidrógeno puro, formando hidruro de plutonio . [11] También reacciona fácilmente con el oxígeno, formando PuO y PuO 2 , así como óxidos intermedios; El óxido de plutonio ocupa un 40% más de volumen que el plutonio metálico. El metal reacciona con los halógenos , dando lugar a compuestos de fórmula general PuX 3 donde X puede ser F , Cl , Br o I y también se ve PuF 4 . Se observan los siguientes oxihaluros: PuOCl, PuOBr y PuOI. Reaccionará con el carbono para formar PuC, el nitrógeno para formar PuN y el silicio para formar PuSi 2 . [14] [38]
La química organometálica de los complejos de plutonio es típica de las especies de organoactínidos ; un ejemplo característico de compuesto de organoplutonio es el plutonoceno . [24] [39] Los métodos de química computacional indican un carácter covalente mejorado en el enlace plutonio-ligando. [11] [39]
Los polvos de plutonio, sus hidruros y ciertos óxidos como el Pu 2 O 3 son pirofóricos , lo que significa que pueden encenderse espontáneamente a temperatura ambiente y, por tanto, se manipulan en una atmósfera inerte y seca de nitrógeno o argón. El plutonio a granel sólo se enciende cuando se calienta a más de 400 °C. Pu 2 O 3 se calienta espontáneamente y se transforma en PuO 2 , que es estable en aire seco, pero reacciona con el vapor de agua cuando se calienta. [40]
Los crisoles utilizados para contener plutonio deben poder resistir sus propiedades fuertemente reductoras . Los metales refractarios como el tantalio y el tungsteno , junto con los óxidos, boruros , carburos , nitruros y siliciuros más estables , pueden tolerar esto. La fusión en un horno de arco eléctrico se puede utilizar para producir pequeños lingotes de metal sin necesidad de crisol. [15]
El cerio se utiliza como simulante químico del plutonio para el desarrollo de tecnologías de contención, extracción y otras tecnologías. [41]
El plutonio es un elemento en el que los electrones 5f son la frontera de transición entre deslocalizado y localizado; por lo que se considera uno de los elementos más complejos. [42] El comportamiento anómalo del plutonio se debe a su estructura electrónica. La diferencia de energía entre las subcapas 6d y 5f es muy baja. El tamaño de la capa 5f es suficiente para permitir que los electrones formen enlaces dentro de la red, en el límite mismo entre el comportamiento localizado y el de enlace. La proximidad de los niveles de energía conduce a múltiples configuraciones electrónicas de baja energía con niveles de energía casi iguales. Esto lleva a configuraciones competitivas 5f n 7s 2 y 5f n−1 6d 1 7s 2 , lo que provoca la complejidad de su comportamiento químico. La naturaleza altamente direccional de los orbitales 5f es responsable de los enlaces covalentes direccionales en moléculas y complejos de plutonio. [11]
El plutonio puede formar aleaciones y compuestos intermedios con la mayoría de los demás metales. Las excepciones incluyen litio, sodio , potasio , rubidio y cesio de los metales alcalinos ; y magnesio , calcio, estroncio y bario de los metales alcalinotérreos ; y europio e iterbio de los metales de tierras raras . [37] Las excepciones parciales incluyen los metales refractarios cromo , molibdeno , niobio , tantalio y tungsteno, que son solubles en plutonio líquido, pero insolubles o sólo ligeramente solubles en plutonio sólido. [37] El galio, el aluminio, el americio, el escandio y el cerio pueden estabilizar la fase δ del plutonio a temperatura ambiente. El silicio , el indio , el zinc y el circonio permiten la formación de un estado δ metaestable cuando se enfrían rápidamente. Grandes cantidades de hafnio , holmio y talio también permiten cierta retención de la fase δ a temperatura ambiente. El neptunio es el único elemento que puede estabilizar la fase α a temperaturas más altas. [11]
Las aleaciones de plutonio se pueden producir añadiendo un metal al plutonio fundido. Si el metal de aleación es suficientemente reductor, se puede añadir plutonio en forma de óxidos o haluros. Las aleaciones de plutonio-galio y plutonio-aluminio en fase δ se producen añadiendo fluoruro de plutonio (III) al galio o aluminio fundido, lo que tiene la ventaja de evitar el contacto directo con el metal plutonio altamente reactivo. [43]

En la naturaleza se pueden encontrar trazas de plutonio-238, plutonio-239, plutonio-240 y plutonio-244. Pequeñas trazas de plutonio-239, unas pocas partes por billón , y sus productos de desintegración se encuentran naturalmente en algunos minerales concentrados de uranio, [50] como el reactor de fisión nuclear natural de Oklo , Gabón . [51] La proporción de plutonio-239 a uranio en el depósito de uranio de la mina Cigar Lake varía de2,4 × 10 −12 a44 × 10-12 . _ [52] Estas trazas de 239 Pu se originan de la siguiente manera: en raras ocasiones, 238 U sufre fisión espontánea y, en el proceso, el núcleo emite uno o dos neutrones libres con algo de energía cinética. Cuando uno de estos neutrones golpea el núcleo de otro átomo de 238 U, es absorbido por el átomo, que se convierte en 239 U. Con una vida media relativamente corta, 239 U decae a 239 Np, que a su vez decae en 239 Pu. [53] [54] Finalmente, se han encontrado cantidades extremadamente pequeñas de plutonio-238, atribuidas a la extremadamente rara desintegración beta doble del uranio-238, en muestras de uranio natural. [55]
Debido a su vida media relativamente larga, de unos 80 millones de años, se sugirió que el plutonio-244 se produce de forma natural como un nucleido primordial , pero los primeros informes sobre su detección no pudieron confirmarse. [56] Según su probable abundancia inicial en el Sistema Solar, los experimentos actuales a partir de 2022 probablemente estén a un orden de magnitud de distancia de detectar 244 Pu primordial vivo. [57] Sin embargo, su larga vida media aseguró su circulación a través del sistema solar antes de su extinción , [58] y, de hecho, se ha encontrado evidencia de la fisión espontánea del 244 Pu extinto en meteoritos. [59] Se ha confirmado la antigua presencia de 244 Pu en el Sistema Solar temprano, ya que hoy se manifiesta como un exceso de sus hijas, ya sea 232 Th (de la vía de desintegración alfa) o isótopos de xenón (de su fisión espontánea ). Estos últimos son generalmente más útiles, porque las químicas del torio y el plutonio son bastante similares (ambos son predominantemente tetravalentes) y, por lo tanto, un exceso de torio no sería una prueba sólida de que una parte se formó como un descendiente del plutonio. [60] 244 Pu tiene la vida media más larga de todos los nucleidos transuránicos y se produce sólo en el proceso r en supernovas y estrellas de neutrones en colisión ; Cuando los núcleos son expulsados de estos eventos a gran velocidad para llegar a la Tierra, solo el 244 Pu entre los nucleidos transuránicos tiene una vida media lo suficientemente larga como para sobrevivir el viaje y, por lo tanto, se han encontrado pequeños rastros de 244 Pu interestelar vivo en el fondo marino profundo. Dado que el 240 Pu también se encuentra en la cadena de desintegración del 244 Pu, también debe estar presente en el equilibrio secular , aunque en cantidades aún más pequeñas. [61]
Habitualmente se encuentran minúsculas trazas de plutonio en el cuerpo humano debido a las 550 pruebas nucleares atmosféricas y submarinas que se han llevado a cabo, y a un pequeño número de accidentes nucleares importantes . [38] La mayoría de los ensayos nucleares atmosféricos y submarinos fueron detenidos por el Tratado de Prohibición Limitada de Ensayos Nucleares de 1963, que entre las potencias nucleares fue firmado y ratificado por los Estados Unidos, el Reino Unido y la Unión Soviética . Francia continuaría las pruebas nucleares atmosféricas hasta 1974 y China continuaría las pruebas nucleares atmosféricas hasta 1980. Todas las pruebas nucleares posteriores se llevaron a cabo bajo tierra. [62]
Enrico Fermi y un equipo de científicos de la Universidad de Roma informaron que habían descubierto el elemento 94 en 1934. [63] Fermi llamó al elemento hesperium y lo mencionó en su conferencia Nobel en 1938. [64] La muestra en realidad contenía productos de energía nuclear . fisión , principalmente bario y criptón . [65] La fisión nuclear, descubierta en Alemania en 1938 por Otto Hahn y Fritz Strassmann , era desconocida en aquel momento. [66]

El plutonio (específicamente, plutonio-238) fue producido, aislado y luego identificado químicamente por primera vez entre diciembre de 1940 y febrero de 1941 por Glenn T. Seaborg , Edwin McMillan , Emilio Segrè , Joseph W. Kennedy y Arthur Wahl mediante bombardeo de uranio con deuterón en el Ciclotrón de 60 pulgadas (150 cm) en el Laboratorio de Radiación de Berkeley de la Universidad de California, Berkeley . [67] [68] [69] El neptunio-238 fue creado directamente por el bombardeo pero se desintegró por emisión beta con una vida media de poco más de dos días, lo que indicó la formación del elemento 94. [38] El primer bombardeo tuvo lugar tuvo lugar el 14 de diciembre de 1940, y el nuevo elemento se identificó por primera vez mediante oxidación en la noche del 23 al 24 de febrero de 1941. [68]
El equipo preparó un artículo que documentaba el descubrimiento y lo envió a la revista Physical Review en marzo de 1941, [38] pero la publicación se retrasó hasta un año después del final de la Segunda Guerra Mundial debido a preocupaciones de seguridad. [70] En el Laboratorio Cavendish de Cambridge , Egon Bretscher y Norman Feather se dieron cuenta de que un reactor de neutrones lento alimentado con uranio teóricamente produciría cantidades sustanciales de plutonio-239 como subproducto. Calcularon que el elemento 94 sería fisible y tenía la ventaja adicional de ser químicamente diferente del uranio y podría separarse fácilmente de él. [25]
McMillan había nombrado recientemente al primer elemento transuránico neptunio en honor al planeta Neptuno , y sugirió que el elemento 94, siendo el siguiente elemento de la serie, llevara el nombre del que entonces se consideraba el siguiente planeta, Plutón . [8] [nota 2] Nicholas Kemmer, del equipo de Cambridge, propuso de forma independiente el mismo nombre, basándose en el mismo razonamiento que el equipo de Berkeley. [25] Seaborg originalmente consideró el nombre "plutonio", pero luego pensó que no sonaba tan bien como "plutonio". [72] Eligió las letras "Pu" a modo de broma, en referencia a la interjección "P U" para indicar un olor especialmente desagradable, que pasó sin previo aviso a la tabla periódica. [nota 3] Los nombres alternativos considerados por Seaborg y otros fueron "ultimium" o "extremium" debido a la creencia errónea de que habían encontrado el último elemento posible en la tabla periódica . [74]
En ese momento , Hahn y Strassmann, e independientemente Kurt Starke , también estaban trabajando en elementos transuránicos en Berlín. Es probable que Hahn y Strassmann fueran conscientes de que el plutonio-239 debería ser fisible. Sin embargo, no tenían una fuente de neutrones potente. El elemento 93 fue informado por Hahn y Strassmann, así como por Starke, en 1942. El grupo de Hahn no buscó el elemento 94, probablemente porque se sintieron desanimados por la falta de éxito de McMillan y Abelson en aislarlo cuando encontraron por primera vez el elemento 93. Sin embargo, Dado que el grupo de Hahn tenía acceso al ciclotrón más potente de París en ese momento, probablemente habrían podido detectar plutonio si lo hubieran intentado, aunque en pequeñas cantidades (unos pocos becquerelios ). [75]

Se descubrió que la química del plutonio se parecía al uranio después de unos meses de estudio inicial. [38] Las primeras investigaciones continuaron en el Laboratorio Metalúrgico secreto de la Universidad de Chicago . El 20 de agosto de 1942 se aisló y midió por primera vez una traza de este elemento. Se produjeron unos 50 microgramos de plutonio-239 combinado con uranio y productos de fisión y sólo se aisló aproximadamente 1 microgramo. [50] [76] Este procedimiento permitió a los químicos determinar el peso atómico del nuevo elemento. [77] [nota 4] El 2 de diciembre de 1942, en una cancha de raqueta debajo de la tribuna oeste del Stagg Field de la Universidad de Chicago, investigadores encabezados por Enrico Fermi lograron la primera reacción en cadena autosostenida en una pila de grafito y uranio conocida como CP-1 . Utilizando información teórica obtenida del funcionamiento del CP-1, DuPont construyó un reactor de producción experimental refrigerado por aire, conocido como X-10 , y una instalación piloto de separación química en Oak Ridge. La instalación de separación, utilizando métodos desarrollados por Glenn T. Seaborg y un equipo de investigadores del Met Lab, eliminó el plutonio del uranio irradiado en el reactor X-10. La información del CP-1 también fue útil para los científicos del Met Lab que diseñaban los reactores de producción de plutonio refrigerados por agua para Hanford. La construcción en el sitio comenzó a mediados de 1943. [78]
En noviembre de 1943 se redujo algo de trifluoruro de plutonio para crear la primera muestra de plutonio metálico: unos pocos microgramos de cuentas metálicas. [50] Se produjo suficiente plutonio para convertirlo en el primer elemento sintético visible a simple vista. [79]
También se estudiaron las propiedades nucleares del plutonio-239; Los investigadores descubrieron que cuando es golpeado por un neutrón se rompe (fisiones) liberando más neutrones y energía. Estos neutrones pueden chocar con otros átomos de plutonio-239 y así sucesivamente en una reacción en cadena exponencialmente rápida. Esto puede resultar en una explosión lo suficientemente grande como para destruir una ciudad si se concentra suficiente isótopo para formar una masa crítica . [38]
Durante las primeras etapas de la investigación, se utilizaron animales para estudiar los efectos de las sustancias radiactivas en la salud. Estos estudios comenzaron en 1944 en el Laboratorio de Radiación de la Universidad de California en Berkeley y fueron realizados por Joseph G. Hamilton. Hamilton buscaba responder preguntas sobre cómo variaría el plutonio en el cuerpo dependiendo del modo de exposición (ingesta oral, inhalación, absorción a través de la piel), las tasas de retención y cómo el plutonio se fijaría en los tejidos y se distribuiría entre los distintos órganos. Hamilton comenzó a administrar porciones de microgramos solubles de compuestos de plutonio-239 a ratas utilizando diferentes estados de valencia y diferentes métodos de introducción del plutonio (oral, intravenoso, etc.). Finalmente, el laboratorio de Chicago también llevó a cabo sus propios experimentos de inyección de plutonio utilizando diferentes animales como ratones, conejos, peces e incluso perros. Los resultados de los estudios de Berkeley y Chicago mostraron que el comportamiento fisiológico del plutonio difiere significativamente del del radio. El resultado más alarmante fue que hubo un depósito significativo de plutonio en el hígado y en la porción del hueso que se metaboliza activamente. Además, la tasa de eliminación del plutonio en los excrementos difería entre especies de animales hasta en un factor de cinco. Esta variación hacía extremadamente difícil estimar cuál sería la tasa para los seres humanos. [80]
Durante la Segunda Guerra Mundial, el gobierno de Estados Unidos estableció el Proyecto Manhattan , que tenía la tarea de desarrollar una bomba atómica. Los tres sitios principales de investigación y producción del proyecto fueron la instalación de producción de plutonio en lo que ahora es el Sitio Hanford , las instalaciones de enriquecimiento de uranio en Oak Ridge, Tennessee , y el laboratorio de investigación y diseño de armas, ahora conocido como Laboratorio Nacional de Los Álamos . [81]


El primer reactor de producción que produjo plutonio-239 fue el Reactor de Grafito X-10 . Entró en funcionamiento en 1943 y se construyó en una instalación en Oak Ridge que más tarde se convirtió en el Laboratorio Nacional de Oak Ridge . [38] [nota 5]
En enero de 1944, los trabajadores sentaron las bases del primer edificio de separación química, la Planta T ubicada en 200-West. Tanto la Planta T como su instalación hermana en 200-West, la Planta U, se completaron en octubre. (La Planta U se utilizó sólo para capacitación durante el Proyecto Manhattan). El edificio de separación en 200-East, Planta B, se completó en febrero de 1945. La segunda instalación planificada para 200-East fue cancelada. Apodados Queen Marys por los trabajadores que los construyeron, los edificios de separación eran impresionantes estructuras parecidas a cañones de 800 pies de largo, 65 pies de ancho y 80 pies de alto que contenían cuarenta piscinas de proceso. El interior tenía una cualidad inquietante cuando los operadores detrás de dos metros de protección de concreto manipulaban equipos de control remoto mirando a través de monitores de televisión y periscopios desde una galería superior. Incluso con enormes tapas de hormigón en las piscinas de proceso, las precauciones contra la exposición a la radiación eran necesarias e influyeron en todos los aspectos del diseño de la planta. [78]
El 5 de abril de 1944, Emilio Segrè en Los Álamos recibió la primera muestra de plutonio producido en un reactor de Oak Ridge. [83] En diez días, descubrió que el plutonio generado en reactores tenía una mayor concentración del isótopo plutonio-240 que el plutonio producido en ciclotrón. El plutonio-240 tiene una alta tasa de fisión espontánea, lo que eleva el nivel general de neutrones de fondo de la muestra de plutonio. [84] Como resultado, el arma de plutonio tipo pistola original , con el nombre en código " Thin Man ", tuvo que ser abandonada; el mayor número de neutrones espontáneos significaba que la predetonación nuclear ( fallo ) era probable. [85]
Todo el esfuerzo de diseño de armas de plutonio en Los Álamos pronto se cambió al dispositivo de implosión más complicado, cuyo nombre en código era " Fat Man ". En un arma de implosión, el plutonio se comprime a una alta densidad con lentes explosivas , una tarea técnicamente más desalentadora que el diseño simple de un arma, pero necesaria para utilizar el plutonio con fines armamentísticos. El uranio enriquecido , por el contrario, puede utilizarse con cualquiera de los métodos. [85]
La construcción del Reactor B Hanford , el primer reactor nuclear de tamaño industrial destinado a la producción de material, se completó en marzo de 1945. El Reactor B produjo el material fisionable para las armas de plutonio utilizadas durante la Segunda Guerra Mundial. [nota 6] B, D y F fueron los reactores iniciales construidos en Hanford, y posteriormente se construyeron seis reactores productores de plutonio adicionales en el sitio. [88]
A finales de enero de 1945, el plutonio altamente purificado se volvió a concentrar en el edificio de aislamiento químico terminado, donde se eliminaron con éxito las impurezas restantes. Los Álamos recibió su primer plutonio de Hanford el 2 de febrero. Si bien aún no estaba claro que se pudiera producir suficiente plutonio para su uso en bombas al final de la guerra, Hanford ya estaba en funcionamiento a principios de 1945. Sólo habían pasado dos años desde que el coronel Franklin Matthias instaló por primera vez su cuartel general temporal a orillas del río Columbia. [78]
Según Kate Brown , las plantas de producción de plutonio de Hanford y Mayak en Rusia, durante un período de cuatro décadas, "liberaron más de 200 millones de curios de isótopos radiactivos al medio ambiente circundante, el doble de la cantidad expulsada en el desastre de Chernobyl en cada caso ". ". [89] La mayor parte de esta contaminación radiactiva a lo largo de los años fue parte de operaciones normales, pero ocurrieron accidentes imprevistos y la administración de la planta mantuvo esto en secreto, ya que la contaminación continuó sin disminuir. [89]
En 2004, se descubrió una caja fuerte durante las excavaciones de una trinchera funeraria en el sitio nuclear de Hanford . Dentro de la caja fuerte había varios artículos, incluida una gran botella de vidrio que contenía una suspensión blanquecina que posteriormente fue identificada como la muestra más antigua de plutonio apto para armas que se conoce. El análisis de isótopos realizado por el Laboratorio Nacional del Noroeste del Pacífico indicó que el plutonio en la botella fue fabricado en el reactor de grafito X-10 en Oak Ridge durante 1944. [90] [91] [92]
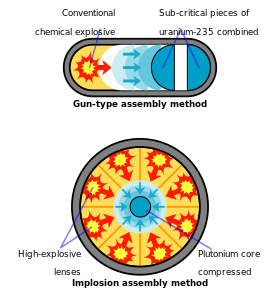
La primera prueba de una bomba atómica, con el nombre en código "Trinity" y detonada el 16 de julio de 1945, cerca de Alamogordo, Nuevo México , utilizó plutonio como material fisionable. [50] El diseño de implosión del " dispositivo ", como se llamó el dispositivo Trinity, utilizó lentes explosivas convencionales para comprimir una esfera de plutonio en una masa supercrítica, que fue simultáneamente bañada con neutrones del "Erizo" , un iniciador. hecho de polonio y berilio ( fuente de neutrones : reacción (α, n) ). [38] Juntos, estos aseguraron una reacción en cadena desbocada y una explosión. El arma total pesaba más de 4 toneladas , aunque sólo utilizaba 6,2 kg de plutonio en su núcleo. [93] Aproximadamente el 20% del plutonio utilizado en el arma Trinity sufrió fisión, lo que resultó en una explosión con una energía equivalente a aproximadamente 20.000 toneladas de TNT. [94] [nota 7]
Se utilizó un diseño idéntico en la bomba atómica "Fat Man" lanzada sobre Nagasaki , Japón , el 9 de agosto de 1945, matando a entre 35.000 y 40.000 personas y destruyendo entre el 68% y el 80% de la producción bélica en Nagasaki. [96] Sólo después del anuncio de las primeras bombas atómicas se dio a conocer al público la existencia y el nombre del plutonio mediante el Informe Smyth del Proyecto Manhattan . [97]
Tanto la Unión Soviética como los Estados Unidos acumularon grandes reservas de plutonio apto para armas durante la Guerra Fría . Los reactores estadounidenses en Hanford y Savannah River Site en Carolina del Sur produjeron 103 toneladas, [98] y se estima que en la URSS se produjeron 170 toneladas de plutonio de grado militar. [99] [nota 8] Cada año todavía se producen alrededor de 20 toneladas del elemento como subproducto de la industria de la energía nuclear . [14] Es posible que haya hasta 1.000 toneladas de plutonio almacenadas, de las cuales más de 200 toneladas se encuentran dentro o extraídas de armas nucleares. [38] El SIPRI estimó que las reservas mundiales de plutonio en 2007 eran de unas 500 toneladas, divididas en partes iguales entre reservas de armas y civiles. [101]
La contaminación radiactiva en la planta de Rocky Flats se debió principalmente a dos grandes incendios de plutonio en 1957 y 1969. Se liberaron concentraciones mucho más bajas de isótopos radiactivos durante la vida operativa de la planta de 1952 a 1992. Los vientos predominantes de la planta transportaron contaminación aérea hacia el sur y el este. , en áreas pobladas al noroeste de Denver. La contaminación del área de Denver por plutonio procedente de los incendios y otras fuentes no se informó públicamente hasta la década de 1970. Según un estudio de 1972 del que es coautor Edward Martell , "en las áreas más densamente pobladas de Denver, el nivel de contaminación de Pu en los suelos superficiales es varias veces mayor que el de la lluvia", y la contaminación de plutonio "justo al este de la planta de Rocky Flats alcanza hasta cientos de veces mayor que el de los ensayos nucleares". [102] Como señaló Carl Johnson en Ambio , "La exposición de una gran población en el área de Denver al plutonio y otros radionucleidos en las columnas de escape de la planta se remonta a 1953". [103] La producción de armas en la planta de Rocky Flats se detuvo después de una redada combinada del FBI y la EPA en 1989 y años de protestas. Desde entonces, la planta ha sido cerrada y sus edificios han sido demolidos y retirados por completo del lugar. [104]
En Estados Unidos, parte del plutonio extraído de armas nucleares desmanteladas se funde para formar trozos de vidrio de óxido de plutonio que pesan dos toneladas. [38] El vidrio está hecho de borosilicatos mezclados con cadmio y gadolinio . [nota 9] Se planea revestir estos troncos en acero inoxidable y almacenarlos hasta 4 km (2 millas) bajo tierra en pozos que se rellenarán con concreto . [38] Estados Unidos planeaba almacenar plutonio de esta manera en el depósito de desechos nucleares de Yucca Mountain , que está a unas 100 millas (160 km) al noreste de Las Vegas, Nevada . [105]
El 5 de marzo de 2009, el secretario de Energía, Steven Chu, dijo en una audiencia en el Senado que "el sitio de Yucca Mountain ya no se consideraba una opción para almacenar residuos de reactores". [106] A partir de 1999, los desechos nucleares generados por el ejército están siendo enterrados en la Planta Piloto de Aislamiento de Desechos en Nuevo México.
En un memorando presidencial fechado el 29 de enero de 2010, el presidente Obama estableció la Comisión del Listón Azul sobre el futuro nuclear de Estados Unidos . [107] En su informe final, la Comisión formuló recomendaciones para desarrollar una estrategia integral a seguir, que incluye: [108]
Durante y después del final de la Segunda Guerra Mundial, los científicos que trabajaban en el Proyecto Manhattan y otros proyectos de investigación de armas nucleares realizaron estudios de los efectos del plutonio en animales de laboratorio y sujetos humanos. [109] Los estudios en animales encontraron que unos pocos miligramos de plutonio por kilogramo de tejido es una dosis letal. [110]
En el caso de seres humanos, esto implicó inyectar soluciones que contenían (típicamente) cinco microgramos de plutonio en pacientes hospitalizados que se pensaba que tenían enfermedades terminales o que tenían una esperanza de vida de menos de diez años debido a la edad o a una enfermedad crónica. [109] Esto se redujo a un microgramo en julio de 1945 después de que estudios en animales descubrieran que la forma en que el plutonio se distribuía en los huesos era más peligrosa que el radio . [110] La mayoría de los sujetos, dice Eileen Welsome , eran pobres, impotentes y enfermos. [111]
De 1945 a 1947, se inyectó plutonio a dieciocho sujetos humanos sin consentimiento informado . Las pruebas se utilizaron para crear herramientas de diagnóstico para determinar la absorción de plutonio en el cuerpo con el fin de desarrollar estándares de seguridad para trabajar con plutonio. [109] Ebb Cade participó involuntariamente en experimentos médicos que implicaron la inyección de 4,7 microgramos de plutonio el 10 de abril de 1945 en Oak Ridge, Tennessee . [112] [113] Este experimento estuvo bajo la supervisión de Harold Hodge . [114] Otros experimentos dirigidos por la Comisión de Energía Atómica de los Estados Unidos y el Proyecto Manhattan continuaron hasta la década de 1970. Plutonium Files narra las vidas de los sujetos del programa secreto nombrando a cada persona involucrada y discutiendo la investigación ética y médica realizada en secreto por los científicos y médicos. El episodio se considera ahora una grave violación de la ética médica y del juramento hipocrático . [115]
El gobierno ocultó la mayoría de estos percances por radiación hasta 1993, cuando el presidente Bill Clinton ordenó un cambio de política y las agencias federales pusieron a disposición los registros pertinentes. La investigación resultante fue realizada por el Comité Asesor sobre Experimentos de Radiación Humana del presidente y descubrió gran parte del material sobre la investigación del plutonio en humanos. El comité emitió un controvertido informe de 1995 que decía que "se cometieron errores", pero no condenaba a quienes los perpetraban. [111]

El isótopo plutonio-239 es un componente fisionable clave en las armas nucleares, debido a su facilidad de fisión y disponibilidad. Encerrar el pozo de plutonio de la bomba con un pisón (una capa opcional de material denso) disminuye la cantidad de plutonio necesaria para alcanzar la masa crítica al reflejar los neutrones que se escapan hacia el núcleo de plutonio. Esto reduce la cantidad de plutonio necesaria para alcanzar la criticidad de 16 kg a 10 kg, que es una esfera con un diámetro de unos 10 centímetros (4 pulgadas). [116] Esta masa crítica es aproximadamente un tercio de la del uranio-235. [8]
Las bombas de plutonio Fat Man utilizaron compresión explosiva de plutonio para obtener densidades significativamente más altas de lo normal, combinadas con una fuente central de neutrones para iniciar la reacción y aumentar la eficiencia. Así, sólo se necesitaron 6,2 kg de plutonio para una potencia explosiva equivalente a 20 kilotones de TNT. [94] [117] Hipotéticamente, tan solo 4 kg de plutonio, y tal vez incluso menos, podrían usarse para fabricar una sola bomba atómica utilizando diseños de ensamblaje muy sofisticados. [117]
El combustible nuclear gastado de los reactores normales de agua ligera contiene plutonio, pero es una mezcla de plutonio-242 , 240, 239 y 238. La mezcla no está suficientemente enriquecida para armas nucleares eficientes, pero puede usarse una vez como combustible MOX . [118] La captura accidental de neutrones hace que la cantidad de plutonio-242 y 240 crezca cada vez que el plutonio se irradia en un reactor con neutrones "térmicos" de baja velocidad, de modo que después del segundo ciclo, el plutonio sólo puede ser consumido por medios rápidos . reactores de neutrones . Si no se dispone de reactores de neutrones rápidos (el caso normal), el exceso de plutonio suele desecharse y constituye uno de los componentes más longevos de los residuos nucleares. El deseo de consumir este plutonio y otros combustibles transuránicos y reducir la radiotoxicidad de los desechos es la razón habitual que dan los ingenieros nucleares para fabricar reactores de neutrones rápidos. [119]
El proceso químico más común, PUREX ( P lutonio – UR anio EX tracción), reprocesa el combustible nuclear gastado para extraer plutonio y uranio, que pueden usarse para formar un combustible de óxido mixto (MOX) para su reutilización en reactores nucleares. Se puede agregar plutonio apto para armas a la mezcla de combustible. El combustible MOX se utiliza en reactores de agua ligera y consta de 60 kg de plutonio por tonelada de combustible; después de cuatro años, tres cuartas partes del plutonio se queman (se convierten en otros elementos). [38] Los reactores reproductores están diseñados específicamente para crear más material fisionable del que consumen. [120]
El combustible MOX se utiliza desde la década de 1980 y se utiliza ampliamente en Europa. [118] En septiembre de 2000, los Estados Unidos y la Federación de Rusia firmaron un Acuerdo de Gestión y Eliminación de Plutonio por el cual cada uno de ellos acordó eliminar 34 toneladas de plutonio apto para armas. [121] El Departamento de Energía de Estados Unidos planea deshacerse de 34 toneladas de plutonio apto para armas en Estados Unidos antes de finales de 2019 mediante la conversión del plutonio en un combustible MOX para su uso en reactores de energía nuclear comerciales. [121]
El combustible MOX mejora el quemado total. Una barra de combustible se reprocesa después de tres años de uso para eliminar los productos de desecho, que para entonces representan el 3% del peso total de las barras. [38] Cualquier isótopo de uranio o plutonio producido durante esos tres años se deja y la varilla vuelve a producirse. [nota 10] La presencia de hasta un 1% de galio por masa en una aleación de plutonio apta para armas tiene el potencial de interferir con el funcionamiento a largo plazo de un reactor de agua ligera. [122]
El plutonio recuperado del combustible gastado de los reactores plantea poco riesgo de proliferación debido a la excesiva contaminación con plutonio-240 y plutonio-242 no fisibles. La separación de los isótopos no es factible. Generalmente se requiere un reactor dedicado que funcione con un quemado muy bajo (de ahí una exposición mínima del plutonio-239 recién formado a neutrones adicionales, lo que hace que se transforme en isótopos de plutonio más pesados) para producir material adecuado para su uso en armas nucleares eficientes . Si bien se define que el plutonio "apto para armas" contiene al menos un 92% de plutonio-239 (del plutonio total), los Estados Unidos han logrado detonar un dispositivo de menos de 20 kt utilizando plutonio que se cree que contiene solo aproximadamente un 85% de plutonio-239. el llamado plutonio "de calidad combustible". [123] El plutonio de "grado de reactor" producido por un ciclo regular de quemado de LWR normalmente contiene menos del 60% de Pu-239, con hasta un 30% de Pu-240/Pu-242 parásito y entre un 10% y un 15% de Pu-241 fisible. . [123] Se desconoce si un dispositivo que utiliza plutonio obtenido de desechos nucleares civiles reprocesados puede ser detonado; sin embargo, dicho dispositivo podría hipotéticamente esfumarse y esparcir materiales radiactivos en una gran área urbana. La OIEA clasifica de manera conservadora el plutonio de todos los vectores isotópicos como material de "uso directo", es decir, "material nuclear que puede utilizarse para la fabricación de componentes de explosivos nucleares sin transmutación ni enriquecimiento adicional". [123]


El isótopo plutonio-238 tiene una vida media de 87,74 años. [124] Emite una gran cantidad de energía térmica con bajos niveles tanto de rayos gamma / fotones como de rayos/partículas de neutrones espontáneos. [125] Al ser un emisor alfa, combina radiación de alta energía con baja penetración y, por lo tanto, requiere un blindaje mínimo. Se puede utilizar una hoja de papel como protección contra las partículas alfa emitidas por el plutonio-238. Un kilogramo de isótopo puede generar unos 570 vatios de calor. [8] [125]
Estas características lo hacen muy adecuado para la generación de energía eléctrica para dispositivos que deben funcionar sin mantenimiento directo durante escalas de tiempo cercanas a la vida humana. Por lo tanto, se utiliza en generadores termoeléctricos de radioisótopos y unidades calentadoras de radioisótopos como los de las sondas espaciales Cassini , [126] Voyager , Galileo y New Horizons [127] , y los rovers de Marte Curiosity [128] y Perseverance ( Mars 2020 ) .
Las naves espaciales gemelas Voyager se lanzaron en 1977 y cada una contenía una fuente de energía de plutonio de 500 vatios. Más de 30 años después, cada fuente sigue produciendo unos 300 vatios, lo que permite un funcionamiento limitado de cada nave espacial. [129] Una versión anterior de la misma tecnología impulsó cinco paquetes de experimentos de superficie lunar Apollo , comenzando con el Apolo 12 en 1969. [38]
El plutonio-238 también se ha utilizado con éxito para alimentar marcapasos cardíacos artificiales , para reducir el riesgo de cirugía repetida. [130] [131] Ha sido reemplazado en gran medida por células primarias basadas en litio , pero en 2003 [update]había entre 50 y 100 marcapasos impulsados por plutonio todavía implantados y funcionando en pacientes vivos en los Estados Unidos. [132] A finales de 2007, se informó que el número de marcapasos propulsados por plutonio se había reducido a sólo nueve. [133] El plutonio-238 se estudió como una forma de proporcionar calor suplementario al buceo . [134] El plutonio-238 mezclado con berilio se utiliza para generar neutrones con fines de investigación. [38]
Hay dos aspectos de los efectos nocivos del plutonio: la radiactividad y los efectos del veneno de metales pesados . Los isótopos y compuestos del plutonio son radiactivos y se acumulan en la médula ósea . La contaminación por óxido de plutonio ha sido el resultado de desastres nucleares e incidentes radiactivos , incluidos accidentes nucleares militares en los que se han quemado armas nucleares. [135] Los estudios de los efectos de estas emisiones más pequeñas, así como de las enfermedades y muertes por envenenamiento por radiación generalizadas tras los bombardeos atómicos de Hiroshima y Nagasaki , han proporcionado información considerable sobre los peligros, los síntomas y el pronóstico del envenenamiento por radiación , que en el El caso de los supervivientes japoneses no tuvo gran relación con la exposición directa al plutonio. [136]
Durante la desintegración del plutonio se liberan tres tipos de radiaciones ionizantes : alfa, beta y gamma. La exposición aguda o a largo plazo conlleva un peligro de consecuencias graves para la salud, incluidas enfermedades por radiación , daños genéticos , cáncer y muerte. El peligro aumenta con la cantidad de exposición. [38] La radiación alfa puede viajar sólo una distancia corta y no puede atravesar la capa exterior muerta de la piel humana. La radiación beta puede penetrar la piel humana, pero no puede atravesar todo el cuerpo. La radiación gamma puede atravesar todo el cuerpo. [137] Aunque la radiación alfa no puede penetrar la piel, el plutonio ingerido o inhalado irradia los órganos internos. [38] Se ha descubierto que las partículas alfa generadas por el plutonio inhalado causan cáncer de pulmón en una cohorte de trabajadores nucleares europeos. [138] El esqueleto , donde se acumula el plutonio, y el hígado , donde se acumula y se concentra, están en riesgo. [37] El plutonio no se absorbe eficientemente en el cuerpo cuando se ingiere; Sólo el 0,04% del óxido de plutonio se absorbe después de la ingestión. [38] El plutonio absorbido por el cuerpo se excreta muy lentamente, con una vida media biológica de 200 años. [139] El plutonio pasa lentamente a través de las membranas celulares y los límites intestinales, por lo que la absorción por ingestión y la incorporación a la estructura ósea se produce muy lentamente. [140] [141] Donald Mastick tragó accidentalmente una pequeña cantidad de cloruro de plutonio (III) , que fue detectable durante los siguientes treinta años de su vida, pero no pareció sufrir efectos nocivos. [142]
El plutonio es más peligroso cuando se inhala que cuando se ingiere. El riesgo de cáncer de pulmón aumenta una vez que la dosis total de radiación equivalente del plutonio inhalado supera los 400 mSv . [143] El Departamento de Energía de EE.UU. estima que el riesgo de cáncer a lo largo de la vida por la inhalación de 5.000 partículas de plutonio, cada una de aproximadamente 3 µm de ancho, es un 1% superior al promedio estadounidense. [144] La ingestión o inhalación de grandes cantidades puede causar envenenamiento agudo por radiación y posiblemente la muerte. Sin embargo, no se sabe que ningún ser humano haya muerto por inhalar o ingerir plutonio, y muchas personas tienen cantidades mensurables de plutonio en sus cuerpos. [123]
La teoría de las " partículas calientes ", según la cual una partícula de polvo de plutonio irradia una zona localizada de tejido pulmonar, no está respaldada por la investigación convencional: tales partículas son más móviles de lo que se pensaba originalmente y la toxicidad no aumenta de manera mensurable debido a la forma de las partículas. [140] Cuando se inhala, el plutonio puede pasar al torrente sanguíneo. Una vez en el torrente sanguíneo, el plutonio se mueve por todo el cuerpo y llega a los huesos, el hígado u otros órganos del cuerpo. El plutonio que llega a los órganos del cuerpo generalmente permanece en el cuerpo durante décadas y continúa exponiendo el tejido circundante a la radiación y, por lo tanto, puede causar cáncer. [145]
Una cita comúnmente citada de Ralph Nader afirma que una libra de polvo de plutonio esparcida en la atmósfera sería suficiente para matar a 8 mil millones de personas. [146] Esto fue cuestionado por Bernard Cohen , un oponente del modelo lineal sin umbral generalmente aceptado de toxicidad por radiación. Cohen estimó que una libra de plutonio podría matar no más de 2 millones de personas por inhalación, de modo que la toxicidad del plutonio es aproximadamente equivalente a la del gas nervioso . [147]
Varias poblaciones de personas que han estado expuestas al polvo de plutonio (por ejemplo, personas que viven a favor del viento en los sitios de pruebas de Nevada, sobrevivientes de Nagasaki, trabajadores de instalaciones nucleares y pacientes "enfermos terminales" a quienes se les inyectó Pu en 1945-46 para estudiar el metabolismo del Pu) han sido expuestas. seguido y analizado cuidadosamente. Cohen encontró que estos estudios eran inconsistentes con las altas estimaciones de la toxicidad del plutonio, citando casos como el de Albert Stevens , que sobrevivió hasta la vejez después de haber sido inyectado con plutonio. [140] "Hubo alrededor de 25 trabajadores del Laboratorio Nacional de Los Álamos que inhalaron una cantidad considerable de polvo de plutonio durante la década de 1940; según la teoría de las partículas calientes, cada uno de ellos tiene un 99,5% de posibilidades de estar muerto por cáncer de pulmón a estas alturas. pero no ha habido ni un solo cáncer de pulmón entre ellos." [147] [148]
Investigar la toxicidad del plutonio en los seres humanos es tan importante como observar los efectos en la fauna de los sistemas marinos. Se sabe que el plutonio ingresa al medio marino mediante el vertido de desechos o fugas accidentales de plantas nucleares. Aunque las mayores concentraciones de plutonio en los ambientes marinos se encuentran en los sedimentos, el complejo ciclo biogeoquímico del plutonio hace que también se encuentre en todos los demás compartimentos. [149] Por ejemplo, varias especies de zooplancton que ayudan en el ciclo de nutrientes consumirán el elemento a diario. La excreción completa del plutonio ingerido por el zooplancton hace que su defecación sea un mecanismo extremadamente importante en la eliminación del plutonio de las aguas superficiales. [150] Sin embargo, el zooplancton que sucumbe a la depredación de organismos más grandes puede convertirse en un vehículo de transmisión de plutonio a los peces.
Además del consumo, el pescado también puede estar expuesto al plutonio por su distribución geográfica en todo el mundo. Un estudio investigó los efectos de los elementos transuránicos ( plutonio-238 , plutonio-239 , plutonio-240 ) en varios peces que viven en la zona de exclusión de Chernobyl (ZEC). Los resultados mostraron que una proporción de hembras de perca en la ZEC presentaba un fallo o un retraso en la maduración de las gónadas. [151] Estudios similares encontraron grandes acumulaciones de plutonio en los órganos respiratorios y digestivos del bacalao, la platija y el arenque. [149]
La toxicidad del plutonio es igualmente perjudicial para las larvas de peces en las zonas de desechos nucleares. Los huevos no desarrollados tienen un mayor riesgo que los peces adultos desarrollados expuestos al elemento en estas áreas de desechos. El Laboratorio Nacional de Oak Ridge demostró que los embriones de carpas y pececillos criados en soluciones que contenían isótopos de plutonio no eclosionaban; Los huevos que eclosionaron mostraron anomalías significativas en comparación con los embriones desarrollados de control. [152] Reveló que se ha descubierto que concentraciones más altas de plutonio causan problemas en la fauna marina expuesta al elemento.

Hay que tener cuidado para evitar la acumulación de cantidades de plutonio que se acerquen a la masa crítica, sobre todo porque la masa crítica del plutonio es sólo un tercio de la del uranio-235. [8] Una masa crítica de plutonio emite cantidades letales de neutrones y rayos gamma . [153] Es más probable que el plutonio en solución forme una masa crítica que en forma sólida debido a la moderación por el hidrógeno en el agua. [ dudoso ] [14]
En el pasado se han producido accidentes de criticidad , algunos de ellos con consecuencias letales. La manipulación descuidada de ladrillos de carburo de tungsteno alrededor de una esfera de plutonio de 6,2 kg resultó en una dosis fatal de radiación en Los Álamos el 21 de agosto de 1945, cuando el científico Harry Daghlian recibió una dosis estimada en 5,1 sievert (510 rems ) y murió 25 días después. [154] [155] Nueve meses después, otro científico de Los Álamos, Louis Slotin , murió a causa de un accidente similar que involucró un reflector de berilio y el mismo núcleo de plutonio (el llamado " núcleo demoníaco ") que anteriormente se había cobrado la vida de Daghlian. . [156]
En diciembre de 1958, durante un proceso de purificación de plutonio en Los Álamos, se formó una masa crítica en un recipiente mezclador, lo que provocó la muerte de un operador químico llamado Cecil Kelley . Otros accidentes nucleares han ocurrido en la Unión Soviética, Japón, Estados Unidos y muchos otros países. [157]
El plutonio metálico presenta peligro de incendio, especialmente si el material está finamente dividido. En un ambiente húmedo, el plutonio forma hidruros en su superficie, que son pirofóricos y pueden encenderse en el aire a temperatura ambiente. El plutonio se expande hasta un 70% en volumen a medida que se oxida y, por tanto, puede romper su contenedor. [40] La radioactividad del material en llamas es un peligro adicional. La arena de óxido de magnesio es probablemente el material más eficaz para extinguir un incendio de plutonio. Enfría el material en llamas, actúa como disipador de calor y también bloquea el oxígeno. Se necesitan precauciones especiales para almacenar o manipular plutonio en cualquier forma; generalmente se requiere una atmósfera seca de gas inerte . [40] [nota 11]
El transporte habitual de plutonio se realiza a través del óxido de plutonio, más estable, en un paquete sellado. Un transporte típico consiste en un camión que transporta un contenedor protegido que contiene varios paquetes con un peso total que varía de 80 a 200 kg de óxido de plutonio. Un envío marítimo puede constar de varios contenedores, cada uno de los cuales contiene un paquete sellado. [159] La Comisión Reguladora Nuclear de los Estados Unidos dicta que debe ser sólido en lugar de polvo si el contenido supera los 0,74 TBq (20 curies ) de actividad radiactiva. [160] En 2016, los barcos Pacific Egret [161] y Pacific Heron de Pacific Nuclear Transport Ltd. transportaron 331 kg (730 lbs) de plutonio a una instalación del gobierno de los Estados Unidos en Savannah River , Carolina del Sur . [162] [163]
Las regulaciones de transporte aéreo del gobierno de los Estados Unidos permiten el transporte de plutonio por vía aérea, sujeto a restricciones sobre otros materiales peligrosos transportados en el mismo vuelo, requisitos de embalaje y estiba en la parte trasera de la aeronave. [164]
En 2012, los medios de comunicación revelaron que se había sacado plutonio de Noruega en aerolíneas comerciales de pasajeros (aproximadamente cada dos años), incluida una vez en 2011. [165] Las regulaciones permiten que un avión transporte 15 gramos de material fisionable. [165] Este transporte de plutonio se realiza sin problemas, según un asesor senior ( seniorrådgiver ) de Statens strålevern . [165]
Si bien el dióxido de plutonio normalmente es de color verde oliva, las muestras pueden ser de varios colores.
Generalmente se cree que el color es función de la pureza química, la estequiometría, el tamaño de las partículas y el método de preparación, aunque el color resultante de un método de preparación determinado no siempre es reproducible.