El glaucoma es un grupo de enfermedades oculares que provocan daños en el nervio óptico , que transmite información visual desde el ojo al cerebro. El glaucoma puede causar pérdida de la visión si no se trata. Se le ha llamado el "ladrón silencioso de la vista" porque la pérdida de la visión suele ocurrir lentamente durante un largo período de tiempo. [5] Un factor de riesgo importante para el glaucoma es el aumento de la presión dentro del ojo, conocida como presión intraocular (PIO) . [1] Se asocia con la vejez, antecedentes familiares de glaucoma y ciertas afecciones médicas o medicamentos. [6] La palabra glaucoma proviene de la palabra griega antigua γλαυκóς ( glaukós ), que significa "brillante, azul verdoso, gris".
Existen diferentes tipos de glaucoma, pero los más comunes se denominan glaucoma de ángulo abierto y glaucoma de ángulo cerrado . [7] Dentro del ojo, un líquido llamado humor acuoso ayuda a mantener la forma y proporciona nutrientes. El humor acuoso normalmente drena a través de la red trabecular . En el glaucoma de ángulo abierto, el drenaje se impide, lo que hace que el líquido se acumule y aumente la presión dentro del ojo. Esta presión elevada puede dañar el nervio óptico. En el glaucoma de ángulo cerrado, el drenaje del ojo se bloquea repentinamente, lo que provoca un rápido aumento de la presión intraocular. Esto puede provocar dolor ocular intenso , visión borrosa y náuseas . El glaucoma de ángulo cerrado es una emergencia que requiere atención inmediata. [1]
Si se trata a tiempo, es posible retardar o detener la progresión del glaucoma. Los exámenes oculares periódicos, especialmente si la persona tiene más de 40 años o tiene antecedentes familiares de glaucoma, son fundamentales para una detección temprana. [8] El tratamiento generalmente incluye la prescripción de gotas para los ojos, medicamentos , tratamiento con láser o cirugía. [1] [9] El objetivo de estos tratamientos es disminuir la presión ocular. [2]
Alrededor de 80 millones de personas en todo el mundo padecen glaucoma y el 50% desconoce que está afectado. [10] Es la principal causa de ceguera en afroamericanos , hispanoamericanos , [11] [12] y asiáticos. [13] Ocurre con mayor frecuencia entre personas mayores, [1] y el glaucoma de ángulo cerrado es más común en mujeres. [2] A nivel mundial, el glaucoma es la segunda causa de ceguera después de las cataratas , y es la principal causa de ceguera irreversible en todo el mundo. [2] [14] [15]

El glaucoma de ángulo abierto generalmente se presenta sin síntomas al principio del curso de la enfermedad. [14] Sin embargo, puede progresar gradualmente hasta implicar dificultades con la visión. [14] Por lo general, implica déficits en la visión periférica seguidos de pérdida de la visión central a medida que avanza la enfermedad, pero con menos frecuencia puede presentarse como pérdida de la visión central o áreas irregulares de pérdida de la visión. [14] En un examen ocular, se observan cambios en el nervio óptico que indican daño en la cabeza del nervio óptico (aumento de la relación copa-disco en el examen fundoscópico ). [14]
El glaucoma agudo de ángulo cerrado, una emergencia médica debido al riesgo de pérdida permanente inminente de la visión, se caracteriza por dolor ocular repentino, visión de halos alrededor de las luces, ojos rojos , presión intraocular muy alta , náuseas y vómitos, y disminución repentina de la visión. [14] El glaucoma agudo de ángulo cerrado puede presentarse además con edema corneal, vasos conjuntivales ingurgitados y una pupila fija y dilatada en el examen. [dieciséis]
En el caso del glaucoma, pueden aparecer manchas opacas en el cristalino, conocidas como glaukomflecken. [17] La palabra es alemana y significa "motas de glaucoma".
El glaucoma puede afectar a cualquier persona; Sin embargo, hay algunas personas con mayor susceptibilidad a desarrollar glaucoma debido a algunos factores de riesgo que incluyen: [18]
La hipertensión ocular (aumento de la presión dentro del ojo) es el factor de riesgo más importante para el glaucoma, pero sólo alrededor del 50% de las personas con glaucoma primario de ángulo abierto en realidad tienen una presión ocular elevada. [19] La hipertensión ocular (una presión intraocular por encima del umbral tradicional de 21 mmHg (28 hPa) o incluso por encima de 24 mmHg (32 hPa)) no es necesariamente una condición patológica, pero aumenta el riesgo de desarrollar glaucoma. Un estudio encontró una tasa de conversión del 18% en cinco años, lo que significa que menos de una de cada cinco personas con presión intraocular elevada desarrollará una pérdida glaucomatosa del campo visual durante ese período de tiempo. [20] Es un tema de debate si todas las personas con una presión intraocular elevada deben recibir terapia para el glaucoma; Actualmente, la mayoría de los oftalmólogos favorecen el tratamiento de aquellos con factores de riesgo adicionales. [21]
Los factores de riesgo del glaucoma incluyen edad avanzada, presión intraocular alta, antecedentes familiares de glaucoma y uso de medicamentos esteroides. [1] Para la presión ocular, a menudo se utiliza un valor de 28 hPa (21 mmHg) por encima de la presión atmosférica de 1.010 hPa (760 mmHg), y presiones más altas conllevan un mayor riesgo. [2] [22] Sin embargo, algunos pueden tener presión ocular alta durante años y nunca desarrollar daños. [2] Por el contrario, el daño al nervio óptico puede ocurrir con presión normal, lo que se conoce como glaucoma de tensión normal. [23] Se cree que el mecanismo del glaucoma de ángulo abierto es la salida lenta del humor acuoso a través de la red trabecular, mientras que en el glaucoma de ángulo cerrado el iris bloquea la red trabecular. [2] El diagnóstico se logra mediante la realización de un examen del ojo con dilatación de las pupilas . [1] A menudo, el nervio óptico muestra una cantidad anormal de ventosas . [2]
Los antecedentes familiares positivos son un factor de riesgo de glaucoma. El riesgo relativo de tener glaucoma primario de ángulo abierto aumenta entre dos y cuatro veces en personas que tienen un hermano con glaucoma. [24] El glaucoma, en particular el glaucoma primario de ángulo abierto, se asocia con mutaciones en varios genes , incluidos MYOC , ASB10, WDR36 , NTF4 , TBK1 , [25] y RPGRIP1 . [26] Muchos de estos genes están involucrados en procesos celulares críticos que están implicados en el desarrollo y la progresión del glaucoma, incluida la regulación de la presión intraocular, la salud de las células ganglionares de la retina y la función del nervio óptico. [27] El glaucoma de tensión normal, que comprende un tercio del glaucoma primario de ángulo abierto, también se asocia con mutaciones genéticas (incluidos los genes OPA1 y OPTN ). [28]
Además, existen algunas afecciones genéticas raras que aumentan el riesgo de glaucoma, como el síndrome de Axenfeld-Rieger y el glaucoma congénito primario, que se asocia con mutaciones en CYP1B1 o LTBP2 . [29] Se heredan de forma autosómica recesiva. [29] El síndrome de Axenfeld-Rieger se hereda de forma autosómica dominante y se asocia con PITX2 o FOXC1 . [30]
Muchas personas de ascendencia de Asia oriental son propensas a desarrollar glaucoma de ángulo cerrado debido a la menor profundidad de la cámara anterior, y la mayoría de los casos de glaucoma en esta población consisten en alguna forma de cierre de ángulo. [31] También se han informado tasas más altas de glaucoma en las poblaciones inuit , en comparación con las poblaciones blancas , en Canadá y Groenlandia. [ cita necesaria ]
En los Estados Unidos, el glaucoma es más común en afroamericanos , latinos y asiático-americanos . [14]
No hay evidencia clara que indique que las deficiencias de vitaminas causen glaucoma en humanos. Como tal, los suplementos vitamínicos orales no son un tratamiento recomendado. [32] La cafeína aumenta la presión intraocular en personas con glaucoma, pero no parece afectar a personas normales. [33]
Otros factores pueden causar glaucoma, conocido como "glaucoma secundario", incluido el uso prolongado de esteroides (glaucoma inducido por esteroides); afecciones que restringen gravemente el flujo sanguíneo al ojo, como retinopatía diabética grave y oclusión de la vena central de la retina (glaucoma neovascular); traumatismo ocular (glaucoma de recesión de ángulo); iris de meseta ; e inflamación de la capa media de la estructura vascular pigmentada del ojo ( uveítis ), conocida como glaucoma uveítico .
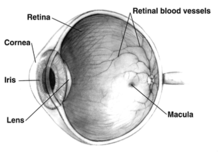
El principal efecto del glaucoma es el daño al nervio óptico. Con el tiempo, este daño conduce a la pérdida de la visión, que puede deteriorarse con el tiempo. La causa subyacente del glaucoma de ángulo abierto aún no está clara. Existen varias teorías sobre su etiología exacta. Sin embargo, el principal factor de riesgo para la mayoría de los glaucomas y el objetivo del tratamiento es el aumento de la presión intraocular. La presión intraocular es función de la producción de humor acuoso líquido por las apófisis ciliares del ojo y su drenaje a través de la red trabecular. El humor acuoso fluye desde los procesos ciliares hacia la cámara posterior , limitada posteriormente por el cristalino y las zónulas de Zinn , y anteriormente por el iris . Luego fluye a través de la pupila del iris hacia la cámara anterior , limitada posteriormente por el iris y anteriormente por la córnea .
Desde aquí, la red trabecular drena el humor acuoso a través del seno venoso escleral ( canal de Schlemm ) hacia los plexos esclerales y la circulación sanguínea general. [35]
En el glaucoma abierto/de gran ángulo, el flujo a través de la malla trabecular se reduce, debido a la degeneración y obstrucción de la malla trabecular, cuya función original es absorber el humor acuoso. La pérdida de absorción del humor acuoso conduce a una mayor resistencia y, por tanto, a una acumulación crónica e indolora de presión en el ojo. [36]
En el glaucoma primario de ángulo cerrado, el ángulo iridocorneal se estrecha o se cierra completamente, obstruyendo el flujo de humor acuoso a la red trabecular para su drenaje. Esto suele deberse al desplazamiento hacia adelante del iris contra la córnea, lo que produce un cierre del ángulo. Esta acumulación de humor acuoso provoca un aumento agudo de la presión y daño al nervio óptico. [14]
La fisiopatología del glaucoma no se comprende bien. Existen varias teorías sobre el mecanismo del daño al nervio óptico en el glaucoma. La teoría biomecánica plantea la hipótesis de que los axones de las células ganglionares de la retina (que forman la cabeza del nervio óptico y la capa de fibras nerviosas de la retina) son particularmente susceptibles al daño mecánico debido al aumento de la presión intraocular a medida que pasan a través de los poros de la lámina cribrosa . Por tanto, los aumentos de la presión intraocular provocarían daño a los nervios como se observa en el glaucoma. [14] La teoría vascular plantea la hipótesis de que una disminución del suministro de sangre a las células ganglionares de la retina provoca daño a los nervios. Esta disminución del suministro de sangre puede deberse al aumento de la presión intraocular y también puede deberse a hipotensión sistémica, vasoespasmo o aterosclerosis. [14] Esto está respaldado por la evidencia de que las personas con presión arterial baja, particularmente presión arterial diastólica baja, tienen un mayor riesgo de glaucoma. [14]
La teoría de la neurodegeneración primaria plantea la hipótesis de que un proceso neurodegenerativo primario puede ser responsable de la degeneración de la cabeza del nervio óptico en el glaucoma. [14] Esto sería consistente con un posible mecanismo del glaucoma de tensión normal (aquellos con glaucoma de ángulo abierto con presiones oculares normales) y está respaldado por evidencia que muestra una correlación del glaucoma con la demencia de Alzheimer y otras causas de deterioro cognitivo. [37] [38] Tanto los estudios experimentales como los clínicos implican que el estrés oxidativo desempeña un papel en la patogénesis del glaucoma de ángulo abierto [39] así como en la enfermedad de Alzheimer. [40]
La degeneración de los axones de las células ganglionares de la retina (el nervio óptico) es una característica del glaucoma. [41] La relación inconsistente de la neuropatía óptica glaucomatosa con el aumento de la presión intraocular ha provocado hipótesis y estudios sobre la estructura anatómica, el desarrollo ocular, el trauma por compresión nerviosa, el flujo sanguíneo del nervio óptico, el neurotransmisor excitador, el factor trófico, la degeneración de las células ganglionares o del axón de la retina, el soporte glial. célula, sistema inmunológico, mecanismos de envejecimiento de la pérdida de neuronas y corte de las fibras nerviosas en el borde escleral. [42] [43 ] [44] [45] [46] [47] [48]


La detección del glaucoma es una parte integral de un examen ocular estándar realizado por optometristas y oftalmólogos. [49] El estudio del glaucoma implica realizar una historia clínica exhaustiva, con énfasis en la evaluación de los factores de riesgo.
Las pruebas de evaluación basal del glaucoma incluyen la medición de la presión intraocular mediante tonometría, la evaluación del ángulo de la cámara anterior mediante tomografía de coherencia óptica , la inspección del ángulo de drenaje ( gonioscopia ) y la evaluación de la capa de fibras nerviosas de la retina con un examen del fondo de ojo dilatado , la medición del espesor de la córnea ( paquimetría ) y pruebas de campo visual . [49]
El glaucoma se ha clasificado en tipos específicos: [50]
Glaucoma primario (H40.1-H40.2)
Variantes de glaucoma primario
El glaucoma primario de ángulo cerrado es causado por el contacto entre el iris y la red trabecular, que a su vez obstruye la salida del humor acuoso del ojo. Este contacto entre el iris y la red trabecular (TM) puede dañar gradualmente la función de la red hasta que deje de seguir el ritmo de la producción acuosa y la presión aumente. En más de la mitad de los casos, el contacto prolongado entre el iris y la MT provoca la formación de sinequias (efectivamente, "cicatrices").
Estos provocan una obstrucción permanente del flujo acuoso. En algunos casos, la presión puede acumularse rápidamente en el ojo, provocando dolor y enrojecimiento (cierre de ángulo sintomático o llamado "agudo"). En esta situación, la visión puede volverse borrosa y se pueden ver halos alrededor de las luces brillantes. Los síntomas que lo acompañan pueden incluir dolor de cabeza y vómitos.
El diagnóstico se realiza a partir de signos y síntomas físicos: pupilas medianamente dilatadas y que no responden a la luz, córnea edematosa (turbia), visión reducida, enrojecimiento y dolor. Sin embargo, la mayoría de los casos son asintomáticos. Antes de una pérdida de visión muy grave, estos casos sólo pueden identificarse mediante un examen, generalmente realizado por un oftalmólogo.
El glaucoma primario de ángulo abierto se produce cuando el daño del nervio óptico provoca una pérdida progresiva del campo visual. [52] Esto se asocia con un aumento de la presión en el ojo. No todas las personas con glaucoma primario de ángulo abierto tienen una presión ocular elevada más allá de lo normal, pero se ha demostrado que disminuir aún más la presión ocular detiene la progresión incluso en estos casos.
El aumento de presión es causado por el bloqueo de la red trabecular. Debido a que los conductos microscópicos están bloqueados, la presión aumenta en el ojo y provoca una pérdida de visión muy gradual e imperceptible. La visión periférica se ve afectada primero, pero eventualmente se perderá toda la visión si no se trata.
El diagnóstico se realiza buscando el ahuecamiento del nervio óptico.
Glaucoma del desarrollo (Q15.0)
Glaucoma secundario (H40.3-H40.6)
El glaucoma neovascular , un tipo poco común de glaucoma, es difícil o casi imposible de tratar y, a menudo, es causado por retinopatía diabética proliferativa (PDR) u oclusión de la vena central de la retina (OVCR). También puede ser desencadenado por otras condiciones que resultan en isquemia de la retina o del cuerpo ciliar . Las personas con un flujo sanguíneo deficiente al ojo tienen un alto riesgo de padecer esta afección.
El glaucoma neovascular se produce cuando nuevos vasos anormales comienzan a desarrollarse en el ángulo del ojo y comienzan a bloquear el drenaje. Las personas con esta condición comienzan a perder rápidamente la vista. A veces, la enfermedad aparece muy rápidamente, especialmente después de procedimientos de cirugía de cataratas.
El glaucoma tóxico es un glaucoma de ángulo abierto con un aumento significativo e inexplicable de la presión intraocular después de una patogénesis desconocida. La presión intraocular a veces puede alcanzar los 80 mmHg (11 kPa). Se manifiesta característicamente como inflamación del cuerpo ciliar y edema trabecular masivo que a veces se extiende hasta el canal de Schlemm. Esta afección se diferencia del glaucoma maligno por la presencia de una cámara anterior clara y profunda y la falta de dirección acuosa errónea. Además, la apariencia de la córnea no es tan turbia. Puede producirse una reducción de la agudeza visual tras una degradación neurorretiniana.
Los factores asociados incluyen inflamación, fármacos, traumatismos y cirugía intraocular, incluida la cirugía de cataratas y los procedimientos de vitrectomía. Gede Pardianto (2005) informó sobre cuatro pacientes que tenían glaucoma tóxico. Uno de ellos fue sometido a facoemulsificación con pequeñas gotas de núcleo de partículas. Algunos casos se pueden resolver con alguna medicación, procedimientos de vitrectomía o trabeculectomía. Los procedimientos de válvulas pueden brindar cierto alivio, pero se requiere más investigación. [53]
El glaucoma absoluto (H44.5) es la etapa final de todos los tipos de glaucoma. El ojo no tiene visión, ausencia de reflejo pupilar a la luz y de respuesta pupilar , y tiene un aspecto pétreo. Hay dolor intenso en el ojo. El tratamiento del glaucoma absoluto es un procedimiento destructivo como la ciclocrioaplicación, la ciclofotocoagulación o la inyección de alcohol al 99%.
Glaucoma es un término general para afecciones oculares que dañan el nervio óptico y que pueden provocar pérdida de visión. [54] La principal causa de daño al nervio óptico es la presión intraocular (PIO), presión excesiva del líquido dentro del ojo, que puede ser causada por factores como el bloqueo de los conductos de drenaje y el estrechamiento o cierre del ángulo entre el iris y la córnea. .
El glaucoma se clasifica principalmente como de ángulo abierto o de ángulo cerrado (o de ángulo cerrado). En el glaucoma de ángulo abierto, el iris se encuentra normalmente con la córnea, lo que permite que drene el líquido del interior del ojo, aliviando así la presión interna. Cuando este ángulo se estrecha o se cierra, la presión aumenta con el tiempo, provocando daño al nervio óptico y provocando ceguera.
El glaucoma primario de ángulo abierto (también llamado glaucoma primario o crónico) implica la obstrucción lenta de los canales de drenaje, lo que resulta en un aumento de la presión ocular, lo que causa daño progresivo al nervio óptico. Esto se manifiesta como una pérdida gradual del campo visual, comenzando con una pérdida de la visión periférica , pero eventualmente se perderá toda la visión si no se trata la afección. [52] Este es el tipo más común de glaucoma y representa el 90% de los casos en los Estados Unidos, pero es menos prevalente en los países asiáticos. El inicio es lento e indoloro y la pérdida de visión es gradual e irreversible.
En el glaucoma de ángulo estrecho (también llamado glaucoma de ángulo cerrado), el iris se inclina hacia adelante, estrechando el ángulo que drena el ojo y aumentando la presión dentro del ojo. Si no se trata, puede provocar la emergencia médica de glaucoma de ángulo cerrado.
En el glaucoma de ángulo cerrado (también llamado glaucoma de ángulo cerrado, de ángulo cerrado primario o glaucoma agudo), el iris se inclina hacia adelante y provoca contacto físico entre el iris y la malla trabecular, lo que bloquea la salida del humor acuoso desde el interior del ojo. Este contacto puede dañar gradualmente la función de drenaje de la malla hasta que deje de seguir el ritmo de la producción acuosa y aumente la presión intraocular. La aparición de los síntomas es repentina y causa dolor y otros síntomas notables, y la afección se trata como una emergencia médica. A diferencia del glaucoma de ángulo abierto, el glaucoma de ángulo cerrado es el resultado del cierre del ángulo entre el iris y la córnea. Esto tiende a ocurrir en personas con hipermetropía , que tienen cámaras anteriores más pequeñas, lo que hace más probable el contacto físico entre el iris y la red trabecular. Se pueden realizar una variedad de pruebas para detectar personas en riesgo de padecer glaucoma de ángulo cerrado. [55] El glaucoma de ángulo cerrado representa menos del 10% de los casos de glaucoma en los Estados Unidos, pero hasta la mitad de los casos de glaucoma en otras naciones (particularmente los países de Asia oriental ). [56]
El glaucoma de tensión normal (NTG, también llamado glaucoma de baja tensión o de presión normal) es una afección en la que el nervio óptico está dañado aunque la presión intraocular (PIO) está en el rango normal (12 a 22 mmHg (1,6 a 2,9 kPa). ). Las personas con antecedentes familiares de NTG, las de ascendencia japonesa, las que tienen antecedentes de enfermedad cardíaca sistémica y las que tienen síndrome de Flammer tienen un riesgo elevado de desarrollar NTG. Se desconoce la causa del NTG.
El glaucoma secundario se refiere a cualquier caso en el que otra enfermedad, trauma, fármaco o procedimiento provoca un aumento de la presión ocular, lo que provoca daño al nervio óptico y pérdida de la visión, que puede ser leve o grave. Esto puede ser consecuencia de una lesión ocular, una inflamación, un tumor o casos avanzados de cataratas o diabetes . También puede ser causada por ciertos medicamentos como los esteroides . El tratamiento depende de si la afección se identifica como glaucoma de ángulo abierto o de ángulo cerrado.
En el glaucoma pseudoexfoliación (también conocido como PEX o glaucoma exfoliación), la presión resulta de la acumulación de fibras proteicas granulares microscópicas, que pueden bloquear el drenaje normal del humor acuoso. PEX es frecuente en Escandinavia , principalmente en personas mayores de 70 años y más comúnmente en mujeres.
El glaucoma pigmentario (también conocido como síndrome de dispersión pigmentaria) es causado por células pigmentarias que se desprenden de la parte posterior del iris y flotan en el humor acuoso. Con el tiempo, estas células pigmentarias pueden acumularse en la cámara anterior y comenzar a obstruir la red trabecular. Es una afección poco común que ocurre principalmente entre hombres blancos de entre 20 y 40 años, la mayoría de los cuales son miopes.
El glaucoma juvenil primario es una anomalía neonatal o juvenil en la que la hipertensión ocular es evidente al nacer o poco después y está causada por anomalías en el desarrollo del ángulo de la cámara anterior que bloquea la salida del humor acuoso.
El glaucoma uveítico es causado por uveítis , la hinchazón e inflamación de la úvea , la capa media del ojo. La úvea proporciona la mayor parte del suministro de sangre a la retina. El aumento de la presión ocular puede deberse a la inflamación misma o a los esteroides utilizados para tratarla. [57]

En el glaucoma, los defectos del campo visual resultan del daño a la capa de fibras nerviosas de la retina . Los defectos de campo se observan principalmente en el glaucoma primario de ángulo abierto. Debido a la anatomía única de la RNFL, se observan muchos patrones notables en el campo visual. La mayoría de los cambios glaucomatosos tempranos se observan dentro del campo visual central, principalmente en el área de Bjerrum, a 10-20° de la fijación. [58]
Los siguientes son los defectos de campo glaucomatosos comunes:


El Grupo de Trabajo de Servicios Preventivos de los Estados Unidos declaró, en 2013, que no había pruebas suficientes para recomendar a favor o en contra de la detección del glaucoma. [64] Por lo tanto, no existe un programa nacional de detección en los EE. UU. Sin embargo, la Academia Estadounidense de Oftalmología recomienda realizar pruebas de detección a partir de los 40 años. [2]
Existe un programa de detección de glaucoma en el Reino Unido. Se recomienda a las personas en riesgo que se realicen un examen de los ojos con dilatación de las pupilas al menos una vez al año. [sesenta y cinco]
El objetivo moderno del tratamiento del glaucoma es disminuir la presión intraocular (PIO), ralentizando así la progresión del glaucoma y preservando la calidad de vida de los pacientes, con efectos secundarios mínimos. [66] [67] [68] Esto requiere técnicas de diagnóstico y exámenes de seguimiento apropiados, y una selección juiciosa de tratamientos para cada paciente individual. Aunque la PIO es sólo uno de los principales factores de riesgo del glaucoma, reducirla mediante diversos fármacos y/o técnicas quirúrgicas es actualmente la base del tratamiento del glaucoma.
La PIO debe reducirse a un nivel objetivo en el que se controle la progresión de la enfermedad, protegiendo el campo visual y mejorando la calidad de vida. [68] [69] El nivel objetivo se establece individualmente dependiendo de múltiples factores, incluida la PIO previa al tratamiento, la gravedad y la tasa de progresión de la enfermedad y los efectos secundarios de los medicamentos. En general, la PIO objetivo es igual o inferior a 18 mmHg en el glaucoma leve, 15 mmHg en el moderado y 12 mmHg en el glaucoma grave. [70] Después de establecer la PIO objetivo, se debe realizar un seguimiento regular para evaluar la PIO y la progresión de la enfermedad.
El flujo vascular y las teorías neurodegenerativas de la neuropatía óptica glaucomatosa han impulsado estudios sobre diversas estrategias terapéuticas neuroprotectoras, incluidos compuestos nutricionales, algunos de los cuales los médicos pueden considerar seguros para su uso ahora, mientras que otros están en prueba. [ cita necesaria ] El estrés mental también se considera consecuencia y causa de la pérdida de visión, lo que significa que el entrenamiento para el manejo del estrés, el entrenamiento autógeno y otras técnicas para afrontar el estrés pueden ser útiles. [71]
Existen varios grupos de medicamentos para reducir la presión que podrían usarse para reducir la PIO, generalmente gotas para los ojos. La elección del medicamento suele depender de la dosis, la duración y los efectos secundarios de cada medicamento. Sin embargo, en general, los análogos de prostaglandinas son el tratamiento de primera línea para el glaucoma. [68] [69]
Los análogos de las prostaglandinas, como el latanoprost , el bimatoprost y el travoprost , reducen la PIO al aumentar la salida del líquido acuoso a través del ángulo de drenaje. Generalmente se prescribe una vez al día por la noche. Los efectos secundarios sistémicos de esta clase son mínimos. Sin embargo, pueden provocar efectos secundarios locales como enrojecimiento de la conjuntiva, cambio en el color del iris y alargamiento de las pestañas. [68] [69]
Existen otras clases de medicamentos que podrían usarse como segunda línea en caso de fracaso del tratamiento o presencia de contraindicaciones para los análogos de prostaglandinas. [72] [69] Estos incluyen:
Cada uno de estos medicamentos puede tener efectos secundarios locales y sistémicos. Limpiar el ojo con una gasa absorbente después de la administración de gotas para los ojos puede provocar menos efectos adversos. [73] Inicialmente, las gotas para el glaucoma pueden administrarse razonablemente en uno o en ambos ojos. [74]
También se están investigando los posibles efectos neuroprotectores de diversos medicamentos tópicos y sistémicos. [32] [75] [76] [77]
El cumplimiento deficiente de los medicamentos y las visitas de seguimiento es una de las principales razones del fracaso del tratamiento y la progresión de la enfermedad en pacientes con glaucoma. Una mala adherencia podría provocar un aumento de las tasas de complicaciones, aumentando así la necesidad de intervenciones no farmacológicas, incluida la cirugía. La educación y la comunicación con el paciente deben ser continuas para mantener planes de tratamiento exitosos para esta enfermedad que dura toda la vida y no presenta síntomas tempranos. [78]
La trabeculoplastia con láser de argón (ALT) se puede utilizar para tratar el glaucoma de ángulo abierto, pero es una solución temporal, no una cura. Se apunta un punto de láser de argón de 50 μm a la malla trabecular para estimular la apertura de la malla y permitir una mayor salida de líquido acuoso. Por lo general, se trata la mitad del ángulo a la vez. La trabeculoplastia láser tradicional utiliza un láser de argón térmico en un procedimiento de trabeculoplastia con láser de argón .
La iridotomía periférica con láser Nd:YAG (LPI) se puede utilizar en pacientes susceptibles o afectados por glaucoma de ángulo cerrado o síndrome de dispersión de pigmentos . Durante la iridotomía con láser, se utiliza energía láser para hacer una pequeña abertura de espesor total en el iris para igualar la presión entre la parte frontal y posterior del iris, corrigiendo así cualquier abultamiento anormal del iris. En personas con ángulos estrechos, esto puede dejar al descubierto la red trabecular. En algunos casos de cierre de ángulo intermitente o de corta duración, esto puede reducir la presión ocular. La iridotomía con láser reduce el riesgo de desarrollar un ataque de cierre de ángulo agudo. En la mayoría de los casos, también reduce el riesgo de desarrollar un cierre angular crónico o de adherencias del iris a la red trabecular. Las simulaciones CFD han demostrado que el tamaño óptimo de la iridotomía para aliviar la diferencia de presión entre el lado anterior y posterior del iris es de alrededor de 0,1 mm a 0,2 mm. [79] Esto coincide con la práctica clínica de LPI, donde comúnmente se usa un tamaño de iridotomía de 150 a 200 micrones. Sin embargo, a veces son necesarios tamaños de iriditomía más grandes.
La cicloablación con láser de diodo reduce la PIO al reducir la secreción acuosa al destruir el epitelio ciliar secretor. [80]

Para tratar el glaucoma se realizan cirugías tanto con láser como convencionales. La cirugía es la terapia principal para las personas con glaucoma congénito . [81] Generalmente, estas operaciones son una solución temporal, ya que aún no existe una cura para el glaucoma.
La canaloplastia es un procedimiento no penetrante que utiliza tecnología de microcatéter . Para realizar una canaloplastia, se hace una incisión en el ojo para acceder al canal de Schlemm de manera similar a una viscocanalostomía. Un microcatéter circunnavegará el canal alrededor del iris, ampliando el canal de drenaje principal y sus canales colectores más pequeños mediante la inyección de un material estéril similar a un gel llamado viscoelástico . Luego se retira el catéter y se coloca una sutura dentro del canal y se aprieta.
Al abrir el canal, se puede aliviar la presión dentro del ojo, aunque el motivo no está claro, ya que el canal (de Schlemm) no tiene ninguna resistencia significativa a los líquidos en ojos con glaucoma o sanos. Los resultados a largo plazo no están disponibles. [82] [83]
La cirugía convencional más común realizada para el glaucoma es la trabeculectomía . Aquí, se hace un colgajo de espesor parcial en la pared escleral del ojo y se hace una abertura de ventana debajo del colgajo para eliminar una porción de la red trabecular. Luego, el colgajo escleral se sutura sin apretar de nuevo en su lugar para permitir que el líquido salga del ojo a través de esta abertura, lo que da como resultado una disminución de la presión intraocular y la formación de una ampolla o burbuja de líquido en la superficie del ojo.
Pueden aparecer cicatrices alrededor o sobre la abertura del colgajo, lo que hace que se vuelva menos eficaz o pierda eficacia por completo. Tradicionalmente, los adyuvantes quimioterapéuticos, como la mitomicina C (MMC) o el 5-fluorouracilo (5-FU), se aplican con esponjas empapadas en el lecho de la herida para evitar que las ampollas filtrantes cicatricen al inhibir la proliferación de fibroblastos. Las alternativas contemporáneas para prevenir la cicatrización de la abertura de la malla incluyen la implementación única o combinada de adyuvantes no quimioterapéuticos como la matriz de colágeno Ologen, que clínicamente ha demostrado que aumenta las tasas de éxito del tratamiento quirúrgico. [84] [85] [86] [87]
La matriz de colágeno previene las cicatrices al aleatorizar y modular la proliferación de fibroblastos, además de prevenir mecánicamente la contracción y adhesión de la herida.
El primer implante de drenaje para glaucoma se desarrolló en 1966. [88] Desde entonces, varios tipos de implantes han seguido al original: la derivación tubular de Baerveldt o los implantes valvulares, como el implante valvular para glaucoma de Ahmed o el ExPress Mini Shunt y los implantes Molteno de cresta de presión de última generación. Están indicados para pacientes con glaucoma que no responden al tratamiento médico máximo y que previamente han fracasado con una cirugía filtrante protegida (trabeculectomía). El tubo de flujo se inserta en la cámara anterior del ojo y la placa se implanta debajo de la conjuntiva para permitir un flujo de líquido acuoso fuera del ojo hacia una cámara llamada ampolla .
La cicatrización en curso sobre el segmento de disipación conjuntival de la derivación puede volverse demasiado espesa para que se filtre el humor acuoso. Esto puede requerir medidas preventivas utilizando medicamentos antifibróticos, como 5-fluorouracilo o mitomicina-C (durante el procedimiento), u otros métodos de medicación no antifibrótica, como implante de matriz de colágeno, [94] [95] o espaciador biodegradable, o más adelante crear una necesidad de cirugía de revisión con el uso exclusivo o combinado de injertos de parche de donante o implante de matriz de colágeno. [95] Y para el ojo ciego doloroso glaucomatoso y algunos casos de glaucoma, se podría considerar la realización de ciclocrioterapia para la ablación del cuerpo ciliar. [80]
El abordaje quirúrgico más común que se utiliza actualmente para el tratamiento del glaucoma es la trabeculectomía, en la que se perfora la esclerótica para aliviar la presión intraocular.
La cirugía de esclerectomía profunda no penetrante (NPDS) es un procedimiento similar, pero modificado, en el que en lugar de perforar el lecho escleral y la malla trabecular debajo de un colgajo escleral, se crea un segundo colgajo escleral profundo, se extirpa, con procedimientos adicionales para quitar el techo del canal de Schlemm. , con lo cual se consigue la percolación del líquido desde el interior del ojo y así aliviar la presión intraocular, sin penetrar el ojo. Se ha demostrado que la NPDS tiene significativamente menos efectos secundarios que la trabeculectomía. [96] Sin embargo, la NPDS se realiza manualmente y requiere un mayor nivel de habilidades que pueden ser asistidas con instrumentos. [ cita necesaria ] Para prevenir la adhesión de la herida después de la escisión escleral profunda y mantener buenos resultados de filtrado, la NPDS, al igual que otros procedimientos no penetrantes, a veces se realiza con una variedad de espaciadores o dispositivos biocompatibles, como la mecha de colágeno Aquaflow, [97 ] Matriz de colágeno ologen, [86] [98] [99] o implante de glaucoma Xenoplast. [100]
La NPDS asistida por láser se realiza mediante el uso de un sistema láser de CO 2 . El sistema basado en láser se autotermina una vez que se ha logrado el espesor escleral requerido y el drenaje adecuado del líquido intraocular. Este efecto de autorregulación se logra porque el láser de CO2 básicamente deja de realizar la ablación tan pronto como entra en contacto con el líquido filtrado intraocular, lo que ocurre tan pronto como el láser alcanza el espesor óptimo de la capa intacta residual.
Para las personas con glaucoma crónico de ángulo cerrado, la extracción del cristalino puede aliviar el bloqueo creado por la pupila y ayudar a regular la presión intraocular. [101] Un estudio encontró que CLE es incluso más eficaz que la iridotomía periférica con láser en pacientes con glaucoma de ángulo cerrado. [102]
Glaucoma primario de ángulo cerrado: una vez que se han controlado los síntomas, el tratamiento de primera línea (y a menudo definitivo) es la iridotomía con láser . Esto se puede realizar utilizando láseres Nd:YAG o argón o, en algunos casos, mediante cirugía incisional convencional. El objetivo del tratamiento es revertir y prevenir el contacto entre el iris y la malla trabecular. En los casos tempranos a moderadamente avanzados, la iridotomía logra abrir el ángulo en alrededor del 75% de los casos. En el otro 25%, puede ser necesaria iridoplastia con láser, medicación (pilocarpina) o cirugía incisional.
Glaucoma primario de ángulo abierto: los agonistas de prostaglandinas actúan abriendo los conductos uveoesclerales. Los betabloqueantes, como el timolol, actúan disminuyendo la formación de agua. Los inhibidores de la anhidrasa carbónica disminuyen la formación de bicarbonato a partir de los procesos ciliares del ojo, disminuyendo así la formación de humor acuoso. Los análogos parasimpáticos son fármacos que actúan sobre el flujo trabecular abriendo el conducto y contrayendo la pupila. Los agonistas alfa 2 ( brimonidina , apraclonidina ) disminuyen la producción de líquido (mediante la inhibición de la AC) y aumentan el drenaje. Una revisión de personas con glaucoma primario de ángulo abierto e hipertensión ocular concluyó que el tratamiento médico para reducir la PIO ralentizó la progresión de la pérdida del campo visual. [9]
Los agentes anti-VEGF como medicamentos inyectables, junto con otros tratamientos estándar para disminuir la presión intraocular, pueden mejorar la presión en personas con glaucoma neovascular durante períodos cortos de tiempo. [103] La evidencia sugiere que esta mejora puede durar de 4 a 6 semanas. [103] No hay pruebas sólidas que sugieran que los medicamentos anti-VEGF sean eficaces para el tratamiento a largo plazo. [103] La seguridad a corto, mediano y largo plazo del tratamiento anti-VEGF no se ha investigado bien. [103]
La Sociedad Estadounidense de Glaucoma no recomienda el cannabis para el tratamiento del glaucoma en adultos ni en niños. [104] [105]
En el glaucoma de ángulo abierto, la progresión típica desde la visión normal hasta la ceguera completa tarda entre 25 y 70 años sin tratamiento, según el método de estimación utilizado. [106] La presión intraocular también puede tener un efecto, ya que presiones más altas reducen el tiempo hasta la ceguera. [107]

En 2010, había 44,7 millones de personas en el mundo con glaucoma de ángulo abierto. [109] El mismo año, había 2,8 millones de personas en los Estados Unidos con glaucoma de ángulo abierto. [109] Para 2020, se prevé que la prevalencia aumentará a 58,6 millones en todo el mundo y 3,4 millones en los Estados Unidos. [109]
Tanto a nivel internacional como en los Estados Unidos, el glaucoma es la segunda causa principal de ceguera . [2] A nivel mundial, las cataratas son una causa más común. El glaucoma también es la principal causa de ceguera entre los afroamericanos, que tienen tasas más altas de glaucoma primario de ángulo abierto. [110] [111] La pérdida de visión bilateral puede afectar negativamente la movilidad e interferir con la conducción. [112]
Un metaanálisis publicado en 2009 encontró que las personas con glaucoma primario de ángulo abierto no tienen mayores tasas de mortalidad ni mayor riesgo de muerte cardiovascular. [113]
La asociación entre presión intraocular elevada (PIO) y glaucoma fue descrita por primera vez por el inglés Richard Banister en 1622: "...que el ojo se vuelva más sólido y duro, entonces naturalmente debería ser...". [114] El glaucoma de ángulo cerrado fue tratado con extracción de cataratas por John Collins Warren en Boston ya en 1806. [115] La invención del oftalmoscopio por Hermann Helmholtz en 1851 permitió a los oftalmólogos identificar por primera vez el sello patológico del glaucoma, la excavación de la cabeza del nervio óptico debido a la pérdida de células ganglionares de la retina. El primer instrumento fiable para medir la presión intraocular fue inventado por el oftalmólogo noruego Hjalmar August Schiøtz en 1905. Aproximadamente medio siglo después, Hans Goldmann desarrolló en Berna (Suiza) su tonómetro de aplanación, que todavía hoy, a pesar de numerosas innovaciones en el diagnóstico, se considera el estándar de oro para determinar este factor patogénico crucial. A finales del siglo XX, se descubrieron otros mecanismos patogénicos además de la PIO elevada y se convirtieron en objeto de investigación, como el suministro insuficiente de sangre (a menudo asociado con una presión arterial baja o irregular) a la retina y la cabeza del nervio óptico. [116] El primer fármaco para reducir la PIO, la pilocarpina , se introdujo en la década de 1870; Otras innovaciones importantes en la terapia farmacológica del glaucoma fueron la introducción de colirios betabloqueantes en la década de 1970 y de análogos de prostaglandinas e inhibidores tópicos (administrados localmente) de la anhidrasa carbónica a mediados de la década de 1990. Recientemente se han complementado las primeras técnicas quirúrgicas como la iridectomía y los métodos de fístula. mediante procedimientos menos invasivos como pequeños implantes, una gama de opciones ahora ampliamente denominadas MIGS (cirugía de glaucoma microinvasiva).
La palabra "glaucoma" proviene del griego antiguo γλαύκωμα , [117] un derivado de γλαυκóς (glaukos), [118] que comúnmente describía el color de los ojos que no eran oscuros (es decir, azul, verde, gris claro). Los ojos descritos como γλαυκóς debido a una enfermedad podrían haber tenido una catarata gris en la era hipocrática o, a principios de la era común, el tono pupilar verdoso que a veces se observa en el glaucoma de ángulo cerrado. [119] [120] Este color se refleja en la palabra china para glaucoma, 青光眼(qīngguāngyǎn), literalmente “ ojo claro cian ”. Una hipótesis alternativa conecta el nombre con el sustantivo griego antiguo para 'búho', [121] γλαύξ o γλαῦξ (ambos glaux ).
El ensayo controlado aleatorio TAGS investigó si las gotas para los ojos o la trabeculectomía son más efectivas en el tratamiento del glaucoma primario de ángulo abierto avanzado. Después de dos años, los investigadores descubrieron que la visión y la calidad de vida son similares en ambos tratamientos. Al mismo tiempo, la presión ocular fue menor en las personas que se sometieron a cirugía y, a largo plazo, la cirugía es más rentable. [122] [123]
El ensayo LiGHT comparó la eficacia de las gotas para los ojos y la trabeculoplastia láser selectiva para el glaucoma de ángulo abierto. Ambos contribuyeron a una calidad de vida similar, pero la mayoría de las personas sometidas a tratamiento con láser pudieron dejar de usar gotas para los ojos. También se demostró que la trabeculoplastia con láser es más rentable. [124]
Una revisión sistemática Cochrane de 2013 comparó el efecto de la brimonidina y el timolol para frenar la progresión del glaucoma de ángulo abierto en participantes adultos. [125] Los resultados mostraron que los participantes asignados a brimonidina mostraron menos progresión del campo visual que aquellos asignados a timolol, aunque los resultados no fueron significativos, dada la gran pérdida durante el seguimiento y la evidencia limitada. [125] Las presiones intraoculares medias para ambos grupos fueron similares. Los participantes del grupo de brimonidina tuvieron una mayor incidencia de efectos secundarios causados por la medicación que los participantes del grupo de timolol. [125]
Un estudio realizado en el Reino Unido demostró que las personas que vivían en zonas de gran privación tenían probabilidades de ser diagnosticadas en una fase más avanzada de la enfermedad. [126] También demostró que había falta de servicios oftalmológicos profesionales en el área de alta privación.
Un estudio de 2017 muestra que existe una gran diferencia en el volumen de pruebas de glaucoma según el tipo de seguro en los EE. UU. [127] Los investigadores revisaron a 21,766 personas de ≥ 40 años de edad con glaucoma de ángulo abierto (GAO) recién diagnosticado y encontraron que a los beneficiarios de Medicaid se les realizó un volumen sustancialmente menor de pruebas de glaucoma en comparación con los pacientes con seguro médico comercial.
Los resultados de un metanálisis de 33.428 participantes con glaucoma primario de ángulo abierto (GPAA) publicado en 2021 sugieren que existen importantes disparidades étnicas y raciales en los ensayos clínicos en los EE. UU. [128] Aunque las minorías étnicas y raciales tienen una mayor carga de enfermedad, el 70,7% de los participantes del estudio eran blancos en comparación con el 16,8% negros y el 3,4% hispanos/latinos.
{{cite web}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )Glaucoma es un término amplio para una serie de afecciones diferentes que dañan el nervio óptico, el "cable" que transporta información visual desde el ojo al cerebro, provocando así cambios en la visión.
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )Resumen en inglés sencillo