El nitrógeno es un elemento químico ; tiene símbolo N y número atómico 7. El nitrógeno es un no metal y el miembro más ligero del grupo 15 de la tabla periódica , a menudo llamado pnictógenos. Es un elemento común en el universo , estimado en el séptimo lugar en abundancia total en la Vía Láctea y el Sistema Solar . A temperatura y presión estándar , dos átomos del elemento se unen para formar N2 , un gas diatómico incoloro e inodoro . El N 2 forma aproximadamente el 78% de la atmósfera terrestre , lo que lo convierte en el elemento no combinado más abundante en el aire. Debido a la volatilidad de los compuestos nitrogenados, el nitrógeno es relativamente raro en las partes sólidas de la Tierra.
Fue descubierto y aislado por primera vez por el médico escocés Daniel Rutherford en 1772 y de forma independiente por Carl Wilhelm Scheele y Henry Cavendish aproximadamente al mismo tiempo. El nombre nitrógeno fue sugerido por el químico francés Jean-Antoine-Claude Chaptal en 1790 cuando se descubrió que el nitrógeno estaba presente en el ácido nítrico y los nitratos . Antoine Lavoisier sugirió en cambio el nombre azote , del griego antiguo : ἀζωτικός "sin vida", por ser un gas asfixiante ; este nombre se utiliza en varios idiomas y aparece en los nombres en inglés de algunos compuestos nitrogenados como hidracina , azidas y compuestos azo .
El nitrógeno elemental generalmente se produce a partir del aire mediante tecnología de adsorción por cambio de presión . Aproximadamente 2/3 del nitrógeno elemental producido comercialmente se utiliza como gas inerte (sin oxígeno) para usos comerciales como el envasado de alimentos, y gran parte del resto se utiliza como nitrógeno líquido en aplicaciones criogénicas . Muchos compuestos de importancia industrial, como el amoníaco , el ácido nítrico, los nitratos orgánicos ( propulsores y explosivos ) y los cianuros , contienen nitrógeno. El triple enlace extremadamente fuerte en el nitrógeno elemental (N≡N), el segundo enlace más fuerte en cualquier molécula diatómica después del monóxido de carbono (CO), [6] domina la química del nitrógeno. Esto causa dificultades tanto para los organismos como para la industria a la hora de convertir el N 2 en compuestos útiles , pero al mismo tiempo significa que quemar, explotar o descomponer compuestos de nitrógeno para formar gas nitrógeno libera grandes cantidades de energía a menudo útil. El amoníaco y los nitratos producidos sintéticamente son fertilizantes industriales clave , y los nitratos de los fertilizantes son contaminantes clave en la eutrofización de los sistemas hídricos. Además de su uso en fertilizantes y reservas de energía, el nitrógeno es un constituyente de compuestos orgánicos tan diversos como el Kevlar utilizado en telas de alta resistencia y el cianoacrilato utilizado en superpegamento .
El nitrógeno se encuentra en todos los organismos, principalmente en los aminoácidos (y, por tanto, en las proteínas ), en los ácidos nucleicos ( ADN y ARN ) y en la molécula transportadora de energía, trifosfato de adenosina . El cuerpo humano contiene aproximadamente un 3% de nitrógeno en masa, el cuarto elemento más abundante en el cuerpo después del oxígeno, el carbono y el hidrógeno. El ciclo del nitrógeno describe el movimiento del elemento desde el aire hacia la biosfera y los compuestos orgánicos, y luego de regreso a la atmósfera. El nitrógeno es un componente de todas las clases de fármacos farmacológicos principales, incluidos los antibióticos . Muchos fármacos son imitadores o profármacos de moléculas señalizadoras naturales que contienen nitrógeno : por ejemplo, los nitratos orgánicos nitroglicerina y nitroprusiato controlan la presión arterial al metabolizarse en óxido nítrico . Muchas drogas notables que contienen nitrógeno, como la cafeína y la morfina naturales o las anfetaminas sintéticas , actúan sobre los receptores de neurotransmisores animales .

Los compuestos de nitrógeno tienen una historia muy larga, ya que Heródoto conocía el cloruro de amonio . Eran muy conocidos en la Edad Media. Los alquimistas conocían el ácido nítrico como agua fuerte (agua fuerte), así como otros compuestos nitrogenados como las sales de amonio y las sales de nitrato . La mezcla de ácidos nítrico y clorhídrico se conocía como agua regia (agua real), célebre por su capacidad para disolver el oro , el rey de los metales. [7]
El descubrimiento del nitrógeno se atribuye al médico escocés Daniel Rutherford en 1772, quien lo llamó aire nocivo . [8] [9] Aunque no lo reconoció como una sustancia química completamente diferente, lo distinguió claramente del "aire fijo" de Joseph Black , o dióxido de carbono. [10] El hecho de que había un componente del aire que no favorece la combustión estaba claro para Rutherford, aunque no era consciente de que se trataba de un elemento. El nitrógeno también fue estudiado aproximadamente al mismo tiempo por Carl Wilhelm Scheele , [11] Henry Cavendish , [12] y Joseph Priestley , [13] quienes se refirieron a él como aire quemado o aire flogistizado . El químico francés Antoine Lavoisier se refirió al gas nitrógeno como "aire mefítico" o azote , del vocablo griego άζωτικός (azotikos), "sin vida", por ser asfixiante . [14] [15] En una atmósfera de nitrógeno puro, los animales morían y las llamas se extinguían. Aunque el nombre de Lavoisier no fue aceptado en inglés porque se señaló que todos los gases excepto el oxígeno son asfixiantes o completamente tóxicos, se usa en muchos idiomas (francés, italiano, portugués, polaco, ruso, albanés, turco, etc.; el El alemán Stickstoff se refiere de manera similar a la misma característica, a saber, ersticken "ahogar o asfixiar") y todavía permanece en inglés en los nombres comunes de muchos compuestos de nitrógeno, como hidrazina y compuestos del ion azida . Finalmente, dio lugar al nombre de " pnictógenos " para el grupo encabezado por el nitrógeno, del griego πνίγειν "ahogar". [7]
La palabra inglesa nitrógeno (1794) ingresó al idioma procedente del francés nitrogène , acuñado en 1790 por el químico francés Jean-Antoine Chaptal (1756-1832), [16] del francés nitre ( nitrato de potasio , también llamado salitre ) y el sufijo francés. -gène , "productor", del griego -γενής (-genes, "engendrado"). El significado de Chaptal era que el nitrógeno es la parte esencial del ácido nítrico , que a su vez se producía a partir del nitro . En épocas anteriores, el salitre se había confundido con el "natrón" egipcio ( carbonato de sodio ), llamado νίτρον (nitrón) en griego, que, a pesar del nombre, no contenía nitrato. [17]
Las primeras aplicaciones militares, industriales y agrícolas de compuestos nitrogenados utilizaron salitre ( nitrato de sodio o nitrato de potasio), sobre todo en pólvora , y más tarde como fertilizante . En 1910, Lord Rayleigh descubrió que una descarga eléctrica en gas nitrógeno producía "nitrógeno activo", un alótropo monoatómico del nitrógeno. [18] La "nube giratoria de luz amarilla brillante" producida por su aparato reaccionó con el mercurio para producir nitruro de mercurio explosivo . [19]
Durante mucho tiempo, las fuentes de compuestos nitrogenados fueron limitadas. Las fuentes naturales se originaron ya sea por biología o por depósitos de nitratos producidos por reacciones atmosféricas. La fijación de nitrógeno mediante procesos industriales como el proceso de Frank-Caro (1895-1899) y el proceso de Haber-Bosch (1908-1913) alivió esta escasez de compuestos nitrogenados, hasta el punto de que la mitad de la producción mundial de alimentos depende ahora de fertilizantes nitrogenados sintéticos. [20] Al mismo tiempo, el uso del proceso de Ostwald (1902) para producir nitratos a partir de la fijación industrial de nitrógeno permitió la producción industrial a gran escala de nitratos como materia prima en la fabricación de explosivos en las guerras mundiales del siglo XX. [21] [22]

Un átomo de nitrógeno tiene siete electrones. En el estado fundamental, están dispuestos en la configuración electrónica 1s.2
2s2
2p1x
_2p1
año2p1
z. Por lo tanto, tiene cinco electrones de valencia en los orbitales 2s y 2p, tres de los cuales (los electrones p) no están apareados. Tiene una de las electronegatividades más altas entre los elementos (3,04 en la escala de Pauling), sólo superada por el cloro (3,16), el oxígeno (3,44) y el flúor (3,98). (Los gases nobles ligeros , helio , neón y argón , presumiblemente también serían más electronegativos, y de hecho están en la escala de Allen.) [23] Siguiendo tendencias periódicas, su radio covalente de enlace simple de 71 pm es más pequeño que los de boro (84 pm) y de carbono (76 pm), mientras que es mayor que las del oxígeno (66 pm) y el flúor (57 pm). El anión nitruro , N 3− , es mucho más grande, 146 pm, similar al de los aniones óxido (O 2− : 140 pm) y fluoruro (F − : 133 pm). [23] Las primeras tres energías de ionización del nitrógeno son 1,402, 2,856 y 4,577 MJ·mol −1 , y la suma de la cuarta y la quinta es16,920 MJ·mol −1 . Debido a estas cifras tan elevadas, el nitrógeno no tiene una química catiónica simple. [24]
La falta de nodos radiales en la subcapa 2p es directamente responsable de muchas de las propiedades anómalas de la primera fila del bloque p , especialmente en nitrógeno, oxígeno y flúor. La subcapa 2p es muy pequeña y tiene un radio muy similar al de la capa 2s, lo que facilita la hibridación orbital . También da como resultado fuerzas electrostáticas de atracción muy grandes entre el núcleo y los electrones de valencia en las capas 2s y 2p, lo que resulta en electronegatividades muy altas. La hipervalencia es casi desconocida en los elementos 2p por la misma razón, porque la alta electronegatividad hace difícil que un pequeño átomo de nitrógeno sea un átomo central en un enlace de tres centros y cuatro electrones rico en electrones , ya que tendería a atraer los electrones. fuertemente a sí mismo. Así, a pesar de la posición del nitrógeno a la cabeza del grupo 15 de la tabla periódica, su química muestra enormes diferencias con la de sus congéneres más pesados , el fósforo , el arsénico , el antimonio y el bismuto . [25]
El nitrógeno puede compararse útilmente con el carbono y el oxígeno de sus vecinos horizontales, así como con sus vecinos verticales en la columna de pnictógeno, el fósforo, el arsénico, el antimonio y el bismuto. Aunque cada elemento del período 2, desde el litio hasta el oxígeno, muestra algunas similitudes con el elemento del período 3 en el siguiente grupo (desde el magnesio hasta el cloro; estos se conocen como relaciones diagonales ), su grado cae abruptamente más allá del par boro-silicio. Las similitudes del nitrógeno con el azufre se limitan principalmente a los compuestos de anillos de nitruro de azufre cuando ambos elementos son los únicos presentes. [26]
El nitrógeno no comparte la propensión del carbono a la catenación . Al igual que el carbono, el nitrógeno tiende a formar compuestos iónicos o metálicos con los metales. El nitrógeno forma una extensa serie de nitruros con carbono, incluidos aquellos con estructuras de tipo cadena, grafítico y fullerénico . [27]
Se parece al oxígeno por su alta electronegatividad y su capacidad concomitante para formar enlaces de hidrógeno y la capacidad de formar complejos de coordinación donando sus pares solitarios de electrones. Existen algunos paralelismos entre la química del amoníaco NH 3 y el agua H 2 O. Por ejemplo, la capacidad de ambos compuestos de ser protonados para dar NH 4 + y H 3 O + o desprotonados para dar NH 2 − y OH − , con todos ellos capaces de aislarse en compuestos sólidos. [28]
El nitrógeno comparte con sus dos vecinos horizontales la preferencia por formar enlaces múltiples, típicamente con átomos de carbono, oxígeno u otros átomos de nitrógeno, a través de interacciones p π –p π . [26] Así, por ejemplo, el nitrógeno se presenta como moléculas diatómicas y por lo tanto tiene puntos de fusión (-210 °C) y de ebullición (-196 °C) mucho más bajos que el resto de su grupo, ya que las moléculas de N 2 sólo se mantienen juntos por interacciones débiles de van der Waals y hay muy pocos electrones disponibles para crear dipolos instantáneos significativos. Esto no es posible para sus vecinos verticales; así, los óxidos de nitrógeno , nitritos , nitratos , compuestos nitro , nitroso , azo y diazo , azidas , cianatos , tiocianatos y derivados imino no encuentran eco con el fósforo, el arsénico, el antimonio o el bismuto. Sin embargo, la complejidad de los oxoácidos de fósforo no encuentra eco en el nitrógeno. [26] Dejando de lado sus diferencias, el nitrógeno y el fósforo forman entre sí una extensa serie de compuestos; estos tienen estructuras de cadena, anillo y jaula. [29]
Tabla de propiedades térmicas y físicas del nitrógeno (N 2 ) a presión atmosférica: [30] [31]

El nitrógeno tiene dos isótopos estables : 14 N y 15 N. El primero es mucho más común y constituye el 99,634% del nitrógeno natural, y el segundo (que es un poco más pesado) constituye el 0,366% restante. Esto lleva a un peso atómico de alrededor de 14,007 u. [23] Ambos isótopos estables se producen en el ciclo CNO en las estrellas , pero el 14 N es más común ya que su captura de protones es el paso limitante de la velocidad. 14 N es uno de los cinco nucleidos impares e impares estables (un nucleido que tiene un número impar de protones y neutrones); los otros cuatro son 2 H , 6 Li, 10 B y 180 m Ta. [32]
La abundancia relativa de 14 N y 15 N es prácticamente constante en la atmósfera, pero puede variar en otros lugares, debido al fraccionamiento isotópico natural de reacciones biológicas redox y a la evaporación de amoníaco natural o ácido nítrico . [33] Las reacciones mediadas biológicamente (por ejemplo, asimilación , nitrificación y desnitrificación ) controlan fuertemente la dinámica del nitrógeno en el suelo. Estas reacciones normalmente resultan en un enriquecimiento de 15 N del sustrato y un agotamiento del producto . [34]
El isótopo pesado 15 N fue descubierto por primera vez por SM Naudé en 1929, y poco después se descubrieron los isótopos pesados de los elementos vecinos oxígeno y carbono . [35] Presenta una de las secciones transversales de captura de neutrones térmicos más bajas de todos los isótopos. [36] Se utiliza con frecuencia en espectroscopia de resonancia magnética nuclear (RMN) para determinar las estructuras de moléculas que contienen nitrógeno, debido a su espín nuclear fraccional de la mitad, lo que ofrece ventajas para la RMN, como un ancho de línea más estrecho. El 14 N, aunque también utilizable teóricamente, tiene un espín nuclear entero de uno y, por tanto, tiene un momento cuadripolar que conduce a espectros más amplios y menos útiles. [23] Sin embargo, la RMN de 15 N tiene complicaciones que no se encuentran en las espectroscopias de RMN de 1 H y 13 C más comunes. La baja abundancia natural del 15 N (0,36 %) reduce significativamente la sensibilidad, problema que sólo se ve agravado por su baja relación giromagnética (sólo el 10,14 % de la del 1 H). Como resultado, la relación señal-ruido para 1 H es aproximadamente 300 veces mayor que la de 15 N con la misma intensidad de campo magnético. [37] Esto puede aliviarse en cierta medida mediante el enriquecimiento isotópico de 15 N mediante intercambio químico o destilación fraccionada. 15 Los compuestos enriquecidos en N tienen la ventaja de que, en condiciones estándar, no sufren intercambio químico de sus átomos de nitrógeno con el nitrógeno atmosférico, a diferencia de los compuestos con isótopos de hidrógeno , carbono y oxígeno marcados que deben mantenerse alejados de la atmósfera. [23] La relación 15 N: 14 N se utiliza comúnmente en el análisis de isótopos estables en los campos de la geoquímica , hidrología , paleoclimatología y paleoceanografía , donde se denomina δ 15 N. [38]
De los otros trece isótopos producidos sintéticamente, que van del 9 N al 23 N, 13 N tienen una vida media de diez minutos y los isótopos restantes tienen vidas medias inferiores a ocho segundos. [39] [40] Dada la diferencia en la vida media, el 13 N es el radioisótopo de nitrógeno más importante, ya que tiene una vida relativamente larga para usarse en tomografía por emisión de positrones (PET), aunque su vida media aún es corta y, por lo tanto, debe producirse en el lugar del PET, por ejemplo en un ciclotrón mediante bombardeo de protones de 16 O produciendo 13 N y una partícula alfa . [41]
El radioisótopo 16 N es el radionucleido dominante en el refrigerante de los reactores de agua a presión o de los reactores de agua en ebullición durante el funcionamiento normal. Se produce a partir de 16 O (en agua) mediante una reacción (n,p) , en la que el átomo de 16 O captura un neutrón y expulsa un protón. Tiene una vida media corta de aproximadamente 7,1 s, [40] pero su desintegración a 16 O produce radiación gamma de alta energía (5 a 7 MeV). [40] [42] Debido a esto, el acceso a la tubería de refrigerante primario en un reactor de agua a presión debe restringirse durante la operación de potencia del reactor . [42] Es un indicador sensible e inmediato de fugas desde el sistema de refrigeración primario al ciclo de vapor secundario y es el principal medio de detección de dichas fugas. [42]

El nitrógeno atómico, también conocido como nitrógeno activo, es altamente reactivo, siendo un trirradical con tres electrones desapareados. Los átomos de nitrógeno libres reaccionan fácilmente con la mayoría de los elementos para formar nitruros, e incluso cuando dos átomos de nitrógeno libres chocan para producir una molécula de N 2 excitada , pueden liberar tanta energía al colisionar incluso con moléculas tan estables como el dióxido de carbono y el agua para causar fisión homolítica. en radicales como CO y O u OH y H. El nitrógeno atómico se prepara haciendo pasar una descarga eléctrica a través de gas nitrógeno a 0,1–2 mmHg, lo que produce nitrógeno atómico junto con una emisión de color amarillo melocotón que se desvanece lentamente como un resplandor durante varios minutos. incluso después de que termine la descarga. [26]
Dada la gran reactividad del nitrógeno atómico, el nitrógeno elemental suele presentarse como N 2 molecular , dinitrógeno. Esta molécula es un gas diamagnético incoloro, inodoro e insípido en condiciones estándar: se funde a -210 °C y hierve a -196 °C. [26] El dinitrógeno es mayoritariamente no reactivo a temperatura ambiente, pero, no obstante, reaccionará con el metal litio y algunos complejos de metales de transición . Esto se debe a su enlace, que es único entre los elementos diatómicos en condiciones estándar porque tiene un triple enlace N≡N . Los enlaces triples tienen longitudes de enlace cortas (en este caso, 109,76 pm) y altas energías de disociación (en este caso, 945,41 kJ/mol) y, por tanto, son muy fuertes, lo que explica el bajo nivel de reactividad química del dinitrógeno. [26] [43]
Pueden ser posibles otros oligómeros y polímeros de nitrógeno. Si pudieran sintetizarse, podrían tener aplicaciones potenciales como materiales con una densidad energética muy alta, que podrían usarse como potentes propulsores o explosivos. [44] Bajo presiones extremadamente altas (1,1 millones de atm ) y altas temperaturas (2000 K), como las que se producen en una celda de yunque de diamante , el nitrógeno se polimeriza en la estructura cristalina cúbica de enlace simple. Esta estructura es similar a la del diamante , y ambos tienen enlaces covalentes extremadamente fuertes , de ahí su apodo de "diamante de nitrógeno". [45]

A presión atmosférica , el nitrógeno molecular se condensa ( licua ) a 77 K (-195,79 ° C ) y se congela a 63 K (-210,01 °C) [46] en la forma alotrópica cristalina beta hexagonal compacta . Por debajo de 35,4 K (−237,6 °C), el nitrógeno asume la forma alotrópica de cristal cúbico (llamada fase alfa). [47] El nitrógeno líquido , un fluido incoloro que se asemeja al agua en apariencia, pero con un 80,8% de densidad (la densidad del nitrógeno líquido en su punto de ebullición es 0,808 g/mL), es un criógeno común . [48] El nitrógeno sólido tiene muchas modificaciones cristalinas. Forma una importante cobertura de superficie dinámica en Plutón [49] y lunas exteriores del Sistema Solar como Tritón . [50] Incluso a las bajas temperaturas del nitrógeno sólido, es bastante volátil y puede sublimarse para formar una atmósfera o condensarse nuevamente en escarcha de nitrógeno. Es muy débil y el gas nitrógeno fluye en forma de glaciares y géiseres de Tritón desde la región de los casquetes polares. [51]

El primer ejemplo de complejo de dinitrógeno que se descubrió fue [Ru(NH 3 ) 5 (N 2 )] 2+ (ver figura a la derecha), y pronto se descubrieron muchos otros complejos similares. Estos complejos , en los que una molécula de nitrógeno dona al menos un par solitario de electrones a un catión metálico central, ilustran cómo el N 2 podría unirse a los metales en la nitrogenasa y al catalizador del proceso de Haber : estos procesos que implican la activación del dinitrógeno son de vital importancia en biología y en la producción de fertilizantes. [52] [53]
El dinitrógeno es capaz de coordinarse con los metales de cinco formas diferentes. Las formas mejor caracterizadas son las terminales M←N≡N ( η 1 ) y M←N≡N→M ( μ , bis- η 1 ), en las que los pares solitarios de los átomos de nitrógeno se donan al catión metálico. Las formas menos caracterizadas implican que el dinitrógeno done pares de electrones del triple enlace, ya sea como ligando puente a dos cationes metálicos ( μ , bis- η 2 ) o a solo uno ( η 2 ). El quinto y único método implica la triple coordinación como ligando puente, donando los tres pares de electrones del triple enlace ( μ 3 -N 2 ). Algunos complejos presentan múltiples ligandos N 2 y algunos presentan N 2 unidos de múltiples formas. Dado que el N 2 es isoelectrónico con el monóxido de carbono (CO) y el acetileno (C 2 H 2 ), el enlace en los complejos de dinitrógeno está estrechamente relacionado con el de los compuestos carbonílicos , aunque el N 2 es un donante σ y un aceptor σ más débiles que el CO. Los estudios teóricos muestran que la donación σ es un factor más importante que permite la formación del vínculo M-N que la retrodonación π, que en su mayoría solo debilita el vínculo N-N, y la donación final ( η 1 ) se logra más fácilmente que la donación σ. Donación lateral ( η 2 ). [26]
Hoy en día, se conocen complejos de dinitrógeno para casi todos los metales de transición y representan varios cientos de compuestos. Normalmente se preparan mediante tres métodos: [26]
Ocasionalmente, el enlace N≡N puede formarse directamente dentro de un complejo metálico, por ejemplo haciendo reaccionar directamente amoníaco coordinado (NH 3 ) con ácido nitroso (HNO 2 ), pero esto no es aplicable generalmente. La mayoría de los complejos de dinitrógeno tienen colores dentro del rango blanco-amarillo-naranja-rojo-marrón; se conocen algunas excepciones, como el azul [{Ti( η 5 -C 5 H 5 ) 2 } 2 -(N 2 )]. [26]
El nitrógeno se une a casi todos los elementos de la tabla periódica excepto a los dos primeros gases nobles , helio y neón , y a algunos de los elementos de vida muy corta después del bismuto , creando una inmensa variedad de compuestos binarios con diversas propiedades y aplicaciones. [26] Se conocen muchos compuestos binarios: con la excepción de los hidruros, óxidos y fluoruros de nitrógeno, normalmente se denominan nitruros . Muchas fases estequiométricas suelen estar presentes para la mayoría de los elementos (por ejemplo, MnN, Mn 6 N 5 , Mn 3 N 2 , Mn 2 N, Mn 4 N y Mn x N para 9,2 < x < 25,3). Pueden clasificarse como "similares a sal" (principalmente iónicos), covalentes, "similares a diamantes" y metálicos (o intersticiales ), aunque esta clasificación tiene limitaciones que generalmente se derivan de la continuidad de los tipos de enlace en lugar de los tipos discretos y separados. que implica. Normalmente se preparan haciendo reaccionar directamente un metal con nitrógeno o amoníaco (a veces después de calentarlo) o mediante descomposición térmica de amidas metálicas: [54]
Son posibles muchas variantes de estos procesos. Los más iónicos de estos nitruros son los de los metales alcalinos y alcalinotérreos , Li 3 N (Na, K, Rb y Cs no forman nitruros estables por razones estéricas) y M 3 N 2 (M = Be, Mg, Ca, Sr, Ba). Formalmente se los puede considerar como sales del anión N 3− , aunque la separación de cargas en realidad no es completa ni siquiera para estos elementos altamente electropositivos. Sin embargo, las azidas de metales alcalinos NaN 3 y KN 3 , que presentan el carácter lineal N−
3anión, son bien conocidos, al igual que Sr(N 3 ) 2 y Ba(N 3 ) 2 . Las azidas de los metales del subgrupo B (los de los grupos 11 a 16 ) son mucho menos iónicas, tienen estructuras más complicadas y detonan fácilmente cuando se les aplica una descarga eléctrica. [54]
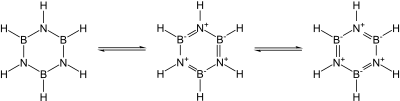
Se conocen muchos nitruros binarios covalentes. Los ejemplos incluyen cianógeno ((CN) 2 ), pentanitruro de trifósforo (P 3 N 5 ), dinitruro de disulfuro (S 2 N 2 ) y tetranitruro de tetraazufre (S 4 N 4 ). También se conocen el nitruro de silicio (Si 3 N 4 ) esencialmente covalente y el nitruro de germanio (Ge 3 N 4 ): el nitruro de silicio en particular sería una cerámica prometedora si no fuera por la dificultad de trabajarlo y sinterizarlo. En particular, los nitruros del grupo 13 , la mayoría de los cuales son semiconductores prometedores , son isoelectrónicos con grafito, diamante y carburo de silicio y tienen estructuras similares: su enlace cambia de covalente a parcialmente iónico y luego a metálico a medida que el grupo desciende. En particular, dado que la unidad B-N es isoelectrónica con respecto al C-C, y el carbono tiene un tamaño esencialmente intermedio entre el boro y el nitrógeno, gran parte de la química orgánica encuentra un eco en la química del boro-nitrógeno, como en la borazina (" benceno inorgánico ") . ). Sin embargo, la analogía no es exacta debido a la facilidad del ataque nucleofílico del boro debido a su deficiencia de electrones, lo que no es posible en un anillo que contenga totalmente carbono. [54]
La categoría más grande de nitruros son los nitruros intersticiales de fórmulas MN, M 2 N y M 4 N (aunque la composición variable es perfectamente posible), donde los pequeños átomos de nitrógeno se colocan en los espacios en una red metálica cúbica o hexagonal compacta. . Son opacos, muy duros y químicamente inertes, y sólo se funden a temperaturas muy altas (generalmente superiores a 2500 °C). Tienen un brillo metálico y conducen la electricidad como los metales. Se hidrolizan muy lentamente para dar amoníaco o nitrógeno. [54]
El anión nitruro (N 3− ) es el donante π más fuerte conocido entre los ligandos (el segundo más fuerte es el O 2− ). Los complejos de nitrido generalmente se forman mediante la descomposición térmica de azidas o desprotonando amoníaco, y generalmente involucran un grupo terminal {≡N} 3− . El anión azida lineal ( norte−
3), al ser isoelectrónico con óxido nitroso , dióxido de carbono y cianato , forma muchos complejos de coordinación. Más catenación es raro, aunque N4-4
_(isoelectrónico con carbonato y nitrato ). [54]

Industrialmente, el amoníaco (NH 3 ) es el compuesto de nitrógeno más importante y se prepara en mayores cantidades que cualquier otro compuesto porque contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de alimentos y fertilizantes. Es un gas alcalino incoloro con un olor acre característico. La presencia de enlaces de hidrógeno tiene efectos muy significativos sobre el amoníaco, confiriéndole sus altos puntos de fusión (-78 °C) y de ebullición (-33 °C). Como líquido, es un muy buen disolvente con un alto calor de vaporización (lo que permite su uso en matraces de vacío), que también tiene una viscosidad y conductividad eléctrica bajas y una constante dieléctrica alta , y es menos denso que el agua. Sin embargo, el enlace de hidrógeno en el NH 3 es más débil que el del H 2 O debido a la menor electronegatividad del nitrógeno en comparación con el oxígeno y a la presencia de un solo par libre en el NH 3 en lugar de dos en el H 2 O. Es una base débil. en solución acuosa ( p K b 4,74); su ácido conjugado es amonio , NH+
4. También puede actuar como un ácido extremadamente débil, perdiendo un protón para producir el anión amida, NH.−
2. Por tanto, sufre una autodisociación, similar al agua, para producir amonio y amida. El amoníaco se quema en el aire o en el oxígeno, aunque no fácilmente, para producir gas nitrógeno; arde en flúor con una llama de color amarillo verdoso para dar trifluoruro de nitrógeno . Las reacciones con otros no metales son muy complejas y tienden a dar lugar a una mezcla de productos. El amoníaco reacciona al calentarlo con los metales para formar nitruros. [56]
Se conocen muchos otros hidruros de nitrógeno binarios, pero los más importantes son la hidracina (N 2 H 4 ) y la azida de hidrógeno (HN 3 ). Aunque no es un hidruro de nitrógeno, la hidroxilamina (NH 2 OH) también es similar en propiedades y estructura al amoníaco y la hidrazina. La hidracina es un líquido incoloro y humeante que huele similar al amoníaco. Sus propiedades físicas son muy similares a las del agua (punto de fusión 2,0 °C, punto de ebullición 113,5 °C, densidad 1,00 g/cm 3 ). A pesar de ser un compuesto endotérmico, es cinéticamente estable. Se quema rápida y completamente en el aire de forma muy exotérmica para producir nitrógeno y vapor de agua. Es un agente reductor muy útil y versátil y es una base más débil que el amoníaco. [57] También se utiliza comúnmente como combustible para cohetes. [58]
La hidracina generalmente se produce mediante la reacción de amoníaco con hipoclorito de sodio alcalino en presencia de gelatina o pegamento: [57]
(Los ataques del hidróxido y el amoníaco pueden revertirse, pasando así a través del intermediario NHCl − .) La razón para agregar gelatina es que elimina iones metálicos como el Cu 2+ que cataliza la destrucción de la hidrazina por reacción con monocloramina (NH 2 Cl) para producir cloruro de amonio y nitrógeno. [57]
La azida de hidrógeno (HN 3 ) se produjo por primera vez en 1890 mediante la oxidación de hidracina acuosa con ácido nitroso. Es muy explosivo e incluso las soluciones diluidas pueden ser peligrosas. Tiene un olor desagradable e irritante y es un veneno potencialmente letal (pero no acumulativo). Puede considerarse el ácido conjugado del anión azida y es igualmente análogo a los ácidos hidrohálicos . [57]

Se conocen los cuatro trihaluros de nitrógeno simples. Se conocen algunos haluros e hidrohaluros mixtos, pero en su mayoría son inestables; los ejemplos incluyen NClF2 , NCl2F , NBrF2 , NF2H , NFH2 , NCl2H y NClH2 . _ _ [59]
El trifluoruro de nitrógeno (NF 3 , preparado por primera vez en 1928) es un gas incoloro e inodoro que es termodinámicamente estable y se produce más fácilmente mediante la electrólisis de fluoruro de amonio fundido disuelto en fluoruro de hidrógeno anhidro . Al igual que el tetrafluoruro de carbono , no es nada reactivo y es estable en agua o ácidos o álcalis acuosos diluidos. Sólo cuando se calienta actúa como agente fluorante y reacciona con cobre , arsénico, antimonio y bismuto al contacto a altas temperaturas para dar tetrafluorohidrazina (N 2 F 4 ). Los cationes NF+
4y N
2F+
3También se conocen (este último por la reacción de tetrafluorohidrazina con fuertes aceptores de fluoruro como el pentafluoruro de arsénico ), al igual que el ONF 3 , que ha despertado interés debido a la corta distancia N-O que implica un doble enlace parcial y el altamente polar y largo N-F. vínculo. La tetrafluorohidrazina, a diferencia de la propia hidracina, puede disociarse a temperatura ambiente y superiores para dar el radical NF 2 •. La azida de flúor (FN 3 ) es muy explosiva y térmicamente inestable. El difluoruro de dinitrógeno (N 2 F 2 ) existe como isómeros cis y trans térmicamente interconvertibles y se encontró por primera vez como producto de la descomposición térmica de FN 3 . [59]
El tricloruro de nitrógeno (NCl 3 ) es un líquido denso, volátil y explosivo cuyas propiedades físicas son similares a las del tetracloruro de carbono , aunque una diferencia es que el NCl 3 se hidroliza fácilmente con agua, mientras que el CCl 4 no. Fue sintetizado por primera vez en 1811 por Pierre Louis Dulong , quien perdió tres dedos y un ojo debido a sus tendencias explosivas. Como gas diluido es menos peligroso y por ello se utiliza industrialmente para blanquear y esterilizar la harina. El tribromuro de nitrógeno (NBr 3 ), preparado por primera vez en 1975, es un sólido volátil, sensible a la temperatura y de color rojo intenso que es explosivo incluso a -100 °C. El triyoduro de nitrógeno (NI 3 ) es aún más inestable y no se preparó hasta 1990. Su aducto con amoníaco, conocido antes, es muy sensible a los golpes: puede activarse con el roce de una pluma, con corrientes de aire cambiantes o incluso partículas alfa . [59] [60] Por esta razón, a veces se sintetizan pequeñas cantidades de triyoduro de nitrógeno como demostración para estudiantes de química de secundaria o como un acto de "magia química". [61] La azida de cloro (ClN 3 ) y la azida de bromo (BrN 3 ) son extremadamente sensibles y explosivas. [62] [63]
Se conocen dos series de oxohaluros de nitrógeno: los haluros de nitrosilo (XNO) y los haluros de nitrilo (XNO 2 ). El primero son los gases muy reactivos que se pueden producir halogenando directamente el óxido nitroso. El fluoruro de nitrosilo (NOF) es incoloro y un potente agente fluorante. El cloruro de nitrosilo (NOCl) se comporta prácticamente de la misma manera y a menudo se ha utilizado como disolvente ionizante. El bromuro de nitrosilo (NOBr) es rojo. Las reacciones de los halogenuros de nitrilo son en su mayoría similares: el fluoruro de nitrilo (FNO 2 ) y el cloruro de nitrilo (ClNO 2 ) son también gases reactivos y potentes agentes halogenantes. [59]

El nitrógeno forma nueve óxidos moleculares, algunos de los cuales fueron los primeros gases identificados: N 2 O ( óxido nitroso ), NO ( óxido nítrico ), N 2 O 3 ( trióxido de dinitrógeno ), NO 2 ( dióxido de nitrógeno ), N 2 O 4 ( tetróxido de dinitrógeno ), N2O5 ( pentóxido de dinitrógeno ), N4O ( nitrosilazida ) , [ 64] y N(NO2 ) 3 ( trinitramida ) . [65] Todos son térmicamente inestables hacia la descomposición en sus elementos. Otro posible óxido que aún no se ha sintetizado es el oxatetrazol (N 4 O), un anillo aromático. [64]
El óxido nitroso (N 2 O), más conocido como gas de la risa, se obtiene mediante la descomposición térmica del nitrato de amonio fundido a 250 °C. Esta es una reacción redox y, por lo tanto, también se producen como subproductos óxido nítrico y nitrógeno. Se utiliza principalmente como propulsor y agente aireante para la crema batida enlatada pulverizada , y antiguamente se utilizaba habitualmente como anestésico. A pesar de las apariencias, no se puede considerar que sea el anhídrido del ácido hiponitroso (H 2 N 2 O 2 ) porque ese ácido no se produce por la disolución del óxido nitroso en agua. Es bastante poco reactivo (no reacciona con los halógenos, los metales alcalinos ni el ozono a temperatura ambiente, aunque la reactividad aumenta con el calentamiento) y tiene la estructura asimétrica N – N – O (N≡N + O − ↔ − N=N + =O): por encima de 600 °C se disocia rompiendo el enlace N-O más débil. [64] El óxido nítrico (NO) es la molécula estable más simple con un número impar de electrones. En los mamíferos, incluidos los humanos, es una importante molécula de señalización celular implicada en muchos procesos fisiológicos y patológicos. [66] Se forma por oxidación catalítica de amoníaco. Es un gas paramagnético incoloro que, al ser termodinámicamente inestable, se descompone en nitrógeno y oxígeno entre 1100 y 1200 °C. Su enlace es similar al del nitrógeno, pero se añade un electrón adicional a un orbital antienlazante π * y, por tanto, el orden de enlace se ha reducido a aproximadamente 2,5; por lo tanto, la dimerización a O=N–N=O es desfavorable excepto por debajo del punto de ebullición (donde el isómero cis es más estable) porque en realidad no aumenta el orden total de enlaces y porque el electrón desapareado se deslocaliza a través de la molécula de NO, otorgándole estabilidad. También hay evidencia del dímero rojo asimétrico O=N–O=N cuando el óxido nítrico se condensa con moléculas polares. Reacciona con oxígeno para dar dióxido de nitrógeno marrón y con halógenos para dar haluros de nitrosilo. También reacciona con compuestos de metales de transición para dar complejos de nitrosilo, la mayoría de los cuales están profundamente coloreados. [64]
El trióxido de dinitrógeno azul (N 2 O 3 ) sólo está disponible como sólido porque se disocia rápidamente por encima de su punto de fusión para dar óxido nítrico, dióxido de nitrógeno (NO 2 ) y tetróxido de dinitrógeno (N 2 O 4 ). Los dos últimos compuestos son algo difíciles de estudiar individualmente debido al equilibrio entre ellos, aunque a veces el tetróxido de dinitrógeno puede reaccionar por fisión heterolítica con nitrosonio y nitrato en un medio con constante dieléctrica alta. El dióxido de nitrógeno es un gas marrón corrosivo y acre. Ambos compuestos pueden prepararse fácilmente descomponiendo un nitrato metálico seco. Ambos reaccionan con el agua para formar ácido nítrico . El tetróxido de dinitrógeno es muy útil para la preparación de nitratos metálicos anhidros y complejos de nitrato, y a finales de los años cincuenta se convirtió en el oxidante almacenable preferido para muchos cohetes tanto en los Estados Unidos como en la URSS . Esto se debe a que es un propulsor hipergólico en combinación con un combustible para cohetes a base de hidracina y se puede almacenar fácilmente ya que es líquido a temperatura ambiente. [64]
El pentóxido de dinitrógeno (N 2 O 5 ), térmicamente inestable y muy reactivo, es el anhídrido del ácido nítrico y puede obtenerse a partir de él mediante deshidratación con pentóxido de fósforo . Es de interés para la preparación de explosivos. [67] Es un sólido cristalino incoloro y delicuescente que es sensible a la luz. En estado sólido es iónico con estructura [NO 2 ] + [NO 3 ] − ; como gas y en solución es molecular O 2 N–O–NO 2 . La hidratación a ácido nítrico se produce fácilmente, al igual que una reacción análoga con peróxido de hidrógeno que da ácido peroxonítrico (HOONO 2 ). Es un agente oxidante violento. El pentóxido de dinitrógeno gaseoso se descompone de la siguiente manera: [64]
Se conocen muchos oxoácidos de nitrógeno, aunque la mayoría de ellos son inestables como compuestos puros y sólo se conocen como soluciones acuosas o como sales. El ácido hiponitroso (H 2 N 2 O 2 ) es un ácido diprótico débil con la estructura HON=NOH (p K a1 6,9, p K a2 11,6). Las soluciones ácidas son bastante estables, pero por encima de pH 4 se produce una descomposición catalizada por bases a través de [HONNO] - a óxido nitroso y el anión hidróxido. Hiponitritos (que involucran el N
2oh2-2
_anión) son estables frente a los agentes reductores y más comúnmente actúan como agentes reductores ellos mismos. Son un paso intermedio en la oxidación del amoníaco a nitrito, que se produce en el ciclo del nitrógeno . El hiponitrito puede actuar como ligando bidentado puente o quelante. [68]
El ácido nitroso (HNO 2 ) no se conoce como un compuesto puro, pero es un componente común en los equilibrios gaseosos y es un reactivo acuoso importante: sus soluciones acuosas pueden prepararse a partir de nitrito acuoso frío acidificado ( NO−
2, dobladas), aunque ya a temperatura ambiente la desproporción con respecto al nitrato y al óxido nítrico es significativa. Es un ácido débil con p K a 3,35 a 18 °C. Pueden analizarse volumétricamente mediante su oxidación a nitrato por permanganato . Se reducen fácilmente a óxido nitroso y óxido nítrico mediante dióxido de azufre , a ácido hiponitroso con estaño (II) y a amoníaco con sulfuro de hidrógeno . Sales de hidrazinio N
2h+
5reacciona con ácido nitroso para producir azidas que reaccionan aún más para dar óxido nitroso y nitrógeno. El nitrito de sodio es ligeramente tóxico en concentraciones superiores a 100 mg/kg, pero a menudo se utilizan pequeñas cantidades para curar la carne y como conservante para evitar el deterioro bacteriano. También se utiliza para sintetizar hidroxilamina y diazotizar aminas aromáticas primarias de la siguiente manera: [68]
El nitrito también es un ligando común que puede coordinarse de cinco maneras. Los más comunes son el nitro (unido a partir de nitrógeno) y el nitrito (unido a partir de oxígeno). La isomería nitro-nitrito es común, donde la forma nitrito suele ser menos estable. [68]

El ácido nítrico (HNO 3 ) es, con diferencia, el más importante y estable de los oxoácidos nitrogenados. Es uno de los tres ácidos más utilizados (los otros dos son el ácido sulfúrico y el ácido clorhídrico ) y fue descubierto por primera vez por los alquimistas en el siglo XIII. Se obtiene mediante la oxidación catalítica de amoníaco a óxido nítrico, que se oxida a dióxido de nitrógeno y luego se disuelve en agua para dar ácido nítrico concentrado. En los Estados Unidos de América se producen cada año más de siete millones de toneladas de ácido nítrico, la mayor parte del cual se utiliza para la producción de nitrato para fertilizantes y explosivos, entre otros usos. El ácido nítrico anhidro se puede preparar destilando ácido nítrico concentrado con pentóxido de fósforo a baja presión en un aparato de vidrio en la oscuridad. Sólo se puede preparar en estado sólido, porque al fundirse se descompone espontáneamente en dióxido de nitrógeno, y el ácido nítrico líquido se autoioniza en mayor medida que cualquier otro líquido covalente de la siguiente manera: [68]
Se conocen dos hidratos, HNO 3 ·H 2 O y HNO 3 ·3H 2 O, que pueden cristalizar. Es un ácido fuerte y las soluciones concentradas son agentes oxidantes fuertes, aunque el oro , el platino , el rodio y el iridio son inmunes al ataque. Una mezcla 3:1 de ácido clorhídrico concentrado y ácido nítrico, llamada agua regia , es aún más fuerte y disuelve con éxito el oro y el platino, porque se forman cloro libre y cloruro de nitrosilo y los aniones cloruro pueden formar complejos fuertes. En el ácido sulfúrico concentrado, el ácido nítrico se protona para formar nitronio , que puede actuar como electrófilo para la nitración aromática: [68]
Las estabilidades térmicas de los nitratos (que involucran el plano trigonal NO−
3anión) depende de la basicidad del metal, al igual que los productos de descomposición (termólisis), que pueden variar entre el nitrito (por ejemplo, sodio), el óxido (potasio y plomo ), o incluso el propio metal ( plata ). dependiendo de sus estabilidades relativas. El nitrato también es un ligando común con muchos modos de coordinación. [68]
Finalmente, aunque el ácido ortonítrico (H 3 NO 4 ), que sería análogo al ácido ortofosfórico , no existe, el anión ortonitrato tetraédrico NO3-4
_se conoce en sus sales de sodio y potasio: [68]
Estas sales cristalinas blancas son muy sensibles al vapor de agua y al dióxido de carbono en el aire: [68]
A pesar de su química limitada, el anión ortonitrato es interesante desde un punto de vista estructural debido a su forma tetraédrica regular y las longitudes cortas de los enlaces N-O, lo que implica un carácter polar significativo del enlace. [68]
El nitrógeno es uno de los elementos más importantes de la química orgánica . Muchos grupos funcionales orgánicos implican un enlace carbono-nitrógeno , como amidas (RCONR 2 ), aminas (R 3 N), iminas (RC(=NR)R), imidas (RCO) 2 NR, azidas (RN 3 ), azo . compuestos (RN 2 R), cianatos (ROCN), isocianatos (RNCO), nitratos (RONO 2 ), nitrilos (RCN), isonitrilos (RNC), nitritos (RONO), compuestos nitro (RNO 2 ), compuestos nitrosos (RNO) , oximas (RC(=NOH)R) y derivados de piridina . Los enlaces C-N están fuertemente polarizados hacia el nitrógeno. En estos compuestos, el nitrógeno suele ser trivalente (aunque puede ser tetravalente en las sales de amonio cuaternario , R 4 N + ), con un par solitario que puede conferir basicidad al compuesto al estar coordinado con un protón. Esto puede compensarse con otros factores: por ejemplo, las amidas no son básicas porque el par solitario está deslocalizado en un doble enlace (aunque pueden actuar como bases a un pH muy bajo, siendo protonadas en el oxígeno), y el pirrol no es básico porque el par solitario está deslocalizado como parte de un anillo aromático . [69] La cantidad de nitrógeno en una sustancia química se puede determinar mediante el método Kjeldahl . [70] En particular, el nitrógeno es un componente esencial de los ácidos nucleicos , los aminoácidos y, por tanto , las proteínas , y de la molécula transportadora de energía, el trifosfato de adenosina , por lo que es vital para toda la vida en la Tierra. [69]

El nitrógeno es el elemento puro más común en la Tierra y constituye el 78,1% del volumen de la atmósfera [7] (75,5% en masa), alrededor de 3,89 millones de gigatoneladas . A pesar de esto, no es muy abundante en la corteza terrestre, ya que representa alrededor de 19 partes por millón , a la par del niobio , el galio y el litio . (Esto representa entre 300.000 y un millón de gigatoneladas de nitrógeno, dependiendo de la masa de la corteza. [71] ) Los únicos minerales nitrogenados importantes son el nitro ( nitrato de potasio , salitre) y el nitro de sodio ( nitrato de sodio , salitre chileno). Sin embargo, estos no han sido una fuente importante de nitratos desde la década de 1920, cuando se volvió común la síntesis industrial de amoníaco y ácido nítrico. [72]
Los compuestos de nitrógeno se intercambian constantemente entre la atmósfera y los organismos vivos. El nitrógeno primero debe procesarse o " fijarse " en una forma utilizable por las plantas, generalmente amoníaco. Parte de la fijación de nitrógeno se realiza mediante rayos que producen óxidos de nitrógeno, pero la mayor parte la realizan bacterias diazotróficas a través de enzimas conocidas como nitrogenasas (aunque hoy en día la fijación industrial de nitrógeno en amoníaco también es importante). Cuando las plantas absorben el amoníaco, se utiliza para sintetizar proteínas. Luego, estas plantas son digeridas por animales que utilizan los compuestos de nitrógeno para sintetizar sus proteínas y excretar los desechos que contienen nitrógeno. Finalmente, estos organismos mueren y se descomponen, sufriendo oxidación y desnitrificación bacteriana y ambiental , devolviendo dinitrógeno libre a la atmósfera. La fijación industrial de nitrógeno mediante el proceso Haber se utiliza principalmente como fertilizante, aunque el exceso de desechos que contienen nitrógeno, cuando se lixivia, conduce a la eutrofización del agua dulce y a la creación de zonas marinas muertas , ya que el crecimiento bacteriano impulsado por el nitrógeno agota el oxígeno del agua hasta el punto de que todos los organismos superiores mueren. Además, el óxido nitroso, que se produce durante la desnitrificación, ataca la capa de ozono atmosférico . [72]
Muchos peces de agua salada fabrican grandes cantidades de óxido de trimetilamina para protegerlos de los altos efectos osmóticos de su entorno; La conversión de este compuesto en dimetilamina es responsable del olor temprano en los peces de agua salada no frescos. [73] En los animales, el radical libre óxido nítrico (derivado de un aminoácido ) sirve como una importante molécula reguladora de la circulación. [74]
La rápida reacción del óxido nítrico con el agua en los animales da como resultado la producción de su metabolito nitrito . El metabolismo animal del nitrógeno en las proteínas, en general, da como resultado la excreción de urea , mientras que el metabolismo animal de los ácidos nucleicos da como resultado la excreción de urea y ácido úrico . El olor característico de la carne animal en descomposición es causado por la creación de aminas de cadena larga que contienen nitrógeno , como la putrescina y la cadaverina , que son productos de degradación de los aminoácidos ornitina y lisina , respectivamente, en las proteínas en descomposición. [75]
El gas nitrógeno es un gas industrial producido por destilación fraccionada de aire líquido , o por medios mecánicos utilizando aire gaseoso ( membrana de ósmosis inversa presurizada o adsorción por oscilación de presión ). Los generadores de gas nitrógeno que utilizan membranas o adsorción por cambio de presión (PSA) suelen ser más económicos y energéticamente eficientes que el nitrógeno suministrado a granel. [76] El nitrógeno comercial es a menudo un subproducto del procesamiento del aire para la concentración industrial de oxígeno para la fabricación de acero y otros fines. Cuando se suministra comprimido en cilindros, a menudo se le llama OFN (nitrógeno libre de oxígeno). [77] El nitrógeno de calidad comercial ya contiene como máximo 20 ppm de oxígeno, y también se encuentran disponibles grados especialmente purificados que contienen como máximo 2 ppm de oxígeno y 10 ppm de argón . [78]
En un laboratorio químico se prepara tratando una solución acuosa de cloruro de amonio con nitrito de sodio . [79]
En esta reacción también se forman pequeñas cantidades de las impurezas NO y HNO 3 . Las impurezas se pueden eliminar haciendo pasar el gas a través de ácido sulfúrico acuoso que contiene dicromato de potasio . [79]
También puede obtenerse por descomposición térmica del dicromato de amonio . [80]
Se puede preparar nitrógeno muy puro mediante la descomposición térmica de azida de bario o azida de sodio . [81]
Las aplicaciones de los compuestos de nitrógeno son naturalmente muy variadas debido al enorme tamaño de esta clase: por lo tanto, aquí sólo se considerarán las aplicaciones del nitrógeno puro. Dos tercios (2/3) del nitrógeno producido por la industria se vende como gas y el tercio restante (1/3) como líquido.
El gas se utiliza principalmente como una atmósfera segura de baja reactividad donde el oxígeno en el aire pueda representar un riesgo de incendio, explosión u oxidación. Algunos ejemplos incluyen: [78]
El nitrógeno se utiliza comúnmente durante la preparación de muestras en análisis químicos . Se utiliza para concentrar y reducir el volumen de muestras líquidas. Dirigir una corriente presurizada de gas nitrógeno perpendicular a la superficie del líquido hace que el disolvente se evapore dejando atrás los solutos y el disolvente no evaporado. [87]
El nitrógeno se puede utilizar como sustituto o en combinación con el dióxido de carbono para presurizar los barriles de algunas cervezas , en particular las stout y las British ales , debido a las burbujas más pequeñas que produce, lo que hace que la cerveza dispensada sea más suave y embriagadora . [88] Una cápsula de nitrógeno sensible a la presión conocida comúnmente como " widget " permite envasar cervezas cargadas de nitrógeno en latas y botellas . [89] [90] Los tanques de nitrógeno también están reemplazando al dióxido de carbono como principal fuente de energía para las pistolas de paintball . El nitrógeno debe mantenerse a una presión más alta que el CO 2 , lo que hace que los tanques de N 2 sean más pesados y caros. [91]
Algunos equipos de construcción utilizan gas nitrógeno presurizado para ayudar al sistema hidráulico a proporcionar potencia adicional a dispositivos como el martillo hidráulico . El gas nitrógeno, que se forma a partir de la descomposición de la azida de sodio , se utiliza para inflar los airbags . [92]
Como el nitrógeno es un gas asfixiante en sí mismo, algunas jurisdicciones han considerado la asfixia por inhalación de nitrógeno puro como un medio de pena capital (como sustituto de la inyección letal ). [93] [94] [95] En enero de 2024, Kenneth Eugene Smith se convirtió en la primera persona ejecutada por asfixia con nitrógeno. [96]
El nitrógeno líquido es un líquido criogénico que parece agua . Cuando se aísla en contenedores adecuados, como matraces Dewar , se puede transportar y almacenar con una baja tasa de pérdida por evaporación . [97]

Al igual que el hielo seco , el principal uso del nitrógeno líquido es el de enfriar a bajas temperaturas. Se utiliza en la criopreservación de materiales biológicos como la sangre y las células reproductivas ( espermatozoides y óvulos ). Se utiliza en crioterapia para eliminar quistes y verrugas de la piel congelándolos. [98] Se utiliza en trampas de frío de laboratorio y en bombas criogénicas para obtener presiones más bajas en sistemas de bombeo al vacío . Se utiliza para enfriar dispositivos electrónicos sensibles al calor , como detectores de infrarrojos y detectores de rayos X. Otros usos incluyen el liofilizado y el mecanizado de materiales blandos o gomosos a temperatura ambiente, el ajuste por contracción y el ensamblaje de componentes de ingeniería y, en general, para alcanzar temperaturas muy bajas cuando sea necesario. Debido a su bajo costo, el nitrógeno líquido se utiliza a menudo para enfriar incluso cuando temperaturas tan bajas no son estrictamente necesarias, como la refrigeración de alimentos, la congelación del ganado, la congelación de tuberías para detener el flujo cuando no hay válvulas presentes y la consolidación de suelos inestables mediante congelarse cada vez que se realiza una excavación debajo. [78]
Aunque el nitrógeno no es tóxico, cuando se libera en un espacio cerrado puede desplazar el oxígeno y, por lo tanto, presenta un riesgo de asfixia . Esto puede suceder con pocos síntomas de advertencia, ya que el cuerpo carotídeo humano es un sistema de detección de niveles bajos de oxígeno (hipoxia) relativamente pobre y lento. [99] Un ejemplo ocurrió poco antes del lanzamiento de la primera misión del Transbordador Espacial el 19 de marzo de 1981, cuando dos técnicos murieron por asfixia después de ingresar a un espacio ubicado en la plataforma de lanzamiento móvil del Transbordador Espacial que estaba presurizado con nitrógeno puro como Precaución contra el fuego. [100]
Cuando se inhala a presiones parciales altas (más de aproximadamente 4 bar, que se encuentran a profundidades inferiores a aproximadamente 30 m en el buceo ), el nitrógeno es un agente anestésico que causa narcosis por nitrógeno , un estado temporal de deterioro mental similar a la intoxicación por óxido nitroso . [101] [102]
El nitrógeno se disuelve en la sangre y las grasas corporales. La descompresión rápida (como cuando los buzos ascienden demasiado rápido o los astronautas se descomprimen demasiado rápido desde la presión de la cabina hasta la presión del traje espacial) puede provocar una afección potencialmente mortal llamada enfermedad de descompresión (anteriormente conocida como enfermedad del cajón o curvas ), cuando se forman burbujas de nitrógeno en el torrente sanguíneo. nervios, articulaciones y otras áreas sensibles o vitales. [103] [104] Las burbujas de otros gases "inertes" (gases distintos del dióxido de carbono y el oxígeno) causan los mismos efectos, por lo que la sustitución del nitrógeno en los gases respirables puede prevenir la narcosis por nitrógeno, pero no previene la enfermedad por descompresión. [105]
Como líquido criogénico , el nitrógeno líquido puede ser peligroso al provocar quemaduras por frío al contacto, aunque el efecto Leidenfrost proporciona protección para una exposición muy breve (aproximadamente un segundo). [106] La ingestión de nitrógeno líquido puede causar daños internos graves. Por ejemplo, en 2012, a una joven en Inglaterra le tuvieron que extirpar el estómago tras ingerir un cóctel elaborado con nitrógeno líquido. [107]
Debido a que la relación de expansión líquido-gas del nitrógeno es 1:694 a 20 °C, se puede generar una enorme cantidad de fuerza si el nitrógeno líquido se vaporiza rápidamente en un espacio cerrado. En un incidente ocurrido el 12 de enero de 2006 en la Universidad Texas A&M , los dispositivos de alivio de presión de un tanque de nitrógeno líquido funcionaron mal y luego se sellaron. Como resultado del posterior aumento de presión, el tanque falló catastróficamente. La fuerza de la explosión fue suficiente para impulsar el tanque a través del techo inmediatamente superior, romper una viga de hormigón armado inmediatamente debajo y volar las paredes del laboratorio entre 0,1 y 0,2 m de sus cimientos. [108]
El nitrógeno líquido se evapora fácilmente para formar nitrógeno gaseoso y, por tanto, las precauciones asociadas con el nitrógeno gaseoso también se aplican al nitrógeno líquido. [109] [110] [111] Por ejemplo, los sensores de oxígeno a veces se utilizan como medida de seguridad cuando se trabaja con nitrógeno líquido para alertar a los trabajadores sobre derrames de gas en un espacio confinado. [112]
Los recipientes que contienen nitrógeno líquido pueden condensar oxígeno del aire. El líquido en un recipiente de este tipo se enriquece cada vez más en oxígeno (punto de ebullición -183 °C, más alto que el del nitrógeno) a medida que el nitrógeno se evapora y puede provocar una oxidación violenta del material orgánico. [113]
Los monitores de deficiencia de oxígeno se utilizan para medir los niveles de oxígeno en espacios confinados y en cualquier lugar donde se almacene o utilice nitrógeno líquido o gaseoso. En caso de una fuga de nitrógeno y una disminución del oxígeno a un nivel de alarma preestablecido, se puede programar un monitor de deficiencia de oxígeno para activar alarmas audibles y visuales, notificando así el posible peligro inminente. Lo más común es que el rango de oxígeno para alertar al personal sea cuando los niveles de oxígeno descienden por debajo del 19,5%. OSHA especifica que una atmósfera peligrosa puede incluir una en la que la concentración de oxígeno sea inferior al 19,5 % o superior al 23,5 %. [114] Los monitores de deficiencia de oxígeno pueden fijarse, montarse en la pared y conectarse mediante cableado a la fuente de alimentación del edificio o simplemente enchufarse a una toma de corriente, o a un monitor portátil o portátil.
{{cite book}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: URL no apta ( enlace ){{cite journal}}: Mantenimiento CS1: URL no apta ( enlace ){{cite journal}}: Mantenimiento CS1: URL no apta ( enlace ){{cite journal}}: Mantenimiento CS1: URL no apta ( enlace )