Organolitio
A continuación se presentan algunos métodos comunes para preparar reactivos de organolitio.
Otro sustrato que se puede reducir con litio metálico para generar reactivos de alquil-litio son los sulfuros.
Dado que el organolitio utilizado es fuertemente básico y, en consecuencia, reacciona con baja selectividad, el protón a extraer debe ser significativamente más ácido que otros protones presentes en la molécula a litiar.
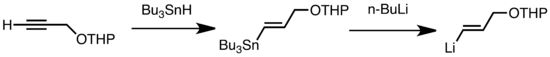
Este es el método más común para preparar reactivos de alquinil-litio, porque el hidrógeno terminal unido al carbono sp es muy ácido y se desprotona fácilmente.
[6] Algunos de los grupos sustituyentes directores más efectivos son alcoxi, amido, sulfóxido, sulfonilo.
(3)Los tipos comunes de transmetalación incluyen el intercambio Li/Sn, Li/Hg y Li/Te, que son rápidos a baja temperatura.
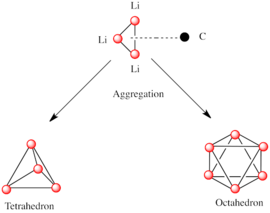
[9] Aunque las especies de alquil-litio simples a menudo se representan como monómero RLi, existen como agregados (oligómeros) o polímeros.
[10] Las electronegatividades relativas del carbono y el litio sugieren que el enlace C−Li será altamente polar.
[14][15][16] Sin embargo, ciertos compuestos de organolitio poseen propiedades como la solubilidad en solventes no polares que complican el problema.
Por ejemplo, en el metillitio, etil-litio y terc-butil-litio en estado sólido , 4 átomos de litio forman un tetraedro con cada cara tapada por un grupo metilo, etilo o terc-butilo [RLi]4 que enlaza simultáneamente con 3 átomos de litio (η3 hapticidad).
Otra clase de alquil-litio adopta estructuras hexámeras, como n-butil-litio, isopropil-litio y ciclohexanil-litio.
:[25] Como ya se ha comentado, el enlace C-Li en los reactivos de organolitio están fuertemente polarizados debido al carácter electropositivo del litio.
Como resultado, el carbono atrae la mayor parte de la densidad electrónica del enlace y se parece a un carbanión.
[27][28] Otra aplicación que aprovecha esta reactividad es la formación de compuestos carbocíclicos y heterocíclicos por carbolitiación intramolecular.
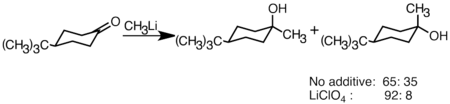
[2] Sin embargo, es menos probable que los reactivos de alquillitio reduzcan la cetona y se pueden usar para sintetizar alcoholes sustituidos.
Esta reacción proporciona cetonas cuando los reactivos de organolitio se usan en exceso, debido a la quelación del ion de litio entre el oxígeno N-metoxi y el oxígeno carbonilo, que forma un intermedio tetraédrico que colapsa con el procesamiento ácido.
Esta reactividad se aplica ampliamente en la síntesis industrial de compuestos farmacéuticos.
[41] Aunque se consideran más reactivos que los reactivos de Grignard en la alquilación, su uso todavía está limitado debido a las reacciones secundarias que compiten, como las reacciones de radicales o el intercambio metal-halógeno.
[2] Los reactivos de organolitio también pueden realizar ataques nucleofílicos con epóxidos para formar alcoholes.
El terc-butil-litio, con tres grupos alquilo dadores de electrones débiles, es la base más fuerte disponible comercialmente (pKa = 53).
Los reactivos con grupos R voluminosos, como la diisopropilamida de litio (LDA) y la bis(trimetilsilil)amida de litio (LiHMDS), a menudo tienen impedimentos estéricos para la adición nucleófila y, por lo tanto, son más selectivos para la desprotonación.
Las sulfonas metaladas, los grupos acilo y las amidas α-metaladas son intermediarios importantes en la síntesis química.
La metalación de alil éter con alquillitio o LDA forma un anión α para el oxígeno y puede proceder a la transposición 2,3-Wittig.
[43] La ortometalación dirigida es una herramienta importante en la síntesis de compuestos aromáticos sustituidos regioespecíficos.
En presencia de dos DMG, la metalación a menudo ocurre orto al grupo director más fuerte, aunque también se observan productos mixtos.
[45] La "superbase" más común se puede formar mediante la adición de KOtBu al butillitio, a menudo abreviado como reactivos "LiCKOR".
Generalmente, se utilizan bases fuertes no nucleofílicas, especialmente amidas de litio tales como LDA, LiHMDS y LiTMP.
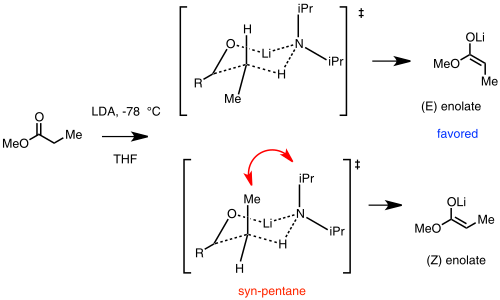
El (E)-enolato se ve favorecido debido a una interacción desfavorable sin-pentano en el estado de transición (Z)-enolato.
[50] En esta reacción, un halogenuro de arilo (comúnmente yoduro o bromuro) se intercambia con un organolitio para formar un areno litiado.
Si el areno porta una cadena lateral con un sustituyente electrofílico, el carbanión asociado al litio llevará a cabo un ataque nucleofílico intramolecular para formar una estructura cíclica nueva.