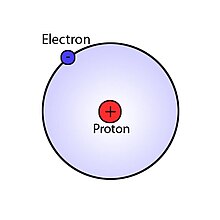
Átomo de hidrógeno
El átomo de hidrógeno es conocido también como átomo monoelectrónico, debido a que está formado por un protón que se encuentra en el núcleo del átomo y que contiene más del 99,945 % de la masa del átomo, y un solo electrón -unas 1836 veces menos masivo que el protón- que "orbita" alrededor de dicho núcleo (aunque también pueden existir átomos de hidrógeno con núcleos formados por un protón y 1 o 2 neutrones más, llamados deuterio y tritio, respectivamente).
Se puede hacer una analogía pedagógica del átomo de hidrógeno con un Sistema Solar, donde el sol sería el único Núcleo atómico y que tiene la mayor cantidad de masa -concretamente es el 99,86 % del Sistema Solar- y en su órbita tuviera un solo planeta (Electrón) que conformaría el resto de la masa del Sistema (átomo de protio (1H)).
Desde principios del siglo XX se conocía que la mecánica clásica no podía explicar ni la estructura interna del átomo, reflejada en la existencia de líneas espectrales, ni la propia existencia y estabilidad de los átomos.
La teoría clásica pronosticaba que el electrón caería sobre el núcleo atómico, haciendo que cualquier átomo como sistema físico tuviera una duración muy corta antes de que el electrón cayera sobre el núcleo atómico, al haber perdido la energía cinética en forma de radiación.
Históricamente se ha enseñado esta solución porque además de corroborar los datos experimentales con el modelo teórico cuántico de los átomos, proporciona las herramientas fundamentales de la teoría atómica actual, y provee una solución aproximada pero muy buena para los átomos más complicados.
En ese caso el problema del átomo de hidrógeno parece admitir una solución simple en la que el electrón se moviera en órbitas elípticas alrededor del núcleo atómico.
Ese proceso acabaría con el colapso del átomo sobre el núcleo en un tiempo muy corto dadas las grandes aceleraciones existentes.
El modelo atómico de Bohr era un modelo fenomenológico que explicaba satisfactoriamente algunos datos, como el orden de magnitud del radio atómico y los espectros de absorción del átomo, pero no explicaba como era posible que el electrón no emitiera radiación perdiendo energía.
La búsqueda de un modelo físicamente más motivado llevó a la formulación del modelo atómico de Schrödinger en el cual puede probarse que el valor esperado de la acelaración es nulo, y sobre esa base puede decirse que la energía electromagnética emitida debería ser también nula.
Sin embargo, la representación cuántica de Schrödinger tiene un alto coste en términos intuitivos.
En ese modelo el electrón queda descrito por una función de onda
fue justamente para que la solución fueran estos polinomios, dado que además de ser una solución conocida a la ecuación, es físicamente aceptable, la otra constante
proporciona lógicamente, dos soluciones linealmente independientes, sin embargo la otra se descarta porque la densidad de probabilidad debe ser independiente de la coordenada
además, solo puede ser un entero, y esto se debe a que
también debe ser un entero, y positivo, para que la solución a la ecuación resultante para
es claro que la ecuación queda la solución físicamente aceptable bajo esta condición es luego otra consideración asintótica,
crece mucho más rápido que los demás términos, de donde se obtiene y la solución aceptable en este caso es si ahora se supone una función
El cual es el valor esperado del radio para la función de onda en su estado fundamental,
que es un resultado coincidente con la experimentación, y además por si fuera poco con el modelo atómico de Bohr.
De la deducción anterior es fácil obtener las soluciones para cualquier átomo hidrogenoide.
Solamente es necesario considerar que en este caso el potencial electrostático se escribe donde
Si bien dicho modelo explica cualitativamente el átomo de hidrógeno y con cierta aproximación las líneas espectrales, los datos experimentales revelan que dichas líneas son algo más complicadas, y el modelo anterior es sólo una simplificación razonable.
En un átomo real los niveles energéticos anteriores y la forma de las funciones de onda debe ser modificada para dar cuenta de la interacción entre el electrón y el protón es algo más complicada debido a efectos relativistas y la existencia del espín del electrón.
Concretamente este último lleva tanto al acoplamiento entre espín y momento angular del electrón, como a la interacción entre el espín y el momento magnético del núcleo atómico.
El hamiltoniano de un átomo de hidrógeno que tenga en cuenta todos estos efectos es más complicado que el Hamiltoniano que sólo incluye el potencial central, aunque numéricamente las energías de los estados ligados son similares:
El factor corrector debido a la corrección relativista y al término de Darwin lleva a que la energía de los niveles energéticos dependa no sólo del número cuántico principal
Además posteriormente se descubrió que el efecto del momento magnético nuclear es desdoblar a su vez estas líneas en la llamada "estructura hiperfina" relacionada con el desplazamiento Lamb.
Un tratamiento similar al anterior y que da resultados similares es emplear el hamiltoniano relativista de Dirac:
Si se prescinde de la energía asociada a la masa en reposo del electrón estos niveles pueden resultan cercanos a los predichos por el hamiltoniano de Schrödinger, especialmente en el caso m = 0:
Finalmente el tercer isótopo, llamado tritio tiene un núcleo formado por dos neutrones y un protón.