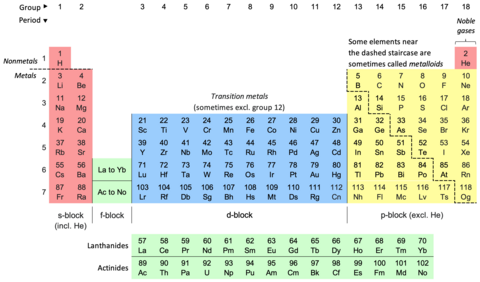
La tabla periódica , también conocida como tabla periódica de los elementos , organiza los elementos químicos en filas (" períodos ") y columnas (" grupos "). Es un ícono de la química y se usa ampliamente en física y otras ciencias. Es una descripción de la ley periódica , que dice que cuando los elementos se ordenan según su número atómico es evidente una recurrencia aproximada de sus propiedades . La mesa está dividida en cuatro áreas aproximadamente rectangulares llamadas bloques . Los elementos del mismo grupo tienden a mostrar características químicas similares.
Las tendencias verticales, horizontales y diagonales caracterizan la tabla periódica. El carácter metálico aumenta a lo largo de un grupo y disminuye de izquierda a derecha a lo largo de un período. Los caracteres no metálicos aumentan desde la parte inferior izquierda de la tabla periódica hasta la parte superior derecha.
La primera tabla periódica que fue generalmente aceptada fue la del químico ruso Dmitri Mendeleev en 1869; formuló la ley periódica como una dependencia de las propiedades químicas de la masa atómica . Como entonces no se conocían todos los elementos, había lagunas en su tabla periódica y Mendeleev utilizó con éxito la ley periódica para predecir algunas propiedades de algunos de los elementos faltantes . La ley periódica fue reconocida como un descubrimiento fundamental a finales del siglo XIX. Se explicó a principios del siglo XX, con el descubrimiento de los números atómicos y el trabajo pionero asociado en mecánica cuántica, ambas ideas sirvieron para iluminar la estructura interna del átomo. En 1945 se alcanzó una forma reconociblemente moderna de la tabla con el descubrimiento de Glenn T. Seaborg de que los actínidos eran en realidad elementos del bloque f en lugar de elementos del bloque d. La tabla periódica y las leyes son ahora una parte central e indispensable de la química moderna.
La tabla periódica continúa evolucionando con el progreso de la ciencia. En la naturaleza sólo existen elementos hasta el número atómico 94; [a] para ir más allá, era necesario sintetizar nuevos elementos en el laboratorio. Hoy en día, si bien se conocen los primeros 118 elementos, completando así las primeras siete filas de la tabla, todavía es necesaria la caracterización química de los elementos más pesados para confirmar que sus propiedades coinciden con sus posiciones. Aún no se sabe hasta dónde irá la tabla más allá de estas siete filas y si los patrones de la parte conocida de la tabla continuarán en esta región desconocida. También continúa cierta discusión científica sobre si algunos elementos están colocados correctamente en la tabla de hoy. Existen muchas representaciones alternativas de la ley periódica y existe cierta discusión sobre si existe una forma óptima de la tabla periódica.
Cada elemento químico tiene un número atómico único ( Z ) que representa el número de protones en su núcleo . [3] La mayoría de los elementos tienen múltiples isótopos , variantes con el mismo número de protones pero diferente número de neutrones . Por ejemplo, el carbono tiene tres isótopos naturales: todos sus átomos tienen seis protones y la mayoría también tiene seis neutrones, pero alrededor del uno por ciento tiene siete neutrones y una fracción muy pequeña tiene ocho neutrones. Los isótopos nunca están separados en la tabla periódica; siempre están agrupados bajo un solo elemento. Cuando se muestra la masa atómica, suele ser el promedio ponderado de los isótopos naturales; pero si no los hay, suele aparecer la masa del isótopo más estable, muchas veces entre paréntesis. [4]
En la tabla periódica estándar, los elementos se enumeran en orden creciente de número atómico Z. Una nueva fila ( período ) comienza cuando una nueva capa de electrones tiene su primer electrón. Las columnas ( grupos ) están determinadas por la configuración electrónica del átomo; Los elementos con el mismo número de electrones en un subnivel particular caen en las mismas columnas (por ejemplo, oxígeno , azufre y selenio están en la misma columna porque todos tienen cuatro electrones en el subnivel p más externo). Los elementos con propiedades químicas similares generalmente caen en el mismo grupo en la tabla periódica, aunque en el bloque f, y hasta cierto punto en el bloque d, los elementos en el mismo período también tienden a tener propiedades similares. Por tanto, es relativamente fácil predecir las propiedades químicas de un elemento si se conocen las propiedades de los elementos que lo rodean. [5]
Los primeros 94 elementos se producen de forma natural; [a] los 24 restantes, americio a oganesson (95-118), ocurren sólo cuando se sintetizan en laboratorios. De los 94 elementos naturales, 83 son primordiales y 11 se encuentran sólo en cadenas de descomposición de elementos primordiales. Algunos de estos últimos son tan raros que no fueron descubiertos en la naturaleza, pero fueron sintetizados en el laboratorio antes de que se determinara que, después de todo, existen en la naturaleza: tecnecio (elemento 43), prometio (elemento 61), astato (elemento 85), neptunio (elemento 93) y plutonio (elemento 94). [6] Nunca se ha observado ningún elemento más pesado que el einstenio (elemento 99) en cantidades macroscópicas en su forma pura, ni tampoco el astato; El francio (elemento 87) sólo ha sido fotografiado en forma de luz emitida por cantidades microscópicas (300.000 átomos). [7]
Según una convención internacional de nomenclatura, los grupos se numeran numéricamente del 1 al 18 desde la columna más a la izquierda (los metales alcalinos) hasta la columna más a la derecha (los gases nobles). Los grupos de bloques f se ignoran en esta numeración. [8] Los grupos también pueden denominarse por su primer elemento, por ejemplo, "grupo escandio" para el grupo 3. [8] Anteriormente, los grupos se conocían por números romanos . En Estados Unidos, los números romanos iban seguidos de una "A" si el grupo estaba en el bloque s o p , o de una "B" si el grupo estaba en el bloque d . Los números romanos utilizados corresponden al último dígito de la convención de nomenclatura actual (por ejemplo, los elementos del grupo 4 eran el grupo IVB y los elementos del grupo 14 eran el grupo IVA). En Europa, las letras eran similares, excepto que "A" se usaba para los grupos 1 a 7, y "B" para los grupos 11 a 17. Además, los grupos 8, 9 y 10 solían ser tratados como un triple. grupo de tamaño, conocido colectivamente en ambas notaciones como grupo VIII. En 1988, se puso en uso el nuevo sistema de denominación de la IUPAC (Unión Internacional de Química Pura y Aplicada) (1-18) y los antiguos nombres de grupo (I-VIII) quedaron obsoletos. [9]
32 columnas
18 columnas
Por razones de espacio, [16] [17] la tabla periódica se presenta comúnmente con los elementos del bloque f recortados y colocados como una parte distinta debajo del cuerpo principal. [18] [16] [9] Esto reduce el número de columnas de elementos de 32 a 18. [16]
Ambas formas representan la misma tabla periódica. [19] El formulario con el bloque f incluido en el cuerpo principal a veces se denomina formulario de 32 columnas [19] o formulario largo; [20] el formulario con el bloque f recorta el formulario de 18 columnas [19] o de longitud media. [20] El formulario de 32 columnas tiene la ventaja de mostrar todos los elementos en su secuencia correcta, pero tiene la desventaja de requerir más espacio. [21] La forma elegida es una elección editorial y no implica ningún cambio de afirmación o declaración científica. Por ejemplo, cuando se discute la composición del grupo 3 , las opciones se pueden mostrar por igual (sin prejuicios) en ambas formas. [22]
Las tablas periódicas suelen mostrar al menos los símbolos de los elementos; muchos también proporcionan información complementaria sobre los elementos, ya sea mediante códigos de colores o como datos en las celdas. La tabla anterior muestra los nombres y números atómicos de los elementos, y también sus bloques, ocurrencias naturales y pesos atómicos estándar . Para los elementos de vida corta sin pesos atómicos estándar, se utiliza en su lugar el número másico del isótopo conocido más estable. Otras tablas pueden incluir propiedades como el estado de la materia, puntos de fusión y ebullición, densidades, además de proporcionar diferentes clasificaciones de los elementos. [b]

Los constituyentes más pequeños de toda la materia normal se conocen como átomos . Los átomos son extremadamente pequeños, miden aproximadamente una diezmilmillonésima parte de un metro de diámetro; por tanto, su estructura interna está regida por la mecánica cuántica . [23] Los átomos constan de un pequeño núcleo cargado positivamente , formado por protones cargados positivamente y neutrones sin carga , rodeado por una nube de electrones cargados negativamente ; las cargas se cancelan, por lo que los átomos son neutros. [24] Los electrones participan en reacciones químicas , pero el núcleo no. [24] Cuando los átomos participan en reacciones químicas, ganan o pierden electrones para formar iones cargados positiva o negativamente ; o compartir electrones entre sí. [18]
Los átomos se pueden subdividir en diferentes tipos según el número de protones (y por tanto también de electrones) que tienen. [24] Esto se llama número atómico , a menudo simbolizado Z [25] (para "Zahl", en alemán "número"). Cada número atómico distinto corresponde, por tanto, a una clase de átomo: estas clases se denominan elementos químicos . [26] Los elementos químicos son los que clasifica y organiza la tabla periódica. El hidrógeno es el elemento de número atómico 1; helio , número atómico 2; litio , número atómico 3; etcétera. Cada uno de estos nombres puede abreviarse mediante un símbolo químico de una o dos letras ; los del hidrógeno, el helio y el litio son, respectivamente, H, He y Li. [19] Los neutrones no afectan la identidad química del átomo, pero sí afectan su peso. Los átomos con el mismo número de protones pero diferente número de neutrones se denominan isótopos de un mismo elemento químico. [19] Los elementos naturales generalmente se presentan como mezclas de diferentes isótopos; Dado que cada isótopo suele presentarse con una abundancia característica, los elementos naturales tienen pesos atómicos bien definidos , definidos como la masa promedio de un átomo natural de ese elemento. [27]
Hoy en día se conocen 118 elementos, de los cuales se sabe que los primeros 94 se encuentran de forma natural en la Tierra en la actualidad. [28] [a] De los 94 elementos naturales, ochenta tienen un isótopo estable y uno más ( bismuto ) tiene un isótopo casi estable (con una vida media de 2,01×10 19 años, más de mil millones de veces la edad del universo ). [31] [c] Dos más, el torio y el uranio , tienen isótopos que experimentan desintegración radiactiva con una vida media comparable a la edad de la Tierra . Los elementos estables más bismuto, torio y uranio constituyen los 83 elementos primordiales que sobrevivieron desde la formación de la Tierra. [d] Los once elementos naturales restantes se desintegran lo suficientemente rápido como para que su aparición continua de rastros dependa principalmente de su regeneración constante como productos intermedios de la desintegración del torio y el uranio. [e] Los 24 elementos artificiales conocidos son radiactivos. [19]
La tabla periódica es una descripción gráfica de la ley periódica, [37] que establece que las propiedades y estructuras atómicas de los elementos químicos son función periódica de su número atómico . [38] Los elementos se colocan en la tabla periódica de acuerdo con sus configuraciones electrónicas , [39] cuyas recurrencias periódicas explican las tendencias en las propiedades a lo largo de la tabla periódica. [40]
Se puede pensar que un electrón habita en un orbital atómico , lo que caracteriza la probabilidad de que se pueda encontrar en cualquier región particular alrededor del átomo. Sus energías están cuantificadas , es decir, que sólo pueden tomar valores discretos. Además, los electrones obedecen el principio de exclusión de Pauli : electrones diferentes siempre deben estar en estados diferentes. Esto permite clasificar los posibles estados que puede adoptar un electrón en varios niveles de energía conocidos como capas, divididos en subcapas individuales, cada una de las cuales contiene uno o más orbitales. Cada orbital puede contener hasta dos electrones: se distinguen por una cantidad conocida como espín , convencionalmente denominada "arriba" o "abajo". [41] [f] En un átomo frío (uno en su estado fundamental), los electrones se organizan de tal manera que la energía total que tienen se minimiza al ocupar los orbitales de menor energía disponibles. [43] Sólo los electrones más externos (los llamados electrones de valencia ) tienen suficiente energía para liberarse del núcleo y participar en reacciones químicas con otros átomos. Los demás se llaman electrones centrales . [44]
Se conocen elementos con hasta las primeras siete conchas ocupadas. La primera capa contiene sólo un orbital, un orbital s esférico. Como ocurre en la primera capa, esto se llama orbital 1s. Este puede contener hasta dos electrones. La segunda capa contiene de manera similar un orbital 2s y también tres orbitales 2p en forma de mancuerna, por lo que puede llenar hasta ocho electrones (2×1 + 2×3 = 8). La tercera capa contiene un orbital 3s, tres orbitales 3p y cinco orbitales 3d, por lo que tiene una capacidad de 2×1 + 2×3 + 2×5 = 18. La cuarta capa contiene un orbital 4s, tres orbitales 4p, cinco orbitales 4d y siete orbitales 4f, lo que lleva a una capacidad de 2×1 + 2×3 + 2×5 + 2×7 = 32. [16] Las capas superiores contienen más tipos de orbitales que continúan el patrón, pero esos tipos de orbitales no se llenan en los estados fundamentales de elementos conocidos. [46] Los tipos de subcapa se caracterizan por los números cuánticos . Cuatro números describen completamente un orbital en un átomo: el número cuántico principal n , el número cuántico azimutal ℓ (el tipo de orbital), el número cuántico magnético m ℓ y el número cuántico de espín s . [40]

La secuencia en la que se llenan las subcapas viene dada en la mayoría de los casos por el principio de Aufbau , también conocido como regla de Madelung o Klechkovsky (en honor a Erwin Madelung y Vsevolod Klechkovsky respectivamente). Esta regla fue observada empíricamente por primera vez por Madelung, y Klechkovsky y autores posteriores le dieron una justificación teórica. [47] [48] [49] [50] Las conchas se superponen en energías, y la regla de Madelung especifica la secuencia de llenado según: [48]
Aquí el signo ≪ significa "mucho menos que" en contraposición a < que significa simplemente "menos que". [48] Dicho de otra manera, los electrones ingresan a los orbitales en orden creciente n + ℓ, y si hay dos orbitales disponibles con el mismo valor de n + ℓ, el que tiene n más bajo se ocupa primero. [46] [50] En general, los orbitales con el mismo valor de n + ℓ son similares en energía, pero en el caso de los orbitales s (con ℓ = 0), los efectos cuánticos elevan su energía para acercarse a la del siguiente. norte + ℓ grupo. Por lo tanto, la tabla periódica generalmente se dibuja para comenzar cada fila (a menudo llamada período) con el llenado de un nuevo orbital s, que corresponde al comienzo de una nueva capa. [48] [49] [16] Así, con la excepción de la primera fila, la duración de cada período aparece dos veces: [48]
Las superposiciones se acercan bastante en el punto donde los orbitales d entran en escena, [51] y el orden puede cambiar ligeramente con el número atómico [52] y la carga atómica. [53] [g]
Partiendo del átomo más simple, esto nos permite construir la tabla periódica uno a la vez en orden de número atómico, considerando los casos de átomos individuales. En el hidrógeno , solo hay un electrón, que debe ir en los orbitales 1 de menor energía. Esta configuración electrónica se escribe 1s 1 , donde el superíndice indica el número de electrones en la subcapa. El helio añade un segundo electrón, que también entra en 1s, llenando completamente la primera capa y dando la configuración 1s 2 . [40] [59] [h]
A partir del tercer elemento, el litio , la primera capa está llena, por lo que su tercer electrón ocupa un orbital 2s, dando una configuración 1s 2 2s 1 . El electrón 2s es el único electrón de valencia del litio, ya que la subcapa 1s está ahora demasiado unida al núcleo para participar en enlaces químicos con otros átomos. Por lo tanto, la primera capa llena se denomina " capa central " para este y todos los elementos más pesados. La subcapa 2s se completa con el siguiente elemento berilio (1s 2 2s 2 ). Los siguientes elementos luego proceden a llenar el subnivel 2p. El boro (1s 2 2s 2 2p 1 ) coloca su nuevo electrón en un orbital 2p; el carbono (1s 2 2s 2 2p 2 ) llena un segundo orbital 2p; y con nitrógeno (1s 2 2s 2 2p 3 ) los tres orbitales 2p quedan ocupados individualmente. Esto es consistente con la regla de Hund , que establece que los átomos generalmente prefieren ocupar individualmente cada orbital del mismo tipo antes de llenarlos con el segundo electrón. Oxígeno (1s 2 2s 2 2p 4 ), flúor (1s 2 2s 2 2p 5 ) y neón (1s 2 2s 2 2p 6 ) luego completan los orbitales 2p ya llenos individualmente; el último de ellos llena completamente el segundo caparazón. [40] [59]
A partir del elemento 11, sodio , la segunda capa está llena, lo que la convierte en una capa central para este y todos los elementos más pesados. El undécimo electrón comienza el llenado de la tercera capa ocupando un orbital 3s, dando una configuración de 1s 2 2s 2 2p 6 3s 1 para el sodio. Esta configuración se abrevia [Ne] 3s 1 , donde [Ne] representa la configuración del neón. El magnesio ([Ne] 3s 2 ) termina este orbital 3s, y los siguientes seis elementos aluminio , silicio , fósforo , azufre , cloro y argón llenan los tres orbitales 3p ([Ne] 3s 2 3p 1 a través de [Ne] 3s 2 3p 6 ). [40] [59] Esto crea una serie análoga en la que las estructuras de la capa exterior del sodio al argón son análogas a las del litio al neón, y es la base de la periodicidad de las propiedades químicas que ilustra la tabla periódica: [40] en intervalos regulares pero cambiantes de números atómicos, las propiedades de los elementos químicos se repiten aproximadamente. [37]
Por tanto, los primeros dieciocho elementos pueden organizarse como el comienzo de una tabla periódica. Los elementos de la misma columna tienen el mismo número de electrones de valencia y configuraciones electrónicas de valencia análogas: estas columnas se denominan grupos. La única excepción es el helio, que tiene dos electrones de valencia como el berilio y el magnesio, pero normalmente se coloca en la columna de neón y argón para enfatizar que su capa exterior está llena. (Algunos autores contemporáneos cuestionan incluso esta única excepción, prefiriendo seguir consistentemente las configuraciones de valencia y colocar el helio sobre el berilio). Hay ocho columnas en este fragmento de la tabla periódica, que corresponden como máximo a ocho electrones de la capa externa. [18] Un período comienza cuando una nueva capa comienza a llenarse. [16] Finalmente, la coloración ilustra los bloques : los elementos del bloque s (de color rojo) son orbitales s de relleno, mientras que los del bloque p (de color amarillo) son orbitales p de relleno. [dieciséis]
Comenzando la siguiente fila, para el potasio y el calcio , la subcapa 4s es la más baja en energía y, por lo tanto, la llenan. [40] [59] El potasio agrega un electrón a la capa 4s ([Ar] 4s 1 ) y luego el calcio lo completa ([Ar] 4s 2 ). Sin embargo, a partir del escandio ([Ar] 3d 1 4s 2 ), la subcapa 3d se convierte en la siguiente en energía. Las subcapas 4s y 3d tienen aproximadamente la misma energía y compiten por llenar los electrones, por lo que la ocupación no es llenar de manera consistente los orbitales 3d uno a la vez. El orden preciso de la energía de 3d y 4s cambia a lo largo de la fila y también cambia dependiendo de cuántos electrones se eliminan del átomo. Por ejemplo, debido a la repulsión entre los electrones 3d y los 4s, en el cromo el nivel de energía 4s se vuelve ligeramente superior al 3d, por lo que resulta más rentable tener una configuración [Ar] 3d 5 4s 1 que una [Ar] 3d 4 4s 2 uno. Una anomalía similar ocurre en el cobre . [40] Se trata de violaciones de la norma Madelung. Tales anomalías, sin embargo, no tienen ningún significado químico: [53] la mayor parte de la química no se trata de átomos gaseosos aislados, [61] y las diversas configuraciones son tan cercanas en energía entre sí [51] que la presencia de un átomo cercano puede cambiar el equilibrio. [40] Por lo tanto, la tabla periódica los ignora y considera solo configuraciones idealizadas. [39]
En el zinc ([Ar] 3d 10 4s 2 ), los orbitales 3d están completamente llenos con un total de diez electrones. [40] [59] A continuación vienen los orbitales 4p, completando la fila, que se van llenando progresivamente de galio ([Ar] 3d 10 4s 2 4p 1 ) hasta criptón ([Ar] 3d 10 4s 2 4p 6 ), de manera análogo a los elementos del bloque p anteriores. [40] [59] A partir del galio, los orbitales 3d forman parte del núcleo electrónico y ya no participan en la química. [58] Los elementos de los bloques s y p, que llenan sus capas exteriores, se denominan elementos del grupo principal ; los elementos del bloque d (de color azul abajo), que llenan una capa interna, se denominan elementos de transición (o metales de transición, ya que todos son metales). [62]
Los siguientes dieciocho elementos llenan los orbitales 5s ( rubidio y estroncio ), luego 4d ( itrio a cadmio , nuevamente con algunas anomalías en el camino), y luego 5p ( indio a xenón ). [16] [59] Nuevamente, desde el indio en adelante, los orbitales 4d están en el núcleo. [59] [63] Por lo tanto, la quinta fila tiene la misma estructura que la cuarta. [dieciséis]
La sexta fila de la tabla comienza también con dos elementos del bloque S: cesio y bario . [59] Después de esto, los primeros elementos del bloque f (de color verde a continuación) comienzan a aparecer, comenzando con el lantano . A veces se les denomina elementos de transición internos. [62] Como ahora no sólo hay subcapas 4f sino también 5d y 6s con energías similares, la competencia se produce una vez más con muchas configuraciones irregulares; [51] Esto dio lugar a cierta disputa sobre dónde exactamente se supone que comienza el bloque F, pero la mayoría de los que estudian el asunto coinciden en que comienza en el lantano de acuerdo con el principio de Aufbau. [13] Aunque el lantano no llena la subcapa 4f como un solo átomo, debido a la repulsión entre electrones, [53] sus orbitales 4f tienen suficiente energía para participar en la química. [64] [54] [65] En el iterbio , los siete orbitales 4f están completamente llenos con catorce electrones; a partir de entonces, sigue una serie de diez elementos de transición ( lutecio a través de mercurio ), [59] [66] [67] [68] y finalmente seis elementos del grupo principal ( talio a través de radón ) completan el período. [59] [69] A partir del lutecio en adelante, los orbitales 4f están en el núcleo, [59] [65] y a partir del talio en adelante también lo están los orbitales 5d. [59] [58] [70]
La séptima fila es análoga a la sexta fila: 7s se llena ( francio y radio ), luego 5f ( actinio a nobelio ), luego 6d ( lawrencio a copernicio ) y finalmente 7p ( nihonio a oganesson ). [59] A partir de lawrencium, los orbitales 5f están en el núcleo, [59] y probablemente los orbitales 6d se unen al núcleo a partir de nihonium. [59] [71] [i] Nuevamente hay algunas anomalías en el camino: [16] por ejemplo, como átomos individuales ni el actinio ni el torio realmente llenan la subcapa 5f, y lawrencio no llena la capa 6d, pero todos estos Las subcapas todavía pueden llenarse en ambientes químicos. [73] [74] [75] Durante mucho tiempo, la séptima fila estuvo incompleta ya que la mayoría de sus elementos no se encuentran en la naturaleza. Los elementos que faltaban más allá del uranio comenzaron a sintetizarse en el laboratorio en 1940, cuando se fabricó el neptunio. [76] La fila se completó con la síntesis de tennessine en 2010 [77] (el último elemento oganesson ya se había realizado en 2002), [78] y los últimos elementos de esta séptima fila recibieron nombres en 2016. [79]
Esto completa la tabla periódica moderna, con las siete filas completamente llenas. [79]
La siguiente tabla muestra la configuración electrónica de un átomo neutro en fase gaseosa de cada elemento. Se pueden favorecer diferentes configuraciones en diferentes entornos químicos. [53] Los elementos del grupo principal tienen configuraciones electrónicas completamente regulares; los elementos de transición y de transición interior muestran veinte irregularidades debido a la competencia antes mencionada entre subcapas cercanas en nivel de energía. Para los últimos diez elementos (109-118), faltan datos experimentales [80] y, por lo tanto, en su lugar se muestran configuraciones calculadas. [81] Los subniveles completamente llenos se han atenuado.
Aunque la tabla periódica moderna es estándar hoy en día, la ubicación de los elementos del período 1, hidrógeno y helio, sigue siendo un tema abierto en discusión, y se pueden encontrar algunas variaciones. [58] [82] Siguiendo sus respectivas configuraciones electrónicas s 1 y s 2 , el hidrógeno se colocaría en el grupo 1 y el helio en el grupo 2. [58] La ubicación del hidrógeno en el grupo 1 es común, pero el helio es casi siempre colocado en el grupo 18 con los demás gases nobles. [19] El debate tiene que ver con interpretaciones contradictorias sobre hasta qué punto las propiedades químicas o electrónicas deberían decidir la ubicación de la tabla periódica. [82]
Al igual que los metales del grupo 1, el hidrógeno tiene un electrón en su capa más externa [83] y normalmente pierde su único electrón en reacciones químicas. [84] El hidrógeno tiene algunas propiedades químicas similares a las de los metales, siendo capaz de desplazar algunos metales de sus sales . [84] Pero forma un gas diatómico no metálico en condiciones estándar, a diferencia de los metales alcalinos que son metales sólidos reactivos. Esto y la formación de hidruros por parte del hidrógeno , en los que gana un electrón, lo acerca a las propiedades de los halógenos que hacen lo mismo [84] (aunque es más raro que el hidrógeno forme H − que H + ). [85] Además, los dos halógenos más ligeros ( flúor y cloro ) son gaseosos como el hidrógeno en condiciones estándar. [84] Algunas propiedades del hidrógeno no encajan bien en ninguno de los grupos: el hidrógeno no es ni altamente oxidante ni altamente reductor y no reacciona con el agua. [85] Por lo tanto, el hidrógeno tiene propiedades que corresponden tanto a las de los metales alcalinos como a las de los halógenos, pero no coincide perfectamente con ninguno de los grupos y, por lo tanto, es difícil de ubicar por su química. [84] Por lo tanto, si bien predomina la ubicación electrónica del hidrógeno en el grupo 1, algunas disposiciones más raras muestran hidrógeno en el grupo 17, [86] hidrógeno duplicado en ambos grupos 1 y 17, [87] [88] o lo hacen flotar por separado de todos grupos. [88] [89] [58] Sin embargo, esta última opción ha sido criticada por el químico y filósofo de la ciencia Eric Scerri con el argumento de que parece implicar que el hidrógeno está por encima de la ley periódica, a diferencia de todos los demás elementos. [90]
El helio es el único elemento que ocupa habitualmente una posición en la tabla periódica que no es coherente con su estructura electrónica. Tiene dos electrones en su capa más externa, mientras que los demás gases nobles tienen ocho; y es un elemento del bloque s, mientras que todos los demás gases nobles son elementos del bloque p. Sin embargo, no es reactivo en condiciones estándar y tiene una capa exterior completa: estas propiedades son como las de los gases nobles del grupo 18, pero no se parecen en nada a los metales alcalinotérreos reactivos del grupo 2. Por estas razones, el helio se ubica casi universalmente en el grupo 18 [19] cuál coincide mejor con sus propiedades; [58] La IUPAC rechazó en 1988 una propuesta para trasladar el helio al grupo 2 por estos motivos. [9] Sin embargo, el helio todavía se ubica ocasionalmente en el grupo 2 hoy en día, [91] y algunas de sus propiedades físicas y químicas están más cerca de los elementos del grupo 2 y respaldan la ubicación electrónica. [83] [58] El helio sólido cristaliza en una estructura hexagonal compacta , que coincide con el berilio y el magnesio en el grupo 2, pero no con los otros gases nobles del grupo 18. [92] Desarrollos teóricos recientes en la química de los gases nobles, en los que el helio se espera que muestre una inercia ligeramente menor que el neón y forme (HeO)(LiF) 2 con una estructura similar al compuesto análogo de berilio (pero sin un análogo de neón esperado), lo que ha dado lugar a que más químicos aboguen por colocar el helio en el grupo 2. Esto se relaciona con el argumento electrónico, ya que la razón de la mayor inercia del neón es la repulsión de su capa p llena de la que carece el helio, aunque siendo realistas es poco probable que las moléculas que contienen helio sean estables fuera de condiciones de temperaturas extremadamente bajas (alrededor de 10 K) . ). [93] [94] [95] [96]
Además, se ha citado la anomalía de la primera fila en la tabla periódica para respaldar el movimiento del helio al grupo 2. Surge porque el primer orbital de cualquier tipo es inusualmente pequeño, ya que a diferencia de sus análogos superiores, no experimenta repulsión interelectrónica desde un orbital más pequeño. del mismo tipo. Esto hace que la primera fila de elementos de cada bloque sea inusualmente pequeña, y dichos elementos tienden a exhibir tipos de anomalías características de su grupo. Algunos químicos que defienden el reposicionamiento del helio han señalado que el helio presenta estas anomalías si se coloca en el grupo 2, pero no si se coloca en el grupo 18: en cambio, el neón, que sería el primer elemento del grupo 18 si se eliminó el helio de ese lugar, presenta esas anomalías. [93] Luego se argumenta que la relación entre helio y berilio se parece a la que existe entre hidrógeno y litio, una ubicación que es mucho más comúnmente aceptada. [94] Por ejemplo, debido a esta tendencia en los tamaños de los orbitales, se observa una gran diferencia en los radios atómicos entre el primer y segundo miembro de cada grupo principal en los grupos 1 y 13-17: existe entre neón y argón, y entre helio y berilio, pero no entre helio y neón. Esto afecta de manera similar a los puntos de ebullición y solubilidades de los gases nobles en agua, donde el helio está demasiado cerca del neón, y la gran diferencia característica entre los dos primeros elementos de un grupo aparece sólo entre el neón y el argón. Mover el helio al grupo 2 hace que esta tendencia sea consistente también en los grupos 2 y 18, al hacer del helio el primer elemento del grupo 2 y el neón el primer elemento del grupo 18: ambos exhiben las propiedades características de un primer elemento kainosimétrico de un grupo. [97] [98] No obstante, la colocación de helio en el grupo 18 sigue siendo casi universal debido a su extrema inercia. [99] Además, rara vez se encuentran mesas que hacen flotar tanto hidrógeno como helio fuera de todos los grupos. [89] [58] [59]
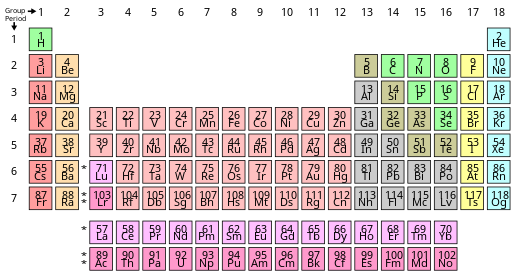
En muchas tablas periódicas, el bloque f se desplaza un elemento hacia la derecha, de modo que el lantano y el actinio se convierten en elementos del bloque d en el grupo 3, y Ce-Lu y Th-Lr forman el bloque f. Así, el bloque d se divide en dos porciones muy desiguales. Este es un vestigio de las primeras mediciones erróneas de configuraciones electrónicas; Las mediciones modernas son más consistentes con la forma con lutecio y lawrencio en el grupo 3, y con La – Yb y Ac – No como bloque f. [11] [100]
La capa 4f está completamente llena en el iterbio, y por esta razón Lev Landau y Evgeny Lifshitz en 1948 consideraron incorrecto agrupar el lutecio como un elemento del bloque f. [12] Todavía no dieron el paso de eliminar el lantano del bloque d también, pero Jun Kondō se dio cuenta en 1963 de que la superconductividad a baja temperatura del lantano implicaba la actividad de su capa 4f. [101] En 1965, David C. Hamilton vinculó esta observación a su posición en la tabla periódica y argumentó que el bloque f debería estar compuesto por los elementos La – Yb y Ac – No. [64] Desde entonces, la evidencia física, química y electrónica ha respaldado esta asignación. [11] [9] [100] William B. Jensen llamó ampliamente la atención sobre el tema en 1982, [11] y la reasignación de lutecio y lawrencio al grupo 3 fue respaldada por informes de la IUPAC que datan de 1988 (cuando el 1– Se recomendaron 18 números de grupo) [9] y 2021. [10] No obstante, la variación todavía existe porque la mayoría de los escritores de libros de texto no son conscientes del problema. [11]
A veces se puede encontrar una tercera forma en la que los espacios debajo del itrio en el grupo 3 se dejan vacíos, como la tabla que aparece en el sitio web de la IUPAC, [19] pero esto crea una inconsistencia con la mecánica cuántica al hacer que el bloque f tenga 15 elementos. de ancho (La – Lu y Ac – Lr) aunque solo caben 14 electrones en una subcapa f. [10] Además, existe cierta confusión en la literatura sobre qué elementos se supone que están en el grupo 3. [10] [ 20] [102] [103] [104] Si bien el informe de la IUPAC de 2021 señaló que 15 elementos en todo el grupo Los bloques f cuentan con el apoyo de algunos practicantes de una rama especializada de la mecánica cuántica relativista que se centra en las propiedades de los elementos superpesados , la opinión del proyecto fue que tales preocupaciones dependientes de los intereses no deberían tener ninguna relación con la forma en que se presenta la tabla periódica al "general". comunidad química y científica". [10] De hecho, los cálculos relativistas de la mecánica cuántica de los compuestos Lu y Lr no encontraron orbitales f de valencia en ninguno de los elementos. [75] Otros autores que se centran en elementos superpesados desde entonces aclararon que la "entrada 15 del bloque f representa la primera ranura del bloque d que queda vacante para indicar el lugar de las inserciones del bloque f", lo que implicaría que esta forma todavía tiene lutecio y lawrencio (las decimoquintas entradas en cuestión) como elementos del bloque d en el grupo 3. [105] De hecho, cuando las publicaciones de la IUPAC amplían la tabla a 32 columnas, dejan esto claro y colocan el lutecio y el lawrencio debajo del itrio en grupo 3. [106] [107]
En la literatura se pueden encontrar varios argumentos a favor de Sc-Y-La-Ac, [108] [109] pero han sido cuestionados por ser lógicamente inconsistentes. [13] [14] [15] Por ejemplo, se ha argumentado que el lantano y el actinio no pueden ser elementos del bloque f porque, como átomos individuales en fase gaseosa, no han comenzado a llenar las subcapas f. [110] Pero lo mismo ocurre con el torio, que nunca se cuestiona como elemento del bloque f, [10] [11] y este argumento pasa por alto el problema del otro extremo: que las capas f se llenan completamente en el iterbio y el nobelio, coincidiendo con la forma Sc-Y-Lu-Lr, y no en lutecio y lawrencio como lo tendría la forma Sc-Y-La-Ac. [111] Estas configuraciones excepcionales no sólo son minoritarias, [111] sino que, en cualquier caso, nunca han sido consideradas relevantes para posicionar otros elementos en la tabla periódica: en los átomos gaseosos, las capas d completan su llenado en cobre, paladio y oro, pero los químicos aceptan universalmente que estas configuraciones son excepcionales y que el bloque d realmente termina de acuerdo con la regla de Madelung en zinc, cadmio y mercurio. [20] El hecho relevante para la ubicación [39] [66] es que el lantano y el actinio (como el torio) tienen orbitales f de valencia que pueden ocuparse en ambientes químicos, mientras que el lutecio y el lawrencio no los tienen: [59] [112] sus Los caparazones f están en el núcleo y no se pueden utilizar para reacciones químicas. [65] [113] Por lo tanto, la relación entre itrio y lantano es sólo una relación secundaria entre elementos con el mismo número de electrones de valencia pero diferentes tipos de orbitales de valencia, como la que existe entre el cromo y el uranio; mientras que la relación entre el itrio y el lutecio es primaria, compartiendo tanto el recuento de electrones de valencia como el tipo de orbital de valencia. [59]
Como las reacciones químicas involucran a los electrones de valencia, [18] se puede esperar que elementos con configuraciones electrónicas externas similares reaccionen de manera similar y formen compuestos con proporciones similares de elementos en ellos. [114] Dichos elementos se colocan en el mismo grupo y, por lo tanto, tienden a haber claras similitudes y tendencias en el comportamiento químico a medida que uno avanza en un grupo. [115] Como configuraciones análogas ocurren a intervalos regulares, las propiedades de los elementos exhiben recurrencias periódicas, de ahí el nombre de tabla periódica y ley periódica. Estas recurrencias periódicas se advirtieron mucho antes de que se desarrollara la teoría subyacente que las explica. [116] [117]
Históricamente, el tamaño físico de los átomos se desconocía hasta principios del siglo XX. La primera estimación calculada del radio atómico del hidrógeno fue publicada por el físico Arthur Haas en 1910 dentro de un orden de magnitud (un factor de 10) del valor aceptado, el radio de Bohr (~0,529 Å). En su modelo, Haas utilizó una configuración de un solo electrón basada en el modelo atómico clásico propuesto por JJ Thomson en 1904, a menudo llamado modelo del pudín de pasas . [118]
Los radios atómicos (el tamaño de los átomos) dependen del tamaño de sus orbitales más externos. [97] Generalmente disminuyen de izquierda a derecha a lo largo de los elementos del grupo principal, porque la carga nuclear aumenta pero los electrones externos todavía están en la misma capa. Sin embargo, al descender por una columna, los radios generalmente aumentan, porque los electrones más externos se encuentran en capas superiores y, por tanto, más alejadas del núcleo. [18] [119] La primera fila de cada bloque es anormalmente pequeña, debido a un efecto llamado kainosimetría o repulsión primogénica: [120] los subniveles 1s, 2p, 3d y 4f no tienen análogos internos. Por ejemplo, los orbitales 2p no experimentan una fuerte repulsión por parte de los orbitales 1s y 2s, que tienen distribuciones de carga angulares bastante diferentes y, por tanto, no son muy grandes; pero los orbitales 3p experimentan una fuerte repulsión por parte de los orbitales 2p, que tienen distribuciones de carga angular similares. Por lo tanto, las subcapas superiores s, p, d y f experimentan una fuerte repulsión de sus análogos internos, que tienen aproximadamente la misma distribución angular de carga, y deben expandirse para evitar esto. Esto hace que surjan diferencias significativas entre los elementos 2p pequeños, que prefieren enlaces múltiples , y los elementos 3p más grandes y p superiores, que no lo hacen. [97] Surgen anomalías similares para los elementos 1s, 2p, 3d, 4f y el hipotético 5g: [121] el grado de esta anomalía de la primera fila es mayor para el bloque s, es moderado para el bloque p y es menos pronunciado para los bloques d y f. [122]
En los elementos de transición se llena una capa interna, pero el tamaño del átomo todavía está determinado por los electrones externos. El aumento de la carga nuclear a lo largo de la serie y el mayor número de electrones internos para el blindaje se compensan en cierta medida entre sí, por lo que la disminución del radio es menor. [119] Los átomos 4p y 5d, que aparecen inmediatamente después de que se introducen por primera vez nuevos tipos de series de transición, son más pequeños de lo que se hubiera esperado, [123] porque las subcapas centrales 3d y 4f agregadas solo proporcionan un blindaje incompleto de la carga nuclear para la electrones exteriores. Por tanto, por ejemplo, los átomos de galio son ligeramente más pequeños que los átomos de aluminio. [97] Junto con la kainosimetría, esto da como resultado una diferencia par-impar entre los períodos (excepto en el bloque s) [j] que a veces se conoce como periodicidad secundaria: los elementos en períodos pares tienen radios atómicos más pequeños y prefieren perder menos electrones, mientras que los elementos en períodos impares (excepto el primero) difieren en la dirección opuesta. Así, por ejemplo, muchas propiedades en el bloque p muestran una tendencia en zigzag en lugar de una tendencia suave a lo largo del grupo. Por ejemplo, el fósforo y el antimonio en períodos impares del grupo 15 alcanzan fácilmente el estado de oxidación +5, mientras que el nitrógeno, el arsénico y el bismuto en períodos pares prefieren permanecer en +3. [122] [124] Una situación similar se aplica al bloque d, donde los átomos de lutecio a tungsteno son ligeramente más pequeños que los de itrio a molibdeno, respectivamente. [125] [126]

Los átomos de talio y plomo son aproximadamente del mismo tamaño que los átomos de indio y estaño respectivamente, pero desde el bismuto hasta el radón los átomos 6p son más grandes que los átomos análogos 5p. Esto sucede porque cuando los núcleos atómicos se cargan mucho, se necesita la relatividad especial para medir el efecto del núcleo sobre la nube de electrones. Estos efectos relativistas dan como resultado que los elementos pesados tengan propiedades cada vez más diferentes en comparación con sus homólogos más ligeros en la tabla periódica. La interacción espín-órbita divide la subcapa p: un orbital p está estabilizado y encogido relativistamente (se rellena con talio y plomo), pero los otros dos (que se rellenan con bismuto a través del radón) se desestabilizan y expanden relativistamente. [97] Los efectos relativistas también explican por qué el oro es dorado y el mercurio es líquido a temperatura ambiente. [127] [128] Se espera que se vuelvan muy fuertes a finales del séptimo período, lo que podría conducir a un colapso de la periodicidad. [129] Las configuraciones electrónicas solo se conocen claramente hasta el elemento 108 ( hasio ), y la química experimental más allá de 108 solo se ha realizado para 112 ( copernicio ), 113 ( nihonio ) y 114 ( flerovio ), por lo que la caracterización química de los elementos más pesados sigue siendo un tema de investigación actual. [130]
La tendencia a que los radios atómicos disminuyan de izquierda a derecha también está presente en los radios iónicos , aunque es más difícil de examinar porque los iones más comunes de elementos consecutivos normalmente difieren en carga. Los iones con la misma configuración electrónica disminuyen de tamaño a medida que aumenta su número atómico, debido al aumento de la atracción del núcleo más cargado positivamente: así, por ejemplo, los radios iónicos disminuyen en la serie Se 2− , Br − , Rb + , Sr 2+ , Y. 3+ , Zr 4+ , Nb 5+ , Mo 6+ , Tc 7+ . Los iones del mismo elemento se vuelven más pequeños a medida que se eliminan más electrones, porque la atracción del núcleo comienza a superar la repulsión entre los electrones que hace que las nubes de electrones se expandan: así, por ejemplo, los radios iónicos disminuyen en la serie V 2+ , V 3+ , V4 + , V5 + . [131]

La primera energía de ionización de un átomo es la energía necesaria para quitarle un electrón. Esto varía con el radio atómico: la energía de ionización aumenta de izquierda a derecha y de abajo hacia arriba, porque los electrones que están más cerca del núcleo están más apretados y son más difíciles de eliminar. De este modo, la energía de ionización se minimiza en el primer elemento de cada período (el hidrógeno y los metales alcalinos ) y luego generalmente aumenta hasta alcanzar el gas noble en el borde derecho del período. [18] Hay algunas excepciones a esta tendencia, como el oxígeno, donde el electrón que se elimina está emparejado y, por lo tanto, la repulsión interelectrónica hace que la eliminación sea más fácil de lo esperado. [132]
En la serie de transición, los electrones externos se pierden preferentemente aunque los orbitales internos se estén llenando. Por ejemplo, en la serie 3d, los electrones 4s se pierden primero aunque los orbitales 3d se estén llenando. El efecto de protección de agregar un electrón 3d adicional compensa aproximadamente el aumento de la carga nuclear y, por lo tanto, las energías de ionización permanecen prácticamente constantes, aunque hay un pequeño aumento, especialmente al final de cada serie de transición. [133]
Como los átomos metálicos tienden a perder electrones en las reacciones químicas, la energía de ionización generalmente se correlaciona con la reactividad química, aunque también intervienen otros factores. [133]
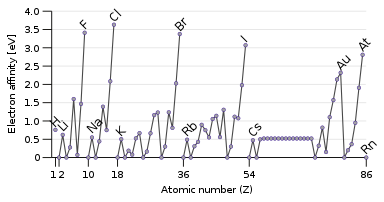
La propiedad opuesta a la energía de ionización es la afinidad electrónica , que es la energía liberada al añadir un electrón al átomo. [134] Un electrón que pasa será atraído más fácilmente hacia un átomo si siente la atracción del núcleo con más fuerza, y especialmente si hay un orbital externo parcialmente lleno disponible que pueda acomodarlo. Por tanto, la afinidad electrónica tiende a aumentar de abajo hacia arriba y de izquierda a derecha. La excepción es la última columna, la de los gases nobles, que tienen la capa llena y no tienen espacio para ningún otro electrón. Esto da a los halógenos de la penúltima columna las mayores afinidades electrónicas. [18]
Algunos átomos, como los gases nobles, no tienen afinidad electrónica: no pueden formar aniones estables en fase gaseosa. [135] Los gases nobles, que tienen altas energías de ionización y ninguna afinidad electrónica, tienen poca inclinación a ganar o perder electrones y generalmente no son reactivos. [18]
Se producen algunas excepciones a las tendencias: el oxígeno y el flúor tienen afinidades electrónicas más bajas que sus homólogos más pesados, el azufre y el cloro, porque son átomos pequeños y, por lo tanto, el electrón recién añadido experimentaría una repulsión significativa de los ya presentes. Para los elementos no metálicos, la afinidad electrónica también se correlaciona en cierta medida con la reactividad, pero no perfectamente, ya que intervienen otros factores. Por ejemplo, el flúor tiene una menor afinidad electrónica que el cloro (debido a la extrema repulsión interelectrónica del muy pequeño átomo de flúor), pero es más reactivo. [134]
La valencia de un elemento se puede definir como el número de átomos de hidrógeno que pueden combinarse con él para formar un hidruro binario simple, o como el doble del número de átomos de oxígeno que pueden combinarse con él para formar un óxido binario simple (es decir, no es un peróxido ni un superóxido ). [111] Las valencias de los elementos del grupo principal están directamente relacionadas con el número del grupo: los hidruros en los grupos principales 1–2 y 13–17 siguen las fórmulas MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 , y finalmente MH. Los óxidos superiores, en cambio, aumentan su valencia, siguiendo las fórmulas M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . [k] Hoy en día la noción de valencia se ha ampliado por la de estado de oxidación , que es la carga formal que queda en un elemento cuando todos los demás elementos de un compuesto han sido eliminados como sus iones. [114]
La configuración electrónica sugiere una explicación sencilla a partir del número de electrones disponibles para el enlace; [114] de hecho, el número de electrones de valencia comienza en 1 en el grupo 1, y luego aumenta hacia el lado derecho de la tabla periódica, y solo se reinicia en 3 cada vez que comienza cada nuevo bloque. Así, en el período 6, Cs-Ba tiene 1 o 2 electrones de valencia; La-Yb tiene 3-16; Lu-Hg tiene 3-12; y Tl – Rn tienen 3–8. [113] Sin embargo, hacia el lado derecho de los bloques d y f, el máximo teórico correspondiente al uso de todos los electrones de valencia no se puede alcanzar en absoluto; [136] la misma situación afecta al oxígeno, al flúor y a los gases nobles ligeros hasta el criptón. [137]
Una explicación completa requiere considerar la energía que se liberaría al formar compuestos con diferentes valencias en lugar de considerar simplemente las configuraciones electrónicas. [138] Por ejemplo, el magnesio forma cationes Mg 2+ en lugar de Mg + cuando se disuelve en agua, porque este último se desproporcionaría espontáneamente en cationes Mg 0 y Mg 2+ . Esto se debe a que la entalpía de hidratación (que rodea el catión con moléculas de agua) aumenta en magnitud con la carga y el radio del ion. En Mg + , el orbital más externo (que determina el radio iónico) sigue siendo 3s, por lo que la entalpía de hidratación es pequeña e insuficiente para compensar la energía necesaria para eliminar el electrón; pero la ionización nuevamente a Mg 2+ descubre la subcapa central 2p, lo que hace que la entalpía de hidratación sea lo suficientemente grande como para permitir que se formen compuestos de magnesio (II). Por razones similares, los estados de oxidación comunes de los elementos más pesados del bloque p (donde los electrones ns tienen menos energía que los np) tienden a variar en pasos de 2, porque eso es necesario para descubrir una subcapa interna y disminuir el radio iónico. (por ejemplo, Tl + descubre 6s y Tl 3+ descubre 5d, por lo que una vez que el talio pierde dos electrones, tiende a perder también el tercero). Se pueden utilizar argumentos análogos basados en la hibridación orbital para los elementos del bloque p menos electronegativos. [139] [l]

Para los metales de transición, los estados de oxidación comunes son casi siempre al menos +2 por razones similares (descubriendo el siguiente subnivel); esto es válido incluso para los metales con configuraciones anómalas d x+1 s 1 o d x+2 s 0 (excepto la plata ), porque la repulsión entre electrones d significa que el movimiento del segundo electrón desde el s- al d- La subcapa no cambia apreciablemente su energía de ionización. [141] Debido a que la ionización adicional de los metales de transición no descubre ninguna nueva subcapa interna, sus estados de oxidación tienden a variar en pasos de 1. [139] Los lantánidos y actínidos tardíos generalmente muestran un estado de oxidación estable +3, eliminando los electrones s externos y luego (generalmente) un electrón de los orbitales (n−2)f, que son similares en energía a ns. [142] Los estados de oxidación comunes y máximos de los elementos del bloque d y f tienden a depender de las energías de ionización. A medida que la diferencia de energía entre los orbitales (n−1)d y ns aumenta a lo largo de cada serie de transición, resulta menos favorable energéticamente ionizar más electrones. Por lo tanto, los grupos de metales de transición tempranos tienden a preferir estados de oxidación más altos, pero el estado de oxidación +2 se vuelve más estable para los grupos de metales de transición tardíos. El estado de oxidación formal más alto aumenta así de +3 al principio de cada fila del bloque d, a +7 o +8 en el medio (por ejemplo, OsO 4 ), y luego disminuye a +2 al final. [141] Los lantánidos y los actínidos tardíos suelen tener una cuarta energía de ionización alta y, por lo tanto, rara vez superan el estado de oxidación +3, mientras que los actínidos tempranos tienen una cuarta energía de ionización baja y, por ejemplo, el neptunio y el plutonio pueden alcanzar +7. [111] [141] [142] Los últimos actínidos van más allá que los lantánidos hacia estados de oxidación bajos: el mendelevio se reduce más fácilmente al estado +2 que el tulio o incluso el europio, y el nobelio favorece directamente +2 sobre +3, en contraste con el iterbio. [55]
Como los elementos del mismo grupo comparten las mismas configuraciones de valencia, suelen exhibir un comportamiento químico similar. Por ejemplo, los metales alcalinos del primer grupo tienen todos un electrón de valencia y forman una clase de elementos muy homogénea: todos son metales blandos y reactivos. Sin embargo, hay muchos factores involucrados y los grupos a menudo pueden ser bastante heterogéneos. Por ejemplo, el hidrógeno también tiene un electrón de valencia y está en el mismo grupo que los metales alcalinos, pero su comportamiento químico es bastante diferente. Los elementos estables del grupo 14 comprenden un no metal ( carbono ), dos semiconductores ( silicio y germanio ) y dos metales ( estaño y plomo ); no obstante, están unidos por tener cuatro electrones de valencia. [143] Esto a menudo conduce a similitudes en los estados de oxidación máximo y mínimo (por ejemplo, el azufre y el selenio en el grupo 16 tienen un estado de oxidación máximo +6, como en SO 3 y SeO 3 , y un estado de oxidación mínimo -2, como en sulfuros y seleniuros) . ); pero no siempre (por ejemplo, no se sabe que el oxígeno forme el estado de oxidación +6, a pesar de estar en el mismo grupo que el azufre y el selenio). [59]

Otra propiedad importante de los elementos es su electronegatividad . Los átomos pueden formar enlaces covalentes entre sí compartiendo electrones en pares, creando una superposición de orbitales de valencia. El grado en que cada átomo atrae el par de electrones compartido depende de la electronegatividad del átomo [144] : la tendencia de un átomo a ganar o perder electrones. [18] El átomo más electronegativo tenderá a atraer más el par de electrones, y el menos electronegativo (o más electropositivo) lo atraerá menos. En casos extremos, se puede pensar que el electrón ha pasado completamente del átomo más electropositivo al más electronegativo, aunque esto es una simplificación. Luego, el enlace une dos iones, uno positivo (habiendo cedido el electrón) y otro negativo (habiéndolo aceptado), y se denomina enlace iónico . [18]
La electronegatividad depende de la fuerza con la que el núcleo puede atraer un par de electrones, por lo que exhibe una variación similar a las otras propiedades ya analizadas: la electronegatividad tiende a caer de arriba a abajo y a aumentar de izquierda a derecha. Los metales alcalinos y alcalinotérreos se encuentran entre los elementos más electropositivos, mientras que los calcógenos, halógenos y gases nobles se encuentran entre los más electronegativos. [144]
La electronegatividad se mide generalmente en la escala de Pauling, en la que al átomo reactivo más electronegativo ( flúor ) se le da una electronegatividad de 4,0, y al átomo menos electronegativo ( cesio ) se le da una electronegatividad de 0,79. [18] De hecho , el neón es el elemento más electronegativo, pero la escala de Pauling no puede medir su electronegatividad porque no forma enlaces covalentes con la mayoría de los elementos. [145]
La electronegatividad de un elemento varía con la identidad y el número de los átomos a los que está unido, así como con la cantidad de electrones que ya ha perdido: un átomo se vuelve más electronegativo cuando ha perdido más electrones. [144] Esto a veces hace una gran diferencia: el plomo en el estado de oxidación +2 tiene una electronegatividad de 1,87 en la escala de Pauling, mientras que el plomo en el estado de oxidación +4 tiene una electronegatividad de 2,33. [146]

Una sustancia simple es una sustancia formada a partir de átomos de un elemento químico. Las sustancias simples de los átomos más electronegativos tienden a compartir electrones (formar enlaces covalentes) entre sí. Forman moléculas pequeñas (como el hidrógeno o el oxígeno, cuyos átomos se unen en pares) o estructuras gigantes que se extienden indefinidamente (como el carbono o el silicio). Los gases nobles simplemente permanecen como átomos individuales, ya que ya tienen una capa completa. [18] Las sustancias compuestas de moléculas discretas o átomos individuales se mantienen unidas por fuerzas de atracción más débiles entre las moléculas, como la fuerza de dispersión de London : a medida que los electrones se mueven dentro de las moléculas, crean desequilibrios momentáneos de carga eléctrica, que inducen desequilibrios similares en las moléculas cercanas. moléculas y crean movimientos sincronizados de electrones a través de muchas moléculas vecinas. [148]

Sin embargo, los átomos más electropositivos tienden a perder electrones, creando un "mar" de electrones que envuelve a los cationes. [18] Los orbitales externos de un átomo se superponen para compartir electrones con todos sus vecinos, creando una estructura gigante de orbitales moleculares que se extiende sobre todos los átomos. [149] Este "mar" cargado negativamente atrae todos los iones y los mantiene unidos en un enlace metálico . Los elementos que forman tales enlaces suelen denominarse metales ; aquellos que no lo hacen a menudo se denominan no metales . [18] Algunos elementos pueden formar múltiples sustancias simples con diferentes estructuras: se llaman alótropos . Por ejemplo, el diamante y el grafito son dos alótropos del carbono. [143] [m]
La metalicidad de un elemento se puede predecir a partir de sus propiedades electrónicas. Cuando los orbitales atómicos se superponen durante el enlace metálico o covalente, crean orbitales moleculares tanto enlazantes como antienlazantes de igual capacidad, siendo los orbitales antienlazantes de mayor energía. El carácter de enlace neto ocurre cuando hay más electrones en los orbitales enlazantes que en los orbitales antienlazantes. Por tanto, el enlace metálico es posible cuando el número de electrones deslocalizados por cada átomo es inferior al doble del número de orbitales que contribuyen al solapamiento. Ésta es la situación de los elementos de los grupos 1 al 13; también tienen muy pocos electrones de valencia para formar estructuras covalentes gigantes donde todos los átomos toman posiciones equivalentes, por lo que casi todos se metalizan. Las excepciones son el hidrógeno y el boro, que tienen una energía de ionización demasiado alta. Así, el hidrógeno forma una molécula covalente de H 2 y el boro forma una estructura covalente gigante basada en grupos icosaédricos de B 12 . En un metal, los orbitales enlazantes y antienlazantes tienen energías superpuestas, creando una banda única por la que los electrones pueden fluir libremente, lo que permite la conducción eléctrica. [151]
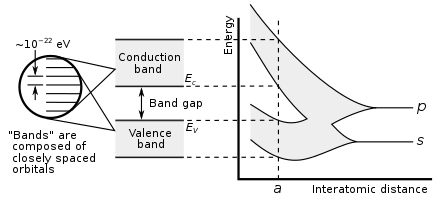
En el grupo 14, se hacen posibles enlaces tanto metálicos como covalentes. En un cristal de diamante, los enlaces covalentes entre los átomos de carbono son fuertes porque tienen un radio atómico pequeño y, por lo tanto, el núcleo tiene más control sobre los electrones. Por lo tanto, los orbitales enlazantes resultantes tienen mucha menor energía que los orbitales antienlazantes y no hay superposición, por lo que la conducción eléctrica se vuelve imposible: el carbono es un no metal. Sin embargo, el enlace covalente se vuelve más débil para los átomos más grandes y la brecha de energía entre los orbitales enlazantes y antienlazantes disminuye. Por lo tanto, el silicio y el germanio tienen bandas prohibidas más pequeñas y son semiconductores en condiciones ambientales: los electrones pueden cruzar la brecha cuando se excitan térmicamente. (El boro también es un semiconductor en condiciones ambientales). La banda prohibida desaparece en el estaño, de modo que el estaño y el plomo se convierten en metales. [151] A medida que aumenta la temperatura, todos los no metales desarrollan algunas propiedades semiconductoras, en mayor o menor medida dependiendo del tamaño de la banda prohibida. Así, los metales y los no metales pueden distinguirse por la dependencia de la temperatura de su conductividad eléctrica: la conductividad de un metal disminuye a medida que aumenta la temperatura (porque el movimiento térmico hace más difícil que los electrones fluyan libremente), mientras que la conductividad de un no metal aumenta (ya que se pueden necesitar más electrones). emocionado de cruzar la brecha). [152]
Los elementos de los grupos 15 a 17 tienen demasiados electrones para formar moléculas covalentes gigantes que se extienden en las tres dimensiones. Para los elementos más ligeros, los enlaces en las pequeñas moléculas diatómicas son tan fuertes que una fase condensada no es favorable: así nitrógeno (N 2 ), oxígeno (O 2 ), fósforo blanco y arsénico amarillo (P 4 y As 4 ), azufre y rojo. el selenio (S 8 y Se 8 ) y los halógenos estables (F 2 , Cl 2 , Br 2 y I 2 ) forman fácilmente moléculas covalentes con pocos átomos. Los más pesados tienden a formar cadenas largas (por ejemplo, fósforo rojo, selenio gris, telurio) o estructuras en capas (por ejemplo, carbono en forma de grafito, fósforo negro, arsénico gris, antimonio, bismuto) que sólo se extienden en una o dos dimensiones en lugar de tres. Ambos tipos de estructuras se pueden encontrar como alótropos de fósforo, arsénico y selenio, aunque los alótropos de cadena larga son más estables en los tres. Como estas estructuras no utilizan todos sus orbitales para enlazarse, terminan con bandas enlazantes, no enlazantes y antienlazantes en orden creciente de energía. De manera similar al grupo 14, las bandas prohibidas se reducen para los elementos más pesados y se hace posible el libre movimiento de electrones entre las cadenas o capas. Así, por ejemplo, el fósforo negro, el arsénico negro, el selenio gris, el telurio y el yodo son semiconductores; el arsénico gris, el antimonio y el bismuto son semimetales (que exhiben conducción cuasi metálica, con una superposición de bandas muy pequeña); y el polonio y probablemente el astato son verdaderos metales. [151] Finalmente, los elementos naturales del grupo 18 permanecen todos como átomos individuales. [151] [n]
La línea divisoria entre metales y no metales es aproximadamente diagonal desde la parte superior izquierda hasta la inferior derecha, y la serie de transición aparece a la izquierda de esta diagonal (ya que tienen muchos orbitales disponibles para superponerse). Esto es de esperar, ya que la metalicidad tiende a correlacionarse con la electropositividad y la disposición a perder electrones, que aumenta de derecha a izquierda y de arriba a abajo. Por tanto, los metales superan con creces a los no metales. Los elementos cercanos al límite son difíciles de clasificar: tienden a tener propiedades intermedias entre las de los metales y los no metales, y pueden tener algunas propiedades características de ambos. A menudo se les denomina semimetales o metaloides . [18] El término "semimetal" utilizado en este sentido no debe confundirse con su sentido físico estricto que tiene que ver con la estructura de la banda: el bismuto es físicamente un semimetal, pero los químicos generalmente lo consideran un metal. [154]
La siguiente tabla considera los alótropos más estables en condiciones estándar. Los elementos coloreados en amarillo forman sustancias simples que se caracterizan por tener enlaces metálicos. Los elementos coloreados de azul claro forman estructuras covalentes de red gigantes, mientras que los de color azul oscuro forman pequeñas moléculas unidas covalentemente que se mantienen unidas por fuerzas de van der Waals más débiles . Los gases nobles están coloreados en violeta: sus moléculas son átomos individuales y no se produce ningún enlace covalente. Las celdas atenuadas corresponden a elementos que no se han preparado en cantidades suficientes para que sus alótropos más estables se hayan caracterizado de esta manera. Las consideraciones teóricas y la evidencia experimental actual sugieren que todos esos elementos se metalizarían si pudieran formar fases condensadas, [151] excepto quizás el oganesson. [155] [o]
MetálicoRed covalentecovalente molecularátomos individualesDesconocidoEl color de fondo muestra el enlace de sustancias simples en la tabla periódica. Si hay varios, se considera el alótropo más estable.
Generalmente los metales son brillantes y densos. [18] Por lo general, tienen altos puntos de fusión y ebullición debido a la fuerza del enlace metálico y, a menudo, son maleables y dúctiles (fácilmente estirados y moldeados) porque los átomos pueden moverse entre sí sin romper el enlace metálico. [165] Conducen electricidad porque sus electrones son libres de moverse en las tres dimensiones. De manera similar, conducen calor, que los electrones transfieren como energía cinética adicional : se mueven más rápido. Estas propiedades persisten en estado líquido, ya que aunque la estructura cristalina se destruye al fundirse, los átomos aún se tocan y el enlace metálico persiste, aunque debilitado. [165] Los metales tienden a ser reactivos con los no metales. [18] Se pueden encontrar algunas excepciones a estas generalizaciones: por ejemplo, el berilio, el cromo, [85] el manganeso, [166] el antimonio, [167] el bismuto, [168] y el uranio son frágiles (no es una lista exhaustiva); [85] el cromo es extremadamente duro; [169] el galio, el rubidio, el cesio y el mercurio son líquidos a temperatura ambiente o cerca de ella; [p] y los metales nobles como el oro son químicamente muy inertes. [170] [171]
Los no metales exhiben diferentes propiedades. Los que forman cristales covalentes gigantes exhiben altos puntos de fusión y ebullición, ya que se necesita una energía considerable para superar los fuertes enlaces covalentes. Las que forman moléculas discretas se mantienen unidas principalmente mediante fuerzas de dispersión, que se superan más fácilmente; por lo tanto, tienden a tener puntos de fusión y ebullición más bajos, [172] y muchos son líquidos o gases a temperatura ambiente. [18] Los no metales suelen tener un aspecto opaco. Suelen ser reactivos con los metales, excepto los gases nobles, que son inertes con la mayoría de las sustancias. [18] Son frágiles cuando están sólidos ya que sus átomos se mantienen firmemente en su lugar. Son menos densos y conducen mal la electricidad [18] porque no tienen electrones móviles. [173] Cerca del límite, las bandas prohibidas son pequeñas y, por lo tanto, muchos elementos en esa región son semiconductores, como el silicio, el germanio, [173] y el telurio. [151] El selenio tiene un alótropo gris semiconductor y un alótropo rojo aislante; El arsénico tiene un alótropo gris metálico, un alótropo negro semiconductor y un alótropo amarillo aislante (aunque este último es inestable en condiciones ambientales). [152] Nuevamente hay excepciones; por ejemplo, el diamante tiene la conductividad térmica más alta de todos los materiales conocidos, mayor que cualquier metal. [174]
Es común designar una clase de metaloides que se extienden a ambos lados del límite entre metales y no metales, ya que los elementos de esa región son intermedios en propiedades físicas y químicas. [18] Sin embargo, no existe consenso en la literatura sobre exactamente qué elementos deben designarse así. Cuando se utiliza esta categoría, casi siempre se incluyen el silicio, el germanio, el arsénico y el teluro, y normalmente el boro y el antimonio; pero la mayoría de las fuentes incluyen también otros elementos, sin acuerdo sobre qué elementos adicionales se deben agregar y, en cambio, algunas otras se restan de esta lista. [q] Por ejemplo, a diferencia de todos los demás elementos generalmente considerados metaloides o no metales, la única forma estable del antimonio tiene conductividad metálica. Además, el elemento se parece al bismuto y, más generalmente, a otros metales del bloque P en su comportamiento físico y químico. Sobre esta base, algunos autores han sostenido que es mejor clasificarlo como metal que como metaloide. [85] [179] [152] Por otro lado, el selenio tiene algunas propiedades semiconductoras en su forma más estable (aunque también tiene alótropos aislantes) y se ha argumentado que debería considerarse un metaloide [179] , aunque esto La situación también se aplica al fósforo, [152] que es una inclusión mucho más rara entre los metaloides. [q]
Existen otras relaciones en toda la tabla periódica entre elementos que no están en el mismo grupo, como las relaciones diagonales entre elementos que son diagonalmente adyacentes (por ejemplo, litio y magnesio). [122] También se pueden encontrar algunas similitudes entre los grupos principales y los grupos de metales de transición, o entre los primeros actínidos y los primeros metales de transición, cuando los elementos tienen el mismo número de electrones de valencia. Así, el uranio se parece un poco al cromo y al tungsteno en el grupo 6, [122] ya que los tres tienen seis electrones de valencia. [180] Las relaciones entre elementos con el mismo número de electrones de valencia pero diferentes tipos de orbitales de valencia se han denominado relaciones secundarias o isodonantes: suelen tener los mismos estados de oxidación máximos, pero no los mismos estados de oxidación mínimos. Por ejemplo, el cloro y el manganeso tienen +7 como su estado de oxidación máximo (por ejemplo, Cl 2 O 7 y Mn 2 O 7 ), pero sus respectivos estados de oxidación mínimos son −1 (por ejemplo, HCl ) y −3 (K 2 [Mn( CO) 4 ]). Los elementos con el mismo número de vacantes de valencia pero diferente número de electrones de valencia están relacionados por una relación terciaria o de isoaceptor: generalmente tienen estados de oxidación mínimos pero no máximos similares. Por ejemplo, el hidrógeno y el cloro tienen -1 como estado de oxidación mínimo (en hidruros y cloruros ), pero el estado de oxidación máximo del hidrógeno es +1 (por ejemplo, H 2 O ), mientras que el del cloro es +7. [59]
Muchas otras propiedades físicas de los elementos exhiben variaciones periódicas de acuerdo con la ley periódica, como los puntos de fusión , los puntos de ebullición , los calores de fusión , los calores de vaporización , la energía de atomización , etc. Aparecen variaciones periódicas similares para los compuestos de los elementos, que pueden observarse comparando hidruros, óxidos, sulfuros, haluros, etc. [144] Las propiedades químicas son más difíciles de describir cuantitativamente, pero también exhiben sus propias periodicidades. Los ejemplos incluyen la variación en las propiedades ácidas y básicas de los elementos y sus compuestos, la estabilidad de los compuestos y los métodos para aislar los elementos. [114] La periodicidad se utiliza y se ha utilizado ampliamente para predecir las propiedades de nuevos elementos y compuestos desconocidos, y es fundamental para la química moderna. [181]
En la literatura se han utilizado muchos términos para describir conjuntos de elementos que se comportan de manera similar. Los nombres de grupo de metal alcalino , metal alcalinotérreo , triel , tetrel , pnictógeno , calcógeno , halógeno y gas noble son reconocidos por la IUPAC; se puede hacer referencia a los otros grupos por su número o por su primer elemento (por ejemplo, el grupo 6 es el grupo del cromo). [8] [182] Algunos dividen los elementos del bloque p de los grupos 13 a 16 por metalicidad, [177] [175] aunque no existe una definición IUPAC ni un consenso preciso sobre exactamente qué elementos deben considerarse metales, no metales o semimetales (a veces llamados metaloides). [177] [175] [8] Tampoco existe consenso sobre cómo deberían llamarse los metales que suceden a los metales de transición, siendo el metal post-transición y el metal pobre entre las posibilidades que se han utilizado. [r] Algunas monografías avanzadas excluyen los elementos del grupo 12 de los metales de transición debido a sus propiedades químicas a veces bastante diferentes, pero esto no es una práctica universal [183] y la IUPAC actualmente no lo menciona como permisible en sus Principios de Nomenclatura química . [184]
Se considera que los lantánidos son los elementos La-Lu, que son todos muy similares entre sí: históricamente incluían solo Ce-Lu, pero el uso común pasó a incluir el lantano. [8] Los elementos de tierras raras (o metales de tierras raras) añaden escandio e itrio a los lantánidos. [8] De manera análoga, se considera que los actínidos son los elementos Ac-Lr (históricamente Th-Lr), [8] aunque la variación de propiedades en este conjunto es mucho mayor que dentro de los lantánidos. [53] La IUPAC recomienda los nombres lantánidos y actinoides para evitar ambigüedades, ya que el sufijo -ide normalmente denota un ion negativo; sin embargo, los lantánidos y actínidos siguen siendo comunes. [8] Con el creciente reconocimiento del lutecio y lawrencio como elementos del bloque d, algunos autores comenzaron a definir los lantánidos como La-Yb y los actínidos como Ac-No, coincidiendo con el bloque f. [58] [11] [185] [186] [187] [188] Los transactínidos o elementos superpesados son los elementos de vida corta más allá de los actínidos, comenzando en lawrencio o rutherfordio (dependiendo de dónde se tomen los actínidos para terminar). [188] [189] [190] [191] [192]
Existen muchas más categorizaciones y se utilizan según determinadas disciplinas. En astrofísica, un metal se define como cualquier elemento con número atómico superior a 2, es decir, cualquier cosa excepto hidrógeno y helio. [193] El término "semimetal" tiene una definición diferente en física que en química: el bismuto es un semimetal según las definiciones físicas, pero los químicos generalmente lo consideran un metal. [194] Algunos términos se utilizan ampliamente, pero sin ninguna definición muy formal, como " heavy metal ", al que se le ha dado una gama tan amplia de definiciones que ha sido criticado como "efectivamente carente de significado". [195]
El alcance de los términos varía significativamente entre autores. Por ejemplo, según la IUPAC, los gases nobles se extienden hasta incluir a todo el grupo, incluido el elemento superpesado muy radiactivo oganesson. [196] Sin embargo, entre aquellos que se especializan en elementos superpesados, esto no se hace a menudo: en este caso, se suele considerar que "gas noble" implica el comportamiento no reactivo de los elementos más ligeros del grupo. Dado que los cálculos generalmente predicen que el oganesson no debería ser particularmente inerte debido a efectos relativistas, y puede que ni siquiera sea un gas a temperatura ambiente si pudiera producirse a granel, su estatus como gas noble a menudo se cuestiona en este contexto. [197] Además, a veces se encuentran variaciones nacionales: en Japón, los metales alcalinotérreos a menudo no incluyen el berilio y el magnesio, ya que su comportamiento es diferente al de los metales más pesados del grupo 2. [198]

En 1817, el físico alemán Johann Wolfgang Döbereiner comenzó a formular uno de los primeros intentos de clasificar los elementos. [199] En 1829, descubrió que podía formar algunos de los elementos en grupos de tres, y que los miembros de cada grupo tenían propiedades relacionadas. A estos grupos los denominó tríadas . [200] [201] El cloro, el bromo y el yodo formaron una tríada; al igual que el calcio, el estroncio y el bario; litio, sodio y potasio; y azufre, selenio y telurio. Hoy, todas estas tríadas forman parte de grupos modernos. [202] Varios químicos continuaron su trabajo y pudieron identificar cada vez más relaciones entre pequeños grupos de elementos. Sin embargo, no pudieron construir un plan que los abarcara a todos. [203]

John Newlands publicó una carta en Chemical News en febrero de 1863 sobre la periodicidad entre los elementos químicos. [204] En 1864, Newlands publicó un artículo en Chemical News mostrando que si los elementos están ordenados según sus pesos atómicos, aquellos que tienen números consecutivos frecuentemente pertenecen al mismo grupo u ocupan posiciones similares en diferentes grupos, y señaló Cabe señalar que cada octavo elemento a partir de uno dado es en este arreglo una especie de repetición del primero, como la corchea de una octava en la música (La Ley de las Octavas). [204] Sin embargo, la formulación de Newlands sólo funcionó bien para los elementos del grupo principal y encontró serios problemas con los demás. [59]
El químico alemán Lothar Meyer observó secuencias de propiedades físicas y químicas similares repetidas a intervalos periódicos. Según él, si los pesos atómicos se trazaran como ordenadas (es decir, verticalmente) y los volúmenes atómicos como abscisas (es decir, horizontalmente) (la curva obtuviera una serie de máximos y mínimos), los elementos más electropositivos aparecerían en los picos de la curva en el orden de sus pesos atómicos. En 1864 se publicó un libro suyo; contenía una versión temprana de la tabla periódica que contenía 28 elementos y los clasificaba en seis familias por su valencia ; por primera vez, los elementos se habían agrupado según su valencia. Los trabajos sobre la organización de los elementos por peso atómico se habían visto obstaculizados hasta entonces por mediciones inexactas de los pesos atómicos. [205] En 1868, revisó su tabla, pero esta revisión se publicó como borrador sólo después de su muerte. [206]

El avance definitivo vino de la mano del químico ruso Dmitri Mendeleev . Aunque otros químicos (incluido Meyer) habían encontrado otras versiones del sistema periódico aproximadamente al mismo tiempo, Mendeleev fue el más dedicado a desarrollar y defender su sistema, y fue su sistema el que más afectó a la comunidad científica. [207] El 17 de febrero de 1869 (1 de marzo de 1869 en el calendario gregoriano), Mendeleev comenzó a ordenar los elementos y a compararlos por sus pesos atómicos. Comenzó con unos pocos elementos y, a lo largo del día, su sistema creció hasta abarcar la mayoría de los elementos conocidos. Después de encontrar una disposición coherente, su tabla impresa apareció en mayo de 1869 en la revista de la Sociedad Química Rusa. [208] Cuando los elementos no parecían encajar en el sistema, predijo audazmente que las valencias o los pesos atómicos se habían medido incorrectamente, o que faltaba un elemento aún por descubrir. [59] En 1871, Mendeleev publicó un largo artículo, que incluía una forma actualizada de su tabla, que hacía explícitas sus predicciones para elementos desconocidos. Mendeleev predijo en detalle las propiedades de tres de estos elementos desconocidos: como les faltarían homólogos más pesados de boro, aluminio y silicio, los llamó eka-boro, eka-aluminio y eka-silicio ("eka" en sánscrito significa "uno"). [208] [209] : 45

En 1875, el químico francés Paul-Émile Lecoq de Boisbaudran , trabajando sin conocimiento de la predicción de Mendeleev, descubrió un nuevo elemento en una muestra del mineral esfalerita y lo llamó galio. Aisló el elemento y comenzó a determinar sus propiedades. Mendeleev, leyendo la publicación de De Boisbaudran, envió una carta afirmando que el galio era el eka-aluminio que predijo. Aunque Lecoq de Boisbaudran se mostró inicialmente escéptico y sospechaba que Mendeleev estaba tratando de atribuirse el mérito de su descubrimiento, más tarde admitió que Mendeleev tenía razón. [210] En 1879, el químico sueco Lars Fredrik Nilson descubrió un nuevo elemento, al que llamó escandio: resultó ser eka-boro. El eka-silicio fue descubierto en 1886 por el químico alemán Clemens Winkler , quien lo llamó germanio. Las propiedades del galio, el escandio y el germanio coincidían con lo que había predicho Mendeleev. [211] En 1889, Mendeleev señaló en la Conferencia de Faraday ante la Royal Institution de Londres que no había esperado vivir lo suficiente "para mencionar su descubrimiento a la Sociedad Química de Gran Bretaña como una confirmación de la exactitud y generalidad de la tabla periódica". ley". [212] Incluso el descubrimiento de los gases nobles a finales del siglo XIX, que Mendeleev no había predicho, encajaba perfectamente en su esquema como octavo grupo principal. [213]
Sin embargo, Mendeleev tuvo algunos problemas para encajar los lantánidos conocidos en su esquema, ya que no exhibían el cambio periódico de valencias que presentaban los otros elementos. Después de mucha investigación, el químico checo Bohuslav Brauner sugirió en 1902 que todos los lantánidos podrían ubicarse todos juntos en un grupo en la tabla periódica. A esto lo llamó "hipótesis de los asteroides" como analogía astronómica: así como entre Marte y Júpiter hay un cinturón de asteroides en lugar de un solo planeta, se pensaba que el lugar debajo del itrio estaba ocupado por todos los lantánidos en lugar de un solo elemento. [20]

Después de que se investigara la estructura interna del átomo, el físico aficionado holandés Antonius van den Broek propuso en 1913 que la carga nuclear determinaba la ubicación de los elementos en la tabla periódica. [214] [215] El físico neozelandés Ernest Rutherford acuñó la palabra "número atómico" para esta carga nuclear. [216] En el artículo publicado de van der Broek, ilustró la primera tabla periódica electrónica que muestra los elementos ordenados según el número de sus electrones. [217] Rutherford confirmó en su artículo de 1914 que Bohr había aceptado la opinión de van der Broek. [218]
.jpg/440px-Henry_Moseley_(1887-1915).jpg)
El mismo año, el físico inglés Henry Moseley , mediante espectroscopia de rayos X, confirmó experimentalmente la propuesta de van den Broek. Moseley determinó el valor de la carga nuclear de cada elemento, desde el aluminio hasta el oro , y demostró que el orden de Mendeleev en realidad coloca los elementos en orden secuencial por carga nuclear. [219] La carga nuclear es idéntica al recuento de protones y determina el valor del número atómico ( Z ) de cada elemento. El uso del número atómico proporciona una secuencia definitiva basada en números enteros para los elementos. La investigación de Moseley resolvió inmediatamente las discrepancias entre el peso atómico y las propiedades químicas; Se trataba de casos como el telurio y el yodo, en los que el número atómico aumenta pero el peso atómico disminuye. [214] Aunque Moseley pronto murió en la Primera Guerra Mundial, el físico sueco Manne Siegbahn continuó su trabajo hasta el uranio , y estableció que era el elemento con mayor número atómico entonces conocido (92). [220] Basado en la investigación de Moseley y Siegbahn, también se sabía qué números atómicos correspondían a elementos faltantes aún por encontrar. [214]
El físico danés Niels Bohr aplicó la idea de cuantificación de Max Planck al átomo. Concluyó que los niveles de energía de los electrones estaban cuantizados: sólo se permitía un conjunto discreto de estados de energía estables. Luego, Bohr intentó comprender la periodicidad a través de las configuraciones electrónicas, y en 1913 supuso que los electrones internos deberían ser responsables de las propiedades químicas del elemento. [221] [222] En 1913, produjo la primera tabla periódica electrónica basada en un átomo cuántico. [223]
Bohr llamó "anillos" a sus capas de electrones en 1913: los orbitales atómicos dentro de las capas no existían en el momento de su modelo planetario. Bohr explica en la parte 3 de su famoso artículo de 1913 que el máximo de electrones en una capa es ocho, y escribe: "Vemos, además, que un anillo de n electrones no puede girar en un solo anillo alrededor de un núcleo de carga ne a menos que n < 8 ". Para átomos más pequeños, las capas de electrones se llenarían de la siguiente manera: "los anillos de electrones sólo se unirán si contienen el mismo número de electrones; y en consecuencia, el número de electrones en los anillos internos sólo será 2, 4, 8". Sin embargo, en átomos más grandes, la capa más interna contendría ocho electrones: "Por otro lado, el sistema periódico de los elementos sugiere fuertemente que ya en el neón N = 10 se formará un anillo interno de ocho electrones". Las configuraciones electrónicas que propone para los átomos (que se muestran a la derecha) en su mayoría no concuerdan con las que se conocen ahora. [224] [225]
El primero en ampliar y corregir sistemáticamente los potenciales químicos de la teoría atómica de Bohr fue Walther Kossel en 1914 y 1916. Kossel explicó que en la tabla periódica se crearían nuevos elementos a medida que se añadieran electrones a la capa exterior. En el artículo de Kossel, escribe: "Esto lleva a la conclusión de que los electrones que se añaden más deben colocarse en anillos o capas concéntricas, en cada uno de los cuales... sólo un cierto número de electrones, es decir, ocho en nuestro caso—se debe arreglar. Tan pronto como se completa un anillo o capa, se debe comenzar uno nuevo para el siguiente elemento; el número de electrones, que son más fácilmente accesibles y se encuentran en la periferia más externa, aumenta nuevamente a partir del elemento a elemento y, por tanto, en la formación de cada nueva capa se repite la periodicidad química." [226] [227]
En un artículo de 1919, Irving Langmuir postuló la existencia de "células" que ahora llamamos orbitales, que sólo podían contener dos electrones cada una, y que estaban dispuestas en "capas equidistantes" que ahora llamamos capas. Hizo una excepción para que la primera capa contuviera solo dos electrones. [228] El químico Charles Rugeley Bury sugirió en 1921 que ocho y dieciocho electrones en una capa forman configuraciones estables. Bury propuso que las configuraciones electrónicas en los elementos de transición dependían de los electrones de valencia en su capa exterior. [229] Introdujo la palabra transición para describir los elementos ahora conocidos como metales de transición o elementos de transición. [230]
Impulsado por Bohr, Wolfgang Pauli abordó el problema de las configuraciones electrónicas en 1923. Pauli amplió el esquema de Bohr para utilizar cuatro números cuánticos y formuló su principio de exclusión que establecía que dos electrones no podían tener los mismos cuatro números cuánticos. Esto explicaba la duración de los períodos de la tabla periódica (2, 8, 18 y 32), que correspondían al número de electrones que podía ocupar cada capa. [231] En 1925, Friedrich Hund llegó a configuraciones cercanas a las modernas. [232] Como resultado de estos avances, la periodicidad pasó a basarse en el número de electrones químicamente activos o de valencia en lugar de en las valencias de los elementos. [59] El principio de Aufbau que describe las configuraciones electrónicas de los elementos fue observado empíricamente por primera vez por Erwin Madelung en 1926, [46] aunque el primero en publicarlo fue Vladimir Karapetoff en 1930. [233] [234] En 1961, Vsevolod Klechkovsky derivó la primera parte de la regla de Madelung (que los orbitales se llenan en orden creciente n + ℓ) del modelo de Thomas-Fermi ; [235] la regla completa fue derivada de un potencial similar en 1971 por Yury N. Demkov y Valentin N. Ostrovsky. [236] [s]

La teoría cuántica aclaraba que los metales de transición y los lantánidos formaban sus propios grupos separados, de transición entre los grupos principales, aunque algunos químicos ya habían propuesto tablas que los mostraban así antes: el químico inglés Henry Bassett lo hizo en 1892, el químico danés Julius Thomsen en 1895 y el químico suizo Alfred Werner en 1905. Bohr utilizó la forma de Thomsen en su Conferencia Nobel de 1922; La forma de Werner es muy similar a la forma moderna de 32 columnas. En particular, esto suplantó la hipótesis asteroidal de Brauner. [20]
La posición exacta de los lantánidos y, por tanto, la composición del grupo 3 , siguió siendo objeto de controversia durante décadas, porque sus configuraciones electrónicas inicialmente se midieron incorrectamente. [11] [93] Desde el punto de vista químico, Bassett, Werner y Bury agruparon el escandio y el itrio con lutecio en lugar de lantano (los dos primeros dejaron un espacio vacío debajo del itrio ya que el lutecio aún no se había descubierto). [20] [229] Hund asumió en 1927 que todos los átomos de lantánidos tenían configuración [Xe]4f 0−14 5d 1 6s 2 , debido a su trivalencia predominante. Ahora se sabe que la relación entre la química y la configuración electrónica es más complicada que eso. [t] [55] La evidencia espectroscópica temprana pareció confirmar estas configuraciones y, por lo tanto, la tabla periódica se estructuró para tener el grupo 3 como escandio, itrio, lantano y actinio, con catorce elementos f rompiendo el bloque d entre el lantano y hafnio. [11] Pero más tarde se descubrió que esto sólo es cierto para cuatro de los quince lantánidos (lantano, cerio, gadolinio y lutecio), y que los otros átomos de lantánidos no tienen un electrón d. En particular, el iterbio completa la capa 4f y, por lo tanto, los físicos soviéticos Lev Landau y Evgeny Lifshitz señalaron en 1948 que el lutecio se considera correctamente como un elemento del bloque d en lugar de un elemento del bloque f; [12] Jun Kondō sugirió por primera vez que el lantano a granel es un metal f en 1963, debido a su superconductividad a baja temperatura . [101] Esto aclaró la importancia de observar los estados excitados bajos de los átomos que pueden desempeñar un papel en entornos químicos al clasificar elementos por bloque y colocarlos en la mesa. [64] [66] [11] Muchos autores redescubrieron posteriormente esta corrección basándose en preocupaciones físicas, químicas y electrónicas y la aplicaron a todos los elementos relevantes, haciendo así que el grupo 3 contenga escandio, itrio, lutecio y lawrencio [64] [ 9] [93] y teniendo lantano a través de iterbio y actinio a través de nobelio como filas del bloque f: [64] [9] esta versión corregida logra coherencia con la regla de Madelung y reivindica la ubicación química inicial de Bassett, Werner y Bury. [20]
En 1988, la IUPAC publicó un informe que respalda esta composición del grupo 3, [9] decisión que fue reafirmada en 2021. [10] Todavía se pueden encontrar variaciones en los libros de texto sobre la composición del grupo 3, [22] y algunos argumentos en contra de esto. El formato todavía se publica hoy, [13] pero los químicos y físicos que han considerado el asunto coinciden en gran medida en que el grupo 3 contiene escandio, itrio, lutecio y lawrencio y cuestionan los contraargumentos por ser inconsistentes. [13]

En 1936, el conjunto de elementos faltantes, desde hidrógeno hasta uranio, se había reducido a cuatro: los elementos 43, 61, 85 y 87 seguían desaparecidos. El elemento 43 finalmente se convirtió en el primer elemento sintetizado artificialmente mediante reacciones nucleares en lugar de descubrirse en la naturaleza. Fue descubierto en 1937 por los químicos italianos Emilio Segrè y Carlo Perrier , quienes llamaron a su descubrimiento tecnecio , por la palabra griega que significa "artificial". [237] Los elementos 61 ( prometio ) y 85 ( astato ) también se produjeron artificialmente en 1945 y 1940 respectivamente; El elemento 87 ( francio ) se convirtió en el último elemento descubierto en la naturaleza por la química francesa Marguerite Perey en 1939. [238] [u] Los elementos más allá del uranio también se descubrieron artificialmente, comenzando con el descubrimiento de Edwin McMillan y Philip Abelson en 1940 de neptunio (mediante bombardeo de uranio con neutrones). [76] Glenn T. Seaborg y su equipo en el Laboratorio Nacional Lawrence Berkeley (LBNL) continuaron descubriendo elementos transuránicos, comenzando con el plutonio en 1941, y descubrieron que, contrariamente a lo que se pensaba anteriormente, los elementos a partir del actinio eran congéneres de los lantánidos en lugar de metales de transición. [239] Bassett (1892), Werner (1905) y el ingeniero francés Charles Janet (1928) habían sugerido esto anteriormente, pero sus ideas no recibieron aceptación general. [20] Seaborg los llamó así actínidos. [239] Los elementos hasta 101 (llamado mendelevio en honor a Mendeleev) se sintetizaron hasta 1955, ya sea mediante irradiación de neutrones o partículas alfa, o en explosiones nucleares en los casos de 99 (einstenio) y 100 (fermio). [76]
Una controversia significativa surgió con los elementos 102 a 106 en las décadas de 1960 y 1970, cuando surgió la competencia entre el equipo LBNL (ahora dirigido por Albert Ghiorso ) y un equipo de científicos soviéticos en el Instituto Conjunto de Investigación Nuclear (JINR) dirigido por Georgy Flyorov . Cada equipo afirmó haberlo descubierto y, en algunos casos, cada uno propuso su propio nombre para el elemento, lo que generó una controversia sobre el nombre de los elementos que duró décadas. Estos elementos se obtuvieron bombardeando actínidos con iones ligeros. [240] Al principio, la IUPAC adoptó un enfoque de no intervención, prefiriendo esperar y ver si se llegaría a un consenso. Pero como también estábamos en el apogeo de la Guerra Fría , quedó claro que esto no sucedería. Como tal, la IUPAC y la Unión Internacional de Física Pura y Aplicada (IUPAP) crearon un Grupo de Trabajo sobre Transfermio (TWG, siendo el fermio el elemento 100) en 1985 para establecer criterios para el descubrimiento, [241] que se publicaron en 1991. [242] Después de alguna controversia adicional, estos elementos recibieron sus nombres finales en 1997, incluido seaborgio (106) en honor a Seaborg. [243]

Los criterios del TWG se utilizaron para arbitrar reclamaciones posteriores de descubrimiento de elementos de LBNL y JINR, así como de institutos de investigación de Alemania ( GSI ) y Japón ( Riken ). [244] Actualmente, el examen de las reclamaciones de descubrimiento lo lleva a cabo un Grupo de Trabajo Conjunto IUPAC/IUPAP . Una vez asignada la prioridad, los elementos se agregaron oficialmente a la tabla periódica y se invitó a los descubridores a proponer sus nombres. [19] Para 2016, esto había ocurrido para todos los elementos hasta 118, completando así las primeras siete filas de la tabla periódica. [19] [245] Los descubrimientos de elementos más allá de 106 fueron posibles gracias a técnicas ideadas por Yuri Oganessian en el JINR: la fusión fría (bombardeo de plomo y bismuto por iones pesados) hizo posibles los descubrimientos de 1981-2004 de los elementos 107 a 112 en GSI y 113 en Riken, y dirigió el equipo JINR (en colaboración con científicos estadounidenses) para descubrir los elementos 114 a 118 mediante fusión caliente (bombardeo de actínidos con iones de calcio) en 1998-2010. [246] [247] El elemento más pesado conocido, oganesson (118), recibe su nombre en honor a Oganessian. El elemento 114 recibe el nombre de flerovium en honor a su predecesor y mentor Flyorov. [247]
Para celebrar el 150 aniversario de la tabla periódica, las Naciones Unidas declararon el año 2019 como el Año Internacional de la Tabla Periódica, celebrando "uno de los logros más significativos de la ciencia". [248] Los criterios de descubrimiento establecidos por el TWG se actualizaron en 2020 en respuesta a avances experimentales y teóricos que no se habían previsto en 1991. [249] Hoy en día, la tabla periódica se encuentra entre los iconos más reconocibles de la química. [82] La IUPAC participa hoy en muchos procesos relacionados con la tabla periódica: el reconocimiento y denominación de nuevos elementos, la recomendación de números de grupo y nombres colectivos, y la actualización de los pesos atómicos. [19]

Los elementos nombrados más recientemente (nihonio (113), moscovium (115), tennessine (117) y oganesson (118) – completaron la séptima fila de la tabla periódica. [19] Los elementos futuros tendrían que comenzar una octava fila . Se puede hacer referencia a estos elementos ya sea por sus números atómicos (por ejemplo, " elemento 119 "), o por los nombres sistemáticos de elementos de la IUPAC adoptados en 1978, que se relacionan directamente con los números atómicos (por ejemplo, "ununennium" para el elemento 119, derivado del latín unus "uno", ennea griega "nueve" y el sufijo tradicional -ium para elementos metálicos). [19] Todos los intentos de sintetizar tales elementos han fracasado hasta ahora. Desde 2018 se está intentando fabricar el elemento 119 en el instituto de investigación Riken de Japón. El LBNL en Estados Unidos y el JINR en Rusia también planean hacer sus propios intentos de sintetizar los primeros elementos del período 8. [252] [253] [254] [255] [256]
Si el octavo período siguiera el patrón establecido por los períodos anteriores, entonces contendría cincuenta elementos, llenando los subniveles 8s, 5g, 6f, 7d y finalmente 8p en ese orden. Pero llegado a este punto, los efectos relativistas deberían dar lugar a desviaciones significativas de la regla de Madelung. Se han sugerido varios modelos diferentes para las configuraciones de los elementos del octavo período, así como también cómo mostrar los resultados en una tabla periódica. Todos coinciden en que el octavo período debe comenzar como los anteriores con dos elementos 8, 119 y 120 . Sin embargo, después de eso, las superposiciones energéticas masivas entre las subcapas 5g, 6f, 7d y 8p significan que todas comienzan a llenarse juntas, y no está claro cómo separar las series específicas de 5g y 6f. [60] [257] [258] [259] [260] Por lo tanto, los elementos 121 a 156 no encajan bien como análogos químicos de ningún grupo anterior en las partes anteriores de la tabla, [129] aunque a veces se han colocado como 5g. , 6f y otras series para reflejar formalmente sus configuraciones electrónicas. [129] Eric Scerri ha planteado la cuestión de si una tabla periódica ampliada debería tener en cuenta el fracaso de la regla de Madelung en esta región, o si tales excepciones deberían ignorarse. [257] La estructura de capa también puede ser bastante formal en este punto: ya se espera que la distribución de electrones en un átomo de oganesson sea bastante uniforme, sin una estructura de capa discernible. [261]
La situación de los elementos 157 a 172 debería volver a la normalidad y recordar más a las filas anteriores. [251] Las pesadas capas p se dividen por la interacción espín-órbita : un orbital p (p 1/2 ) está más estabilizado y los otros dos (p 3/2 ) están desestabilizados. (Estos cambios en los números cuánticos ocurren para todos los tipos de capas, pero marcan la mayor diferencia en el orden de las capas p). Es probable que para el elemento 157, las capas 8s y 8p 1/2 llenas con cuatro electrones en total se han hundido en el núcleo. Más allá del núcleo, los siguientes orbitales son 7d y 9s con energías similares, seguidos por 9p 1/2 y 8p 3/2 con energías similares, y luego una gran brecha. [251] Por lo tanto, los orbitales 9s y 9p 1/2 en esencia reemplazan a los 8s y 8p 1/2 , lo que hace que los elementos 157-172 probablemente sean químicamente análogos a los grupos 3-18: por ejemplo, el elemento 164 aparecería dos lugares debajo del plomo. en el grupo 14 según el patrón habitual, pero se calcula que es muy análogo al paladio en el grupo 10. [55] [259] [60] [250] [129] Por lo tanto, se necesitan cincuenta y cuatro elementos en lugar de cincuenta para alcanzar el siguiente elemento noble después de 118. [262] Sin embargo, si bien estas conclusiones sobre la química de los elementos 157 a 172 son generalmente aceptado por los modelos, [129] [60] hay desacuerdo sobre si la tabla periódica debe dibujarse para reflejar analogías químicas, o si debe reflejar configuraciones electrónicas formales probables, que deberían ser bastante diferentes de períodos anteriores y no están acordadas entre ellos. fuentes. Por tanto, continúa la discusión sobre el formato de la octava fila. [60] [259] [260] [105]
Más allá del elemento 172, el cálculo se complica porque el nivel de energía del electrón 1s se vuelve imaginario. Tal situación tiene interpretación física y no plantea en sí misma un límite electrónico a la tabla periódica, pero la forma correcta de incorporar tales estados en cálculos multielectrónicos sigue siendo un problema abierto. Esto debería resolverse para continuar calculando la estructura de la tabla periódica más allá de este punto. [263]
La estabilidad nuclear probablemente será un factor decisivo que limite el número de elementos posibles. Depende del equilibrio entre la repulsión eléctrica entre los protones y la fuerza fuerte que une a los protones y los neutrones. [264] Los protones y neutrones están dispuestos en capas , al igual que los electrones, por lo que una capa cerrada puede aumentar significativamente la estabilidad: los núcleos superpesados conocidos existen debido a dicho cierre de capa, probablemente en alrededor de 114-126 protones y 184 neutrones. [263] Probablemente estén cerca de una isla de estabilidad prevista , donde los nucleidos superpesados deberían tener una vida más larga de lo esperado: las predicciones para los nucleidos más longevos en la isla varían desde microsegundos hasta millones de años. [105] [265] [266] No obstante, cabe señalar que se trata esencialmente de extrapolaciones a una parte desconocida del gráfico de nucleidos, y es necesario tener en cuenta las incertidumbres sistemáticas del modelo. [105]
A medida que se atraviesan las capas cerradas, el efecto estabilizador debería desaparecer: [267] por lo tanto, se espera que los nucleidos superpesados con más de 184 neutrones tengan tiempos de vida mucho más cortos y se fisionen espontáneamente en 10-15 segundos . Si esto es así, entonces no tendría sentido considerarlos elementos químicos: la IUPAC define que un elemento existe sólo si el núcleo vive más de 10 −14 segundos, el tiempo necesario para que forme una nube de electrones. No obstante, las estimaciones teóricas de las vidas medias dependen en gran medida del modelo y varían en muchos órdenes de magnitud. [263] Se predice que la repulsión extrema entre protones dará como resultado topologías nucleares exóticas, con burbujas, anillos y toros: esto complica aún más la extrapolación. [105] No está claro si existen cierres de capas más lejanos, debido a una esperada mancha de capas nucleares distintas (como ya se espera para las capas de electrones en oganesson). [267] Además, incluso si existen cierres de proyectiles posteriores, no está claro si permitirían la existencia de elementos tan pesados. [268] [269] [270] [177] Como tal, puede ser que la tabla periódica prácticamente termine alrededor del elemento 120, ya que los elementos se vuelven demasiado efímeros para observarlos, y luego demasiado efímeros para tener química; La era del descubrimiento de nuevos elementos estaría así cerca de su fin. [177] [271] Si existe otro cierre de capa de protón más allá de 126, entonces probablemente ocurra alrededor de 164; [268] por lo tanto, la región donde falla la periodicidad coincide más o menos con la región de inestabilidad entre los cierres de la capa. [129]
Alternativamente, la materia de los quarks puede volverse estable con números de masa elevados, en los que el núcleo está compuesto de quarks que fluyen libremente hacia arriba y hacia abajo en lugar de unirlos en protones y neutrones; esto crearía un continente de estabilidad en lugar de una isla. [272] [273] Otros efectos pueden entrar en juego: por ejemplo, en elementos muy pesados, es probable que los electrones 1s pasen una cantidad significativa de tiempo tan cerca del núcleo que en realidad estén dentro de él, lo que los haría vulnerables a captura de electrones . [274]
Incluso si pudieran existir elementos de la octava fila, producirlos probablemente sería difícil, y debería volverse aún más difícil a medida que aumente el número atómico. [275] Aunque se espera que los elementos 8s 119 y 120 sean alcanzables con los medios actuales, se espera que los elementos más allá requieran nueva tecnología, [276] si es que pueden producirse. [277] La caracterización química experimental de estos elementos también plantearía un gran desafío. [252]

La ley periódica se puede representar de múltiples formas, de las cuales la tabla periódica estándar es solo una. [278] Dentro de los 100 años posteriores a la aparición de la tabla de Mendeleev en 1869, Edward G. Mazurs había recopilado aproximadamente 700 versiones publicadas diferentes de la tabla periódica. [180] [279] Muchas formas conservan la estructura rectangular, incluida la tabla periódica del paso izquierdo de Charles Janet (en la foto de abajo) y la forma modernizada del diseño original de 8 columnas de Mendeleev que todavía es común en Rusia. Otros formatos de tablas periódicas han tenido formas mucho más exóticas, como las espirales ( la de Otto Theodor Benfey en la foto a la derecha), los círculos y los triángulos. [280]
A menudo se desarrollan tablas periódicas alternativas para resaltar o enfatizar las propiedades químicas o físicas de los elementos que no son tan evidentes en las tablas periódicas tradicionales, y otras se inclinan más hacia enfatizar la química o la física en ambos extremos. [281] La forma estándar, que sigue siendo, con diferencia, la más común, se sitúa en algún punto intermedio. [281]
Las muchas formas diferentes de la tabla periódica han suscitado la pregunta de si existe una forma óptima o definitiva de la tabla periódica y, de ser así, cuál podría ser. Actualmente no hay respuestas consensuadas a ninguna de las preguntas. [282] [281] La tabla del paso izquierdo de Janet se discute cada vez más como candidata a ser la forma óptima o más fundamental; Scerri ha escrito en apoyo de esto, ya que aclara la naturaleza del helio como un elemento de bloque s, aumenta la regularidad al repetir todas las longitudes de los períodos, sigue fielmente la regla de Madelung al hacer que cada período corresponda a un valor de n + ℓ y regulariza el número atómico. tríadas y la tendencia de anomalía de la primera fila. Si bien señala que la colocación de helio sobre los metales alcalinotérreos puede verse como una desventaja desde una perspectiva química, contrarresta esto apelando a la anomalía de la primera fila, señalando que la tabla periódica "se reduce fundamentalmente a la mecánica cuántica", y que se ocupa de "elementos abstractos" y, por tanto, de propiedades atómicas más que de propiedades macroscópicas. [283]
En el Grupo 15 de la Tabla Periódica, como en los dos grupos vecinos, el carácter metálico aumenta al descender. Más concretamente se produce una transición desde un elemento puramente no metálico (N), pasando por elementos con modificaciones no metálicas y metálicas, hasta elementos puramente metálicos (Sb, Bi). Este capítulo aborda los dos elementos además del nitrógeno, que son claramente no metálicos en condiciones estándar: fósforo y arsénico. La química del arsénico, sin embargo, sólo se describe brevemente ya que muchos de los compuestos de arsénico se parecen a las correspondientes especies de fósforo.
Los elementos superpesados (
Z
> 102) se tambalean en los límites de masa y carga.
「12.アルカリ土類金属」の範囲についても,△を含めれば,すべての教科書で提案が考慮されている。歴史的には第4 周期のカルシウム以下を指していた用語だったが,「周期表の2 族に対応する用語とする」というIUPAC の勧告1)に従うのは現在では自然な流れだろう.
El primer uso del término "transición" en su sentido electrónico moderno parece deberse al químico británico CRBury, quien utilizó por primera vez el término en su artículo de 1921 sobre la estructura electrónica de los átomos y la tabla periódica.