En física y química, el número cuántico de espín es un número cuántico (designado s ) que describe el momento angular intrínseco (o momento angular de espín, o simplemente espín ) de un electrón u otra partícula . Tiene el mismo valor para todas las partículas del mismo tipo, como por ejemplo s =1/2para todos los electrones. Es un número entero para todos los bosones , como los fotones , y un número medio impar para todos los fermiones , como los electrones y los protones .
La componente del espín a lo largo de un eje específico viene dada por el número cuántico magnético del espín , convencionalmente escrito m s . [1] [2] El valor de m s es el componente del momento angular de giro, en unidades de la constante de Planck reducida ħ , paralelo a una dirección dada (convencionalmente denominada eje z ). Puede tomar valores que van desde + sa − s en incrementos enteros. Para un electrón, m s puede ser ++1/2o -+1/2.
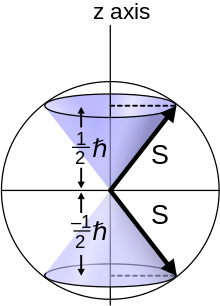
La frase número cuántico de espín se refiere al momento angular de espín cuantificado . El símbolo s se utiliza para el número cuántico de espín, y m s se describe como el número cuántico magnético de espín [3] o como el componente z del espín s z . [4]
Tanto el espín total como el componente z del espín están cuantificados, lo que da lugar a dos números cuánticos: el espín y los números cuánticos del imán de espín. [5] El número cuántico de espín (total) como un solo valor para cada partícula elemental. Algunos libros de texto de introducción a la química describen m s como el número cuántico de espín , [6] [7] y s no se menciona ya que su valor1/2es una propiedad fija del electrón; algunos incluso usan la variable s en lugar de m s . [5]
Los dos números cuánticos de espín y son los análogos del momento angular de espín de los dos números cuánticos de momento angular orbital y . [8] : 152
Los números cuánticos de espín se aplican también a sistemas de espines acoplados, como los átomos que pueden contener más de un electrón. Se utilizan símbolos en mayúscula: S para el giro electrónico total y m S o M S para el componente del eje z . Un par de electrones en estado singlete de espín tiene S = 0, y un par en estado triplete tiene S = 1, con m S = −1, 0 o +1. Los números cuánticos de espín nuclear se escriben convencionalmente I para el espín y m I o M I para el componente del eje z .
El nombre "espín" proviene de un giro geométrico del electrón alrededor de un eje, como propusieron Uhlenbeck y Goudsmit . Sin embargo, rápidamente se comprendió que esta imagen simplista era físicamente poco realista, porque requeriría que los electrones giraran más rápido que la velocidad de la luz. [9] Por lo tanto, fue reemplazado por una descripción mecánico-cuántica más abstracta.
Durante el período comprendido entre 1916 y 1925, se lograron muchos avances en relación con la disposición de los electrones en la tabla periódica . Para explicar el efecto Zeeman en el átomo de Bohr, Sommerfeld propuso que los electrones se basarían en tres "números cuánticos", n, k y m, que describían el tamaño de la órbita, la forma de la órbita y la dirección. hacia el que apuntaba la órbita. [10] Irving Langmuir había explicado en su artículo de 1919 sobre los electrones en sus capas: "Rydberg ha señalado que estos números se obtienen de la serie . El factor dos sugiere una simetría doble fundamental para todos los átomos estables". [11] Esta configuración fue adoptada por Edmund Stoner , en octubre de 1924 en su artículo 'La distribución de electrones entre niveles atómicos' publicado en la Revista Filosófica.
El éxito cualitativo del esquema de números cuánticos de Sommerfeld no logró explicar el efecto Zeeman en intensidades de campos magnéticos débiles, el efecto Zeeman anómalo . En diciembre de 1924, Wolfgang Pauli demostró que el momento angular del electrón central no estaba relacionado con el efecto como se había supuesto anteriormente. [12] : 563 Más bien propuso que sólo los electrones "ligeros" externos determinaban el momento angular y planteó la hipótesis de que esto requería un cuarto número cuántico con dos valores. [13] Este cuarto número cuántico se convirtió en el número cuántico magnético de espín.
Una vuelta- 1 /2La partícula se caracteriza por un número cuántico de momento angular para el espín s = 1 /2. En las soluciones de la ecuación de Schrödinger-Pauli , el momento angular se cuantifica de acuerdo con este número, de modo que la magnitud del momento angular de espín es
La estructura fina del espectro de hidrógeno se observa como un doblete correspondiente a dos posibilidades para el componente z del momento angular, donde para cualquier dirección dada z :
cuya solución tiene sólo dos posibles componentes z para el electrón. En el electrón, las dos orientaciones de espín diferentes a veces se denominan "giro ascendente" o "giro descendente".
La propiedad de espín de un electrón daría lugar al momento magnético , que era un requisito para el cuarto número cuántico.
El vector de momento magnético del espín de un electrón viene dado por:
donde está la carga del electrón , es la masa del electrón y es el factor g de espín del electrón , que es aproximadamente 2,0023. Su proyección en el eje z viene dada por el número cuántico magnético de espín según:
¿Dónde está el magnetón de Bohr ?
Cuando los átomos tienen un número par de electrones, el espín de cada electrón en cada orbital tiene una orientación opuesta a la de su vecino inmediato. Sin embargo, muchos átomos tienen un número impar de electrones o una disposición de electrones en la que hay un número desigual de orientaciones de "giro ascendente" y "descendente". Se dice que estos átomos o electrones tienen espines desapareados que se detectan en la resonancia de espín electrónico .
Los núcleos atómicos también tienen espines. El espín nuclear I es una propiedad fija de cada núcleo y puede ser un número entero o un semientero. El componente m I del espín nuclear paralelo al eje z puede tener (2 I + 1) valores I , I –1, ..., –I . Por ejemplo, un núcleo de 14 N tiene I = 1, de modo que hay 3 posibles orientaciones relativas al eje z , correspondientes a los estados m I = +1, 0 y −1. [14]
Los espines I de diferentes núcleos se interpretan utilizando el modelo de capa nuclear . Los núcleos pares con números pares de protones y neutrones, como el 12 C y el 16 O , tienen espín cero. Los núcleos con números de masa impares tienen espines semienteros, como3/ 2 por 7 Li , 1 /2para 13 C y5/ 2 para 17 O , normalmente correspondiente al momento angular del último nucleón añadido. Los núcleos impares con números impares de protones y neutrones tienen espines enteros, como 3 para 10 B y 1 para 14 N. [15] Los valores del espín nuclear para un isótopo determinado se encuentran en las listas de isótopos de cada elemento. (Ver isótopos de oxígeno , isótopos de aluminio , etc., etc.)
Cuando se examinan las líneas del espectro del hidrógeno a muy alta resolución, se descubre que son dobletes muy próximos entre sí. Esta división se llama estructura fina y fue una de las primeras evidencias experimentales del espín del electrón. La observación directa del momento angular intrínseco del electrón se logró en el experimento de Stern-Gerlach .
Era necesario demostrar experimentalmente la teoría de la cuantificación espacial del momento de espín del impulso de los electrones de los átomos situados en el campo magnético . En 1922 (dos años antes de que se creara la descripción teórica del espín), Otto Stern y Walter Gerlach lo observaron en el experimento que realizaron.
Los átomos de plata se evaporaron utilizando un horno eléctrico al vacío. Utilizando finas rendijas, los átomos fueron guiados hacia un haz plano y el haz se envió a través de un campo magnético no homogéneo antes de chocar con una placa metálica. Las leyes de la física clásica predicen que la colección de átomos de plata condensados en la placa debería formar una delgada línea continua con la misma forma que el haz original. Sin embargo, el campo magnético no homogéneo provocó que el haz se dividiera en dos direcciones distintas, creando dos líneas en la placa metálica.
El fenómeno se puede explicar con la cuantificación espacial del momento de espín. En los átomos, los electrones están emparejados de manera que uno gira hacia arriba y el otro hacia abajo, neutralizando el efecto de su espín sobre la acción del átomo en su conjunto. Pero en la capa de valencia de los átomos de plata hay un único electrón cuyo espín permanece desequilibrado.
El espín desequilibrado crea un momento magnético de espín , lo que hace que el electrón actúe como un imán muy pequeño. A medida que los átomos pasan a través del campo magnético no homogéneo, el momento de fuerza en el campo magnético influye en el dipolo del electrón hasta que su posición coincide con la dirección del campo más fuerte. Luego, el átomo sería atraído hacia o lejos del campo magnético más fuerte en una cantidad específica, dependiendo del valor del espín del electrón de valencia. Cuando el espín del electrón es ++ 1 /2el átomo se aleja del campo más fuerte y cuando el espín es -+ 1 /2el átomo se mueve hacia él. Así, el haz de átomos de plata se divide mientras viaja a través del campo magnético no homogéneo, según el espín del electrón de valencia de cada átomo.
En 1927, Phipps y Taylor llevaron a cabo un experimento similar utilizando átomos de hidrógeno con resultados similares. Posteriormente, los científicos realizaron experimentos utilizando otros átomos que tienen un solo electrón en su capa de valencia: ( cobre , oro , sodio , potasio ). Cada vez se formaban dos líneas en la placa metálica.
El núcleo atómico también puede tener espín, pero los protones y neutrones son mucho más pesados que los electrones (unas 1836 veces) y el momento dipolar magnético es inversamente proporcional a la masa. Entonces, el momento dipolar magnético nuclear es mucho menor que el del átomo completo. Este pequeño dipolo magnético fue medido posteriormente por Stern, Frisch y Easterman.
Para átomos o moléculas con un electrón desapareado, también se pueden observar transiciones en un campo magnético en las que solo cambia el número cuántico de espín, sin cambios en el orbital del electrón ni en los otros números cuánticos. Este es el método de resonancia paramagnética electrónica (EPR) o resonancia de espín electrónico (ESR), utilizado para estudiar los radicales libres . Dado que sólo cambia la interacción magnética del espín, el cambio de energía es mucho menor que en las transiciones entre orbitales, y los espectros se observan en la región de microondas .
Para una solución de la ecuación de Pauli no relativista o de la ecuación relativista de Dirac , el momento angular cuantificado (ver número cuántico de momento angular ) se puede escribir como:
Dada una dirección arbitraria z (generalmente determinada por un campo magnético externo), la proyección del espín z viene dada por
donde m s es el número cuántico de espín magnético , que va desde − sa + s en pasos de uno. Esto genera 2 s + 1 valores diferentes de m s .
Los valores permitidos para s son enteros no negativos o semienteros . Los fermiones tienen valores semienteros, incluidos el electrón , el protón y el neutrón , todos los cuales tienen s = + + 1 /2. Los bosones como el fotón y todos los mesones ) tienen valores de espín enteros.
La teoría algebraica del espín es una copia al carbón del momento angular de la teoría de la mecánica cuántica . [16] En primer lugar, el espín satisface la relación de conmutación fundamental :
A continuación, los vectores propios de y satisfacen:
En 1928, Paul Dirac desarrolló una ecuación de onda relativista , ahora denominada ecuación de Dirac , que predijo correctamente el momento magnético del espín y, al mismo tiempo, trató al electrón como una partícula puntual. Al resolver la ecuación de Dirac para los niveles de energía de un electrón en el átomo de hidrógeno, los cuatro números cuánticos, incluido s, ocurrieron de forma natural y coincidieron bien con el experimento.
Para algunos átomos, los espines de varios electrones desapareados ( s 1 , s 2 , ...) se acoplan para formar un número cuántico de espín total S. [17] [18] Esto ocurre especialmente en átomos ligeros (o en moléculas formadas solo por átomos ligeros) cuando el acoplamiento espín-órbita es débil en comparación con el acoplamiento entre espines o el acoplamiento entre momentos angulares orbitales , una situación conocida como acoplamiento LS porque L y S son constantes de movimiento . Aquí L es el número cuántico del momento angular orbital total . [18]
Para átomos con una S bien definida , la multiplicidad de un estado se define como 2 S + 1 . Esto es igual al número de valores posibles diferentes del momento angular total (orbital más espín) J para una combinación dada ( L , S ), siempre que S ≤ L (el caso típico). Por ejemplo, si S = 1, hay tres estados que forman un triplete . Los valores propios de S z para estos tres estados son +1ħ, 0 y −1ħ . [17] El término símbolo de un estado atómico indica sus valores de L , S y J.
Como ejemplo, los estados fundamentales tanto del átomo de oxígeno como de la molécula de dioxígeno tienen dos electrones desapareados y, por lo tanto, son estados tripletes. El estado atómico se describe con el término símbolo 3 P y el estado molecular con el término símbolo 3 Σ.−
gramo.