El nitrógeno es un elemento químico ; su símbolo es N y su número atómico es 7. El nitrógeno es un no metal y el miembro más ligero del grupo 15 de la tabla periódica , a menudo llamado pnicógenos . Es un elemento común en el universo , y se estima que ocupa el séptimo lugar en abundancia total en la Vía Láctea y el Sistema Solar . A temperatura y presión estándar , dos átomos del elemento se unen para formar N 2 , un gas diatómico incoloro e inodoro . El N 2 forma aproximadamente el 78% de la atmósfera de la Tierra , lo que lo convierte en la especie química más abundante en el aire. Debido a la volatilidad de los compuestos de nitrógeno, el nitrógeno es relativamente raro en las partes sólidas de la Tierra.
Fue descubierto y aislado por primera vez por el médico escocés Daniel Rutherford en 1772 y de forma independiente por Carl Wilhelm Scheele y Henry Cavendish aproximadamente al mismo tiempo. El nombre nitrogène fue sugerido por el químico francés Jean-Antoine-Claude Chaptal en 1790 cuando se descubrió que el nitrógeno estaba presente en el ácido nítrico y los nitratos . Antoine Lavoisier sugirió en su lugar el nombre azote , del griego antiguo : ἀζωτικός "sin vida", ya que es un gas asfixiante ; este nombre se utiliza en varios idiomas y aparece en los nombres en inglés de algunos compuestos de nitrógeno como la hidracina , las azidas y los compuestos azoicos .
El nitrógeno elemental se produce generalmente a partir del aire mediante tecnología de adsorción por oscilación de presión . Aproximadamente 2/3 del nitrógeno elemental producido comercialmente se utiliza como gas inerte (sin oxígeno) para usos comerciales, como el envasado de alimentos, y gran parte del resto se utiliza como nitrógeno líquido en aplicaciones criogénicas . Muchos compuestos industrialmente importantes, como el amoníaco , el ácido nítrico, los nitratos orgánicos ( propulsores y explosivos ) y los cianuros , contienen nitrógeno. El triple enlace extremadamente fuerte en el nitrógeno elemental (N≡N), el segundo enlace más fuerte en cualquier molécula diatómica después del monóxido de carbono (CO), [8] domina la química del nitrógeno. Esto causa dificultades tanto para los organismos como para la industria a la hora de convertir el N 2 en compuestos útiles , pero al mismo tiempo significa que la quema, explosión o descomposición de compuestos de nitrógeno para formar gas nitrógeno libera grandes cantidades de energía a menudo útil. El amoníaco y los nitratos producidos sintéticamente son fertilizantes industriales clave , y los nitratos fertilizantes son contaminantes clave en la eutrofización de los sistemas hídricos. Además de su uso en fertilizantes y depósitos de energía, el nitrógeno es un componente de compuestos orgánicos tan diversos como las aramidas utilizadas en tejidos de alta resistencia y el cianoacrilato empleado en el pegamento instantáneo .
El nitrógeno se encuentra en todos los organismos, principalmente en los aminoácidos (y por lo tanto en las proteínas ), en los ácidos nucleicos ( ADN y ARN ) y en la molécula de transferencia de energía trifosfato de adenosina . El cuerpo humano contiene aproximadamente un 3% de nitrógeno en masa, el cuarto elemento más abundante en el cuerpo después del oxígeno, el carbono y el hidrógeno. El ciclo del nitrógeno describe el movimiento del elemento desde el aire, hacia la biosfera y los compuestos orgánicos, y luego de regreso a la atmósfera. El nitrógeno es un componente de cada clase farmacológica importante, incluidos los antibióticos . Muchos medicamentos son imitadores o profármacos de moléculas de señal naturales que contienen nitrógeno : por ejemplo, los nitratos orgánicos nitroglicerina y nitroprusiato controlan la presión arterial metabolizándose en óxido nítrico . Muchos medicamentos notables que contienen nitrógeno, como la cafeína natural y la morfina o las anfetaminas sintéticas , actúan sobre los receptores de neurotransmisores animales .

Los compuestos nitrogenados tienen una historia muy larga, ya que Heródoto conocía el cloruro de amonio . Eran bien conocidos en la Edad Media. Los alquimistas conocían el ácido nítrico como aqua fortis (agua fuerte), así como otros compuestos nitrogenados como las sales de amonio y las sales de nitrato . La mezcla de ácidos nítrico y clorhídrico se conocía como agua regia (agua real), famosa por su capacidad para disolver el oro , el rey de los metales. [9]
El descubrimiento del nitrógeno se atribuye al médico escocés Daniel Rutherford en 1772, quien lo llamó aire nocivo . [10] [11] Aunque no lo reconoció como una sustancia química completamente diferente, lo distinguió claramente del "aire fijo" de Joseph Black , o dióxido de carbono. [12] El hecho de que hubiera un componente del aire que no favorece la combustión era evidente para Rutherford, aunque no sabía que fuera un elemento. El nitrógeno también fue estudiado aproximadamente al mismo tiempo por Carl Wilhelm Scheele , [13] Henry Cavendish , [14] y Joseph Priestley , [15] quienes se refirieron a él como aire quemado o aire flogístico . El químico francés Antoine Lavoisier se refirió al gas nitrógeno como "aire mefítico" o azote , de la palabra griega άζωτικός (azotikos), "sin vida", debido a que es asfixiante . [16] [17] En una atmósfera de nitrógeno puro, los animales morían y las llamas se extinguían. Aunque el nombre de Lavoisier no fue aceptado en inglés porque se señaló que todos los gases, excepto el oxígeno, son asfixiantes o directamente tóxicos, se utiliza en muchos idiomas (francés, italiano, portugués, polaco, ruso, albanés, turco, etc.; el alemán Stickstoff se refiere de manera similar a la misma característica, es decir, ersticken "ahogar o sofocar") y todavía permanece en inglés en los nombres comunes de muchos compuestos de nitrógeno, como la hidracina y los compuestos del ion azida . Finalmente, dio lugar al nombre " pnictógenos " para el grupo encabezado por el nitrógeno, del griego πνίγειν "ahogar". [9]
La palabra inglesa nitrogen (1794) entró en el idioma a partir del francés nitrogène , acuñado en 1790 por el químico francés Jean-Antoine Chaptal (1756-1832), [18] del francés nitre ( nitrato de potasio , también llamado salitre ) y el sufijo francés -gène , "produciendo", del griego -γενής (-genes, "engendrado"). El significado de Chaptal era que el nitrógeno es la parte esencial del ácido nítrico , que a su vez se producía a partir del nitro . En épocas anteriores, el nitro se había confundido con el "natrón" egipcio ( carbonato de sodio ), llamado νίτρον (nitron) en griego, que, a pesar del nombre, no contenía nitrato. [19]
Las primeras aplicaciones militares, industriales y agrícolas de los compuestos de nitrógeno utilizaban salitre ( nitrato de sodio o nitrato de potasio), sobre todo en la pólvora y, más tarde, como fertilizante . En 1910, Lord Rayleigh descubrió que una descarga eléctrica en el gas nitrógeno producía "nitrógeno activo", un alótropo monoatómico del nitrógeno. [20] La "nube giratoria de luz amarilla brillante" producida por su aparato reaccionaba con el mercurio para producir nitruro de mercurio explosivo . [21]
Durante mucho tiempo, las fuentes de compuestos nitrogenados fueron limitadas. Las fuentes naturales se originaban en la biología o en depósitos de nitratos producidos por reacciones atmosféricas. La fijación de nitrógeno mediante procesos industriales como el proceso Frank-Caro (1895-1899) y el proceso Haber-Bosch (1908-1913) aliviaron esta escasez de compuestos nitrogenados, hasta el punto de que la mitad de la producción mundial de alimentos depende ahora de fertilizantes nitrogenados sintéticos. [22] Al mismo tiempo, el uso del proceso Ostwald (1902) para producir nitratos a partir de la fijación industrial de nitrógeno permitió la producción industrial a gran escala de nitratos como materia prima en la fabricación de explosivos en las guerras mundiales del siglo XX. [23] [24]

Un átomo de nitrógeno tiene siete electrones. En el estado fundamental, están dispuestos en la configuración electrónica 1s.2
2s2
2p1
x2p1
año2p1z
. Por lo tanto, tiene cinco electrones de valencia en los orbitales 2s y 2p, tres de los cuales (los electrones p) no están apareados. Tiene una de las electronegatividades más altas entre los elementos (3,04 en la escala de Pauling), superada solo por el cloro (3,16), el oxígeno (3,44) y el flúor (3,98). (Los gases nobles ligeros , helio , neón y argón , presumiblemente también serían más electronegativos y, de hecho, lo están en la escala de Allen). [25] Siguiendo las tendencias periódicas, su radio covalente de enlace simple de 71 pm es menor que los del boro (84 pm) y el carbono (76 pm), mientras que es mayor que los del oxígeno (66 pm) y el flúor (57 pm). El anión nitruro , N 3− , es mucho más grande a 146 pm, similar al de los aniones óxido (O 2− : 140 pm) y fluoruro (F − : 133 pm). [25] Las primeras tres energías de ionización del nitrógeno son 1,402, 2,856 y 4,577 MJ·mol −1 , y la suma de la cuarta y la quinta es16.920 MJ·mol −1 . Debido a estas cifras tan altas, el nitrógeno no tiene una química catiónica sencilla. [26]
La falta de nodos radiales en la subcapa 2p es directamente responsable de muchas de las propiedades anómalas de la primera fila del bloque p , especialmente en nitrógeno, oxígeno y flúor. La subcapa 2p es muy pequeña y tiene un radio muy similar a la capa 2s, lo que facilita la hibridación orbital . También da lugar a fuerzas electrostáticas de atracción muy grandes entre el núcleo y los electrones de valencia en las capas 2s y 2p, lo que da lugar a electronegatividades muy elevadas. La hipervalencia es casi desconocida en los elementos 2p por la misma razón, porque la alta electronegatividad dificulta que un átomo de nitrógeno pequeño sea un átomo central en un enlace de cuatro electrones y tres centros rico en electrones , ya que tendería a atraer fuertemente a los electrones hacia sí mismo. Por lo tanto, a pesar de la posición del nitrógeno a la cabeza del grupo 15 en la tabla periódica, su química muestra enormes diferencias con la de sus congéneres más pesados: el fósforo , el arsénico , el antimonio y el bismuto . [27]
El nitrógeno puede compararse de forma útil con sus vecinos horizontales, el carbono y el oxígeno, así como con sus vecinos verticales en la columna de nitruro, el fósforo, el arsénico, el antimonio y el bismuto. Aunque cada elemento del período 2, desde el litio hasta el oxígeno, muestra algunas similitudes con el elemento del período 3 del siguiente grupo (desde el magnesio hasta el cloro; estas se conocen como relaciones diagonales ), su grado cae abruptamente más allá del par boro-silicio. Las similitudes del nitrógeno con el azufre se limitan principalmente a los compuestos del anillo de nitruro de azufre cuando ambos elementos son los únicos presentes. [28]
El nitrógeno no comparte la tendencia del carbono a la concatenación . Al igual que el carbono, el nitrógeno tiende a formar compuestos iónicos o metálicos con los metales. El nitrógeno forma una amplia serie de nitruros con el carbono, incluidos aquellos con estructuras de tipo cadena, grafítico y fullerénico . [29]
Se asemeja al oxígeno por su alta electronegatividad y su capacidad concomitante para formar enlaces de hidrógeno y formar complejos de coordinación mediante la donación de sus pares solitarios de electrones. Existen algunos paralelismos entre la química del amoniaco NH 3 y el agua H 2 O. Por ejemplo, la capacidad de ambos compuestos de ser protonados para dar NH 4 + y H 3 O + o desprotonados para dar NH 2 − y OH − , siendo todos ellos capaces de aislarse en compuestos sólidos. [30]
El nitrógeno comparte con sus vecinos horizontales una preferencia por formar enlaces múltiples, típicamente con carbono, oxígeno u otros átomos de nitrógeno, a través de interacciones p π –p π . [28] Así, por ejemplo, el nitrógeno se presenta como moléculas diatómicas y por lo tanto tiene puntos de fusión (−210 °C) y de ebullición (−196 °C) mucho más bajos que el resto de su grupo, ya que las moléculas de N 2 solo se mantienen unidas por interacciones débiles de van der Waals y hay muy pocos electrones disponibles para crear dipolos instantáneos significativos. Esto no es posible para sus vecinos verticales; por lo tanto, los óxidos de nitrógeno , nitritos , nitratos , compuestos nitro , nitroso , azo y diazo , azidas , cianatos , tiocianatos y derivados de imino no encuentran eco con fósforo, arsénico, antimonio o bismuto. De la misma manera, sin embargo, la complejidad de los oxiácidos de fósforo no encuentra eco en el nitrógeno. [28] Dejando de lado sus diferencias, el nitrógeno y el fósforo forman entre sí una extensa serie de compuestos que tienen estructuras de cadena, anillo y jaula. [31]
Tabla de propiedades térmicas y físicas del nitrógeno (N 2 ) a presión atmosférica: [32] [33]

El nitrógeno tiene dos isótopos estables : 14 N y 15 N. El primero es mucho más común, ya que constituye el 99,634% del nitrógeno natural, y el segundo (que es ligeramente más pesado) constituye el 0,366% restante. Esto conduce a un peso atómico de alrededor de 14,007 u. [25] Ambos isótopos estables se producen en el ciclo CNO en las estrellas , pero 14 N es más común ya que su captura de protones es el paso limitante de la velocidad. 14 N es uno de los cinco nucleidos estables impar-impar (un nucleido que tiene un número impar de protones y neutrones); los otros cuatro son 2 H , 6 Li, 10 B y 180m Ta. [34]
La abundancia relativa de 14 N y 15 N es prácticamente constante en la atmósfera, pero puede variar en otras partes, debido al fraccionamiento isotópico natural de las reacciones redox biológicas y la evaporación de amoníaco natural o ácido nítrico . [35] Las reacciones mediadas biológicamente (por ejemplo, asimilación , nitrificación y desnitrificación ) controlan fuertemente la dinámica del nitrógeno en el suelo. Estas reacciones generalmente resultan en un enriquecimiento de 15 N del sustrato y el agotamiento del producto . [36]
El isótopo pesado 15 N fue descubierto por primera vez por SM Naudé en 1929, y poco después se descubrieron los isótopos pesados de los elementos vecinos oxígeno y carbono . [37] Presenta una de las secciones eficaces de captura de neutrones térmicos más bajas de todos los isótopos. [38] Se utiliza con frecuencia en la espectroscopia de resonancia magnética nuclear (RMN) para determinar las estructuras de las moléculas que contienen nitrógeno, debido a su espín nuclear fraccional de la mitad, que ofrece ventajas para la RMN, como un ancho de línea más estrecho. El 14 N, aunque también se puede utilizar en teoría, tiene un espín nuclear entero de uno y, por lo tanto, tiene un momento cuadrupolar que conduce a espectros más amplios y menos útiles. [25] Sin embargo, la RMN de 15 N tiene complicaciones que no se encuentran en la espectroscopia de RMN de 1 H y 13 C más común. La baja abundancia natural de 15 N (0,36%) reduce significativamente la sensibilidad, un problema que solo se ve agravado por su baja relación giromagnética (solo el 10,14% de la de 1 H). Como resultado, la relación señal-ruido para 1 H es aproximadamente 300 veces mayor que la de 15 N con la misma intensidad de campo magnético. [39] Esto se puede aliviar un poco mediante el enriquecimiento isotópico de 15 N mediante intercambio químico o destilación fraccionada. Los compuestos enriquecidos con 15 N tienen la ventaja de que, en condiciones estándar, no experimentan intercambio químico de sus átomos de nitrógeno con el nitrógeno atmosférico, a diferencia de los compuestos con isótopos marcados de hidrógeno , carbono y oxígeno que deben mantenerse alejados de la atmósfera. [25] La relación 15 N: 14 N se usa comúnmente en el análisis de isótopos estables en los campos de la geoquímica , la hidrología , la paleoclimatología y la paleoceanografía , donde se denomina δ 15 N. [40]
De los otros trece isótopos producidos sintéticamente, que van desde 9 N a 23 N, 13 N tiene una vida media de diez minutos y los isótopos restantes tienen vidas medias de menos de ocho segundos. [41] [42] Dada la diferencia de vida media, 13 N es el radioisótopo de nitrógeno más importante, siendo relativamente lo suficientemente longevo como para usarse en tomografía por emisión de positrones (PET), aunque su vida media todavía es corta y, por lo tanto, debe producirse en el lugar de la PET, por ejemplo en un ciclotrón a través del bombardeo de protones de 16 O produciendo 13 N y una partícula alfa . [43]
El radioisótopo 16 N es el radionúclido dominante en el refrigerante de los reactores de agua a presión o de agua en ebullición durante el funcionamiento normal. Se produce a partir de 16 O (en agua) mediante una reacción (n,p) , en la que el átomo de 16 O captura un neutrón y expulsa un protón. Tiene una vida media corta de unos 7,1 s, [42] pero su desintegración de nuevo en 16 O produce radiación gamma de alta energía (5 a 7 MeV). [42] [44] Debido a esto, el acceso a la tubería de refrigerante primario en un reactor de agua a presión debe restringirse durante el funcionamiento del reactor . [44] Es un indicador sensible e inmediato de fugas del sistema de refrigeración primario al ciclo de vapor secundario y es el principal medio de detección de dichas fugas. [44]

El nitrógeno atómico, también conocido como nitrógeno activo, es altamente reactivo, ya que es un trirradical con tres electrones desapareados. Los átomos de nitrógeno libre reaccionan fácilmente con la mayoría de los elementos para formar nitruros, e incluso cuando dos átomos de nitrógeno libre chocan para producir una molécula de N2 excitada , pueden liberar tanta energía al colisionar incluso con moléculas tan estables como el dióxido de carbono y el agua que causan la fisión homolítica en radicales como CO y O u OH y H. El nitrógeno atómico se prepara haciendo pasar una descarga eléctrica a través de gas nitrógeno a 0,1–2 mmHg, que produce nitrógeno atómico junto con una emisión de color amarillo melocotón que se desvanece lentamente como un resplandor durante varios minutos incluso después de que termina la descarga. [28]
Dada la gran reactividad del nitrógeno atómico, el nitrógeno elemental se presenta generalmente como N 2 molecular , dinitrógeno. Esta molécula es un gas diamagnético incoloro, inodoro e insípido en condiciones estándar: se funde a −210 °C y hierve a −196 °C. [28] El dinitrógeno es en su mayoría no reactivo a temperatura ambiente, pero sin embargo reaccionará con el metal litio y algunos complejos de metales de transición . Esto se debe a su enlace, que es único entre los elementos diatómicos en condiciones estándar en el sentido de que tiene un triple enlace N≡N . Los triples enlaces tienen longitudes de enlace cortas (en este caso, 109,76 pm) y altas energías de disociación (en este caso, 945,41 kJ/mol), y por lo tanto son muy fuertes, lo que explica el bajo nivel de reactividad química del dinitrógeno. [28] [45]
Se pueden encontrar otros oligómeros y polímeros de nitrógeno. Si se pudieran sintetizar, podrían tener aplicaciones potenciales como materiales con una densidad energética muy alta, que podrían usarse como potentes propelentes o explosivos. [46] Bajo presiones extremadamente altas (1,1 millones de atm ) y temperaturas altas (2000 K), como las que se producen en una celda de yunque de diamante , el nitrógeno se polimeriza en la estructura cristalina cúbica de enlace simple gauche. Esta estructura es similar a la del diamante , y ambos tienen enlaces covalentes extremadamente fuertes , lo que da lugar a su apodo de "diamante de nitrógeno". [47]

A presión atmosférica , el nitrógeno molecular se condensa ( se licúa ) a 77 K (−195,79 ° C ) y se congela a 63 K (−210,01 °C) [48] en la forma alotrópica de cristal compacto hexagonal beta. Por debajo de 35,4 K (−237,6 °C), el nitrógeno asume la forma alotrópica de cristal cúbico (llamada fase alfa). [49] El nitrógeno líquido , un fluido incoloro que se parece al agua en apariencia, pero con el 80,8% de la densidad (la densidad del nitrógeno líquido en su punto de ebullición es 0,808 g/mL), es un criógeno común . [50] El nitrógeno sólido tiene muchas modificaciones cristalinas. Forma una importante cobertura de superficie dinámica en Plutón [51] y las lunas exteriores del Sistema Solar como Tritón . [52] Incluso a bajas temperaturas, el nitrógeno sólido es bastante volátil y puede sublimar para formar una atmósfera o condensarse nuevamente en forma de escarcha de nitrógeno. Es muy débil y fluye en forma de glaciares, y en Tritón, los géiseres de gas nitrógeno provienen de la región de los casquetes polares. [53]

El primer ejemplo de un complejo de dinitrógeno que se descubrió fue [Ru(NH 3 ) 5 (N 2 )] 2+ (ver figura a la derecha), y pronto se descubrieron muchos otros complejos similares. Estos complejos , en los que una molécula de nitrógeno dona al menos un par solitario de electrones a un catión metálico central, ilustran cómo el N 2 podría unirse al metal o metales en la nitrogenasa y el catalizador para el proceso Haber : estos procesos que implican la activación del dinitrógeno son de vital importancia en biología y en la producción de fertilizantes. [54] [55]
El dinitrógeno es capaz de coordinarse con los metales de cinco formas diferentes. Las formas mejor caracterizadas son la M←N≡N ( η 1 ) y la M←N≡N→M ( μ , bis- η 1 ), en las que los pares solitarios de los átomos de nitrógeno se donan al catión metálico. Las formas menos caracterizadas implican que el dinitrógeno done pares de electrones del triple enlace, ya sea como ligando puente a dos cationes metálicos ( μ , bis- η 2 ) o a solo uno ( η 2 ). El quinto y único método implica la triple coordinación como ligando puente, donando los tres pares de electrones del triple enlace ( μ 3 -N 2 ). Algunos complejos presentan múltiples ligandos N 2 y algunos presentan N 2 unido de múltiples formas. Dado que el N 2 es isoelectrónico con el monóxido de carbono (CO) y el acetileno (C 2 H 2 ), el enlace en los complejos de dinitrógeno está estrechamente relacionado con el de los compuestos carbonílicos , aunque el N 2 es un donador σ y un aceptor π más débil que el CO. Los estudios teóricos muestran que la donación σ es un factor más importante que permite la formación del enlace M–N que la donación inversa π , que en su mayoría solo debilita el enlace N–N, y la donación de extremo ( η 1 ) se logra más fácilmente que la donación de lado ( η 2 ). [28]
En la actualidad, se conocen complejos de dinitrógeno para casi todos los metales de transición , lo que representa varios cientos de compuestos. Normalmente se preparan mediante tres métodos: [28]
Ocasionalmente, el enlace N≡N puede formarse directamente dentro de un complejo metálico, por ejemplo, al reaccionar directamente amoníaco coordinado (NH 3 ) con ácido nitroso (HNO 2 ), pero esto no es generalmente aplicable. La mayoría de los complejos de dinitrógeno tienen colores dentro del rango blanco-amarillo-naranja-rojo-marrón; se conocen algunas excepciones, como el azul [{Ti( η 5 -C 5 H 5 ) 2 } 2 -(N 2 )]. [28]
El nitrógeno se enlaza con casi todos los elementos de la tabla periódica, excepto los dos primeros gases nobles , helio y neón , y algunos de los elementos de vida muy corta después del bismuto , creando una inmensa variedad de compuestos binarios con propiedades y aplicaciones variables. [28] Se conocen muchos compuestos binarios: con la excepción de los hidruros, óxidos y fluoruros de nitrógeno, estos se denominan típicamente nitruros . Muchas fases estequiométricas suelen estar presentes para la mayoría de los elementos (por ejemplo, MnN, Mn 6 N 5 , Mn 3 N 2 , Mn 2 N, Mn 4 N y Mn x N para 9,2 < x < 25,3). Pueden clasificarse como "similares a sales" (principalmente iónicos), covalentes, "similares a diamantes" y metálicos (o intersticiales ), aunque esta clasificación tiene limitaciones que generalmente se derivan de la continuidad de los tipos de enlace en lugar de los tipos discretos y separados que implica. Normalmente se preparan haciendo reaccionar directamente un metal con nitrógeno o amoníaco (a veces después de calentarlo), o por descomposición térmica de amidas metálicas: [56]
Son posibles muchas variantes de estos procesos. Los nitruros más iónicos son los de los metales alcalinos y alcalinotérreos , Li 3 N (Na, K, Rb y Cs no forman nitruros estables por razones estéricas) y M 3 N 2 (M = Be, Mg, Ca, Sr, Ba). Estos pueden considerarse formalmente como sales del anión N 3− , aunque la separación de cargas en realidad no es completa ni siquiera para estos elementos altamente electropositivos. Sin embargo, las azidas de metales alcalinos NaN 3 y KN 3 , que presentan la estructura lineal N−
3Los aniones son bien conocidos, al igual que el Sr(N 3 ) 2 y el Ba(N 3 ) 2 . Las azidas de los metales del subgrupo B (aquellos en los grupos 11 a 16 ) son mucho menos iónicas, tienen estructuras más complicadas y detonan fácilmente cuando se someten a un choque. [56]
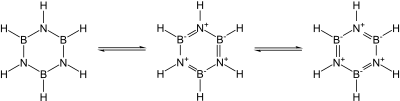
Se conocen muchos nitruros binarios covalentes. Algunos ejemplos son el cianógeno ((CN) 2 ), el pentanitruro de trifósforo ( P3N5 ) , el dinitruro de disulfuro ( S2N2 ) y el tetranitruro de tetraazufre ( S4N4 ) . También se conocen el nitruro de silicio ( Si3N4 ) y el nitruro de germanio ( Ge3N4 ) , que son esencialmente covalentes : el nitruro de silicio, en particular, sería un material cerámico prometedor si no fuera por la dificultad de trabajarlo y sinterizarlo. En particular, los nitruros del grupo 13 , la mayoría de los cuales son semiconductores prometedores , son isoelectrónicos con el grafito, el diamante y el carburo de silicio y tienen estructuras similares: su enlace cambia de covalente a parcialmente iónico y metálico a medida que desciende el grupo. En particular, dado que la unidad B–N es isoelectrónica a C–C, y el carbono es esencialmente intermedio en tamaño entre el boro y el nitrógeno, gran parte de la química orgánica encuentra un eco en la química boro-nitrógeno, como en la borazina (" benceno inorgánico "). Sin embargo, la analogía no es exacta debido a la facilidad de ataque nucleofílico en el boro debido a su deficiencia de electrones, lo que no es posible en un anillo que contiene completamente carbono. [56]
La categoría más grande de nitruros son los nitruros intersticiales de fórmulas MN, M2N y M4N ( aunque es perfectamente posible que tengan una composición variable), en los que los pequeños átomos de nitrógeno se colocan en los huecos de una red metálica compacta, cúbica o hexagonal . Son opacos, muy duros y químicamente inertes, fundiéndose sólo a temperaturas muy altas (generalmente superiores a 2500 °C). Tienen un brillo metálico y conducen la electricidad como los metales. Se hidrolizan sólo muy lentamente para dar amoníaco o nitrógeno. [56]
El anión nitruro (N 3− ) es el donante π más fuerte conocido entre los ligandos (el segundo más fuerte es O 2− ). Los complejos de nitruro generalmente se forman por descomposición térmica de azidas o por desprotonación de amoníaco, y generalmente involucran un grupo terminal {≡N} 3− . El anión azida lineal ( N−
3), al ser isoelectrónico con óxido nitroso , dióxido de carbono y cianato , forma muchos complejos de coordinación. La concatenación posterior es rara, aunque N4−
4(isoelectrónico con carbonato y nitrato ) es conocido. [56]

Industrialmente, el amoniaco (NH3 ) es el compuesto más importante del nitrógeno y se prepara en mayores cantidades que cualquier otro compuesto porque contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de alimentos y fertilizantes. Es un gas alcalino incoloro con un olor penetrante característico. La presencia de enlaces de hidrógeno tiene efectos muy significativos en el amoniaco, lo que le confiere sus altos puntos de fusión (−78 °C) y ebullición (−33 °C). Como líquido, es un muy buen disolvente con un alto calor de vaporización (lo que permite su uso en frascos de vacío), que también tiene una baja viscosidad y conductividad eléctrica y una alta constante dieléctrica , y es menos denso que el agua. Sin embargo, el enlace de hidrógeno en NH 3 es más débil que en H 2 O debido a la menor electronegatividad del nitrógeno en comparación con el oxígeno y la presencia de solo un par solitario en NH 3 en lugar de dos en H 2 O. Es una base débil en solución acuosa ( p K b 4,74); su ácido conjugado es amonio , NH+
4También puede actuar como un ácido extremadamente débil, perdiendo un protón para producir el anión amida, NH−
2. Por lo tanto, sufre una autodisociación, similar al agua, para producir amonio y amida. El amoníaco arde en aire u oxígeno, aunque no fácilmente, para producir gas nitrógeno; arde en flúor con una llama de color amarillo verdoso para dar trifluoruro de nitrógeno . Las reacciones con los otros no metales son muy complejas y tienden a dar lugar a una mezcla de productos. El amoníaco reacciona al calentarse con metales para dar nitruros. [58]
Se conocen muchos otros hidruros de nitrógeno binarios, pero los más importantes son la hidracina ( N2H4 ) y la azida de hidrógeno (HN3 ) . Aunque no es un hidruro de nitrógeno, la hidroxilamina (NH2OH ) es similar en propiedades y estructura al amoníaco y a la hidracina. La hidracina es un líquido incoloro y humeante que huele de forma similar al amoníaco. Sus propiedades físicas son muy similares a las del agua (punto de fusión 2,0 °C, punto de ebullición 113,5 °C, densidad 1,00 g/cm3 ) . A pesar de ser un compuesto endotérmico, es cinéticamente estable. Se quema rápidamente y completamente en el aire de forma muy exotérmica para dar nitrógeno y vapor de agua. Es un agente reductor muy útil y versátil y es una base más débil que el amoníaco. [59] También se utiliza comúnmente como combustible para cohetes. [60]
La hidracina se fabrica generalmente mediante la reacción del amoníaco con hipoclorito de sodio alcalino en presencia de gelatina o pegamento: [59]
(Los ataques del hidróxido y el amoníaco pueden revertirse, pasando así a través del intermediario NHCl − en su lugar). La razón para agregar gelatina es que elimina iones metálicos como Cu 2+ que cataliza la destrucción de la hidrazina por reacción con monocloramina (NH 2 Cl) para producir cloruro de amonio y nitrógeno. [59]
La azida de hidrógeno (HN 3 ) se produjo por primera vez en 1890 mediante la oxidación de hidrazina acuosa con ácido nitroso. Es muy explosiva e incluso las soluciones diluidas pueden ser peligrosas. Tiene un olor desagradable e irritante y es un veneno potencialmente letal (pero no acumulativo). Puede considerarse el ácido conjugado del anión azida y es análogo a los ácidos hidrohalogenados . [59]

Se conocen los cuatro trihaluros de nitrógeno simples. Se conocen algunos haluros mixtos e hidrohaluros, pero en su mayoría son inestables; algunos ejemplos son NClF 2 , NCl 2 F, NBrF 2 , NF 2 H, NFH 2 , NCl 2 H y NClH 2 . [61]
El trifluoruro de nitrógeno (NF 3 , preparado por primera vez en 1928) es un gas incoloro e inodoro que es termodinámicamente estable y se produce más fácilmente mediante la electrólisis del fluoruro de amonio fundido disuelto en fluoruro de hidrógeno anhidro . Al igual que el tetrafluoruro de carbono , no es en absoluto reactivo y es estable en agua o en ácidos o álcalis acuosos diluidos. Solo cuando se calienta actúa como agente fluorante y reacciona con cobre , arsénico, antimonio y bismuto al contacto a altas temperaturas para dar tetrafluorohidrazina (N 2 F 4 ). Los cationes NF+
4y N
2F+
3También se conocen (este último por la reacción de la tetrafluorohidrazina con fuertes aceptores de fluoruro como el pentafluoruro de arsénico ), al igual que el ONF 3 , que ha despertado interés debido a la corta distancia N–O que implica un doble enlace parcial y el enlace N–F altamente polar y largo. La tetrafluorohidrazina, a diferencia de la propia hidrazina, puede disociarse a temperatura ambiente y superior para dar el radical NF 2 •. La azida de flúor (FN 3 ) es muy explosiva y térmicamente inestable. El difluoruro de dinitrógeno (N 2 F 2 ) existe como isómeros cis y trans térmicamente interconvertibles , y se encontró por primera vez como un producto de la descomposición térmica del FN 3 . [61]
El tricloruro de nitrógeno (NCl 3 ) es un líquido denso, volátil y explosivo cuyas propiedades físicas son similares a las del tetracloruro de carbono , aunque una diferencia es que el NCl 3 se hidroliza fácilmente con agua mientras que el CCl 4 no. Fue sintetizado por primera vez en 1811 por Pierre Louis Dulong , quien perdió tres dedos y un ojo por sus tendencias explosivas. Como gas diluido es menos peligroso y por lo tanto se utiliza industrialmente para blanquear y esterilizar harina. El tribromuro de nitrógeno (NBr 3 ), preparado por primera vez en 1975, es un sólido volátil, sensible a la temperatura y de color rojo oscuro que es explosivo incluso a -100 °C. El triyoduro de nitrógeno (NI 3 ) es aún más inestable y solo se preparó en 1990. Su aducto con amoníaco, que se conocía antes, es muy sensible a los golpes: puede activarse con el toque de una pluma, corrientes de aire cambiantes o incluso partículas alfa . [61] [62] Por esta razón, a veces se sintetizan pequeñas cantidades de triyoduro de nitrógeno como demostración a estudiantes de química de secundaria o como un acto de "magia química". [63] La azida de cloro (ClN 3 ) y la azida de bromo (BrN 3 ) son extremadamente sensibles y explosivas. [64] [65]
Se conocen dos series de oxohaluros de nitrógeno: los haluros de nitrosilo (XNO) y los haluros de nitrilo (XNO 2 ). Los primeros son gases muy reactivos que se pueden obtener halogenando directamente el óxido nitroso. El fluoruro de nitrosilo (NOF) es incoloro y un agente fluorante vigoroso. El cloruro de nitrosilo (NOCl) se comporta de forma muy similar y se ha utilizado a menudo como disolvente ionizante. El bromuro de nitrosilo (NOBr) es rojo. Las reacciones de los haluros de nitrilo son en su mayoría similares: el fluoruro de nitrito (FNO 2 ) y el cloruro de nitrito (ClNO 2 ) son igualmente gases reactivos y agentes halogenantes vigorosos. [61]

El nitrógeno forma nueve óxidos moleculares, algunos de los cuales fueron los primeros gases en ser identificados: N 2 O ( óxido nitroso ), NO ( óxido nítrico ), N 2 O 3 ( trióxido de dinitrógeno ), NO 2 ( dióxido de nitrógeno ), N 2 O 4 ( tetróxido de dinitrógeno ), N 2 O 5 ( pentóxido de dinitrógeno ), N 4 O ( nitrosilazida ), [66] y N(NO 2 ) 3 ( trinitramida ). [67] Todos son térmicamente inestables a la descomposición de sus elementos. Otro posible óxido que aún no ha sido sintetizado es el oxatetrazol (N 4 O), un anillo aromático. [66]
El óxido nitroso (N2O ) , más conocido como gas de la risa, se obtiene por descomposición térmica del nitrato de amonio fundido a 250 °C. Se trata de una reacción redox y, por lo tanto, también se producen óxido nítrico y nitrógeno como subproductos . Se utiliza principalmente como propulsor y agente aireante para la nata montada en lata en aerosol , y antiguamente se utilizaba comúnmente como anestésico. A pesar de las apariencias, no se puede considerar que sea el anhídrido del ácido hiponitroso ( H2N2O2 ) porque ese ácido no se produce por la disolución del óxido nitroso en agua . Es bastante poco reactivo (no reacciona con los halógenos, los metales alcalinos ni el ozono a temperatura ambiente, aunque la reactividad aumenta con el calentamiento) y tiene la estructura asimétrica N–N–O (N≡N + O − ↔ − N=N + =O): por encima de los 600 °C se disocia rompiendo el enlace N–O más débil. [66] El óxido nítrico (NO) es la molécula estable más simple con un número impar de electrones. En los mamíferos, incluidos los humanos, es una importante molécula de señalización celular involucrada en muchos procesos fisiológicos y patológicos. [68] Se forma por oxidación catalítica del amoniaco. Es un gas paramagnético incoloro que, al ser termodinámicamente inestable, se descompone en nitrógeno y oxígeno gaseoso a 1100–1200 °C. Su enlace es similar al del nitrógeno, pero se agrega un electrón adicional a un orbital antienlazante π * y, por lo tanto, el orden de enlace se ha reducido a aproximadamente 2,5; Por lo tanto, la dimerización a O=N–N=O es desfavorable excepto por debajo del punto de ebullición (donde el isómero cis es más estable) porque en realidad no aumenta el orden de enlace total y porque el electrón desapareado está deslocalizado a través de la molécula de NO, lo que le otorga estabilidad. También hay evidencia del dímero rojo asimétrico O=N–O=N cuando el óxido nítrico se condensa con moléculas polares. Reacciona con el oxígeno para dar dióxido de nitrógeno marrón y con halógenos para dar haluros de nitrosilo. También reacciona con compuestos de metales de transición para dar complejos de nitrosilo, la mayoría de los cuales son de color intenso. [66]
El trióxido de dinitrógeno azul (N 2 O 3 ) solo está disponible en forma sólida porque se disocia rápidamente por encima de su punto de fusión para dar óxido nítrico, dióxido de nitrógeno (NO 2 ) y tetróxido de dinitrógeno (N 2 O 4 ). Los dos últimos compuestos son algo difíciles de estudiar individualmente debido al equilibrio entre ellos, aunque a veces el tetróxido de dinitrógeno puede reaccionar por fisión heterolítica a nitrosonio y nitrato en un medio con alta constante dieléctrica. El dióxido de nitrógeno es un gas marrón acre y corrosivo. Ambos compuestos pueden prepararse fácilmente descomponiendo un nitrato metálico seco. Ambos reaccionan con agua para formar ácido nítrico . El tetróxido de dinitrógeno es muy útil para la preparación de nitratos metálicos anhidros y complejos de nitrato, y se convirtió en el oxidante almacenable de elección para muchos cohetes tanto en los Estados Unidos como en la URSS a fines de la década de 1950. Esto se debe a que es un propulsor hipergólico en combinación con un combustible para cohetes a base de hidracina y se puede almacenar fácilmente ya que es líquido a temperatura ambiente. [66]
El pentóxido de dinitrógeno (N 2 O 5 ), térmicamente inestable y muy reactivo, es el anhídrido del ácido nítrico y se puede obtener a partir de él por deshidratación con pentóxido de fósforo . Es de interés para la preparación de explosivos. [69] Es un sólido cristalino delicuescente , incoloro y sensible a la luz. En estado sólido es iónico con la estructura [NO 2 ] + [NO 3 ] − ; como gas y en solución es molecular O 2 N–O–NO 2 . La hidratación a ácido nítrico se produce fácilmente, al igual que la reacción análoga con peróxido de hidrógeno dando lugar al ácido peroxonítrico (HOONO 2 ). Es un agente oxidante violento. El pentóxido de dinitrógeno gaseoso se descompone de la siguiente manera: [66]
Se conocen muchos oxoácidos de nitrógeno , aunque la mayoría de ellos son inestables como compuestos puros y se conocen solo como soluciones acuosas o como sales. El ácido hiponitroso (H 2 N 2 O 2 ) es un ácido diprótico débil con la estructura HON=NOH (p K a1 6,9, p K a2 11,6). Las soluciones ácidas son bastante estables, pero por encima de pH 4 se produce una descomposición catalizada por bases a través de [HONNO] − en óxido nitroso y el anión hidróxido. Los hiponitritos (que involucran el ácido N
2Oh2−
2Los aniones son estables a los agentes reductores y, más comúnmente, actúan como agentes reductores. Son un paso intermedio en la oxidación del amoníaco a nitrito, que ocurre en el ciclo del nitrógeno . El hiponitrito puede actuar como un ligando bidentado quelante o puente. [70]
El ácido nitroso (HNO 2 ) no se conoce como un compuesto puro, pero es un componente común en los equilibrios gaseosos y es un reactivo acuoso importante: sus soluciones acuosas pueden prepararse a partir de la acidificación del nitrito acuoso frío ( NO−
2, soluciones dobladas), aunque ya a temperatura ambiente la desproporción con nitrato y óxido nítrico es significativa. Es un ácido débil con p K a 3,35 a 18 °C. Pueden analizarse titrimétricamente por su oxidación a nitrato por permanganato . Se reducen fácilmente a óxido nitroso y óxido nítrico por dióxido de azufre , a ácido hiponitroso con estaño (II) y a amoníaco con sulfuro de hidrógeno . Sales de hidrazinio N
2yo+
5reaccionan con el ácido nitroso para producir azidas que reaccionan a su vez para dar óxido nitroso y nitrógeno. El nitrito de sodio es ligeramente tóxico en concentraciones superiores a 100 mg/kg, pero a menudo se utilizan pequeñas cantidades para curar la carne y como conservante para evitar el deterioro bacteriano. También se utiliza para sintetizar hidroxilamina y diazotar aminas aromáticas primarias de la siguiente manera: [70]
El nitrito también es un ligando común que puede coordinarse de cinco maneras. Las más comunes son el nitro (unido al nitrógeno) y el nitrito (unido al oxígeno). La isomería nitro-nitrito es común, donde la forma nitrito suele ser menos estable. [70]

El ácido nítrico (HNO 3 ) es, con diferencia, el más importante y el más estable de los oxoácidos de nitrógeno. Es uno de los tres ácidos más utilizados (los otros dos son el ácido sulfúrico y el ácido clorhídrico ) y fue descubierto por primera vez por alquimistas en el siglo XIII. Se obtiene por oxidación catalítica del amoníaco a óxido nítrico, que se oxida a dióxido de nitrógeno y luego se disuelve en agua para dar ácido nítrico concentrado. En los Estados Unidos de América , se producen más de siete millones de toneladas de ácido nítrico cada año, la mayoría de las cuales se utilizan para la producción de nitrato para fertilizantes y explosivos, entre otros usos. El ácido nítrico anhidro se puede obtener destilando ácido nítrico concentrado con pentóxido de fósforo a baja presión en un aparato de vidrio en la oscuridad. Sólo se puede obtener en estado sólido, porque al fundirse se descompone espontáneamente en dióxido de nitrógeno, y el ácido nítrico líquido sufre una autoionización en mayor medida que cualquier otro líquido covalente, como se indica a continuación: [70]
Se sabe que se pueden cristalizar dos hidratos, HNO3 · H2O y HNO3 · 3H2O . Es un ácido fuerte y las soluciones concentradas son agentes oxidantes fuertes, aunque el oro , el platino , el rodio y el iridio son inmunes al ataque. Una mezcla 3:1 de ácido clorhídrico concentrado y ácido nítrico, llamada agua regia , es aún más fuerte y disuelve con éxito el oro y el platino, porque se forman cloro libre y cloruro de nitrosilo y los aniones cloruro pueden formar complejos fuertes. En el ácido sulfúrico concentrado, el ácido nítrico se protona para formar nitronio , que puede actuar como electrófilo para la nitración aromática: [70]
Las estabilidades térmicas de los nitratos (que involucran el NO trigonal planar−
3La composición química del anión depende de la basicidad del metal, al igual que los productos de descomposición (termólisis), que pueden variar entre el nitrito (por ejemplo, sodio), el óxido (potasio y plomo ) o incluso el propio metal ( plata ) dependiendo de sus estabilidades relativas. El nitrato también es un ligando común con muchos modos de coordinación. [70]
Finalmente, aunque el ácido ortonítrico (H 3 NO 4 ), que sería análogo al ácido ortofosfórico , no existe, el anión ortonitrato tetraédrico NO3−
4Se conoce en sus sales de sodio y potasio: [70]
Estas sales cristalinas blancas son muy sensibles al vapor de agua y al dióxido de carbono en el aire: [70]
A pesar de su química limitada, el anión ortonitrato es interesante desde un punto de vista estructural debido a su forma tetraédrica regular y las longitudes de enlace N–O cortas, lo que implica un carácter polar significativo en el enlace. [70]
El nitrógeno es uno de los elementos más importantes en la química orgánica . Muchos grupos funcionales orgánicos implican un enlace carbono-nitrógeno , como las amidas (RCONR 2 ), las aminas (R 3 N), las iminas (RC(=NR)R), las imidas (RCO) 2 NR, las azidas (RN 3 ), los compuestos azoicos (RN 2 R), los cianatos (ROCN), los isocianatos (RNCO), los nitratos (RONO 2 ) , los nitrilos (RCN), los isonitrilos (RNC), los nitritos (RONO), los compuestos nitro (RNO 2 ), los compuestos nitrosos (RNO), las oximas (RC(=NOH)R) y los derivados de la piridina . Los enlaces C–N están fuertemente polarizados hacia el nitrógeno. En estos compuestos, el nitrógeno suele ser trivalente (aunque puede ser tetravalente en las sales de amonio cuaternario , R 4 N + ), con un par solitario que puede conferir basicidad al compuesto al estar coordinado a un protón. Esto puede ser compensado por otros factores: por ejemplo, las amidas no son básicas porque el par solitario está deslocalizado en un doble enlace (aunque pueden actuar como bases a pH muy bajo, estando protonadas en el oxígeno), y el pirrol no es básico porque el par solitario está deslocalizado como parte de un anillo aromático . [71] La cantidad de nitrógeno en una sustancia química se puede determinar mediante el método Kjeldahl . [72] En particular, el nitrógeno es un componente esencial de los ácidos nucleicos , aminoácidos y, por lo tanto, proteínas , y la molécula transportadora de energía trifosfato de adenosina y, por lo tanto, es vital para toda la vida en la Tierra. [71]
El nitrógeno es el elemento puro más común en la Tierra y constituye el 78,1% del volumen de la atmósfera [9] (75,5% en masa), alrededor de 3,89 millones de gigatoneladas (3,89 × 10 18 kg ). A pesar de esto, no es muy abundante en la corteza terrestre, representando alrededor de 19 partes por millón de esta, a la par con el niobio , el galio y el litio . (Esto representa de 300.000 a un millón de gigatoneladas de nitrógeno, dependiendo de la masa de la corteza. [73] ) Los únicos minerales nitrogenados importantes son el nitro ( nitrato de potasio , salitre) y el nitro de sodio ( nitrato de sodio , salitre chileno). Sin embargo, estos no han sido una fuente importante de nitratos desde la década de 1920, cuando la síntesis industrial de amoníaco y ácido nítrico se volvió común. [74]
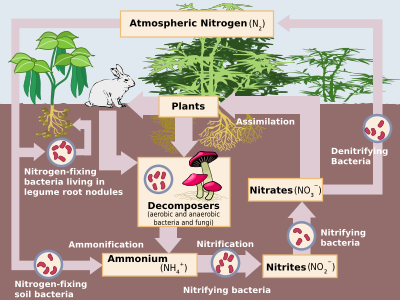
Los compuestos nitrogenados se intercambian constantemente entre la atmósfera y los organismos vivos. El nitrógeno debe primero ser procesado, o " fijado ", en una forma utilizable por las plantas, generalmente amoníaco. Parte de la fijación del nitrógeno se realiza mediante la caída de rayos que producen los óxidos de nitrógeno, pero la mayor parte es realizada por bacterias diazotróficas a través de enzimas conocidas como nitrogenasas (aunque hoy en día la fijación industrial del nitrógeno al amoníaco también es significativa). Cuando las plantas absorben el amoníaco, lo utilizan para sintetizar proteínas. Estas plantas son luego digeridas por animales que utilizan los compuestos nitrogenados para sintetizar sus proteínas y excretar desechos que contienen nitrógeno. Finalmente, estos organismos mueren y se descomponen, sufriendo oxidación y desnitrificación bacteriana y ambiental , devolviendo el dinitrógeno libre a la atmósfera. La fijación industrial del nitrógeno mediante el proceso Haber se utiliza principalmente como fertilizante, aunque el exceso de desechos que contienen nitrógeno, cuando se lixivia, conduce a la eutrofización del agua dulce y a la creación de zonas muertas marinas , ya que el crecimiento bacteriano impulsado por el nitrógeno agota el oxígeno del agua hasta el punto de que todos los organismos superiores mueren. Además, el óxido nitroso, que se produce durante la desnitrificación, ataca la capa de ozono atmosférico . [74]
Muchos peces de agua salada fabrican grandes cantidades de óxido de trimetilamina para protegerse de los altos efectos osmóticos de su entorno; la conversión de este compuesto en dimetilamina es responsable del olor inicial en los peces de agua salada no frescos. [75] En los animales, el óxido nítrico radical libre (derivado de un aminoácido ), sirve como una molécula reguladora importante para la circulación. [76]
La rápida reacción del óxido nítrico con el agua en los animales da como resultado la producción de su metabolito nitrito . El metabolismo animal del nitrógeno en las proteínas, en general, da como resultado la excreción de urea , mientras que el metabolismo animal de los ácidos nucleicos da como resultado la excreción de urea y ácido úrico . El olor característico de la descomposición de la carne animal es causado por la creación de aminas de cadena larga que contienen nitrógeno , como la putrescina y la cadaverina , que son productos de degradación de los aminoácidos ornitina y lisina , respectivamente, en las proteínas en descomposición. [77]
El gas nitrógeno es un gas industrial producido por la destilación fraccionada de aire líquido o por medios mecánicos utilizando aire gaseoso ( membrana de ósmosis inversa presurizada o adsorción por oscilación de presión ). Los generadores de gas nitrógeno que utilizan membranas o adsorción por oscilación de presión (PSA) suelen ser más rentables y energéticamente eficientes que el nitrógeno suministrado a granel. [78] El nitrógeno comercial es a menudo un subproducto del procesamiento del aire para la concentración industrial de oxígeno para la fabricación de acero y otros fines. Cuando se suministra comprimido en cilindros, a menudo se lo denomina OFN (nitrógeno libre de oxígeno). [79] El nitrógeno de grado comercial ya contiene como máximo 20 ppm de oxígeno, y también hay grados especialmente purificados que contienen como máximo 2 ppm de oxígeno y 10 ppm de argón . [80]
En un laboratorio químico, se prepara tratando una solución acuosa de cloruro de amonio con nitrito de sodio . [81]
En esta reacción también se forman pequeñas cantidades de las impurezas NO y HNO3 . Las impurezas se pueden eliminar haciendo pasar el gas a través de ácido sulfúrico acuoso que contenga dicromato de potasio . [81]
También se puede obtener por descomposición térmica del dicromato de amonio . [82]
Se puede preparar nitrógeno muy puro mediante la descomposición térmica de azida de bario o azida de sodio . [83]
Las aplicaciones de los compuestos nitrogenados son muy variadas debido al gran tamaño de esta clase, por lo que aquí sólo se considerarán las aplicaciones del nitrógeno puro. Dos tercios (2/3) del nitrógeno producido por la industria se vende en forma de gas y el tercio restante (1/3) en forma líquida.
El gas se utiliza principalmente como atmósfera segura de baja reactividad en aquellos lugares donde el oxígeno del aire podría representar un peligro de incendio, explosión u oxidación. Algunos ejemplos incluyen: [80]
El nitrógeno se utiliza habitualmente durante la preparación de muestras en el análisis químico . Se utiliza para concentrar y reducir el volumen de muestras líquidas. Dirigir una corriente presurizada de gas nitrógeno perpendicular a la superficie del líquido hace que el disolvente se evapore, dejando atrás el soluto y el disolvente no evaporado. [89]
El nitrógeno se puede utilizar como sustituto, o en combinación con, el dióxido de carbono para presurizar los barriles de algunas cervezas , en particular las stouts y las ales británicas , debido a las burbujas más pequeñas que produce, lo que hace que la cerveza dispensada sea más suave y con más espuma . [90] Una cápsula de nitrógeno sensible a la presión conocida comúnmente como " widget " permite envasar cervezas cargadas con nitrógeno en latas y botellas . [91] [92] Los tanques de nitrógeno también están reemplazando al dióxido de carbono como la principal fuente de energía para las pistolas de paintball . El nitrógeno debe mantenerse a una presión más alta que el CO 2 , lo que hace que los tanques de N 2 sean más pesados y más caros. [93]
Algunos equipos de construcción utilizan gas nitrógeno presurizado para ayudar al sistema hidráulico a proporcionar potencia adicional a dispositivos como el martillo hidráulico . El gas nitrógeno, formado a partir de la descomposición de la azida de sodio , se utiliza para inflar los airbags . [94]
Como el nitrógeno es un gas asfixiante en sí mismo, algunas jurisdicciones han considerado la asfixia por inhalación de nitrógeno puro como un medio de pena capital (como sustituto de la inyección letal ). [95] [96] [97] En enero de 2024, Kenneth Eugene Smith se convirtió en la primera persona ejecutada por asfixia con nitrógeno. [98]
El nitrógeno líquido es un líquido criogénico que parece agua . Cuando se aísla en recipientes adecuados, como frascos Dewar , se puede transportar y almacenar con una baja tasa de pérdida por evaporación . [99]

Al igual que el hielo seco , el principal uso del nitrógeno líquido es para enfriar a bajas temperaturas. Se utiliza en la criopreservación de materiales biológicos como la sangre y las células reproductivas ( esperma y óvulos ). Se utiliza en crioterapia para eliminar quistes y verrugas en la piel congelándolos. [100] Se utiliza en trampas de frío de laboratorio y en criobombas para obtener presiones más bajas en sistemas de bombeo de vacío . Se utiliza para enfriar dispositivos electrónicos sensibles al calor, como detectores infrarrojos y detectores de rayos X. Otros usos incluyen el molido por congelación y el mecanizado de materiales que son blandos o gomosos a temperatura ambiente, el ajuste por contracción y el ensamblaje de componentes de ingeniería y, de manera más general, para alcanzar temperaturas muy bajas cuando sea necesario. Debido a su bajo costo, el nitrógeno líquido se utiliza a menudo para enfriar incluso cuando esas bajas temperaturas no son estrictamente necesarias, como la refrigeración de alimentos, el marcado por congelación del ganado, la congelación de tuberías para detener el flujo cuando no hay válvulas presentes y la consolidación de suelos inestables mediante congelación siempre que se realicen excavaciones debajo. [80]
Aunque el nitrógeno no es tóxico, cuando se libera en un espacio cerrado puede desplazar el oxígeno y, por lo tanto, presenta un riesgo de asfixia . Esto puede ocurrir con pocos síntomas de advertencia, ya que el cuerpo carotídeo humano es un sistema de detección de niveles bajos de oxígeno (hipoxia) relativamente deficiente y lento. [101] Un ejemplo ocurrió poco antes del lanzamiento de la primera misión del transbordador espacial el 19 de marzo de 1981, cuando dos técnicos murieron por asfixia después de caminar hacia un espacio ubicado en la plataforma de lanzamiento móvil del transbordador espacial que estaba presurizado con nitrógeno puro como medida de precaución contra incendios. [102]
Cuando se inhala a presiones parciales altas (más de unos 4 bares, que se encuentran a profundidades inferiores a unos 30 m en el buceo ), el nitrógeno es un agente anestésico que causa narcosis por nitrógeno , un estado temporal de deterioro mental similar a la intoxicación por óxido nitroso . [103] [104]
El nitrógeno se disuelve en la sangre y las grasas corporales. La descompresión rápida (como cuando los buzos ascienden demasiado rápido o los astronautas se descomprimen demasiado rápido de la presión de la cabina a la presión del traje espacial) puede provocar una afección potencialmente mortal llamada enfermedad por descompresión (antes conocida como enfermedad del cajón o síndrome de Down ), cuando se forman burbujas de nitrógeno en el torrente sanguíneo, los nervios, las articulaciones y otras áreas sensibles o vitales. [105] [106] Las burbujas de otros gases "inertes" (gases distintos del dióxido de carbono y el oxígeno) causan los mismos efectos, por lo que la sustitución del nitrógeno en los gases respirables puede prevenir la narcosis por nitrógeno, pero no previene la enfermedad por descompresión. [107]
El nitrógeno líquido, como líquido criogénico , puede ser peligroso porque provoca quemaduras por frío al contacto, aunque el efecto Leidenfrost proporciona protección tras una exposición muy breve (aproximadamente un segundo). [108] La ingestión de nitrógeno líquido puede provocar graves daños internos. Por ejemplo, en 2012, una joven inglesa tuvo que ser extirpada del estómago tras ingerir un cóctel elaborado con nitrógeno líquido. [109]
Debido a que la relación de expansión de líquido a gas del nitrógeno es de 1:694 a 20 °C, se puede generar una enorme cantidad de fuerza si el nitrógeno líquido se vaporiza rápidamente en un espacio cerrado. En un incidente ocurrido el 12 de enero de 2006 en la Universidad Texas A&M , los dispositivos de alivio de presión de un tanque de nitrógeno líquido funcionaron mal y luego se sellaron. Como resultado de la acumulación de presión posterior, el tanque falló catastróficamente. La fuerza de la explosión fue suficiente para impulsar el tanque a través del techo inmediatamente superior, romper una viga de hormigón armado inmediatamente inferior y hacer volar las paredes del laboratorio a 0,1-0,2 m de sus cimientos. [110]
El nitrógeno líquido se evapora fácilmente para formar nitrógeno gaseoso y, por lo tanto, las precauciones asociadas con el nitrógeno gaseoso también se aplican al nitrógeno líquido. [111] [112] [113] Por ejemplo, a veces se utilizan sensores de oxígeno como medida de seguridad cuando se trabaja con nitrógeno líquido para alertar a los trabajadores de derrames de gas en un espacio confinado. [114]
Los recipientes que contienen nitrógeno líquido pueden condensar el oxígeno del aire. El líquido en dichos recipientes se enriquece cada vez más con oxígeno (punto de ebullición -183 °C, más alto que el del nitrógeno) a medida que el nitrógeno se evapora, y puede causar una oxidación violenta de la materia orgánica. [115]
Los monitores de deficiencia de oxígeno se utilizan para medir los niveles de oxígeno en espacios confinados y en cualquier lugar donde se almacene o utilice nitrógeno líquido o gaseoso. En caso de una fuga de nitrógeno y una disminución del oxígeno hasta un nivel de alarma preestablecido, un monitor de deficiencia de oxígeno se puede programar para que active alarmas audibles y visuales, proporcionando así una notificación del posible peligro inminente. El rango de oxígeno más común para alertar al personal es cuando los niveles de oxígeno caen por debajo del 19,5%. OSHA especifica que una atmósfera peligrosa puede incluir una donde la concentración de oxígeno sea inferior al 19,5% o superior al 23,5%. [116] Los monitores de deficiencia de oxígeno pueden ser fijos, montados en la pared y conectados directamente a la fuente de alimentación del edificio o simplemente enchufados a una toma de corriente, o un monitor portátil de mano o portátil.
{{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace )