El óxido de zinc es un compuesto inorgánico con la fórmula ZnO . Es un polvo blanco insoluble en agua. El ZnO se utiliza como aditivo en numerosos materiales y productos, incluidos cosméticos, complementos alimenticios , cauchos, plásticos, cerámicas, vidrio, cemento, lubricantes, [12] pinturas, protectores solares, ungüentos, adhesivos, selladores, pigmentos, alimentos, baterías, ferritas, retardantes de fuego, semiconductores, [13] y cintas de primeros auxilios. Aunque se presenta de forma natural como el mineral zincita , la mayor parte del óxido de zinc se produce de forma sintética. [14]
Los primeros humanos probablemente usaban compuestos de zinc en formas procesadas [14] y sin procesar, como pintura o ungüento medicinal; sin embargo, su composición es incierta. El uso de pushpanjan , probablemente óxido de zinc, como ungüento para ojos y heridas abiertas se menciona en el texto médico indio Charaka Samhita , que se cree que data del 500 a. C. o antes. [15] El médico griego Dioscórides (siglo I d. C.) también menciona el ungüento de óxido de zinc . [16] Galeno sugirió tratar los cánceres ulcerantes con óxido de zinc, [17] como lo hizo Avicena en su Canon de la medicina . Se utiliza como ingrediente en productos como polvos para bebés y cremas contra las rozaduras del pañal , crema de calamina , champús anticaspa y ungüentos antisépticos . [18]
Los romanos produjeron cantidades considerables de latón (una aleación de cinc y cobre ) ya en el año 200 a. C. mediante un proceso de cementación en el que el cobre reaccionaba con óxido de cinc. [19] Se cree que el óxido de cinc se producía calentando mineral de cinc en un horno de cuba. Esto liberaba cinc metálico en forma de vapor, que luego ascendía por el conducto de humos y se condensaba en forma de óxido. Este proceso fue descrito por Dioscórides en el siglo I d. C. [20] También se ha recuperado óxido de cinc de las minas de cinc de Zawar, en la India , que datan de la segunda mitad del primer milenio a. C. [16]
Entre los siglos XII y XVI, el zinc y el óxido de zinc se reconocieron y produjeron en la India utilizando una forma primitiva del proceso de síntesis directa. Desde la India, la fabricación de zinc se trasladó a China en el siglo XVII. En 1743, se estableció la primera fundición de zinc europea en Bristol , Reino Unido. [21] Alrededor de 1782, Louis-Bernard Guyton de Morveau propuso reemplazar el pigmento blanco de plomo con óxido de zinc. [22]
El óxido de cinc (blanco de cinc) se utilizaba principalmente en pinturas y como aditivo para ungüentos. El blanco de cinc se aceptó como pigmento en las pinturas al óleo en 1834, pero no se mezclaba bien con el aceite. Este problema se resolvió optimizando la síntesis de ZnO. En 1845, Edme-Jean Leclaire en París producía la pintura al óleo a gran escala; en 1850, el blanco de cinc se fabricaba en toda Europa. El éxito de la pintura blanca de cinc se debió a sus ventajas sobre el albayalde tradicional : el blanco de cinc es esencialmente permanente a la luz del sol, no se ennegrece con el aire que contiene azufre, no es tóxico y es más económico. Debido a que el blanco de cinc es tan "limpio", es valioso para hacer tintes con otros colores, pero forma una película seca bastante quebradiza cuando no se mezcla con otros colores. Por ejemplo, a finales de la década de 1890 y principios de la de 1900, algunos artistas utilizaron el blanco de cinc como base para sus pinturas al óleo. Estas pinturas desarrollaron grietas con el tiempo. [23]
En los últimos tiempos, la mayor parte del óxido de cinc se ha utilizado en la industria del caucho para resistir la corrosión . En la década de 1970, la segunda aplicación más importante del ZnO fue la fotocopia . El ZnO de alta calidad producido mediante el "proceso francés" se añadió al papel de fotocopia como relleno. Esta aplicación pronto fue desplazada por el titanio . [24]
El ZnO puro es un polvo blanco. Sin embargo, en la naturaleza se presenta como el raro mineral zincita , que generalmente contiene manganeso y otras impurezas que le confieren un color entre amarillo y rojo. [25]
El óxido de zinc cristalino es termocrómico , cambia de blanco a amarillo cuando se calienta en el aire y vuelve a blanco al enfriarse. [26] Este cambio de color es causado por una pequeña pérdida de oxígeno al ambiente a altas temperaturas para formar el no estequiométrico Zn 1+x O, donde a 800 °C, x = 0,00007. [26]
El óxido de zinc es un óxido anfótero . Es casi insoluble en agua, pero se disolverá en la mayoría de los ácidos , como el ácido clorhídrico : [27]
El óxido de zinc sólido también se disolverá en álcalis para dar zincatos solubles:
El ZnO reacciona lentamente con los ácidos grasos de los aceites para producir los carboxilatos correspondientes , como el oleato o el estearato . Cuando se mezcla con una solución acuosa fuerte de cloruro de zinc , el ZnO forma productos similares al cemento, mejor descritos como cloruros de hidroxi de zinc. [28] Este cemento se utilizaba en odontología. [29]

El ZnO también forma un material similar al cemento cuando se trata con ácido fosfórico ; en odontología se utilizan materiales relacionados. [29] Un componente principal del cemento de fosfato de zinc producido por esta reacción es la hopeíta , Zn 3 (PO 4 ) 2 ·4H 2 O. [30]
El ZnO se descompone en vapor de zinc y oxígeno a unos 1975 °C con una presión de oxígeno estándar. En una reacción carbotérmica , el calentamiento con carbono convierte el óxido en vapor de zinc a una temperatura mucho más baja (alrededor de 950 °C). [27]


El óxido de zinc cristaliza en dos formas principales , wurtzita hexagonal [31] y blenda de zinc cúbica . La estructura de wurtzita es más estable en condiciones ambientales y, por lo tanto, la más común. La forma de blenda de zinc se puede estabilizar mediante el crecimiento de ZnO en sustratos con estructura reticular cúbica. En ambos casos, los centros de zinc y óxido son tetraédricos , la geometría más característica para Zn(II). ZnO se convierte en el motivo de sal de roca a presiones relativamente altas de aproximadamente 10 GPa. [13]
Los polimorfos hexagonales y de blenda de cinc no tienen simetría de inversión (la reflexión de un cristal con respecto a un punto determinado no lo transforma en sí mismo). Esta y otras propiedades de simetría reticular dan como resultado la piezoelectricidad del ZnO hexagonal y de blenda de cinc, y la piroelectricidad del ZnO hexagonal.
La estructura hexagonal tiene un grupo puntual de 6 mm ( notación de Hermann–Mauguin ) o C 6v ( notación de Schoenflies ), y el grupo espacial es P6 3 mc o C 6v 4 . Las constantes reticulares son a = 3,25 Å y c = 5,2 Å; su relación c/a ~ 1,60 está cerca del valor ideal para la celda hexagonal c/a = 1,633. [32] Como en la mayoría de los materiales del grupo II-VI , el enlace en ZnO es en gran parte iónico (Zn 2+ O 2− ) con los radios correspondientes de 0,074 nm para Zn 2+ y 0,140 nm para O 2− . Esta propiedad explica la formación preferencial de la estructura de wurtzita en lugar de la de blenda de zinc, [33] así como la fuerte piezoelectricidad de ZnO. Debido a los enlaces polares Zn−O, los planos de zinc y oxígeno están cargados eléctricamente. Para mantener la neutralidad eléctrica, esos planos se reconstruyen a nivel atómico en la mayoría de los materiales relativos, pero no en ZnO: sus superficies son atómicamente planas, estables y no presentan reconstrucción. [34] Sin embargo, los estudios que utilizan estructuras wurtzoides explicaron el origen de la planitud de la superficie y la ausencia de reconstrucción en las superficies de wurtzita de ZnO [35] además del origen de las cargas en los planos de ZnO.
El ZnO es un semiconductor de banda ancha del grupo de semiconductores II-VI . El dopaje nativo del semiconductor debido a vacantes de oxígeno o intersticiales de zinc es de tipo n. [13]
El ZnO es un material relativamente blando con una dureza aproximada de 4,5 en la escala de Mohs . [12] Sus constantes elásticas son menores que las de los semiconductores III-V relevantes, como el GaN . La alta capacidad térmica y conductividad térmica, la baja expansión térmica y la alta temperatura de fusión del ZnO son beneficiosas para la cerámica. [24] El fonón óptico E2 en el ZnO exhibe una vida útil inusualmente larga de 133 ps a 10 K. [36]
Entre los semiconductores con enlaces tetraédricos, se ha afirmado que el ZnO tiene el tensor piezoeléctrico más alto, o al menos uno comparable al de GaN y AlN . [37] Esta propiedad lo convierte en un material tecnológicamente importante para muchas aplicaciones piezoeléctricas , que requieren un gran acoplamiento electromecánico. Por lo tanto, el ZnO en forma de película delgada ha sido uno de los materiales resonadores más estudiados para resonadores acústicos en masa de película delgada .
Las propiedades favorables del óxido de zinc incluyen buena transparencia, alta movilidad de electrones , amplio intervalo de banda y fuerte luminiscencia a temperatura ambiente . Esas propiedades hacen que el ZnO sea valioso para una variedad de aplicaciones emergentes: electrodos transparentes en pantallas de cristal líquido , ventanas que ahorran energía o protegen del calor y productos electrónicos como transistores de película delgada y diodos emisores de luz .
El ZnO tiene una banda prohibida directa relativamente amplia de ~3,3 eV a temperatura ambiente. Las ventajas asociadas con una banda prohibida amplia incluyen voltajes de ruptura más altos , capacidad para sostener grandes campos eléctricos, menor ruido electrónico y operación a alta temperatura y alta potencia. La banda prohibida del ZnO se puede ajustar aún más a ~3–4 eV mediante su aleación con óxido de magnesio u óxido de cadmio . [13] Debido a esta gran banda prohibida, se han hecho esfuerzos para crear células solares visiblemente transparentes utilizando ZnO como capa absorbente de luz. Sin embargo, hasta ahora estas células solares han demostrado ser altamente ineficientes. [38]
La mayor parte del ZnO tiene un carácter de tipo n , incluso en ausencia de dopaje intencional . La no estequiometría es típicamente el origen del carácter de tipo n, pero el tema sigue siendo controvertido. [39] Se ha propuesto una explicación alternativa, basada en cálculos teóricos, de que las impurezas de hidrógeno sustitucionales no intencionales son las responsables. [40] El dopaje de tipo n controlable se logra fácilmente sustituyendo Zn con elementos del grupo III como Al, Ga, In o sustituyendo oxígeno con elementos del grupo VII cloro o yodo . [41]
El dopaje de tipo p fiable del ZnO sigue siendo difícil. Este problema se origina en la baja solubilidad de los dopantes de tipo p y su compensación por abundantes impurezas de tipo n. Este problema se observa con GaN y ZnSe . La medición del tipo p en material "intrínsecamente" de tipo n se complica por la falta de homogeneidad de las muestras. [42]
Las limitaciones actuales del dopaje p limitan las aplicaciones electrónicas y optoelectrónicas del ZnO, que normalmente requieren uniones de material de tipo n y tipo p. Los dopantes de tipo p conocidos incluyen elementos del grupo I Li, Na, K; elementos del grupo V N, P y As; así como cobre y plata. Sin embargo, muchos de ellos forman aceptores profundos y no producen una conducción de tipo p significativa a temperatura ambiente. [13]
La movilidad electrónica del ZnO varía fuertemente con la temperatura y tiene un máximo de ~2000 cm 2 /(V·s) a 80 K. [43] Los datos sobre la movilidad de los huecos son escasos, con valores en el rango de 5 a 30 cm 2 /(V·s). [44]
Los discos de ZnO, que actúan como varistores , son el material activo en la mayoría de los pararrayos . [45] [46]
El óxido de zinc se caracteriza por sus propiedades ópticas fuertemente no lineales , especialmente en masa. La no linealidad de las nanopartículas de ZnO se puede ajustar con precisión en función de su tamaño. [47]
Para uso industrial, el ZnO se produce en niveles de 10 5 toneladas por año [25] mediante tres procesos principales: [24]
En el proceso indirecto o francés, el zinc metálico se funde en un crisol de grafito y se vaporiza a temperaturas superiores a 907 °C (normalmente alrededor de 1000 °C). El vapor de zinc reacciona con el oxígeno del aire para dar ZnO, acompañado de una caída de su temperatura y una luminiscencia brillante. Las partículas de óxido de zinc se transportan a un conducto de refrigeración y se recogen en una cámara de filtros. Este método indirecto fue popularizado por Edme Jean LeClaire de París en 1844 y, por lo tanto, se lo conoce comúnmente como el proceso francés. Su producto normalmente consiste en partículas de óxido de zinc aglomeradas con un tamaño medio de 0,1 a unos pocos micrómetros. En peso, la mayor parte del óxido de zinc del mundo se fabrica mediante el proceso francés.
El proceso directo o americano comienza con diversos compuestos de zinc contaminados, como minerales de zinc o subproductos de fundición. Los precursores de zinc se reducen ( reducción carbotérmica ) mediante calentamiento con una fuente de carbono como la antracita para producir vapor de zinc, que luego se oxida como en el proceso indirecto. Debido a la menor pureza del material de origen, el producto final también es de menor calidad en el proceso directo en comparación con el indirecto.
Una pequeña parte de la producción industrial se realiza mediante procesos químicos húmedos, que parten de soluciones acuosas de sales de cinc, de las que se precipita carbonato o hidróxido de cinc . El precipitado sólido se calcina a temperaturas de alrededor de 800 °C.

Existen numerosos métodos especializados para producir ZnO para estudios científicos y aplicaciones específicas. Estos métodos se pueden clasificar según la forma resultante del ZnO (a granel, película delgada, nanocable ), la temperatura ("baja", es decir, cercana a la temperatura ambiente, o "alta", es decir, T ~ 1000 °C), el tipo de proceso (deposición de vapor o crecimiento a partir de una solución) y otros parámetros.
Los monocristales grandes (de muchos centímetros cúbicos) se pueden cultivar mediante transporte de gas (deposición en fase de vapor), síntesis hidrotermal [34] [48] [49] o crecimiento en estado fundido. [7] Sin embargo, debido a la alta presión de vapor de ZnO, el crecimiento a partir del estado fundido es problemático. El crecimiento por transporte de gas es difícil de controlar, lo que deja al método hidrotermal como una preferencia. [7] Se pueden producir películas delgadas mediante deposición química de vapor , epitaxia en fase de vapor metalorgánica , electrodeposición , deposición láser pulsada , pulverización catódica , síntesis sol-gel , deposición de capa atómica , pirólisis por pulverización, etc.
El óxido de cinc blanco en polvo común se puede producir en el laboratorio mediante la electrolisis de una solución de bicarbonato de sodio con un ánodo de cinc. Se produce hidróxido de cinc y gas hidrógeno. El hidróxido de cinc, al calentarse, se descompone en óxido de cinc:
Las nanoestructuras de ZnO se pueden sintetizar en una variedad de morfologías, incluyendo nanocables, nanobarras , tetrápodos, nanocintas, nanoflores, nanopartículas, etc. Las nanoestructuras se pueden obtener con la mayoría de las técnicas mencionadas anteriormente, en ciertas condiciones, y también con el método vapor-líquido-sólido . [34] [50] [51] La síntesis se lleva a cabo típicamente a temperaturas de aproximadamente 90 °C, en una solución acuosa equimolar de nitrato de zinc y hexamina , esta última proporcionando el entorno básico. Ciertos aditivos, como polietilenglicol o polietilenimina, pueden mejorar la relación de aspecto de los nanocables de ZnO. [52] El dopaje de los nanocables de ZnO se ha logrado añadiendo otros nitratos metálicos a la solución de crecimiento. [53] La morfología de las nanoestructuras resultantes se puede ajustar modificando los parámetros relacionados con la composición del precursor (como la concentración de zinc y el pH) o con el tratamiento térmico (como la temperatura y la velocidad de calentamiento). [54]
Los nanocables de ZnO alineados sobre sustratos de silicio , vidrio y nitruro de galio pre-sembrados se han cultivado utilizando sales de zinc acuosas como nitrato de zinc y acetato de zinc en entornos básicos. [55] La pre-siembra de sustratos con ZnO crea sitios para la nucleación homogénea del cristal de ZnO durante la síntesis. Los métodos comunes de pre-siembra incluyen la descomposición térmica in situ de cristalitos de acetato de zinc , recubrimiento por centrifugación de nanopartículas de ZnO y el uso de métodos de deposición física de vapor para depositar películas delgadas de ZnO. [56] [57] La pre-siembra se puede realizar junto con métodos de modelado de arriba hacia abajo como la litografía de haz de electrones y la litografía de nanoesferas para designar sitios de nucleación antes del crecimiento. Los nanocables de ZnO alineados se pueden utilizar en células solares sensibilizadas con colorante y dispositivos de emisión de campo. [58] [59]
Las aplicaciones del polvo de óxido de zinc son numerosas y las principales se resumen a continuación. La mayoría de las aplicaciones explotan la reactividad del óxido como precursor de otros compuestos de zinc. Para aplicaciones de ciencia de materiales, el óxido de zinc tiene un alto índice de refracción , alta conductividad térmica, propiedades aglutinantes, antibacterianas y de protección UV. En consecuencia, se agrega a materiales y productos que incluyen plásticos, cerámicas, vidrio, cemento, [60] caucho, lubricantes, [12] pinturas, ungüentos, adhesivos, selladores, fabricación de hormigón , pigmentos, alimentos, baterías, ferritas y retardantes de fuego. [61]
Entre el 50% y el 60% del uso de ZnO se encuentra en la industria del caucho. [62] El óxido de zinc junto con el ácido esteárico se utiliza en la vulcanización del caucho con azufre. [24] [63] Los aditivos de ZnO también protegen el caucho de los hongos (ver aplicaciones médicas) y de la luz ultravioleta.
La industria cerámica consume una cantidad significativa de óxido de cinc, en particular en las composiciones de frita y esmalte cerámico. La capacidad térmica relativamente alta, la conductividad térmica y la estabilidad a altas temperaturas del ZnO, junto con un coeficiente de expansión comparativamente bajo, son propiedades deseables en la producción de cerámica. El ZnO afecta el punto de fusión y las propiedades ópticas de los esmaltes, esmaltes y formulaciones cerámicas. El óxido de cinc como fundente secundario de baja expansión mejora la elasticidad de los esmaltes al reducir el cambio de viscosidad en función de la temperatura y ayuda a prevenir el agrietamiento y el temblor. Al sustituir el BaO y el PbO por ZnO, se reduce la capacidad térmica y se aumenta la conductividad térmica. El cinc en pequeñas cantidades mejora el desarrollo de superficies brillantes y lustrosas. Sin embargo, en cantidades moderadas a altas, produce superficies mate y cristalinas. Con respecto al color, el cinc tiene una influencia complicada. [62]
El óxido de cinc mezclado con aproximadamente un 0,5 % de óxido de hierro (III) (Fe 2 O 3 ) se denomina calamina y se utiliza en lociones de calamina. Históricamente, el mineral calamina es una mezcla de los óxidos cincita y hemimorfita .
El óxido de zinc se usa ampliamente para tratar una variedad de afecciones de la piel, incluyendo dermatitis atópica , dermatitis de contacto , picazón debido al eczema , dermatitis del pañal y acné . [64] Se utiliza en productos como talco para bebés y cremas protectoras para tratar la dermatitis del pañal , crema de calamina , champús anticaspa y ungüentos antisépticos . [18] [65] A menudo se combina con aceite de ricino para formar una crema emoliente y astringente de zinc y aceite de ricino, comúnmente utilizada para tratar a los bebés. [66] [67]
También es un componente de la cinta (llamada "cinta de óxido de zinc") utilizada por los atletas como vendaje para prevenir daños en los tejidos blandos durante los entrenamientos. [68]
El óxido de zinc se utiliza en productos de enjuague bucal y pastas de dientes como un agente antibacteriano propuesto para prevenir la formación de placa y sarro , [69] y para controlar el mal aliento al reducir los gases volátiles y compuestos volátiles de azufre (VSC) en la boca. [70] Junto con el óxido de zinc o las sales de zinc, estos productos también contienen comúnmente otros ingredientes activos, como cloruro de cetilpiridinio , [71] xilitol , [72] hinokitiol , [73] aceites esenciales y extractos de plantas . [74] [75] El óxido de zinc en polvo tiene propiedades desodorizantes y antibacterianas. [76]
El ZnO se añade a las telas de algodón, al caucho, a los productos de cuidado bucal, [77] [78] y a los envases de alimentos. [79] [80] La acción antibacteriana mejorada de las partículas finas en comparación con el material a granel no es exclusiva del ZnO y se observa en otros materiales, como la plata . [81] El mecanismo del efecto antibacteriano del ZnO se ha descrito de diversas formas como la generación de especies reactivas de oxígeno , la liberación de iones Zn 2+ y una alteración general de la membrana celular bacteriana por las nanopartículas. [82]
El óxido de zinc se utiliza en los protectores solares para absorber la luz ultravioleta . [64] Es el absorbente de UVA y UVB de espectro más amplio [83] [84] que está aprobado para su uso como protector solar por la Administración de Alimentos y Medicamentos de los EE. UU. (FDA), [85] y es completamente fotoestable. [86] Cuando se utiliza como ingrediente en protectores solares, el óxido de zinc bloquea los rayos UVA (320-400 nm) y UVB (280-320 nm) de luz ultravioleta . El óxido de zinc y el otro protector solar físico más común, el dióxido de titanio , se consideran no irritantes, no alergénicos y no comedogénicos . [87] Sin embargo, el zinc del óxido de zinc se absorbe ligeramente en la piel. [88]
Muchos protectores solares utilizan nanopartículas de óxido de zinc (junto con nanopartículas de dióxido de titanio) porque estas partículas tan pequeñas no dispersan la luz y, por lo tanto, no parecen blancas. Las nanopartículas no se absorben en la piel más que las partículas de óxido de zinc de tamaño normal [89] y solo se absorben en la capa más externa de la piel, pero no en el cuerpo. [89]
Al mezclarse con eugenol se forma óxido de zinc eugenol , que tiene aplicaciones como restaurador y protésico en odontología . [29] [90]
El óxido de zinc se añade a muchos productos alimenticios, incluidos los cereales para el desayuno , como fuente de zinc, [91] un nutriente necesario . El sulfato de zinc también se utiliza con el mismo propósito. Algunos alimentos preenvasados también incluyen trazas de ZnO, incluso si no está destinado a ser un nutriente.
El óxido de zinc (blanco de zinc) se utiliza como pigmento en pinturas y es más opaco que el litopón , pero menos opaco que el dióxido de titanio . [14] También se utiliza en revestimientos para papel. El blanco chino es un grado especial de blanco de zinc utilizado en pigmentos de artistas. [92] El uso del blanco de zinc como pigmento en la pintura al óleo comenzó a mediados del siglo XVIII. [93] Ha reemplazado parcialmente al venenoso blanco de plomo y fue utilizado por pintores como Böcklin , Van Gogh , [94] Manet , Munch y otros. También es un ingrediente principal del maquillaje mineral (CI 77947). [95]
El óxido de zinc micronizado y a escala nanométrica proporciona una fuerte protección contra la radiación ultravioleta UVA y UVB , y por ello se utiliza en protectores solares , [96] y también en gafas de sol con bloqueo UV para usar en el espacio y como protección durante la soldadura , según una investigación realizada por científicos del Laboratorio de Propulsión a Chorro ( JPL ). [97]
Las pinturas que contienen polvo de óxido de cinc se han utilizado desde hace mucho tiempo como revestimientos anticorrosivos para metales. Son especialmente eficaces para el hierro galvanizado. El hierro es difícil de proteger porque su reactividad con los revestimientos orgánicos provoca fragilidad y falta de adherencia. Las pinturas de óxido de cinc conservan su flexibilidad y adherencia en dichas superficies durante muchos años. [61]
El ZnO altamente dopado con aluminio , galio o indio es transparente y conductor ( transparencia ~90%, resistividad mínima ~10 −4 Ω·cm [98] ). Los recubrimientos de ZnO:Al se utilizan para ventanas que ahorran energía o protegen del calor. El recubrimiento permite la entrada de la parte visible del espectro, pero refleja la radiación infrarroja (IR) de vuelta a la habitación (ahorro de energía) o no permite la entrada de la radiación IR a la habitación (protección del calor), según qué lado de la ventana tenga el recubrimiento. [25]
Los plásticos, como el naftalato de polietileno (PEN), se pueden proteger mediante la aplicación de un revestimiento de óxido de zinc. El revestimiento reduce la difusión de oxígeno a través del PEN. [99] Las capas de óxido de zinc también se pueden utilizar sobre policarbonato en aplicaciones al aire libre. El revestimiento protege al policarbonato de la radiación solar y disminuye su tasa de oxidación y el fotoamarilleo. [100]
El óxido de cinc empobrecido en 64 Zn (el isótopo de cinc con masa atómica 64) se utiliza en la prevención de la corrosión en los reactores nucleares de agua presurizada . El empobrecimiento es necesario, porque el 64 Zn se transforma en 65 Zn radiactivo bajo la irradiación de los neutrones del reactor. [101]
El óxido de zinc (ZnO) se utiliza como paso de pretratamiento para eliminar el sulfuro de hidrógeno (H 2 S) del gas natural después de la hidrogenación de cualquier compuesto de azufre antes de un reformador de metano , que puede envenenar el catalizador. A temperaturas de entre 230 y 430 °C (446 y 806 °F), el H 2 S se convierte en agua mediante la siguiente reacción: [102]
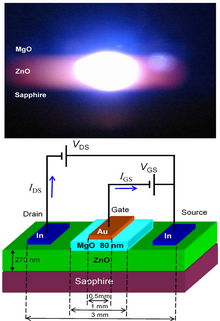

El ZnO tiene una banda prohibida directa amplia (3,37 eV o 375 nm a temperatura ambiente). Por lo tanto, sus aplicaciones potenciales más comunes son en diodos láser y diodos emisores de luz (LED). [105] Además, se han informado no linealidades ultrarrápidas y funciones fotoconductoras en ZnO. [106] Algunas aplicaciones optoelectrónicas del ZnO se superponen con las del GaN , que tiene una banda prohibida similar (~3,4 eV a temperatura ambiente). En comparación con el GaN, el ZnO tiene una energía de enlace de excitones mayor (~60 meV, 2,4 veces la energía térmica a temperatura ambiente), lo que da como resultado una emisión brillante a temperatura ambiente del ZnO. El ZnO se puede combinar con GaN para aplicaciones LED. Por ejemplo, una capa de óxido conductor transparente y nanoestructuras de ZnO proporcionan un mejor acoplamiento de la luz. [107] Otras propiedades del ZnO favorables para aplicaciones electrónicas incluyen su estabilidad a la radiación de alta energía y su capacidad para ser modelado mediante grabado químico húmedo. [108] La resistencia a la radiación [109] hace del ZnO un candidato adecuado para aplicaciones espaciales. El ZnO es el candidato más prometedor en el campo de los láseres aleatorios para producir una fuente láser UV bombeada electrónicamente.
Las puntas puntiagudas de las nanobarras de ZnO dan como resultado una fuerte intensificación del campo eléctrico, por lo que pueden utilizarse como emisores de campo . [110]
Las capas de ZnO dopadas con aluminio se utilizan como electrodos transparentes . Los componentes Zn y Al son mucho más baratos y menos tóxicos en comparación con el óxido de indio y estaño (ITO) de uso general. Una aplicación que ha comenzado a estar disponible comercialmente es el uso de ZnO como contacto frontal para células solares o pantallas de cristal líquido . [111]
Los transistores de película fina transparentes (TTFT) se pueden producir con ZnO. Como transistores de efecto de campo, no necesitan una unión p-n, [112] evitando así el problema de dopaje de tipo p del ZnO. Algunos de los transistores de efecto de campo incluso utilizan nanobarras de ZnO como canales conductores. [113]
El óxido de zinc se utiliza en sensores de gas semiconductores para detectar compuestos transportados por el aire, como sulfuro de hidrógeno , dióxido de nitrógeno y compuestos orgánicos volátiles . El ZnO es un semiconductor que se dopa con n mediante la adsorción de compuestos reductores , lo que reduce la resistencia eléctrica detectada a través del dispositivo, de manera similar a los sensores de gas semiconductores de óxido de estaño ampliamente utilizados . Se forma en nanoestructuras como películas delgadas, nanopartículas , nanopilares o nanocables para proporcionar una gran área de superficie para la interacción con los gases. Los sensores se hacen selectivos para gases específicos mediante el dopado o la fijación de materiales a la superficie, como metales nobles catalíticos. [114] [115]
Se ha demostrado que la piezoelectricidad en fibras textiles recubiertas de ZnO es capaz de fabricar "nanosistemas autoalimentados" con el estrés mecánico cotidiano del viento o los movimientos corporales. [116] [117]
En 2008, el Centro de Caracterización de Nanoestructuras del Instituto de Tecnología de Georgia informó sobre la producción de un dispositivo generador de electricidad (llamado generador de bomba de carga flexible) que suministra corriente alterna mediante el estiramiento y la liberación de nanocables de óxido de zinc. Este minigenerador crea un voltaje oscilante de hasta 45 milivoltios, convirtiendo cerca del siete por ciento de la energía mecánica aplicada en electricidad. Los investigadores utilizaron cables con longitudes de 0,2 a 0,3 mm y diámetros de tres a cinco micrómetros, pero el dispositivo podría reducirse a un tamaño menor. [118]

El ZnO se ha demostrado en forma de película delgada en resonadores, sensores y filtros de película delgada de alta frecuencia miniaturizados.
El ZnO es un material prometedor para el ánodo de las baterías de iones de litio porque es barato, biocompatible y respetuoso con el medio ambiente. El ZnO tiene una capacidad teórica mayor (978 mAh g −1 ) que muchos otros óxidos de metales de transición, como CoO (715 mAh g −1 ), NiO (718 mAh g −1 ) y CuO (674 mAh g −1 ). [119] El ZnO también se utiliza como electrodo en supercondensadores. [120]
El ZnO, tanto en escala macro [121] como nano [122] , se utiliza como electrodo en fotocatálisis , principalmente como ánodo [123] en aplicaciones de química verde . Como fotocatalizador, el ZnO reacciona cuando se expone a la radiación UV [121] y se utiliza en reacciones de fotodegradación para eliminar contaminantes orgánicos del medio ambiente. [124] [125] También se utiliza para reemplazar los catalizadores utilizados en reacciones fotoquímicas que normalmente requerirían condiciones de reacción costosas o inconvenientes con bajos rendimientos . [121]
Como aditivo alimentario , el óxido de zinc está en la lista de sustancias generalmente reconocidas como seguras de la Administración de Alimentos y Medicamentos de los Estados Unidos . [126]
El óxido de zinc en sí no es tóxico; sin embargo, es peligroso inhalar altas concentraciones de vapores de óxido de zinc, como los que se generan cuando el zinc o las aleaciones de zinc se funden y oxidan a alta temperatura. Este problema ocurre al fundir aleaciones que contienen latón porque el punto de fusión del latón está cerca del punto de ebullición del zinc. [127] La inhalación de óxido de zinc, que puede ocurrir al soldar acero galvanizado (galvanizado) , puede provocar una enfermedad llamada fiebre de vapores metálicos . [127]
En formulaciones de protectores solares que combinaban óxido de zinc con absorbentes de UV de moléculas pequeñas, la luz UV causó fotodegradación de los absorbentes de UV de moléculas pequeñas y toxicidad en ensayos con embriones de pez cebra. [128]