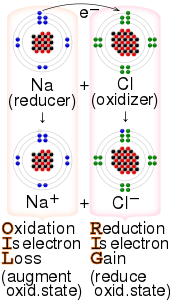
En química , un agente reductor (también conocido como reductor , reductor o donante de electrones ) es una especie química que "dona" un electrón a un receptor de electrones (llamado agente oxidante , oxidante , oxidante o aceptor de electrones ).
Entre los ejemplos de sustancias que son agentes reductores comunes se incluyen el hidrógeno , los metales alcalinos , el ácido fórmico , [1] el ácido oxálico , [2] y los compuestos de sulfito .
En sus estados previos a la reacción, los reductores tienen electrones adicionales (es decir, se reducen por sí mismos) y los oxidantes carecen de electrones (es decir, se oxidan por sí mismos). Esto se expresa comúnmente en términos de sus estados de oxidación. El estado de oxidación de un agente describe su grado de pérdida de electrones, donde cuanto mayor sea el estado de oxidación, menos electrones tiene. Entonces, inicialmente, antes de la reacción, un agente reductor está típicamente en uno de sus estados de oxidación más bajos posibles; su estado de oxidación aumenta durante la reacción mientras que el del oxidante disminuye. Por lo tanto, en una reacción redox , el agente cuyo estado de oxidación aumenta, que "pierde/ dona electrones", que "se oxida" y que "reduce" se llama reductor o agente reductor , mientras que el agente cuyo estado de oxidación disminuye, que "gana/ acepta /recibe electrones", que "se reduce" y que "oxida" se llama oxidante o agente oxidante .
Por ejemplo, consideremos la reacción general de la respiración celular aeróbica :
El oxígeno ( O2 ) se está reduciendo , por lo que es el agente oxidante. La glucosa ( C6H12O6 ) se está oxidando, por lo que es el agente reductor.
Considere la siguiente reacción:
El agente reductor en esta reacción es el ferrocianuro ( [Fe(CN) 6 ] 4− ). Este dona un electrón, oxidándose a ferricianuro ( [Fe(CN) 6 ] 3− ). Simultáneamente, ese electrón es recibido por el oxidante cloro ( Cl
2), que se reduce a cloruro ( Cl−
).
Los agentes reductores fuertes pierden (o donan) electrones con facilidad. Un átomo con un radio atómico relativamente grande tiende a ser un mejor reductor. En tales especies, la distancia desde el núcleo hasta los electrones de valencia es tan grande que estos electrones no son fuertemente atraídos. Estos elementos tienden a ser agentes reductores fuertes. Los buenos agentes reductores tienden a consistir en átomos con una baja electronegatividad , que es la capacidad de un átomo o molécula para atraer electrones de enlace, y las especies con energías de ionización relativamente pequeñas también sirven como buenos agentes reductores. [ cita requerida ]
La medida de la capacidad de un material para reducirse se conoce como su potencial de reducción . [3] La siguiente tabla muestra algunos potenciales de reducción, que pueden cambiarse a potenciales de oxidación invirtiendo el signo. Los agentes reductores pueden clasificarse aumentando su fuerza clasificando sus potenciales de reducción. Los reductores donan electrones a (es decir, "reducen") agentes oxidantes , que se dice que "son reducidos por" el reductor. El agente reductor es más fuerte cuando tiene un potencial de reducción más negativo y más débil cuando tiene un potencial de reducción más positivo. Cuanto más positivo sea el potencial de reducción, mayor será la afinidad de la especie por los electrones y la tendencia a reducirse (es decir, a recibir electrones). La siguiente tabla proporciona los potenciales de reducción del agente reductor indicado a 25 °C. Por ejemplo, entre el sodio (Na), el cromo (Cr), el cuproso (Cu + ) y el cloruro (Cl − ), es Na el agente reductor más fuerte mientras que Cl − es el más débil; Dicho de otra manera, Na + es el agente oxidante más débil de esta lista, mientras que Cl es el más fuerte. [ cita requerida ]
Los agentes reductores comunes incluyen los metales potasio, calcio, bario, sodio y magnesio, y también compuestos que contienen el ion hidruro H − , como NaH , LiH , [5] LiAlH 4 y CaH 2 .
Algunos elementos y compuestos pueden ser a la vez agentes reductores y oxidantes . El gas hidrógeno es un agente reductor cuando reacciona con no metales y un agente oxidante cuando reacciona con metales.
El hidrógeno (cuyo potencial de reducción es 0,0) actúa como agente oxidante porque acepta una donación de electrones del agente reductor litio (cuyo potencial de reducción es -3,04), lo que hace que el Li se oxide y el hidrógeno se reduzca.
El hidrógeno actúa como un agente reductor porque dona sus electrones al flúor , lo que permite que el flúor se reduzca.
Los agentes reductores y oxidantes son los responsables de la corrosión , que es la "degradación de los metales como resultado de la actividad electroquímica". [3] La corrosión requiere un ánodo y un cátodo para que se produzca. El ánodo es un elemento que pierde electrones (agente reductor), por lo que la oxidación siempre ocurre en el ánodo, y el cátodo es un elemento que gana electrones (agente oxidante), por lo que la reducción siempre ocurre en el cátodo. La corrosión se produce siempre que hay una diferencia de potencial de oxidación. Cuando esto está presente, el metal del ánodo comienza a deteriorarse, siempre que haya una conexión eléctrica y la presencia de un electrolito . [ cita requerida ]
Históricamente, la reducción se refería a la eliminación de oxígeno de un compuesto, de ahí el nombre "reducción". [7] Un ejemplo de este fenómeno ocurrió durante el Gran Evento de Oxidación , en el que el oxígeno molecular producido biológicamente ( dioxígeno ( O2 ), un oxidante y receptor de electrones) se agregó a la atmósfera de la Tierra primitiva , que originalmente era una atmósfera débilmente reductora que contenía gases reductores como metano ( CH4 ) y monóxido de carbono ( CO ) (junto con otros donantes de electrones) [8] y prácticamente nada de oxígeno porque cualquiera que se produjera reaccionaría con estos u otros reductores (particularmente con hierro disuelto en agua de mar ), lo que resultaría en su eliminación . Al usar agua como agente reductor, las cianobacterias fotosintetizadoras acuáticas produjeron este oxígeno molecular como un producto de desecho. [9] Este O 2 inicialmente oxidó el hierro ferroso disuelto del océano (Fe(II) − es decir, hierro en su estado de oxidación +2) para formar óxidos de hierro férrico insolubles como el óxido de hierro (III) (Fe(II) perdió un electrón ante el oxidante y se convirtió en Fe(III) − es decir, hierro en su estado de oxidación +3) que se precipitó al fondo del océano para formar formaciones de hierro en bandas , eliminando así el oxígeno (y el hierro). La tasa de producción de oxígeno finalmente superó la disponibilidad de materiales reductores que eliminaron el oxígeno, lo que finalmente llevó a la Tierra a obtener una atmósfera fuertemente oxidante que contenía abundante oxígeno (como la atmósfera moderna ). [10] El sentido moderno de donar electrones es una generalización de esta idea, que reconoce que otros componentes pueden desempeñar un papel químico similar al oxígeno.
La formación de óxido de hierro (III) ;
En la ecuación anterior, el hierro (Fe) tiene un número de oxidación de 0 antes y 3+ después de la reacción. Para el oxígeno (O), el número de oxidación comenzó como 0 y disminuyó a 2−. Estos cambios pueden verse como dos " semirreacciones " que ocurren simultáneamente:
El hierro (Fe) se ha oxidado porque el número de oxidación ha aumentado. El hierro es el agente reductor porque cedió electrones al oxígeno (O 2 ). El oxígeno (O 2 ) se ha reducido porque el número de oxidación ha disminuido y es el agente oxidante porque le quitó electrones al hierro (Fe).
En su
Traité élémentaire de chimie
,
estableció
claramente que la combustión consiste en una combinación química entre el oxígeno de la atmósfera y la materia combustible [...]. A finales de siglo, sus ideas fueron ampliamente aceptadas y se habían aplicado con éxito a los procesos más complejos de la respiración y la fotosíntesis. Las reacciones en las que se consumía oxígeno se clasificaban como oxidaciones, mientras que aquellas en las que se perdía oxígeno se denominaban reducciones.