La reducción de Wolff-Kishner es una reacción que se utiliza en química orgánica para convertir las funcionalidades carbonílicas en grupos metileno . [1] [2] En el contexto de la síntesis de moléculas complejas, se emplea con mayor frecuencia para eliminar un grupo carbonilo después de que haya cumplido su propósito sintético de activar un intermediario en un paso anterior. Como tal, no hay un retron obvio para esta reacción. La reacción fue reportada por Nikolai Kischner en 1911 [3] y Ludwig Wolff en 1912. [4]

En general, el mecanismo de reacción implica primero la generación in situ de una hidrazona por condensación de hidrazina con el sustrato de cetona o aldehído. Sin embargo, a veces es ventajoso utilizar una hidrazona preformada como sustrato (ver modificaciones). El paso que determina la velocidad de la reacción es la desprotonación de la hidrazona por una base de alcóxido para formar un anión diimida mediante un paso de protonación/desprotonación concertado, mediado por solvente. El colapso de esta alquildiimida con pérdida de N 2 [2] conduce a la formación de un anión alquilado que puede ser protonado por solvente para dar el producto deseado.

Debido a que la reducción de Wolff-Kishner requiere condiciones muy básicas, no es adecuada para sustratos sensibles a las bases. En algunos casos, la formación de la hidrazona requerida no se producirá en grupos carbonilo estéricamente impedidos, lo que impedirá la reacción. Sin embargo, este método puede ser superior a la reducción de Clemmensen relacionada para compuestos que contienen grupos funcionales sensibles a los ácidos, como los pirroles, y para compuestos de alto peso molecular.
La reducción de Wolff-Kishner fue descubierta independientemente por N. Kishner [3] en 1911 y Ludwig Wolff en 1912. [4] Kishner descubrió que la adición de hidrazona preformada a una placa porosa platinizada triturada que contenía hidróxido de potasio caliente conducía a la formación del hidrocarburo correspondiente. En 2013 se publicó una reseña titulada “Discapacidad, despotismo, desoxigenación: del exilio a miembro de la Academia: Nikolai Matveevich Kizhner” que describe la vida y la obra de Kishner. [5]

Posteriormente, Wolff logró el mismo resultado calentando una solución etanólica de semicarbazonas o hidrazonas en un tubo sellado a 180 °C en presencia de etóxido de sodio.
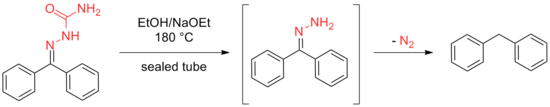
El método desarrollado por Kishner tiene la ventaja de evitar el requisito de un tubo sellado, pero ambas metodologías adolecía de falta de fiabilidad cuando se aplicaban a muchos sustratos con impedimentos. Estas desventajas promovieron el desarrollo del procedimiento de Wolff, en el que se implementó el uso de disolventes de alto punto de ebullición, como el etilenglicol y el trietilenglicol, para permitir las altas temperaturas requeridas para la reacción y evitar la necesidad de un tubo sellado. [6] [7] Estas modificaciones iniciales fueron seguidas por muchas otras mejoras, como se describe a continuación.
El mecanismo de la reducción de Wolff-Kishner ha sido estudiado por Szmant y colaboradores. [8] [9] [10] [11] Según la investigación de Szmant, el primer paso en esta reacción es la formación de un anión hidrazona 1 por desprotonación del nitrógeno terminal por MOH. Si se utilizan semicarbazonas como sustratos, la conversión inicial en la hidrazona correspondiente es seguida por la desprotonación. [4] Una serie de datos mecanicistas sugieren que el paso determinante de la velocidad implica la formación de un nuevo enlace carbono-hidrógeno en el terminal de carbono en el anión hidrazona deslocalizado. Esta captura de protones tiene lugar de manera concertada con una abstracción inducida por disolvente del segundo protón en el terminal de nitrógeno. El hallazgo de Szmant de que esta reacción es de primer orden tanto en el ion hidróxido como en la hidrazona cetona apoya esta propuesta mecanicista. [12] Varias moléculas de disolvente tienen que estar involucradas en este proceso para permitir un proceso concertado. Un análisis Hammett detallado [8] de arilaldehídos, metilarilcetonas y diarilcetonas mostró una relación no lineal que los autores atribuyen a la complejidad del paso que determina la velocidad. Los sustituyentes que atraen electrones ligeramente favorecen la formación de enlaces carbono-hidrógeno, pero los sustituyentes que atraen electrones fuertemente disminuirán la carga negativa en el nitrógeno terminal y, a su vez, favorecerán una capa de solvatación más grande y más dura que dificultará la ruptura del enlace NH. Los valores de entropía negativa excepcionalmente altos de activación observados pueden explicarse por el alto grado de organización en el estado de transición propuesto.
Además, se encontró que la velocidad de la reacción depende de la concentración del disolvente hidroxílico y del catión en el catalizador de alcóxido. La presencia de éter corona en el medio de reacción puede aumentar la reactividad del anión hidrazona 1 al disociar el par iónico y, por lo tanto, mejorar la velocidad de reacción. [11] El paso final de la reducción de Wolff-Kishner es el colapso del anión dimuro 2 en presencia de una fuente de protones para dar el hidrocarburo a través de la pérdida de dinitrógeno para proporcionar un anión alquilo 3 , que experimenta una reacción ácido-base rápida e irreversible con el disolvente para dar el alcano. Taber obtuvo evidencia de este intermedio de alta energía a través de atrapamiento intramolecular. El resultado estereoquímico de este experimento fue más consistente con un intermedio de anión alquilo que con la posibilidad alternativa de un radical alquilo. [13] La fuerza impulsora general de la reacción es la evolución de gas nitrógeno de la mezcla de reacción.

Muchos de los esfuerzos dedicados a mejorar la reducción de Wolff-Kishner se han centrado en la formación más eficiente del intermediario hidrazona mediante la eliminación del agua y una velocidad más rápida de descomposición de la hidrazona mediante el aumento de la temperatura de reacción. [6] [7] Algunas de las modificaciones más nuevas proporcionan avances más significativos y permiten reacciones en condiciones considerablemente más suaves. La tabla muestra un resumen de algunas de las modificaciones que se han desarrollado desde el descubrimiento inicial.
En 1946, Huang Minlon informó un procedimiento modificado para la reducción de cetonas de Wolff-Kishner en el que el exceso de hidrazina y agua se eliminaban por destilación después de la formación de hidrazona. [14] [20] El efecto reductor de temperatura del agua que se producía en la formación de hidrazona generalmente daba como resultado tiempos de reacción largos y condiciones de reacción duras incluso si se usaba hidrazona anhidra en la formación de la hidrazona. El procedimiento modificado consiste en refluir el compuesto carbonílico en hidrato de hidracina al 85% con tres equivalentes de hidróxido de sodio seguido de la destilación del agua y el exceso de hidracina y la elevación de la temperatura a 200 °C. Se pueden obtener tiempos de reacción significativamente reducidos y rendimientos mejorados utilizando esta modificación. El informe original de Minlon describió la reducción del ácido β- ( p -fenoxibenzoil)propiónico a ácido γ- ( p -fenoxifenil)butírico con un rendimiento del 95% en comparación con el rendimiento del 48% obtenido por el procedimiento tradicional.

Nueve años después de la primera modificación de Huang Minlon, Barton desarrolló un método para la reducción de grupos carbonilo estéricamente impedidos. [15] Este método incluye la exclusión rigurosa de agua, temperaturas más altas y tiempos de reacción más prolongados, así como sodio en dietilenglicol en lugar de base alcóxido. En estas condiciones, se pueden aliviar algunos de los problemas que normalmente surgen con las cetonas impedidas; por ejemplo, el grupo carbonilo C11 en el compuesto esteroidal que se muestra a continuación se redujo con éxito en las condiciones de Barton, mientras que las condiciones de Huang-Minlon no lograron efectuar esta transformación.

La adición lenta de hidrazonas preformadas al terc -butóxido de potasio en DMSO como medio de reacción en lugar de glicoles permite que la formación de hidrocarburos se lleve a cabo con éxito a temperaturas tan bajas como 23 °C. [16] Cram atribuyó la mayor reactividad en DMSO como solvente a una mayor fuerza básica del terc -butóxido de potasio en este medio.

Esta modificación no se ha explotado en gran medida en la síntesis orgánica debido a la necesidad de aislar sustratos de hidrazona preformados y agregar la hidrazona durante varias horas a la mezcla de reacción.
Henbest amplió el procedimiento de Cram sometiendo a reflujo hidrazonas de carbonilo y terc -butóxido de potasio en tolueno seco. [17] La adición lenta de la hidrazona no es necesaria y se encontró que este procedimiento es más adecuado para compuestos carbonílicos propensos a reacciones secundarias inducidas por bases que la modificación de Cram. Por ejemplo, se ha encontrado que la migración de dobles enlaces en enonas α,β -insaturadas y la eliminación de grupos funcionales de ciertas cetonas α -sustituidas tienen menos probabilidades de ocurrir bajo las condiciones de Henbest. [21]
El tratamiento de tosilhidrazonas con reactivos donantes de hidruro para obtener los alcanos correspondientes se conoce como reacción de Caglioti. [18] [22] Las condiciones de reacción informadas inicialmente se han modificado y los donantes de hidruro como el cianoborohidruro de sodio , el triacetoxiborohidruro de sodio o el catecolborano pueden reducir las tosilhidrazonas a hidrocarburos. [23] La reacción se lleva a cabo en condiciones relativamente suaves y, por lo tanto, puede tolerar una gama más amplia de grupos funcionales que el procedimiento original. Las reducciones con cianoborohidruro de sodio como agente reductor se pueden realizar en presencia de ésteres, amidas, sustituyentes ciano, nitro y cloro. Los sustituyentes primarios bromo y yodo son desplazados por hidruro nucleofílico en estas condiciones.

La vía de reducción es sensible al pH, al agente reductor y al sustrato. [24] [25] Una posibilidad, que ocurre en condiciones ácidas, incluye el ataque directo con hidruro del ion iminio 1 tras la protonación previa de la tosilhidrazona. El derivado de tosilhidrazina 2 resultante sufre posteriormente la eliminación del ácido p -toluenosulfínico y se descompone a través de un intermediario diimina 3 al hidrocarburo correspondiente.

Una ligera variación de este mecanismo ocurre cuando la tautomerización a la azohidrazina se ve facilitada por efectos inductivos . La azohidrazina transitoria 4 puede entonces reducirse al derivado de tosilhidrazina 2 y proporcionar el producto descarbonilado de manera análoga a la primera posibilidad. Este mecanismo opera cuando se utilizan donantes de hidruro relativamente débiles, como el cianoborohidruro de sodio . Se sabe que este cianoborohidruro de sodio no es lo suficientemente fuerte como para reducir las iminas , pero puede reducir los iones de iminio .
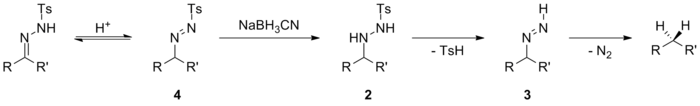
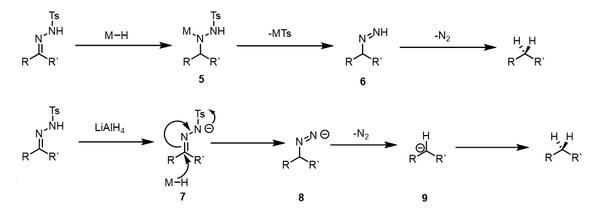
Cuando se utilizan donantes de hidruro más fuertes, se pone en funcionamiento un mecanismo diferente, que evita el uso de condiciones ácidas. La entrega de hidruro se produce para dar el intermedio 5, seguido de la eliminación del sulfinato metálico para dar el intermedio azo 6. Este intermedio se descompone luego, con pérdida de gas nitrógeno , para dar el compuesto reducido. Cuando se utilizan donantes de hidruro fuertemente básicos, como el hidruro de litio y aluminio , puede producirse la desprotonación de la tosilhidrazona antes de la entrega del hidruro. El anión intermedio 7 puede sufrir un ataque de hidruro, eliminando un sulfinato metálico para dar el anión azo 8. Este se descompone fácilmente en el carbanión 9 , que se protona para dar el producto reducido.
Al igual que con la reducción de Wolff-Kishner, la reacción de descarbonilación puede fallar a menudo debido a la formación no exitosa de la tosilhidrazona correspondiente. Esto es común para las cetonas estéricamente impedidas, como fue el caso de la cetona amino cíclica que se muestra a continuación. [26]

Se pueden emplear métodos alternativos de reducción cuando falla la formación de la hidrazona, incluida la reducción de tiocetal con níquel Raney o la reacción con trietilborohidruro de sodio .
Las tosilhidrazonas carbonílicas α,β -insaturadas pueden convertirse en los alquenos correspondientes mediante la migración del doble enlace. La reducción se lleva a cabo de forma estereoselectiva para formar el isómero geométrico E. [27]

Un método muy suave utiliza un equivalente de catecolborano para reducir las tosilhidrazonas α,β -insaturadas. [28]

Se ha examinado el mecanismo de reducción de tosilhidrazonas α,β -insaturadas con NaBH3CN utilizando el marcaje con deuterio. La formación de alquenos se inicia mediante la reducción con hidruro del ion iminio seguida de la migración del doble enlace y la extrusión de nitrógeno que ocurren de manera concertada. [29] El reordenamiento del diazeno alílico como paso final en la transposición 1,3-reductiva de tosilhidrazonas α,β -insaturadas a los alquenos reducidos también se puede utilizar para establecer estereocentros sp3 a partir de diazenos alílicos que contienen estereocentros proquirales. La influencia del estereocentro alcoxi da como resultado la reducción diastereoselectiva de la tosilhidrazona α,β -insaturada. [30] Los autores predijeron que la transferencia diastereoselectiva del hidrógeno del diazeno a una cara del alqueno proquiral podría ser forzada durante el reordenamiento suprafacial.

En 2004, Myers y colaboradores desarrollaron un método para la preparación de N-terc -butildimetilsililhidrazonas a partir de compuestos que contienen carbonilo. [19] Estos productos se pueden utilizar como una alternativa superior a las hidrazonas en la transformación de cetonas en alcanos. Las ventajas de este procedimiento son condiciones de reacción considerablemente más suaves y mayor eficiencia, así como conveniencia operativa. La condensación de 1,2-bis( terc -butildimetilsilil)-hidrazina con aldehídos y cetonas con Sc(OTf) 3 como catalizador es rápida y eficiente a temperatura ambiente. La formación y reducción de N-terc -butildimetilsililhidrazonas se puede realizar en un procedimiento de un solo recipiente con alto rendimiento.

[Este gráfico es incorrecto. Debería ser TBS-N, no TBSO-N] El método recientemente desarrollado se comparó directamente con las condiciones de reducción estándar de Huang-Minlon Wolff-Kishner (hidrato de hidrazina, hidróxido de potasio, dietilenglicol, 195 °C) para la cetona esteroidea que se muestra arriba. El producto se obtuvo con un rendimiento del 79 % en comparación con el 91 % obtenido a partir de la reducción mediante un intermediario N-tert -butildimetilsililhidrazona.
La reducción de Wolff-Kishner no es adecuada para sustratos sensibles a bases y, en determinadas condiciones, puede verse obstaculizada por el impedimento estérico que rodea al grupo carbonilo. A continuación se enumeran algunas de las reacciones secundarias más comunes.
Una reacción secundaria que se encuentra con frecuencia en las reducciones de Wolff-Kishner implica la formación de azina por reacción de la hidrazona con el compuesto carbonílico. La formación de la cetona se puede suprimir mediante la exclusión vigorosa del agua durante la reacción. Varios de los procedimientos presentados requieren el aislamiento del compuesto de hidrazona antes de la reducción. Esto se puede complicar por una mayor transformación de la hidrazona producto a la hidracina correspondiente durante la purificación del producto. Cram descubrió que la formación de azina se ve favorecida por la rápida adición de hidrazonas preformadas al terc -butóxido de potasio en dimetilsulfóxido anhidro. [16]

La segunda reacción secundaria principal es la reducción de la cetona o el aldehído al alcohol correspondiente. Después de la hidrólisis inicial de la hidrazona, el derivado carbonílico libre se reduce mediante alcóxido al carbinol. En 1924, Eisenlohr informó que se observaron cantidades sustanciales de hidroxidecalina durante el intento de reducción de Wolff-Kishner de la trans-β -decalona. [31] En general, la formación de alcohol puede reprimirse mediante la exclusión de agua o mediante la adición de un exceso de hidrazina.
Kishner observó durante sus investigaciones iniciales que en algunos casos, la α -sustitución de un grupo carbonilo puede conducir a la eliminación, lo que produce hidrocarburos insaturados en condiciones de reacción típicas. Más tarde, Leonard desarrolló aún más esta reacción e investigó la influencia de diferentes α -sustituyentes en el resultado de la reacción. [21] [32] Descubrió que la cantidad de eliminación aumenta con el aumento del volumen estérico del grupo saliente. Además, las cetonas α -dialquilamino-sustituidas generalmente dieron una mezcla de producto de reducción y eliminación, mientras que los grupos salientes menos básicos dieron como resultado la formación exclusiva del producto alqueno.

La fragmentación de cetonas α,β -epoxi en alcoholes alílicos se ha extendido a un proceso sintéticamente útil y se conoce como reacción de Wharton . [33]
Erman y colaboradores observaron la reorganización de Grob de los anillos tensos adyacentes al grupo carbonilo. [34] Durante un intento de reducción de Wolff-Kishner de trans-π -bromocanfor en las condiciones de Cram, se aisló limoneno como único producto.
De manera similar, puede ocurrir la escisión de anillos tensos adyacentes al grupo carbonilo. Cuando el 9 β ,19-ciclo-5 α -pregnano-3,11,20-triona 3,20-dietilen cetal se sometió a condiciones de Huang-Minlon, se observó un agrandamiento del anillo en lugar de la formación del compuesto 11-deoxo. [35]

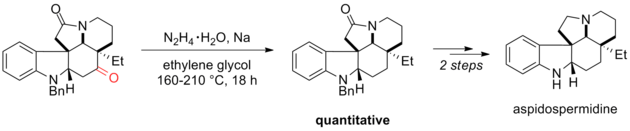
La reducción de Wolff-Kishner se ha aplicado a la síntesis total de ácido escopadulcico B, [36] aspidospermidina [37] [38] y disiolida. [39] La modificación de Huang Minlon de la reducción de Wolff-Kishner es uno de los pasos finales en su síntesis de (±)-aspidospermidina. El grupo carbonilo que se redujo en la reducción de Wolff-Kishner fue esencial para los pasos anteriores en la síntesis. La amida terciaria era estable a las condiciones de reacción y se redujo posteriormente con hidruro de litio y aluminio. [38]
Las amidas no suelen ser sustratos adecuados para la reducción de Wolff-Kishner, como se demuestra en el ejemplo anterior. Sin embargo, Coe y colaboradores descubrieron que una amida retorcida se puede reducir de manera eficiente en condiciones de Wolff-Kishner. [40] Los autores explican esta observación con el sesgo estereoelectrónico del sustrato que evita la formación de iones de iminio “ anti-Bredt ” y, por lo tanto, favorece la expulsión de alcohol y la formación de hidrazona. La funcionalidad de amida en este sustrato deformado se puede considerar como funcionalidades de amina y cetona aisladas, ya que se evita la estabilización por resonancia debido a las restricciones torsionales. El producto se obtuvo con un rendimiento general del 68 % en un procedimiento de dos pasos.
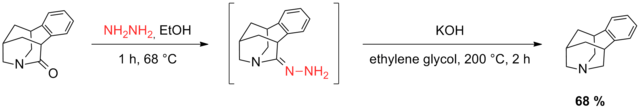
Se redujo un compuesto carbonílico tricíclico utilizando la modificación de Huang Minlon de la reducción de Wolff-Kishner. [41] Varios intentos de descarbonilación de acetato alílico tricíclico que contenía cetona fracasaron y se tuvo que eliminar la funcionalidad del acetato para permitir la reducción de Wolff-Kishner. Finalmente, se instaló el alcohol alílico mediante oxiplumbación.

La reducción de Wolff-Kishner también se ha utilizado a escala de kilogramos para la síntesis de un sustrato de imidazol funcionalizado. Se investigaron varios métodos de reducción alternativos, pero todas las condiciones probadas resultaron infructuosas. Se abordaron las cuestiones de seguridad para una reducción de Wolff-Kishner a gran escala y se obtuvo un procedimiento altamente optimizado para obtener un producto con un buen rendimiento. [42]

Se utilizó un reordenamiento diazeno alílico en la síntesis del fragmento C 21 – C 34 de la antascomicina B. [43] La hidrazona se redujo selectivamente con catecolborano y el exceso de agente reductor se descompuso con tiosulfato de sodio. Luego, el producto de reacción crudo se trató con acetato de sodio para dar el isómero 1,4- syn .
