La dopamina ( DA , una contracción de 3,4 - dihidroxifeniletilamina ) es una molécula neuromoduladora que desempeña varias funciones importantes en las células. Es una sustancia química orgánica de las familias de las catecolaminas y las fenetilaminas . La dopamina constituye aproximadamente el 80 % del contenido de catecolaminas en el cerebro. Es una amina sintetizada al eliminar un grupo carboxilo de una molécula de su sustancia química precursora , L-DOPA , que se sintetiza en el cerebro y los riñones. La dopamina también se sintetiza en plantas y la mayoría de los animales. En el cerebro, la dopamina funciona como un neurotransmisor , una sustancia química liberada por las neuronas (células nerviosas) para enviar señales a otras células nerviosas. Los neurotransmisores se sintetizan en regiones específicas del cerebro, pero afectan a muchas regiones sistémicamente. El cerebro incluye varias vías de dopamina distintas , una de las cuales desempeña un papel importante en el componente motivacional de la conducta motivada por la recompensa . La anticipación de la mayoría de los tipos de recompensas aumenta el nivel de dopamina en el cerebro [4] y muchas drogas adictivas aumentan la liberación de dopamina o bloquean su recaptación en las neuronas después de la liberación [5] . Otras vías de dopamina cerebrales están involucradas en el control motor y en el control de la liberación de varias hormonas. Estas vías y grupos de células forman un sistema de dopamina que es neuromodulador [5] .
En la cultura popular y los medios de comunicación, la dopamina suele representarse como la principal sustancia química del placer, pero la opinión actual en farmacología es que la dopamina, en cambio, confiere prominencia motivacional ; [6] [7] [8] en otras palabras, la dopamina señala la prominencia motivacional percibida (es decir, la deseabilidad o aversión) de un resultado, lo que a su vez impulsa el comportamiento del organismo hacia o lejos del logro de ese resultado. [8] [9]
Fuera del sistema nervioso central, la dopamina funciona principalmente como un mensajero paracrino local . En los vasos sanguíneos, inhibe la liberación de noradrenalina y actúa como vasodilatador ; en los riñones, aumenta la excreción de sodio y la diuresis; en el páncreas, reduce la producción de insulina; en el sistema digestivo, reduce la motilidad gastrointestinal y protege la mucosa intestinal ; y en el sistema inmunitario, reduce la actividad de los linfocitos . Con excepción de los vasos sanguíneos, la dopamina en cada uno de estos sistemas periféricos se sintetiza localmente y ejerce sus efectos cerca de las células que la liberan.
Varias enfermedades importantes del sistema nervioso están asociadas con disfunciones del sistema de dopamina, y algunos de los medicamentos clave utilizados para tratarlas funcionan alterando los efectos de la dopamina. La enfermedad de Parkinson , una afección degenerativa que causa temblor y deterioro motor, es causada por una pérdida de neuronas secretoras de dopamina en un área del mesencéfalo llamada sustancia negra . Su precursor metabólico L-DOPA puede fabricarse; La levodopa , una forma pura de L-DOPA, es el tratamiento más utilizado para el Parkinson. Existe evidencia de que la esquizofrenia implica niveles alterados de actividad de la dopamina, y la mayoría de los fármacos antipsicóticos utilizados para tratarla son antagonistas de la dopamina que reducen la actividad de la dopamina. [10] Los fármacos antagonistas de la dopamina similares también son algunos de los agentes antináuseas más eficaces . El síndrome de piernas inquietas y el trastorno por déficit de atención con hiperactividad (TDAH) están asociados con una disminución de la actividad de la dopamina. [11] Los estimulantes dopaminérgicos pueden ser adictivos en dosis altas, pero algunos se utilizan en dosis más bajas para tratar el TDAH. La dopamina en sí está disponible como un medicamento manufacturado para inyección intravenosa . Es útil en el tratamiento de la insuficiencia cardíaca grave o el shock cardiogénico . [12] En los recién nacidos se puede utilizar para la hipotensión y el shock séptico . [13]
Una molécula de dopamina consiste en una estructura de catecol (un anillo de benceno con dos grupos laterales hidroxilo ) con un grupo amina unido a través de una cadena de etilo . [14] Como tal, la dopamina es la catecolamina más simple posible , una familia que también incluye los neurotransmisores norepinefrina y epinefrina . [15] La presencia de un anillo de benceno con esta unión de amina la convierte en una fenetilamina sustituida , una familia que incluye numerosas drogas psicoactivas . [16]
Como la mayoría de las aminas , la dopamina es una base orgánica . [17] Como base , generalmente se protona en entornos ácidos (en una reacción ácido-base ). [17] La forma protonada es altamente soluble en agua y relativamente estable, pero puede oxidarse si se expone al oxígeno u otros oxidantes . [17] En entornos básicos, la dopamina no está protonada. [17] En esta forma de base libre , es menos soluble en agua y también más reactiva. [17] Debido a la mayor estabilidad y solubilidad en agua de la forma protonada, la dopamina se suministra para uso químico o farmacéutico como clorhidrato de dopamina , es decir, la sal de clorhidrato que se crea cuando la dopamina se combina con ácido clorhídrico . [17] En forma seca, el clorhidrato de dopamina es un polvo fino de color blanco a amarillo. [18]
La dopamina se sintetiza en un conjunto restringido de tipos de células, principalmente neuronas y células de la médula de las glándulas suprarrenales . [22] Las vías metabólicas primarias y secundarias respectivamente son:
El precursor directo de la dopamina, la L -DOPA , se puede sintetizar indirectamente a partir del aminoácido esencial fenilalanina o directamente a partir del aminoácido no esencial tirosina . [25] Estos aminoácidos se encuentran en casi todas las proteínas y, por lo tanto, están fácilmente disponibles en los alimentos, siendo la tirosina el más común. Aunque la dopamina también se encuentra en muchos tipos de alimentos, es incapaz de atravesar la barrera hematoencefálica que rodea y protege el cerebro. [26] Por lo tanto, debe sintetizarse dentro del cerebro para realizar su actividad neuronal . [26]
La L -fenilalanina se convierte en L -tirosina por la enzima fenilalanina hidroxilasa , con oxígeno molecular (O 2 ) y tetrahidrobiopterina como cofactores . La L -tirosina se convierte en L -DOPA por la enzima tirosina hidroxilasa , con tetrahidrobiopterina, O 2 y hierro (Fe 2+ ) como cofactores. [25] La L -DOPA se convierte en dopamina por la enzima L -aminoácido aromático descarboxilasa (también conocida como DOPA descarboxilasa), con fosfato de piridoxal como cofactor. [25]
La dopamina en sí se utiliza como precursora en la síntesis de los neurotransmisores noradrenalina y epinefrina. [25] La dopamina se convierte en noradrenalina por la enzima dopamina β-hidroxilasa , con O 2 y ácido L -ascórbico como cofactores. [25] La noradrenalina se convierte en epinefrina por la enzima feniletanolamina N -metiltransferasa con S -adenosil- L -metionina como cofactor. [25]
Algunos de los cofactores también requieren su propia síntesis. [25] La deficiencia de cualquier aminoácido o cofactor requerido puede perjudicar la síntesis de dopamina, norepinefrina y epinefrina. [25]
La dopamina se descompone en metabolitos inactivos por un conjunto de enzimas: monoaminooxidasa (MAO), catecol- O -metiltransferasa (COMT) y aldehído deshidrogenasa (ALDH), que actúan en secuencia. [27] Ambas isoformas de la monoaminooxidasa, MAO-A y MAO-B , metabolizan eficazmente la dopamina. [25] Existen diferentes vías de degradación, pero el principal producto final es el ácido homovanílico (HVA), que no tiene actividad biológica conocida. [27] Desde el torrente sanguíneo, el ácido homovanílico es filtrado por los riñones y luego excretado en la orina. [27] Las dos rutas metabólicas principales que convierten la dopamina en HVA son: [28]
En la investigación clínica sobre la esquizofrenia, se han utilizado mediciones de ácido homovanílico en plasma para estimar los niveles de actividad de la dopamina en el cerebro. Sin embargo, una dificultad de este enfoque es separar el alto nivel de ácido homovanílico plasmático que contribuye al metabolismo de la noradrenalina. [29] [30]
Aunque la dopamina normalmente se descompone por una enzima oxidorreductasa , también es susceptible a la oxidación por reacción directa con el oxígeno, produciendo quinonas y diversos radicales libres como productos. [31] La tasa de oxidación puede aumentar por la presencia de hierro férrico u otros factores. Las quinonas y los radicales libres producidos por la autooxidación de la dopamina pueden envenenar las células , y hay evidencia de que este mecanismo puede contribuir a la pérdida de células que ocurre en la enfermedad de Parkinson y otras afecciones. [32]
La dopamina ejerce sus efectos uniéndose a los receptores de la superficie celular y activándolos . [22] En los seres humanos, la dopamina tiene una alta afinidad de unión a los receptores de dopamina y al receptor 1 asociado a trazas de amina humana (hTAAR1). [3] [33] En los mamíferos, se han identificado cinco subtipos de receptores de dopamina , etiquetados de D 1 a D 5. [22] Todos ellos funcionan como receptores metabotrópicos acoplados a proteína G , lo que significa que ejercen sus efectos a través de un complejo sistema de segundo mensajero . [34] Estos receptores se pueden dividir en dos familias, conocidas como similares a D 1 y similares a D 2. [22] Para los receptores ubicados en las neuronas del sistema nervioso, el efecto final de la activación similar a D 1 ( D 1 y D 5 ) puede ser la excitación (a través de la apertura de los canales de sodio ) o la inhibición (a través de la apertura de los canales de potasio ); El efecto final de la activación tipo D 2 (D 2 , D 3 y D 4 ) es usualmente la inhibición de la neurona objetivo. [34] En consecuencia, es incorrecto describir la dopamina en sí misma como excitatoria o inhibidora: su efecto sobre una neurona objetivo depende de qué tipos de receptores estén presentes en la membrana de esa neurona y de las respuestas internas de esa neurona al segundo mensajero cAMP . [34] Los receptores D 1 son los receptores de dopamina más numerosos en el sistema nervioso humano; los receptores D 2 son los siguientes; los receptores D 3 , D 4 y D 5 están presentes en niveles significativamente más bajos. [34]
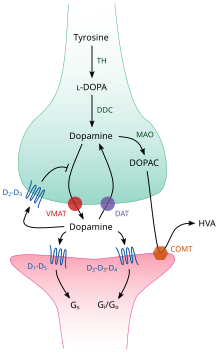
Dentro del cerebro, la dopamina funciona como un neurotransmisor y neuromodulador , y está controlada por un conjunto de mecanismos comunes a todos los neurotransmisores monoamínicos . [22] Después de la síntesis, la dopamina es transportada desde el citosol a las vesículas sinápticas por un transportador de soluto : un transportador vesicular de monoamina , VMAT2 . [35] La dopamina se almacena en estas vesículas hasta que se expulsa a la hendidura sináptica . En la mayoría de los casos, la liberación de dopamina ocurre a través de un proceso llamado exocitosis que es causado por potenciales de acción , pero también puede ser causado por la actividad de un receptor intracelular asociado a trazas de amina , TAAR1 . [33] TAAR1 es un receptor de alta afinidad para la dopamina, trazas de aminas y ciertas anfetaminas sustituidas que se encuentra a lo largo de las membranas en el medio intracelular de la célula presináptica; [33] La activación del receptor puede regular la señalización de la dopamina induciendo la inhibición de la recaptación y el eflujo de dopamina , así como inhibiendo la activación neuronal a través de un conjunto diverso de mecanismos. [33] [36]
Una vez en la sinapsis, la dopamina se une a los receptores de dopamina y los activa. [37] Estos pueden ser receptores de dopamina postsinápticos , que se encuentran en las dendritas (la neurona postsináptica), o autorreceptores presinápticos (por ejemplo, los receptores D 2 sh y D 3 presinápticos ), que se encuentran en la membrana de una terminal axónica (la neurona presináptica). [22] [37] Después de que la neurona postsináptica provoca un potencial de acción, las moléculas de dopamina se liberan rápidamente de sus receptores. Luego son absorbidas nuevamente en la célula presináptica, a través de la recaptación mediada por el transportador de dopamina o por el transportador de monoamina de la membrana plasmática . [38] Una vez de regreso en el citosol, la dopamina puede ser descompuesta por una monoaminooxidasa o reempaquetada en vesículas por VMAT2, dejándola disponible para su liberación futura. [35]
En el cerebro, el nivel de dopamina extracelular está modulado por dos mecanismos: transmisión fásica y tónica . [39] La liberación fásica de dopamina, como la liberación de la mayoría de los neurotransmisores en el sistema nervioso, está impulsada directamente por los potenciales de acción en las células que contienen dopamina. [39] La transmisión tónica de dopamina ocurre cuando se liberan pequeñas cantidades de dopamina sin ser precedidas por potenciales de acción presinápticos. [39] La transmisión tónica está regulada por una variedad de factores, incluida la actividad de otras neuronas y la recaptación de neurotransmisores. [39]

Dentro del cerebro, la dopamina desempeña papeles importantes en las funciones ejecutivas , el control motor , la motivación , la excitación , el refuerzo y la recompensa , así como en funciones de nivel inferior, como la lactancia , la gratificación sexual y las náuseas . Los grupos de células y vías dopaminérgicas conforman el sistema de la dopamina, que es neuromodulador .
Las neuronas dopaminérgicas (células nerviosas productoras de dopamina) son comparativamente pocas en número (un total de alrededor de 400.000 en el cerebro humano [40] ) y sus cuerpos celulares están confinados en grupos a unas pocas áreas cerebrales relativamente pequeñas. [41] Sin embargo, sus axones se proyectan a muchas otras áreas cerebrales y ejercen efectos poderosos sobre sus objetivos. [41] Estos grupos de células dopaminérgicas fueron cartografiados por primera vez en 1964 por Annica Dahlström y Kjell Fuxe, quienes les asignaron etiquetas que comenzaban con la letra "A" (por "aminérgico"). [42] En su esquema, las áreas A1 a A7 contienen el neurotransmisor norepinefrina, mientras que A8 a A14 contienen dopamina. Las áreas dopaminérgicas que identificaron son la sustancia negra (grupos 8 y 9); el área tegmental ventral (grupo 10); el hipotálamo posterior (grupo 11); el núcleo arqueado (grupo 12); la zona incerta (grupo 13) y el núcleo periventricular (grupo 14). [42]
La sustancia negra es una pequeña zona del mesencéfalo que forma un componente de los ganglios basales . Tiene dos partes: un área de entrada llamada pars reticulata y un área de salida llamada pars compacta . Las neuronas dopaminérgicas se encuentran principalmente en la pars compacta (grupo de células A8) y cerca (grupo A9). [41] En los seres humanos, la proyección de neuronas dopaminérgicas desde la pars compacta de la sustancia negra hasta el cuerpo estriado dorsal, denominada vía nigroestriatal , desempeña un papel importante en el control de la función motora y en el aprendizaje de nuevas habilidades motoras . [43] Estas neuronas son especialmente vulnerables a los daños y, cuando muere una gran cantidad de ellas, el resultado es un síndrome parkinsoniano . [44]
El área tegmental ventral (ATV) es otra área del mesencéfalo. El grupo más destacado de neuronas dopaminérgicas de la ATV se proyecta a la corteza prefrontal a través de la vía mesocortical y otro grupo más pequeño se proyecta al núcleo accumbens a través de la vía mesolímbica . Juntas, estas dos vías se denominan colectivamente proyección mesocorticolímbica . [41] [43] La ATV también envía proyecciones dopaminérgicas a la amígdala , el giro cingulado , el hipocampo y el bulbo olfatorio . [41] [43] Las neuronas mesocorticolímbicas desempeñan un papel central en la recompensa y otros aspectos de la motivación. [43] La literatura acumulada muestra que la dopamina también desempeña un papel crucial en el aprendizaje aversivo a través de sus efectos en varias regiones cerebrales. [45] [46] [47]
El hipotálamo posterior tiene neuronas dopaminérgicas que se proyectan a la médula espinal, pero su función no está bien establecida. [48] Hay cierta evidencia de que la patología en esta área juega un papel en el síndrome de piernas inquietas, una condición en la que las personas tienen dificultad para dormir debido a una compulsión abrumadora de mover constantemente partes del cuerpo, especialmente las piernas. [48]
El núcleo arqueado y el núcleo periventricular del hipotálamo tienen neuronas dopaminérgicas que forman una proyección importante: la vía tuberoinfundibular que va a la glándula pituitaria , donde influye en la secreción de la hormona prolactina . [49] La dopamina es el principal inhibidor neuroendocrino de la secreción de prolactina de la glándula pituitaria anterior . [49] La dopamina producida por las neuronas en el núcleo arqueado se secreta en el sistema portal hipofisario de la eminencia media , que irriga la glándula pituitaria . [49] Las células prolactínicas que producen prolactina, en ausencia de dopamina, secretan prolactina continuamente; la dopamina inhibe esta secreción. [49]
La zona incerta, agrupada entre los núcleos arqueado y periventricular, se proyecta a varias áreas del hipotálamo, y participa en el control de la hormona liberadora de gonadotropina , necesaria para activar el desarrollo de los sistemas reproductores masculino y femenino , después de la pubertad. [49]
En la retina del ojo se encuentra un grupo adicional de neuronas secretoras de dopamina . [50] Estas neuronas son células amacrinas , lo que significa que no tienen axones. [50] Liberan dopamina en el medio extracelular y están específicamente activas durante las horas del día, volviéndose silenciosas por la noche. [50] Esta dopamina retiniana actúa para mejorar la actividad de las células cónicas en la retina mientras suprime las células bastón ; el resultado es aumentar la sensibilidad al color y al contraste durante condiciones de luz brillante, a costa de una sensibilidad reducida cuando la luz es tenue. [50]

Las fuentes más grandes e importantes de dopamina en el cerebro de los vertebrados son la sustancia negra y el área tegmental ventral. [41] Ambas estructuras son componentes del mesencéfalo, estrechamente relacionadas entre sí y funcionalmente similares en muchos aspectos. [41] El componente más grande de los ganglios basales es el cuerpo estriado. [51] La sustancia negra envía una proyección dopaminérgica al cuerpo estriado dorsal , mientras que el área tegmental ventral envía un tipo similar de proyección dopaminérgica al cuerpo estriado ventral . [41]
El progreso en la comprensión de las funciones de los ganglios basales ha sido lento. [51] Las hipótesis más populares, enunciadas de forma amplia, proponen que los ganglios basales desempeñan un papel central en la selección de acciones . [52] La teoría de la selección de acciones en su forma más simple propone que cuando una persona o un animal se encuentra en una situación en la que son posibles varias conductas, la actividad en los ganglios basales determina cuál de ellas se ejecuta, al liberar esa respuesta de la inhibición mientras continúa inhibiendo otros sistemas motores que, si se activaran, generarían conductas competitivas. [53] Así pues, los ganglios basales, en este concepto, son responsables de iniciar las conductas, pero no de determinar los detalles de cómo se llevan a cabo. En otras palabras, forman esencialmente un sistema de toma de decisiones. [53]
Los ganglios basales se pueden dividir en varios sectores, y cada uno de ellos está involucrado en el control de tipos particulares de acciones. [54] El sector ventral de los ganglios basales (que contiene el cuerpo estriado ventral y el área tegmental ventral) opera en el nivel más alto de la jerarquía, seleccionando acciones a nivel de todo el organismo. [53] Los sectores dorsales (que contienen el cuerpo estriado dorsal y la sustancia negra) operan en niveles inferiores, seleccionando los músculos y movimientos específicos que se utilizan para implementar un patrón de comportamiento dado. [54]
La dopamina contribuye al proceso de selección de acciones de al menos dos maneras importantes. En primer lugar, establece el "umbral" para iniciar acciones. [52] Cuanto mayor sea el nivel de actividad de la dopamina, menor será el ímpetu necesario para evocar una conducta determinada. [52] Como consecuencia, los niveles elevados de dopamina conducen a altos niveles de actividad motora y comportamiento impulsivo ; los niveles bajos de dopamina conducen al letargo y a reacciones más lentas. [52] La enfermedad de Parkinson, en la que los niveles de dopamina en el circuito de la sustancia negra están muy reducidos, se caracteriza por rigidez y dificultad para iniciar el movimiento; sin embargo, cuando las personas con la enfermedad se enfrentan a estímulos fuertes, como una amenaza grave, sus reacciones pueden ser tan vigorosas como las de una persona sana. [55] En la dirección opuesta, las drogas que aumentan la liberación de dopamina, como la cocaína o la anfetamina, pueden producir niveles elevados de actividad, incluyendo, en el extremo, agitación psicomotora y movimientos estereotipados . [56]
El segundo efecto importante de la dopamina es el de señal de "enseñanza". [52] Cuando una acción es seguida por un aumento en la actividad de la dopamina, el circuito de los ganglios basales se altera de manera que hace que la misma respuesta sea más fácil de evocar cuando surjan situaciones similares en el futuro. [52] Esta es una forma de condicionamiento operante , en el que la dopamina desempeña el papel de señal de recompensa. [53]

En el lenguaje utilizado para discutir el sistema de recompensa, la recompensa es la propiedad atractiva y motivadora de un estímulo que induce un comportamiento apetitivo (también conocido como comportamiento de aproximación) y un comportamiento consumatorio . [57] Un estímulo gratificante es aquel que puede inducir al organismo a acercarse a él y elegir consumirlo. [57] El placer , el aprendizaje (por ejemplo, el condicionamiento clásico y operante ) y el comportamiento de aproximación son las tres funciones principales de la recompensa. [57] Como aspecto de la recompensa, el placer proporciona una definición de recompensa; [57] sin embargo, mientras que todos los estímulos placenteros son gratificantes, no todos los estímulos gratificantes son placenteros (por ejemplo, las recompensas extrínsecas como el dinero). [57] [58] El aspecto motivacional o deseable de los estímulos gratificantes se refleja en el comportamiento de aproximación que inducen, mientras que el placer de las recompensas intrínsecas resulta de consumirlas después de adquirirlas. [57] Un modelo neuropsicológico que distingue estos dos componentes de un estímulo intrínsecamente gratificante es el modelo de saliencia de incentivo , donde "querer" o deseo (menos comúnmente, "buscar" [59] ) corresponde al comportamiento apetitivo o de aproximación mientras que "gustar" o placer corresponde al comportamiento consumatorio. [57] [6] [60] En los drogadictos humanos , "querer" se disocia de "gustar" a medida que aumenta el deseo de usar una droga adictiva, mientras que el placer obtenido al consumirla disminuye debido a la tolerancia a la droga . [6]
Dentro del cerebro, la dopamina funciona en parte como una señal de recompensa global. Una respuesta inicial de dopamina a un estímulo gratificante codifica información sobre la prominencia , el valor y el contexto de una recompensa. [57] En el contexto del aprendizaje relacionado con la recompensa, la dopamina también funciona como una señal de error de predicción de recompensa , es decir, el grado en que el valor de una recompensa es inesperado. [57] Según esta hipótesis propuesta por Montague, Dayan y Sejnowski, [61] las recompensas esperadas no producen una segunda respuesta fásica de dopamina en ciertas células dopaminérgicas, pero las recompensas que son inesperadas, o mayores de lo esperado, producen un aumento de corta duración en la dopamina sináptica, mientras que la omisión de una recompensa esperada en realidad hace que la liberación de dopamina caiga por debajo de su nivel de fondo. [57] La hipótesis del "error de predicción" ha atraído un interés particular de los neurocientíficos computacionales, porque un influyente método de aprendizaje computacional conocido como aprendizaje de diferencia temporal hace un uso intensivo de una señal que codifica el error de predicción. [57] Esta confluencia de teoría y datos ha dado lugar a una interacción fértil entre neurocientíficos y científicos informáticos interesados en el aprendizaje automático . [57]
La evidencia de los registros de microelectrodos de los cerebros de animales muestra que las neuronas dopaminérgicas en el área tegmental ventral (ATV) y la sustancia negra se activan fuertemente por una amplia variedad de eventos gratificantes. [57] Estas neuronas dopaminérgicas sensibles a la recompensa en el ATV y la sustancia negra son cruciales para la cognición relacionada con la recompensa y sirven como el componente central del sistema de recompensa. [6] [62] [63] La función de la dopamina varía en cada proyección axonal del ATV y la sustancia negra; [6] Por ejemplo, la proyección VTA- capa del núcleo accumbens asigna prominencia de incentivo ("deseo") a estímulos gratificantes y sus señales asociadas , la proyección VTA - corteza prefrontal actualiza el valor de diferentes objetivos de acuerdo con su prominencia de incentivo, las proyecciones VTA-amígdala y VTA-hipocampo median la consolidación de recuerdos relacionados con la recompensa, y tanto las vías VTA- núcleo accumbens como sustancia negra-estriado dorsal están involucradas en el aprendizaje de respuestas motoras que facilitan la adquisición de estímulos gratificantes. [6] [64] Alguna actividad dentro de las proyecciones dopaminérgicas VTA parece estar asociada también con la predicción de recompensas. [6] [64]
Si bien la dopamina tiene un papel central en causar "querer", asociado con las respuestas conductuales apetitivas o de aproximación a estímulos gratificantes, estudios detallados han demostrado que la dopamina no puede simplemente equipararse con el "gusto" o placer hedónico, como se refleja en la respuesta conductual consumatoria. [58] La neurotransmisión de dopamina está involucrada en algunos, pero no en todos los aspectos de la cognición relacionada con el placer, ya que se han identificado centros de placer tanto dentro del sistema de dopamina (es decir, la cubierta del núcleo accumbens) como fuera del sistema de dopamina (es decir, el pálido ventral y el núcleo parabranquial ). [58] [60] [65] Por ejemplo, la estimulación eléctrica directa de las vías de dopamina, utilizando electrodos implantados en el cerebro, se experimenta como placentera, y muchos tipos de animales están dispuestos a trabajar para obtenerla. [66] Los fármacos antipsicóticos reducen los niveles de dopamina y tienden a causar anhedonia , una capacidad disminuida para experimentar placer. [67] Muchos tipos de experiencias placenteras, como las relaciones sexuales, comer y jugar videojuegos, aumentan la liberación de dopamina. [68] Todas las drogas adictivas afectan directa o indirectamente la neurotransmisión de dopamina en el núcleo accumbens; [6] [66] estas drogas aumentan el "deseo" de la droga, lo que lleva al uso compulsivo de la droga, cuando se toman repetidamente en dosis altas, presumiblemente a través de la sensibilización de la saliencia de incentivo . [60] Las drogas que aumentan las concentraciones sinápticas de dopamina incluyen psicoestimulantes como la metanfetamina y la cocaína. Estos producen aumentos en las conductas de "deseo", pero no alteran en gran medida las expresiones de placer ni cambian los niveles de saciedad. [60] [66] Sin embargo, las drogas opiáceas como la heroína y la morfina producen aumentos en las expresiones de conductas de "gusto" y "deseo". [60] Además, los animales en los que el sistema dopaminérgico tegmental ventral se ha vuelto inactivo no buscan comida y morirán de hambre si se los deja solos, pero si se les coloca comida en la boca la consumirán y mostrarán expresiones indicativas de placer. [69]
Un estudio clínico de enero de 2019 que evaluó el efecto de un precursor de la dopamina ( levodopa ), un antagonista de la dopamina ( risperidona ) y un placebo en las respuestas de recompensa a la música, incluido el grado de placer experimentado durante los escalofríos musicales , medido por los cambios en la actividad electrodérmica , así como las calificaciones subjetivas, encontró que la manipulación de la neurotransmisión de dopamina regula bidireccionalmente la cognición del placer (específicamente, el impacto hedónico de la música ) en sujetos humanos. [70] [71] Esta investigación demostró que el aumento de la neurotransmisión de dopamina actúa como una condición sine qua non para las reacciones hedónicas placenteras a la música en humanos. [70] [71]
Un estudio publicado en Nature en 1998 encontró evidencia de que jugar videojuegos libera dopamina en el cuerpo estriado humano. Esta dopamina está asociada con el aprendizaje, el refuerzo del comportamiento, la atención y la integración sensoriomotora . [72] Los investigadores utilizaron tomografías por emisión de positrones y racloprida marcada con 11 C para rastrear los niveles de dopamina en el cerebro durante tareas motoras dirigidas a un objetivo y descubrieron que la liberación de dopamina se correlacionaba positivamente con el desempeño de la tarea y era mayor en el cuerpo estriado ventral . Este fue el primer estudio en demostrar las condiciones conductuales bajo las cuales se libera dopamina en humanos. Destaca la capacidad de la tomografía por emisión de positrones para detectar flujos de neurotransmisores durante cambios en el comportamiento. Según la investigación, el uso potencialmente problemático de videojuegos está relacionado con rasgos de personalidad como baja autoestima y baja autoeficacia, ansiedad, agresión y síntomas clínicos de depresión y trastornos de ansiedad. [73] Además, las razones por las que las personas juegan videojuegos varían y pueden incluir afrontamiento , socialización y satisfacción personal. El DSM-5 define el trastorno por juego en Internet como un trastorno mental estrechamente relacionado con el trastorno por juego. Esta afirmación ha sido apoyada por algunos investigadores, pero también ha suscitado controversia.
La dopamina no cruza la barrera hematoencefálica, por lo que su síntesis y funciones en áreas periféricas son en gran medida independientes de su síntesis y funciones en el cerebro. [26] Una cantidad sustancial de dopamina circula en el torrente sanguíneo, pero sus funciones allí no están completamente claras. [27] La dopamina se encuentra en el plasma sanguíneo en niveles comparables a los de la epinefrina, pero en los humanos, más del 95% de la dopamina en el plasma está en forma de sulfato de dopamina , un conjugado producido por la enzima sulfotransferasa 1A3/1A4 que actúa sobre la dopamina libre. [27] La mayor parte de este sulfato de dopamina se produce en los órganos mesentéricos. [27] Se cree que la producción de sulfato de dopamina es un mecanismo para desintoxicar la dopamina que se ingiere como alimento o se produce por el proceso digestivo; los niveles en el plasma generalmente aumentan más de cincuenta veces después de una comida. [27] El sulfato de dopamina no tiene funciones biológicas conocidas y se excreta en la orina. [27]
La cantidad relativamente pequeña de dopamina no conjugada en el torrente sanguíneo puede ser producida por el sistema nervioso simpático , el sistema digestivo o posiblemente otros órganos. [27] Puede actuar sobre los receptores de dopamina en los tejidos periféricos, o ser metabolizada, o ser convertida en noradrenalina por la enzima dopamina beta hidroxilasa , que es liberada en el torrente sanguíneo por la médula suprarrenal. [27] Algunos receptores de dopamina se encuentran en las paredes de las arterias, donde actúan como vasodilatadores e inhibidores de la liberación de noradrenalina de las terminales nerviosas simpáticas posganglionares (la dopamina puede inhibir la liberación de noradrenalina actuando sobre los receptores de dopamina presinápticos, y también sobre los receptores α-1 presinápticos, como la propia noradrenalina). [74] Estas respuestas pueden ser activadas por la dopamina liberada del cuerpo carotídeo en condiciones de bajo oxígeno, pero no se sabe si los receptores de dopamina arteriales realizan otras funciones biológicamente útiles. [74]
Más allá de su papel en la modulación del flujo sanguíneo, existen varios sistemas periféricos en los que la dopamina circula dentro de un área limitada y realiza una función exocrina o paracrina . [27] Los sistemas periféricos en los que la dopamina juega un papel importante incluyen el sistema inmunológico , los riñones y el páncreas .
En el sistema inmunológico, la dopamina actúa sobre los receptores presentes en las células inmunes, especialmente los linfocitos . [75] La dopamina también puede afectar a las células inmunes en el bazo , la médula ósea y el sistema circulatorio . [76] Además, la dopamina puede ser sintetizada y liberada por las propias células inmunes. [75] El principal efecto de la dopamina sobre los linfocitos es reducir su nivel de activación. La importancia funcional de este sistema no está clara, pero ofrece una posible ruta para las interacciones entre el sistema nervioso y el sistema inmunológico, y puede ser relevante para algunos trastornos autoinmunes. [76]
El sistema dopaminérgico renal está ubicado en las células de la nefrona en el riñón, donde están presentes todos los subtipos de receptores de dopamina. [77] La dopamina también se sintetiza allí, por las células tubulares , y se descarga en el líquido tubular . Sus acciones incluyen aumentar el suministro de sangre a los riñones, aumentar la tasa de filtración glomerular y aumentar la excreción de sodio en la orina. Por lo tanto, los defectos en la función de la dopamina renal pueden conducir a una excreción reducida de sodio y, en consecuencia, dar lugar al desarrollo de hipertensión arterial . Existe una fuerte evidencia de que las fallas en la producción de dopamina o en los receptores pueden dar lugar a una serie de patologías, incluido el estrés oxidativo , el edema y la hipertensión genética o esencial. El estrés oxidativo puede causar hipertensión en sí mismo. [78] Los defectos en el sistema también pueden ser causados por factores genéticos o presión arterial alta. [79]
En el páncreas, el papel de la dopamina es algo complejo. El páncreas consta de dos partes, un componente exocrino y otro endocrino . La parte exocrina sintetiza y secreta enzimas digestivas y otras sustancias, incluida la dopamina, en el intestino delgado. [80] La función de esta dopamina secretada después de que ingresa al intestino delgado no está claramente establecida; las posibilidades incluyen proteger la mucosa intestinal de daños y reducir la motilidad gastrointestinal (la velocidad a la que el contenido se mueve a través del sistema digestivo). [80]
Los islotes pancreáticos forman la parte endocrina del páncreas y sintetizan y secretan hormonas, incluida la insulina , en el torrente sanguíneo. [80] Hay evidencia de que las células beta en los islotes que sintetizan insulina contienen receptores de dopamina y que la dopamina actúa para reducir la cantidad de insulina que liberan. [80] La fuente de su entrada de dopamina no está claramente establecida: puede provenir de la dopamina que circula en el torrente sanguíneo y deriva del sistema nervioso simpático, o puede ser sintetizada localmente por otros tipos de células pancreáticas. [80]

La dopamina como medicamento manufacturado se vende bajo los nombres comerciales Intropin, Dopastat y Revimine, entre otros. Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [81] Se utiliza más comúnmente como fármaco estimulante en el tratamiento de la presión arterial baja grave , la frecuencia cardíaca lenta y el paro cardíaco . Es especialmente importante en el tratamiento de estos trastornos en los recién nacidos . [82] [13] Se administra por vía intravenosa. Dado que la vida media de la dopamina en el plasma es muy corta (aproximadamente un minuto en adultos, dos minutos en recién nacidos y hasta cinco minutos en prematuros), generalmente se administra en un goteo intravenoso continuo en lugar de una sola inyección. [83]
Sus efectos, dependiendo de la dosis, incluyen un aumento en la excreción de sodio por los riñones, un aumento en la producción de orina, un aumento en la frecuencia cardíaca y un aumento en la presión arterial . [83] En dosis bajas actúa a través del sistema nervioso simpático para aumentar la fuerza de contracción del músculo cardíaco y la frecuencia cardíaca, aumentando así el gasto cardíaco y la presión arterial. [84] Las dosis más altas también causan vasoconstricción que aumenta aún más la presión arterial. [84] [85] La literatura más antigua también describe dosis muy bajas que se cree que mejoran la función renal sin otras consecuencias, pero revisiones recientes han concluido que las dosis a niveles tan bajos no son efectivas y, a veces, pueden ser dañinas. [86] Si bien algunos efectos resultan de la estimulación de los receptores de dopamina, los efectos cardiovasculares prominentes resultan de la acción de la dopamina en los receptores adrenérgicos α 1 , β 1 y β 2 . [87] [88]
Los efectos secundarios de la dopamina incluyen efectos negativos en la función renal y latidos cardíacos irregulares . [84] Se ha descubierto que la LD 50 , o dosis letal que se espera que resulte fatal en el 50% de la población, es: 59 mg/kg (ratón; administrada por vía intravenosa ); 95 mg/kg (ratón; administrado por vía intraperitoneal ); 163 mg/kg (rata; administrada por vía intraperitoneal); 79 mg/kg (perro; administrado por vía intravenosa). [89]
El sistema de la dopamina desempeña un papel central en varias enfermedades importantes, como la enfermedad de Parkinson , el trastorno por déficit de atención con hiperactividad , el síndrome de Tourette , la esquizofrenia , el trastorno bipolar y la adicción . Además de la dopamina en sí, hay muchos otros fármacos importantes que actúan sobre los sistemas de dopamina en varias partes del cerebro o el cuerpo. Algunos se utilizan con fines médicos o recreativos, pero los neuroquímicos también han desarrollado una variedad de fármacos de investigación, algunos de los cuales se unen con alta afinidad a tipos específicos de receptores de dopamina y agonizan o antagonizan sus efectos, y muchos que afectan a otros aspectos de la fisiología de la dopamina, [90] incluidos los inhibidores del transportador de dopamina , los inhibidores de VMAT y los inhibidores de enzimas .
Varios estudios han informado de una disminución relacionada con la edad en la síntesis de dopamina y la densidad del receptor de dopamina (es decir, la cantidad de receptores) en el cerebro. [91] Se ha demostrado que esta disminución ocurre en el cuerpo estriado y en las regiones extraestriatales . [92] Las disminuciones en los receptores D 1 , D 2 y D 3 están bien documentadas. [93] [94] [95] Se cree que la reducción de la dopamina con el envejecimiento es responsable de muchos síntomas neurológicos que aumentan en frecuencia con la edad, como la disminución del balanceo de los brazos y el aumento de la rigidez . [96] Los cambios en los niveles de dopamina también pueden causar cambios relacionados con la edad en la flexibilidad cognitiva. [96]
Los estudios informaron que el desequilibrio de la dopamina influye en la fatiga en la esclerosis múltiple . [97] En pacientes con esclerosis múltiple, la dopamina inhibe la producción de IL-17 e IFN-γ por las células mononucleares de la sangre periférica. [98]
La enfermedad de Parkinson es un trastorno relacionado con la edad que se caracteriza por trastornos del movimiento como rigidez del cuerpo, lentitud del movimiento y temblor de las extremidades cuando no están en uso. [55] En etapas avanzadas progresa a demencia y finalmente a la muerte. [55] Los síntomas principales son causados por la pérdida de células secretoras de dopamina en la sustancia negra. [99] Estas células de dopamina son especialmente vulnerables al daño, y una variedad de agresiones, incluyendo encefalitis (como se muestra en el libro y la película Awakenings ), conmociones cerebrales repetidas relacionadas con los deportes y algunas formas de intoxicación química como MPTP , pueden conducir a una pérdida celular sustancial, produciendo un síndrome parkinsoniano que es similar en sus características principales a la enfermedad de Parkinson. [100] Sin embargo, la mayoría de los casos de enfermedad de Parkinson son idiopáticos , lo que significa que no se puede identificar la causa de la muerte celular. [100]
El tratamiento más utilizado para el parkinsonismo es la administración de L-DOPA, el precursor metabólico de la dopamina. [26] La L-DOPA se convierte en dopamina en el cerebro y en varias partes del cuerpo por la enzima DOPA descarboxilasa. [25] Se utiliza L-DOPA en lugar de la dopamina en sí porque, a diferencia de la dopamina, es capaz de atravesar la barrera hematoencefálica . [26] A menudo se coadministra con un inhibidor enzimático de la descarboxilación periférica, como carbidopa o benserazida , para reducir la cantidad convertida en dopamina en la periferia y, por lo tanto, aumentar la cantidad de L-DOPA que ingresa al cerebro. [26] Cuando se administra L-DOPA regularmente durante un período de tiempo prolongado, a menudo comienzan a aparecer una variedad de efectos secundarios desagradables, como la discinesia ; aun así, se considera la mejor opción de tratamiento a largo plazo disponible para la mayoría de los casos de enfermedad de Parkinson. [26]
El tratamiento con L-DOPA no puede restaurar las células dopaminérgicas que se han perdido, pero hace que las células restantes produzcan más dopamina, compensando así la pérdida al menos en algún grado. [26] En etapas avanzadas, el tratamiento comienza a fallar porque la pérdida de células es tan grave que las restantes no pueden producir suficiente dopamina independientemente de los niveles de L-DOPA. [26] Otros medicamentos que mejoran la función de la dopamina, como la bromocriptina y la pergolida , también se utilizan a veces para tratar el parkinsonismo, pero en la mayoría de los casos la L-DOPA parece ofrecer la mejor relación entre efectos positivos y efectos secundarios negativos. [26]
Los medicamentos dopaminérgicos que se utilizan para tratar la enfermedad de Parkinson a veces se asocian con el desarrollo de un síndrome de desregulación de la dopamina , que implica el uso excesivo de medicamentos dopaminérgicos y la participación compulsiva inducida por medicamentos en recompensas naturales como el juego y la actividad sexual. [101] [102] Estos últimos comportamientos son similares a los observados en personas con una adicción conductual . [101]

La cocaína , las anfetaminas sustituidas (incluida la metanfetamina ), el Adderall , el metilfenidato (comercializado como Ritalin o Concerta ) y otros psicoestimulantes ejercen sus efectos principalmente o en parte al aumentar los niveles de dopamina en el cerebro mediante una variedad de mecanismos. [103] La cocaína y el metilfenidato son bloqueadores del transportador de dopamina o inhibidores de la recaptación ; [104] inhiben de forma no competitiva la recaptación de dopamina, lo que resulta en un aumento de las concentraciones de dopamina en la hendidura sináptica. [105] [106] : 54–58 Al igual que la cocaína, las anfetaminas sustituidas y la anfetamina también aumentan la concentración de dopamina en la hendidura sináptica , pero mediante mecanismos diferentes. [36] [106] : 147–150
Los efectos de los psicoestimulantes incluyen aumentos en la frecuencia cardíaca, la temperatura corporal y la sudoración; mejoras en el estado de alerta, la atención y la resistencia; aumentos en el placer producido por eventos gratificantes; pero en dosis más altas agitación, ansiedad o incluso pérdida de contacto con la realidad . [103] Las drogas de este grupo pueden tener un alto potencial de adicción, debido a sus efectos activadores en el sistema de recompensa mediado por la dopamina en el cerebro. [103] Sin embargo, algunas también pueden ser útiles, en dosis más bajas, para tratar el trastorno por déficit de atención con hiperactividad (TDAH) y la narcolepsia . [107] [108] Un factor diferenciador importante es el inicio y la duración de la acción. [103] La cocaína puede hacer efecto en segundos si se inyecta o inhala en forma de base libre; los efectos duran de 5 a 90 minutos. [109] Esta acción rápida y breve hace que sus efectos se perciban fácilmente y, en consecuencia, le da un alto potencial de adicción. [103] Por el contrario, el metilfenidato tomado en forma de píldora puede tardar dos horas en alcanzar niveles máximos en el torrente sanguíneo, [107] y, dependiendo de la formulación, los efectos pueden durar hasta 12 horas. [110] Estas formulaciones de acción más prolongada tienen el beneficio de reducir el potencial de abuso y mejorar la adherencia al tratamiento mediante el uso de regímenes de dosificación más convenientes. [111]

Una variedad de drogas adictivas producen un aumento en la actividad de la dopamina relacionada con la recompensa. [103] Los estimulantes como la nicotina , la cocaína y la metanfetamina promueven mayores niveles de dopamina que parecen ser el factor principal en causar adicción. Para otras drogas adictivas como el opioide heroína, los mayores niveles de dopamina en el sistema de recompensa pueden jugar solo un papel menor en la adicción. [112] Cuando las personas adictas a los estimulantes pasan por la abstinencia, no experimentan el sufrimiento físico asociado con la abstinencia de alcohol o abstinencia de opiáceos; en cambio, experimentan ansia, un deseo intenso por la droga caracterizado por irritabilidad, inquietud y otros síntomas de excitación, [113] provocados por la dependencia psicológica .
El sistema de la dopamina desempeña un papel crucial en varios aspectos de la adicción. En la etapa más temprana, las diferencias genéticas que alteran la expresión de los receptores de dopamina en el cerebro pueden predecir si una persona encontrará atractivos o aversivos los estimulantes. [114] El consumo de estimulantes produce aumentos en los niveles de dopamina en el cerebro que duran de minutos a horas. [103] Finalmente, la elevación crónica de dopamina que viene con el consumo repetitivo de estimulantes en dosis altas desencadena un amplio conjunto de cambios estructurales en el cerebro que son responsables de las anomalías conductuales que caracterizan una adicción. [115] El tratamiento de la adicción a los estimulantes es muy difícil, porque incluso si el consumo cesa, el ansia que viene con la abstinencia psicológica no lo hace. [113] Incluso cuando el ansia parece haberse extinguido, puede resurgir cuando se enfrenta a estímulos que están asociados con la droga, como amigos, lugares y situaciones. [113] Las redes de asociación en el cerebro están muy interconectadas. [116]
Los psiquiatras a principios de la década de 1950 descubrieron que una clase de fármacos conocidos como antipsicóticos típicos (también conocidos como tranquilizantes mayores ), a menudo eran eficaces para reducir los síntomas psicóticos de la esquizofrenia. [117] La introducción del primer antipsicótico ampliamente utilizado, la clorpromazina (Thorazine), en la década de 1950, condujo a la liberación de muchos pacientes con esquizofrenia de las instituciones en los años siguientes. [117] En la década de 1970, los investigadores comprendieron que estos antipsicóticos típicos funcionaban como antagonistas de los receptores D 2. [117] [118] Esta constatación condujo a la llamada hipótesis de la dopamina de la esquizofrenia , que postula que la esquizofrenia es causada en gran medida por la hiperactividad de los sistemas de dopamina del cerebro. [119] La hipótesis de la dopamina recibió apoyo adicional de la observación de que los síntomas psicóticos a menudo se intensificaban con estimulantes que potenciaban la dopamina, como la metanfetamina, y que estos fármacos también podían producir psicosis en personas sanas si se tomaban en dosis suficientemente grandes. [119] En las décadas siguientes se desarrollaron otros antipsicóticos atípicos que tenían menos efectos secundarios graves. [117] Muchos de estos fármacos más nuevos no actúan directamente sobre los receptores de dopamina, sino que producen alteraciones en la actividad de la dopamina de forma indirecta. [120] Estos fármacos también se utilizaron para tratar otras psicosis. [117] Los fármacos antipsicóticos tienen un efecto ampliamente supresor sobre la mayoría de los tipos de comportamiento activo y, en particular, reducen el comportamiento delirante y agitado característico de la psicosis manifiesta. [118]
Sin embargo, observaciones posteriores han hecho que la hipótesis de la dopamina pierda popularidad, al menos en su forma original y simple. [119] Por un lado, los pacientes con esquizofrenia no suelen mostrar niveles mensurablemente mayores de actividad de la dopamina en el cerebro. [119] Aun así, muchos psiquiatras y neurocientíficos siguen creyendo que la esquizofrenia implica algún tipo de disfunción del sistema de la dopamina. [117] Sin embargo, a medida que la "hipótesis de la dopamina" ha evolucionado con el tiempo, los tipos de disfunciones que postula han tendido a volverse cada vez más sutiles y complejos. [117]
El psicofarmacólogo Stephen M. Stahl sugirió en una revisión de 2018 que en muchos casos de psicosis, incluida la esquizofrenia, tres redes interconectadas basadas en dopamina, serotonina y glutamato, cada una por sí sola o en varias combinaciones, contribuían a una sobreexcitación de los receptores de dopamina D 2 en el estriado ventral . [121]
La neurotransmisión alterada de dopamina está implicada en el trastorno por déficit de atención con hiperactividad (TDAH), una afección asociada con un control cognitivo deteriorado , que a su vez conduce a problemas con la regulación de la atención ( control atencional ), inhibición de conductas ( control inhibitorio ) y olvido de cosas o pérdida de detalles ( memoria de trabajo ), entre otros problemas. [122] Existen vínculos genéticos entre los receptores de dopamina, el transportador de dopamina y el TDAH, además de vínculos con otros receptores y transportadores de neurotransmisores. [123] La relación más importante entre la dopamina y el TDAH involucra los medicamentos que se usan para tratar el TDAH. [124] Algunos de los agentes terapéuticos más efectivos para el TDAH son psicoestimulantes como el metilfenidato (Ritalin, Concerta) y la anfetamina (Evekeo, Adderall, Dexedrine), medicamentos que aumentan los niveles de dopamina y noradrenalina en el cerebro. [124] Los efectos clínicos de estos psicoestimulantes en el tratamiento del TDAH están mediados por la activación indirecta de los receptores de dopamina y noradrenalina, específicamente el receptor de dopamina D 1 y el adrenoceptor α 2 , en la corteza prefrontal. [122] [125] [126]
La dopamina desempeña un papel en el procesamiento del dolor en múltiples niveles del sistema nervioso central, incluida la médula espinal, la sustancia gris periacueductal , el tálamo , los ganglios basales y la corteza cingulada . [127] Los niveles reducidos de dopamina se han asociado con síntomas dolorosos que ocurren con frecuencia en la enfermedad de Parkinson. [127] Las anomalías en la neurotransmisión dopaminérgica también ocurren en varias condiciones clínicas dolorosas, incluido el síndrome de boca ardiente , la fibromialgia y el síndrome de piernas inquietas. [127]
Las náuseas y los vómitos están determinados en gran medida por la actividad en el área postrema en el bulbo raquídeo del tronco encefálico , en una región conocida como zona gatillo de los quimiorreceptores . [128] Esta área contiene una gran población de receptores de dopamina tipo D 2. [128] En consecuencia, los fármacos que activan los receptores D 2 tienen un alto potencial para causar náuseas. [128] Este grupo incluye algunos medicamentos que se administran para la enfermedad de Parkinson, así como otros agonistas de la dopamina como la apomorfina . [129] En algunos casos, los antagonistas del receptor D 2 como la metoclopramida son útiles como fármacos contra las náuseas . [128]
Miedo y ansiedad
La tomografía por emisión de positrones (PET) y la resonancia magnética funcional (fMRI) simultáneas han demostrado que la cantidad de liberación de dopamina depende de la fuerza de la respuesta de miedo condicionado y está acoplada linealmente a la actividad inducida por el aprendizaje en la amígdala [130] . La dopamina está generalmente vinculada al aprendizaje de recompensa, pero también juega un papel clave en el aprendizaje y la extinción del miedo al ayudar a formar, almacenar y actualizar los recuerdos del miedo a través de su interacción con otras regiones del cerebro como la amígdala, la corteza prefrontal ventromedial y el cuerpo estriado. [131]
No hay informes de dopamina en arqueas , pero se ha detectado en algunos tipos de bacterias y en el protozoo llamado Tetrahymena . [132] Quizás más importante aún, hay tipos de bacterias que contienen homólogos de todas las enzimas que los animales usan para sintetizar dopamina. [133] Se ha propuesto que los animales derivaron su maquinaria de síntesis de dopamina de las bacterias, a través de la transferencia horizontal de genes que puede haber ocurrido relativamente tarde en el tiempo evolutivo, tal vez como resultado de la incorporación simbiótica de bacterias en células eucariotas que dieron origen a las mitocondrias . [133]
La dopamina se utiliza como neurotransmisor en la mayoría de los animales multicelulares. [134] En las esponjas solo hay un único informe de la presencia de dopamina, sin indicación de su función; [135] sin embargo, se ha informado de dopamina en los sistemas nerviosos de muchas otras especies radialmente simétricas , incluidas las medusas cnidarias , las hidras y algunos corales . [136] Esto data la aparición de la dopamina como neurotransmisor en la primera aparición del sistema nervioso, hace más de 500 millones de años en el Período Cámbrico . La dopamina funciona como neurotransmisor en vertebrados , equinodermos , artrópodos , moluscos y varios tipos de gusanos . [137] [138]
En todos los tipos de animales que se han examinado, se ha visto que la dopamina modifica la conducta motora. [134] En el organismo modelo , el nematodo Caenorhabditis elegans , reduce la locomoción y aumenta los movimientos de exploración de alimentos; en los platelmintos produce movimientos "en espiral"; en las sanguijuelas inhibe la natación y promueve el gateo. En una amplia gama de vertebrados, la dopamina tiene un efecto "activador" sobre el cambio de comportamiento y la selección de respuestas, comparable a su efecto en los mamíferos. [134] [139]
También se ha demostrado de forma consistente que la dopamina desempeña un papel en el aprendizaje de recompensas, en todos los grupos animales. [134] Como en todos los vertebrados, los invertebrados como los gusanos redondos , los platelmintos , los moluscos y las moscas de la fruta comunes pueden ser entrenados para repetir una acción si es seguida consistentemente por un aumento en los niveles de dopamina. [134] En las moscas de la fruta , los distintos elementos para el aprendizaje de recompensas sugieren una estructura modular para el sistema de procesamiento de recompensas de los insectos que es ampliamente paralela a la del mamífero. [140] Por ejemplo, la dopamina regula el aprendizaje a corto y largo plazo en los monos; [141] en las moscas de la fruta, diferentes grupos de neuronas de dopamina median las señales de recompensa para los recuerdos a corto y largo plazo. [142]
Durante mucho tiempo se creyó que los artrópodos eran una excepción a esta regla, ya que se consideraba que la dopamina tenía un efecto adverso. En cambio, se observó que la recompensa estaba mediada por la octopamina , un neurotransmisor estrechamente relacionado con la noradrenalina. [143] Sin embargo, estudios más recientes han demostrado que la dopamina sí desempeña un papel en el aprendizaje de la recompensa en las moscas de la fruta. También se ha descubierto que el efecto gratificante de la octopamina se debe a que activa un conjunto de neuronas dopaminérgicas a las que no se había accedido previamente en la investigación. [143]

Muchas plantas, incluidas varias plantas alimenticias, sintetizan dopamina en distintos grados. [144] Las concentraciones más altas se han observado en los plátanos: la pulpa de los plátanos rojos y amarillos contiene dopamina en niveles de 40 a 50 partes por millón en peso. [144] Las patatas, los aguacates, el brócoli y las coles de Bruselas también pueden contener dopamina en niveles de 1 parte por millón o más; las naranjas, los tomates, las espinacas, los frijoles y otras plantas contienen concentraciones mensurables de menos de 1 parte por millón. [144] La dopamina en las plantas se sintetiza a partir del aminoácido tirosina, mediante mecanismos bioquímicos similares a los que utilizan los animales. [144] Puede metabolizarse de diversas formas, produciendo melanina y una variedad de alcaloides como subproductos. [144] Las funciones de las catecolaminas vegetales no han sido claramente establecidas, pero hay evidencia de que desempeñan un papel en la respuesta a factores estresantes como infecciones bacterianas, actúan como factores promotores del crecimiento en algunas situaciones y modifican la forma en que se metabolizan los azúcares. Los receptores que median estas acciones aún no han sido identificados, ni tampoco los mecanismos intracelulares que activan. [144]
La dopamina consumida en los alimentos no puede actuar sobre el cerebro, porque no puede atravesar la barrera hematoencefálica. [26] Sin embargo, también hay una variedad de plantas que contienen L-DOPA, el precursor metabólico de la dopamina. [145] Las concentraciones más altas se encuentran en las hojas y las vainas de las plantas del género Mucuna , especialmente en Mucuna pruriens (frijoles aterciopelados), que se han utilizado como fuente de L-DOPA como fármaco. [146] Otra planta que contiene cantidades sustanciales de L-DOPA es Vicia faba , la planta que produce habas (también conocidas como "frijoles anchos"). Sin embargo, el nivel de L-DOPA en los frijoles es mucho menor que en las cáscaras de las vainas y otras partes de la planta. [147] Las semillas de los árboles Cassia y Bauhinia también contienen cantidades sustanciales de L-DOPA. [145]
En una especie de alga verde marina , Ulvaria obscura , un componente importante de algunas floraciones de algas , la dopamina está presente en concentraciones muy altas, estimadas en un 4,4% del peso seco. Hay evidencia de que esta dopamina funciona como una defensa antiherbívora , reduciendo el consumo por parte de caracoles e isópodos . [148]
Las melaninas son una familia de sustancias pigmentadas oscuras que se encuentran en una amplia gama de organismos. [149] Químicamente están estrechamente relacionadas con la dopamina, y hay un tipo de melanina, conocida como dopamina-melanina , que puede sintetizarse por oxidación de la dopamina a través de la enzima tirosinasa . [149] La melanina que oscurece la piel humana no es de este tipo: se sintetiza por una vía que utiliza L-DOPA como precursor pero no dopamina. [149] Sin embargo, hay evidencia sustancial de que la neuromelanina que da un color oscuro a la sustancia negra del cerebro es al menos en parte dopamina-melanina. [150]
La melanina derivada de la dopamina probablemente también aparece en al menos otros sistemas biológicos. Es probable que parte de la dopamina presente en las plantas se utilice como precursora de la dopamina-melanina. [151] También se cree que los patrones complejos que aparecen en las alas de las mariposas, así como las rayas blancas y negras en los cuerpos de las larvas de los insectos, son causados por acumulaciones de dopamina-melanina estructuradas espacialmente. [152]
La dopamina fue sintetizada por primera vez en 1910 por George Barger y James Ewens en los Laboratorios Wellcome en Londres, Inglaterra [153] y fue identificada por primera vez en el cerebro humano por Katharine Montagu en 1957. Se le denominó dopamina porque es una monoamina cuyo precursor en la síntesis de Barger-Ewens es la 3,4- dihidroxifenilalanina ( levodopa o L-DOPA). La función de la dopamina como neurotransmisor fue reconocida por primera vez en 1958 por Arvid Carlsson y Nils -Åke Hillarp en el Laboratorio de Farmacología Química del Instituto Nacional del Corazón de Suecia . [154] Carlsson recibió el Premio Nobel de Fisiología o Medicina en 2000 por demostrar que la dopamina no solo es un precursor de la noradrenalina y la epinefrina, sino que también es en sí misma un neurotransmisor. [155]
La investigación motivada por las proteínas polifenólicas adhesivas en los mejillones condujo al descubrimiento en 2007 de que una amplia variedad de materiales, si se colocan en una solución de dopamina a un pH ligeramente básico , se recubrirán con una capa de dopamina polimerizada, a menudo denominada polidopamina . [156] [157] Esta dopamina polimerizada se forma por una reacción de oxidación espontánea y es formalmente un tipo de melanina. [158] Además, la autopolimerización de la dopamina se puede utilizar para modular las propiedades mecánicas de los geles basados en péptidos. [159] La síntesis de polidopamina generalmente implica la reacción del clorhidrato de dopamina con Tris como base en agua. La estructura de la polidopamina es desconocida. [157]
Los recubrimientos de polidopamina se pueden formar en objetos que varían en tamaño desde nanopartículas hasta grandes superficies. [158] Las capas de polidopamina tienen propiedades químicas que tienen el potencial de ser extremadamente útiles, y numerosos estudios han examinado sus posibles aplicaciones. [158] En el nivel más simple, se pueden utilizar para la protección contra el daño causado por la luz, o para formar cápsulas para la administración de fármacos. [158] En un nivel más sofisticado, sus propiedades adhesivas pueden hacerlas útiles como sustratos para biosensores u otras macromoléculas biológicamente activas. [158]
Por lo tanto, los estímulos que evocan miedo son capaces de alterar de manera diferencial la transmisión fásica de dopamina en las subregiones del NAcc. Los autores proponen que la mejora observada en la dopamina de la capa del NAcc probablemente refleje una prominencia motivacional general, tal vez debido al alivio de un estado de miedo inducido por CS cuando no se administra el EI (descarga eléctrica en el pie). Este razonamiento está respaldado por un informe de Budygin y colegas
112
que muestra que, en ratas anestesiadas, la terminación del pellizco de la cola da como resultado una mayor liberación de dopamina en el caparazón.
Sustrato: L-fenilalanina + tetrahidrobiopterina + O2
Producto: L-tirosina + 3-hidroxifenilalanina [(aka m-tirosina)] + dihidropteridina + H2O
Organismo: Homo sapiens
Sustrato: m-tirosina
Producto: m-tiramina + CO2
Organismo: Homo sapiens
TAAR1 es un receptor de alta afinidad para METH/AMPH y DA.
Escuchar música placentera suele ir acompañado de reacciones corporales mensurables, como piel de gallina o escalofríos en la columna vertebral, comúnmente llamados "escalofríos" o "frissons". ... En general, nuestros resultados revelaron de manera directa que las intervenciones farmacológicas modulaban de manera bidireccional las respuestas de recompensa provocadas por la música. En particular, descubrimos que la risperidona perjudicaba la capacidad de los participantes para experimentar placer musical, mientras que la levodopa la mejoraba. ... Aquí, en cambio, al estudiar las respuestas a recompensas abstractas en sujetos humanos, demostramos que la manipulación de la transmisión dopaminérgica afecta tanto al placer (es decir, la cantidad de tiempo que se informa sobre escalofríos y excitación emocional medida por EDA) como a los componentes motivacionales de la recompensa musical (dinero dispuesto a gastar). Estos hallazgos sugieren que la señalización dopaminérgica es una condición sine qua non no solo para las respuestas motivacionales, como se ha demostrado con las recompensas primarias y secundarias, sino también para las reacciones hedónicas a la música. Este resultado respalda hallazgos recientes que muestran que la dopamina también media la percepción de placer lograda por otros tipos de recompensas abstractas (37) y desafía hallazgos previos en modelos animales sobre recompensas primarias, como la comida (42, 43).
En un estudio farmacológico publicado en PNAS, Ferreri et al. (1) presentan evidencia de que mejorar o inhibir la señalización de la dopamina usando levodopa o risperidona modula el placer experimentado al escuchar música. ... En una salva final para establecer no sólo la implicación correlacional sino también causal de la dopamina en el placer musical, los autores han recurrido a la manipulación directa de la señalización dopaminérgica en el cuerpo estriado, primero aplicando estimulación magnética transcraneal excitatoria e inhibitoria sobre la corteza prefrontal dorsolateral izquierda de sus participantes, una región conocida por modular la función estriatal (5), y finalmente, en el estudio actual, administrando agentes farmacéuticos capaces de alterar la disponibilidad sináptica de la dopamina (1), ambos influyeron en el placer percibido, las medidas fisiológicas de excitación y el valor monetario asignado a la música en la dirección prevista. ... Si bien la cuestión de la expresión musical de la emoción tiene una larga historia de investigación, incluso en PNAS (6), y la línea de investigación psicofisiológica de la década de 1990 ya había establecido que el placer musical podía activar el sistema nervioso autónomo (7), la demostración de los autores de la implicación del sistema de recompensa en las emociones musicales se tomó como prueba inaugural de que se trataba de emociones verídicas cuyo estudio tiene plena legitimidad para informar la neurobiología de nuestras funciones cognitivas, sociales y afectivas cotidianas (8). Por cierto, esta línea de trabajo, que culminó en el artículo de Ferreri et al. (1), ha hecho plausiblemente más para atraer fondos de investigación para el campo de las ciencias de la música que cualquier otra en esta comunidad.
La evidencia de Ferreri et al. (1) proporciona el respaldo más reciente a un modelo neurobiológico convincente en el que el placer musical surge de la interacción de antiguos sistemas de recompensa/valoración (estriatal-límbico-paralímbico) con sistemas de percepción/predicciones filogenéticamente más avanzados (temporofrontal).
La dopamina se une a los receptores beta-1, beta-2, alfa-1 y dopaminérgicos.