
Un fertilizante ( inglés americano ) o fertilizante ( inglés británico ) es cualquier material de origen natural o sintético que se aplica al suelo o a los tejidos vegetales para suministrar nutrientes a las plantas . Los fertilizantes pueden ser distintos de los materiales de encalado u otras enmiendas del suelo que no son nutrientes . Existen muchas fuentes de fertilizantes, tanto naturales como producidos industrialmente. [1] Para la mayoría de las prácticas agrícolas modernas, la fertilización se centra en tres macronutrientes principales: nitrógeno (N), fósforo (P) y potasio (K), con la adición ocasional de suplementos como harina de roca para micronutrientes. Los agricultores aplican estos fertilizantes de diversas formas: mediante procesos de aplicación secos, granulados o líquidos, utilizando grandes equipos agrícolas o métodos con herramientas manuales.
Históricamente, la fertilización procedía de fuentes naturales u orgánicas: abono , estiércol animal , estiércol humano , minerales recolectados, rotaciones de cultivos y subproductos de industrias de naturaleza humana (es decir, desechos del procesamiento de pescado o harina de sangre procedente del sacrificio de animales ). Sin embargo, a partir del siglo XIX, después de las innovaciones en la nutrición de las plantas , se desarrolló una industria agrícola en torno a los fertilizantes creados sintéticamente. Esta transición fue importante para transformar el sistema alimentario mundial , permitiendo una agricultura industrial a mayor escala con grandes rendimientos agrícolas.
Los procesos químicos de fijación de nitrógeno , como el proceso de Haber , inventado a principios del siglo XX y amplificado por la capacidad de producción creada durante la Segunda Guerra Mundial, provocaron un auge en el uso de fertilizantes nitrogenados. [2] En la segunda mitad del siglo XX, el mayor uso de fertilizantes nitrogenados (aumento del 800% entre 1961 y 2019) ha sido un componente crucial del aumento de la productividad de los sistemas alimentarios convencionales (más del 30% per cápita) como parte de la llamada " Revolución Verde ". [3]
El uso de fertilizantes artificiales y de aplicación industrial ha provocado consecuencias ambientales como la contaminación del agua y la eutrofización por escorrentía nutricional; emisiones de carbono y otras emisiones procedentes de la producción de fertilizantes y la minería; y la contaminación y polución del suelo . Se pueden implementar varias prácticas de agricultura sostenible para reducir los efectos ambientales adversos del uso de fertilizantes y pesticidas , así como otros daños ambientales causados por la agricultura industrial .




La gestión de la fertilidad del suelo ha preocupado a los agricultores durante miles de años. Se registra que egipcios, romanos, babilonios y los primeros alemanes utilizaban minerales o estiércol para mejorar la productividad de sus granjas. [1] La ciencia de la nutrición vegetal comenzó mucho antes del trabajo del químico alemán Justus von Liebig , aunque su nombre es el más mencionado. Nicolas Théodore de Saussure y sus colegas científicos de la época se apresuraron a refutar las simplificaciones de von Liebig. Existía una comprensión científica compleja de la nutrición vegetal, en la que el papel del humus y las interacciones órgano-minerales era central, y que estaba en consonancia con descubrimientos más recientes a partir de 1990. [ cita necesaria ] Los científicos destacados en quienes von Liebig se basó fueron Carl Ludwig Sprenger y Hermann Hellriegel . En este campo se produjo una "erosión del conocimiento" [6] , impulsada en parte por una mezcla de economía e investigación. [7] John Bennet Lawes , un empresario inglés , comenzó a experimentar sobre los efectos de varios abonos en plantas que crecían en macetas en 1837, y uno o dos años más tarde los experimentos se extendieron a cultivos en el campo. Una consecuencia inmediata fue que en 1842 patentó un estiércol formado tratando fosfatos con ácido sulfúrico y, por tanto, fue el primero en crear la industria del estiércol artificial. Al año siguiente contrató los servicios de Joseph Henry Gilbert ; juntos realizaron experimentos de cultivos en el Instituto de Investigación de Cultivos Arables . [8]
El proceso Birkeland-Eyde fue uno de los procesos industriales competidores al comienzo de la producción de fertilizantes a base de nitrógeno. [9] Este proceso se utilizó para fijar el nitrógeno atmosférico (N 2 ) en ácido nítrico (HNO 3 ), uno de varios procesos químicos generalmente denominados fijación de nitrógeno . El ácido nítrico resultante se utilizó luego como fuente de nitrato (NO 3 − ). Se construyó una fábrica basada en este proceso en Rjukan y Notodden en Noruega, junto con la construcción de grandes instalaciones de energía hidroeléctrica . [10]
Las décadas de 1910 y 1920 fueron testigos del surgimiento del proceso Haber y del proceso Ostwald . El proceso Haber produce amoníaco (NH 3 ) a partir de gas metano (CH 4 ) ( gas natural ) y nitrógeno molecular (N 2 ) del aire. A continuación, el amoniaco procedente del proceso Haber se convierte parcialmente en ácido nítrico (HNO3 ) en el proceso Ostwald . [11] Después de la Segunda Guerra Mundial, las plantas de producción de nitrógeno que se habían intensificado para la fabricación de bombas en tiempos de guerra se orientaron hacia usos agrícolas. [12] El uso de fertilizantes nitrogenados sintéticos ha aumentado constantemente durante los últimos 50 años, casi 20 veces hasta la tasa actual de 100 millones de toneladas de nitrógeno por año. [13]
El desarrollo de fertilizantes nitrogenados sintéticos ha apoyado significativamente el crecimiento de la población mundial. Se ha estimado que casi la mitad de la población mundial se alimenta actualmente gracias al uso de fertilizantes nitrogenados sintéticos. [14] El uso de fertilizantes fosfatados también ha aumentado de 9 millones de toneladas por año en 1960 a 40 millones de toneladas por año en 2000.
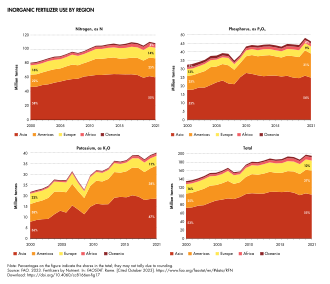
El uso agrícola de fertilizantes inorgánicos en 2021 fue de 195 millones de toneladas de nutrientes, de los cuales el 56% fue nitrógeno. [15] Asia representó el 53% del uso agrícola total mundial de fertilizantes inorgánicos en 2021, seguida de América (29%), Europa (12%), África (4%) y Oceanía (2%). Esta clasificación de las regiones es la misma para todos los nutrientes. Los principales usuarios de fertilizantes inorgánicos son, en orden descendente, China, India, Brasil y los Estados Unidos de América (ver Cuadro 15), siendo China el mayor usuario de cada nutriente. [15]
Un cultivo de maíz que produzca de 6 a 9 toneladas de grano por hectárea (2,5 acres) requiere la aplicación de 31 a 50 kilogramos (68 a 110 libras) de fertilizante fosfatado ; los cultivos de soja requieren alrededor de la mitad, entre 20 y 25 kg por hectárea. [16] Yara International es el mayor productor mundial de fertilizantes a base de nitrógeno. [17]
.jpg/440px-Reuse_of_urine_demonstration_-_fertilised_and_not_fertilised_tomato_plant_experiment_(3617543234).jpg)
Los fertilizantes mejoran el crecimiento de las plantas. Este objetivo se cumple de dos formas, la tradicional siendo los aditivos que aportan nutrientes. La segunda forma por la que actúan algunos fertilizantes es potenciar la eficacia del suelo modificando su retención de agua y aireación. Este artículo, como muchos sobre fertilizantes, enfatiza el aspecto nutricional. Los fertilizantes suelen proporcionar, en proporciones variables : [19]
Los nutrientes necesarios para una vida vegetal sana se clasifican según los elementos, pero los elementos no se utilizan como fertilizantes. En cambio, los compuestos que contienen estos elementos son la base de los fertilizantes. Los macronutrientes se consumen en mayores cantidades y están presentes en el tejido vegetal en cantidades del 0,15% al 6,0% sobre la base de materia seca (MS) (0% de humedad). Las plantas se componen de cuatro elementos principales: hidrógeno, oxígeno, carbono y nitrógeno. El carbono, el hidrógeno y el oxígeno están ampliamente disponibles, respectivamente, en el dióxido de carbono y en el agua. Aunque el nitrógeno constituye la mayor parte de la atmósfera , se encuentra en una forma que no está disponible para las plantas. El nitrógeno es el fertilizante más importante ya que está presente en las proteínas ( enlace amida entre aminoácidos ), el ADN ( bases púricas y pirimídicas ) y otros componentes (p. ej., hemo tetrapirrólico en la clorofila ). Para que sea nutritivo para las plantas, el nitrógeno debe estar disponible en forma "fija". Sólo algunas bacterias y sus plantas hospedantes (en particular las leguminosas ) pueden fijar el nitrógeno atmosférico ( N 2 ) convirtiéndolo en amoníaco ( NH 3 ). Fosfato ( PO3-4) es necesario para la producción de ADN ( código genético ) y ATP , principal portador de energía de las células , así como de determinados lípidos ( fosfolípidos , principales componentes de la doble capa lipídica de las membranas celulares ).
Dos conjuntos de reacciones enzimáticas son muy relevantes para la eficiencia de los fertilizantes a base de nitrógeno.
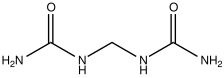
La primera es la hidrólisis (reacción con agua) de la urea ( CO(NH 2 ) 2 ). Muchas bacterias del suelo poseen la enzima ureasa , que cataliza la conversión de urea en ion amonio ( NH +4) y el ion bicarbonato ( HCO−3).
Las bacterias oxidantes de amoníaco (AOB), como las especies de Nitrosomonas , oxidan el amoníaco ( NH 3 ) a nitrito ( NO−2), un proceso denominado nitrificación . [20] Las bacterias oxidantes de nitrito , especialmente Nitrobacter , oxidan el nitrito ( NO−2) a nitrato ( NO−3), que es extremadamente soluble y móvil y es una de las principales causas de eutrofización y proliferación de algas .
Los fertilizantes se clasifican de varias formas. Se clasifican según aporten un único nutriente (p. ej., K, P o N), en cuyo caso se clasifican como "fertilizantes simples". Los "fertilizantes multinutrientes" (o "fertilizantes complejos") proporcionan dos o más nutrientes, por ejemplo N y P. Los fertilizantes a veces también se clasifican como inorgánicos (el tema de la mayor parte de este artículo) versus orgánicos. Los fertilizantes inorgánicos excluyen los materiales que contienen carbono, excepto las ureas . Los fertilizantes orgánicos suelen ser materia (reciclada) de origen vegetal o animal. Los inorgánicos a veces se denominan fertilizantes sintéticos ya que para su fabricación se requieren diversos tratamientos químicos. [21]
El principal fertilizante simple a base de nitrógeno es el amoníaco (NH 3 ) y el amonio (NH 4 + ) o sus soluciones, que incluyen:
Los principales fertilizantes fosfatados puros son los superfosfatos :
Una mezcla de superfosfato simple y superfosfato triple se llama superfosfato doble. Más del 90% de un fertilizante superfosfato típico es soluble en agua.
El principal fertilizante simple a base de potasio es el muriato de potasa (MOP, 95–99% KCl). Por lo general, está disponible como fertilizante 0-0-60 o 0-0-62.
Estos fertilizantes son comunes. Consisten en dos o más componentes nutritivos.
Los principales fertilizantes de dos componentes aportan nitrógeno y fósforo a las plantas. Se denominan fertilizantes NP. Los principales fertilizantes NP son el fosfato monoamónico (MAP) y el fosfato diamónico (DAP). El ingrediente activo del MAP es NH 4 H 2 PO 4 . El ingrediente activo de DAP es (NH 4 ) 2 HPO 4 . Aproximadamente el 85% de los fertilizantes MAP y DAP son solubles en agua.
Los fertilizantes NPK son fertilizantes de tres componentes que aportan nitrógeno, fósforo y potasio. Existen dos tipos de fertilizantes NPK: compuestos y mezclas. Los fertilizantes NPK compuestos contienen ingredientes unidos químicamente, mientras que los fertilizantes NPK mezclados son mezclas físicas de componentes de nutrientes únicos.
La clasificación NPK es un sistema de clasificación que describe la cantidad de nitrógeno, fósforo y potasio en un fertilizante. Las clasificaciones NPK constan de tres números separados por guiones (por ejemplo, 10-10-10 o 16-4-8) que describen el contenido químico de los fertilizantes. [23] [24] El primer número representa el porcentaje de nitrógeno en el producto; el segundo número, P 2 O 5 ; el tercero, K 2 O. Los fertilizantes en realidad no contienen P 2 O 5 o K 2 O, pero el sistema es una abreviatura convencional de la cantidad de fósforo (P) o potasio (K) en un fertilizante. Una bolsa de 50 libras (23 kg) de fertilizante con la etiqueta 16-4-8 contiene 8 libras (3,6 kg) de nitrógeno (16% de las 50 libras), una cantidad de fósforo equivalente a la de 2 libras de P 2 O 5 . (4% de 50 libras) y 4 libras de K 2 O (8% de 50 libras). La mayoría de los fertilizantes están etiquetados según esta convención NPK, aunque la convención australiana, siguiendo un sistema NPKS, agrega un cuarto número para el azufre y utiliza valores elementales para todos los valores, incluidos P y K. [25]
Los micronutrientes se consumen en cantidades más pequeñas y están presentes en el tejido vegetal en el orden de partes por millón (ppm), entre 0,15 y 400 ppm o menos del 0,04% de materia seca. [26] [27] Estos elementos a menudo son necesarios para las enzimas esenciales para el metabolismo de la planta. Debido a que estos elementos activan los catalizadores (enzimas), su impacto excede con creces su porcentaje en peso. Los micronutrientes típicos son el boro , el zinc , el molibdeno , el hierro y el manganeso . [19] Estos elementos se proporcionan como sales solubles en agua. El hierro presenta problemas especiales porque se convierte en compuestos insolubles (biono disponibles) a concentraciones moderadas de fosfato y pH del suelo. Por esta razón, el hierro se administra a menudo como un complejo quelato , por ejemplo, los derivados EDTA o EDDHA . Las necesidades de micronutrientes dependen de la planta y del medio ambiente. Por ejemplo, la remolacha azucarera parece requerir boro y las legumbres requieren cobalto , [1] mientras que las condiciones ambientales como el calor o la sequía hacen que el boro esté menos disponible para las plantas. [28]
La producción de fertilizantes sintéticos o inorgánicos requiere productos químicos preparados, mientras que los fertilizantes orgánicos se derivan de procesos orgánicos de plantas y animales en procesos biológicos que utilizan bioquímicos.

Los fertilizantes nitrogenados se elaboran a partir de amoníaco (NH 3 ) producido mediante el proceso Haber-Bosch . [22] En este proceso que consume mucha energía, el gas natural (CH 4 ) normalmente suministra el hidrógeno y el nitrógeno (N 2 ) se obtiene del aire . Este amoníaco se utiliza como materia prima para todos los demás fertilizantes nitrogenados, como el nitrato de amonio anhidro (NH 4 NO 3 ) y la urea (CO(NH 2 ) 2 ).
Los depósitos de nitrato de sodio (NaNO 3 ) ( salitre chileno ) también se encuentran en el desierto de Atacama en Chile y fue uno de los fertilizantes ricos en nitrógeno originales (1830) utilizados. [31] Todavía se extrae para obtener fertilizante. [32] Los nitratos también se producen a partir de amoníaco mediante el proceso de Ostwald .

Los fertilizantes fosfatados se obtienen mediante extracción de roca fosfórica , que contiene dos minerales principales que contienen fósforo, fluorapatita Ca 5 (PO 4 ) 3 F (CFA) e hidroxiapatita Ca 5 (PO 4 ) 3 OH. Anualmente se extraen miles de millones de kilogramos de roca fosfórica, pero el tamaño y la calidad del mineral restante están disminuyendo. Estos minerales se convierten en sales de fosfato solubles en agua mediante tratamiento con ácidos . [33] La gran producción de ácido sulfúrico está motivada principalmente por esta aplicación. [34] En el proceso de nitrofosfato o proceso Odda (inventado en 1927), la roca de fosfato con hasta un 20% de contenido de fósforo (P) se disuelve con ácido nítrico (HNO 3 ) para producir una mezcla de ácido fosfórico (H 3 PO 4 ) y nitrato de calcio (Ca(NO 3 ) 2 ). Esta mezcla se puede combinar con un fertilizante de potasio para producir un fertilizante compuesto con los tres macronutrientes N, P y K en forma fácilmente disuelta. [35]
La potasa es una mezcla de minerales de potasio que se utiliza para fabricar fertilizantes de potasio (símbolo químico: K). La potasa es soluble en agua, por lo que el esfuerzo principal para producir este nutriente a partir del mineral implica algunos pasos de purificación; por ejemplo, para eliminar el cloruro de sodio (NaCl) ( sal común ). A veces se hace referencia a la potasa como K 2 O, por conveniencia para quienes describen el contenido de potasio. De hecho, los fertilizantes potásicos suelen ser cloruro potásico , sulfato potásico , carbonato potásico o nitrato potásico . [36]
Hay cuatro rutas principales para fabricar fertilizantes NPK (llamados así por sus ingredientes principales: nitrógeno (N), fósforo (P) y potasio (K)):
Los primeros tres procesos se utilizan para producir NPK compuestos. Durante la granulación con vapor, las materias primas se mezclan y se granulan adicionalmente utilizando vapor como agente aglutinante. El proceso de granulación química se basa en reacciones químicas entre materias primas líquidas (como ácido fosfórico , ácido sulfúrico , amoníaco ) y materias primas sólidas (como cloruro de potasio , material reciclado). La compactación implementa alta presión para aglomerar materiales en polvo seco. Por último, las mezclas a granel se producen mezclando fertilizantes simples.


" Fertilizantes orgánicos " puede describir aquellos fertilizantes de origen biológico, derivados de materiales vivos o anteriormente vivos. Los fertilizantes orgánicos también pueden describir productos disponibles comercialmente y frecuentemente envasados que se esfuerzan por seguir las expectativas y restricciones adoptadas por la " agricultura orgánica " y la jardinería " ecológica ", sistemas relacionados de producción de alimentos y plantas que limitan significativamente o evitan estrictamente el uso de fertilizantes sintéticos. y pesticidas. Los productos de "fertilizantes orgánicos" normalmente contienen algunos materiales orgánicos así como aditivos aceptables tales como polvos de roca nutritivos, conchas marinas molidas (cangrejo, ostra, etc.), otros productos preparados como harina de semillas o algas marinas, y microorganismos y derivados cultivados. .
Los fertilizantes de origen orgánico (primera definición) incluyen desechos animales , desechos vegetales de la agricultura, algas marinas , compost y lodos de depuradora tratados ( biosólidos ). Más allá del estiércol, las fuentes animales pueden incluir productos del sacrificio de animales: harina de sangre , harina de huesos , harina de plumas , pieles, pezuñas y cuernos, todos ellos son componentes típicos. [19] Los materiales derivados orgánicamente disponibles para la industria, como los lodos de depuradora, pueden no ser componentes aceptables de la agricultura y la jardinería orgánicas, debido a factores que van desde contaminantes residuales hasta la percepción pública. Por otra parte, los "fertilizantes orgánicos" comercializados pueden incluir y promover productos orgánicos procesados porque los materiales tienen atractivo para el consumidor. No importa la definición ni la composición, la mayoría de estos productos contienen nutrientes menos concentrados y los nutrientes no se cuantifican tan fácilmente. Pueden ofrecer ventajas para la formación del suelo y ser atractivos para quienes intentan cultivar o cultivar un huerto de forma más "natural". [37]
En términos de volumen, la turba es la enmienda orgánica envasada para suelos más utilizada. Es una forma inmadura de carbón y mejora el suelo al airearlo y absorber agua, pero no confiere ningún valor nutricional a las plantas. Por tanto, no se trata de un fertilizante tal como se define al principio del artículo, sino más bien de una modificación. La fibra de coco (derivada de la cáscara de coco), la corteza y el aserrín, cuando se agregan al suelo, actúan de manera similar (pero no idéntica) a la turba y también se consideran enmiendas orgánicas del suelo (o texturizantes) debido a sus limitados aportes nutritivos. Algunos aditivos orgánicos pueden tener un efecto inverso sobre los nutrientes (el aserrín fresco puede consumir los nutrientes del suelo a medida que se descompone y puede reducir el pH del suelo), pero estos mismos texturizantes orgánicos (así como el compost, etc.) pueden aumentar la disponibilidad de nutrientes a través de mejoras. intercambio catiónico, o mediante un mayor crecimiento de microorganismos que a su vez aumentan la disponibilidad de ciertos nutrientes vegetales. Los fertilizantes orgánicos como el compost y el estiércol pueden distribuirse localmente sin dedicarse a la producción industrial, lo que hace que el consumo real sea más difícil de cuantificar.

China se ha convertido en el mayor productor y consumidor de fertilizantes nitrogenados [39] , mientras que África depende poco de los fertilizantes nitrogenados. [40] Los minerales agrícolas y químicos son muy importantes en el uso industrial de fertilizantes, que está valorado en aproximadamente 200 mil millones de dólares. [41] El nitrógeno tiene un impacto significativo en el uso global de minerales, seguido por la potasa y el fosfato. La producción de nitrógeno ha aumentado drásticamente desde los años 1960. El precio del fosfato y la potasa ha aumentado desde la década de 1960, un precio mayor que el índice de precios al consumidor. [41] La potasa se produce en Canadá, Rusia y Bielorrusia, y en conjunto representan más de la mitad de la producción mundial. [41] La producción de potasa en Canadá aumentó en 2017 y 2018 un 18,6%. [42] Estimaciones conservadoras informan que entre el 30 y el 50% del rendimiento de los cultivos se atribuyen a fertilizantes comerciales naturales o sintéticos. [36] [43] El consumo de fertilizantes ha superado la cantidad de tierras agrícolas en los Estados Unidos. [41]
El Banco Mundial publica datos sobre el consumo de fertilizantes por hectárea de tierra cultivable en 2012 . [44] El siguiente diagrama muestra el consumo de fertilizantes por parte de los países de la Unión Europea (UE) en kilogramos por hectárea (libras por acre). El consumo total de fertilizantes en la UE es de 15,9 millones de toneladas por 105 millones de hectáreas de tierra cultivable [45] (o 107 millones de hectáreas de tierra cultivable según otra estimación [46] ). Esta cifra equivale a 151 kg de fertilizantes consumidos por hectárea de tierra cultivable en promedio en los países de la UE.


Los fertilizantes se utilizan comúnmente para todos los cultivos, y las tasas de aplicación dependen de la fertilidad del suelo, generalmente medida mediante una prueba de suelo y de acuerdo con el cultivo en particular. Las legumbres, por ejemplo, fijan nitrógeno de la atmósfera y generalmente no requieren fertilizantes nitrogenados.
Los fertilizantes se aplican a los cultivos tanto en forma sólida como líquida. Alrededor del 90% de los fertilizantes se aplican en forma sólida. Los fertilizantes inorgánicos sólidos más utilizados son la urea , el fosfato diamónico y el cloruro potásico. [47] Los fertilizantes sólidos suelen ser granulados o en polvo. A menudo , los sólidos están disponibles en forma de glóbulos sólidos. Los fertilizantes líquidos comprenden amoníaco anhidro, soluciones acuosas de amoníaco, soluciones acuosas de nitrato de amonio o urea. Estos productos concentrados se pueden diluir con agua para formar un fertilizante líquido concentrado (por ejemplo, UAN ). Las ventajas del fertilizante líquido son su efecto más rápido y su fácil cobertura. [19] La adición de fertilizante al agua de riego se denomina " fertirriego ". [36]
La urea es muy soluble en agua y, por tanto, también es muy adecuada para su uso en soluciones fertilizantes (en combinación con nitrato de amonio: UAN), por ejemplo, en fertilizantes para 'alimentos foliares'. Para el uso de fertilizantes, se prefieren los gránulos a las pepitas debido a su distribución de tamaño de partícula más estrecha, lo cual es una ventaja para la aplicación mecánica.
La urea generalmente se aplica en dosis de entre 40 y 300 kg/ha (35 a 270 libras/acre), pero las dosis varían. Las aplicaciones más pequeñas incurren en menores pérdidas debido a la lixiviación. Durante el verano, la urea suele esparcirse justo antes o durante la lluvia para minimizar las pérdidas por volatilización (un proceso en el que el nitrógeno se pierde a la atmósfera en forma de gas amoníaco).
Debido a la alta concentración de nitrógeno en la urea, es muy importante lograr una distribución uniforme. La perforación no debe realizarse en contacto con la semilla o cerca de ella, debido al riesgo de dañar la germinación. La urea se disuelve en agua para su aplicación en forma de aspersión o mediante sistemas de riego.
En los cultivos de cereales y algodón, la urea suele aplicarse en el momento del último cultivo antes de la siembra. En áreas con abundantes precipitaciones y en suelos arenosos (donde el nitrógeno se puede perder por lixiviación) y donde se esperan buenas lluvias durante la temporada, la urea se puede aplicar como abono lateral o superior durante la temporada de crecimiento. El aderezo también es popular en pastos y cultivos forrajeros. En el cultivo de caña de azúcar, la urea se aplica después de la siembra y a cada socavo .
Debido a que absorbe la humedad de la atmósfera, la urea suele almacenarse en recipientes cerrados.
La sobredosis o la colocación de urea cerca de las semillas es perjudicial. [48]
Los fertilizantes foliares se aplican directamente sobre las hojas. Este método se utiliza casi invariablemente para aplicar fertilizantes nitrogenados puros solubles en agua y se utiliza especialmente para cultivos de alto valor como las frutas. La urea es el fertilizante foliar más común. [19]


Se utilizan varios productos químicos para mejorar la eficiencia de los fertilizantes a base de nitrógeno. De esta manera los agricultores pueden limitar los efectos contaminantes de la escorrentía de nitrógeno . Los inhibidores de la nitrificación (también conocidos como estabilizadores de nitrógeno) suprimen la conversión de amoníaco en nitrato , un anión que es más propenso a lixiviarse. Son populares el 1-carbamoil-3-metilpirazol (CMP), la diciandiamida , la nitrapirina (2-cloro-6-triclorometilpiridina) y el fosfato de 3,4-dimetilpirazol ( DMPP ). [51] Los inhibidores de la ureasa se utilizan para retardar la conversión hidrolítica de la urea en amoníaco, que es propenso a la evaporación y a la nitrificación. La conversión de urea en amoníaco catalizada por enzimas llamadas ureasas . Un inhibidor popular de las ureasas es la triamida N-(n-butil)tiofosfórica ( NBPT ).
El uso cuidadoso de las tecnologías de fertilización es importante porque el exceso de nutrientes puede ser perjudicial. [52] Las quemaduras por fertilizantes pueden ocurrir cuando se aplica demasiado fertilizante, lo que resulta en daños o incluso la muerte de la planta. Los fertilizantes varían en su tendencia a quemarse aproximadamente de acuerdo con su índice de sal. [53] [54]

Los fertilizantes sintéticos utilizados en la agricultura tienen consecuencias ambientales de amplio alcance .
Según el Informe especial sobre el cambio climático y la tierra del Panel Intergubernamental sobre el Cambio Climático (IPCC) , la producción de estos fertilizantes y las prácticas asociadas de uso de la tierra son impulsores del calentamiento global . [3] El uso de fertilizantes también ha tenido una serie de consecuencias ambientales directas: escorrentía agrícola que produce efectos aguas abajo, como zonas muertas en los océanos y contaminación de las vías fluviales, degradación del microbioma del suelo , [55] y acumulación de toxinas en los ecosistemas. Los impactos ambientales indirectos incluyen: los impactos ambientales del fracking para obtener gas natural utilizado en el proceso Haber , el auge agrícola es parcialmente responsable del rápido crecimiento de la población humana y las prácticas agrícolas industriales a gran escala están asociadas con la destrucción del hábitat , la presión sobre la biodiversidad y la agricultura. pérdida de suelo .
Para mitigar las preocupaciones ambientales y de seguridad alimentaria , la comunidad internacional ha incluido los sistemas alimentarios en el Objetivo de Desarrollo Sostenible 2 , que se centra en la creación de un sistema de producción de alimentos sostenible y respetuoso con el clima . [56] La mayoría de los enfoques normativos y normativos para abordar estas cuestiones se centran en orientar las prácticas agrícolas hacia prácticas agrícolas sostenibles o regenerativas : estas utilizan menos fertilizantes sintéticos, una mejor gestión del suelo (por ejemplo, agricultura sin labranza ) y más fertilizantes orgánicos.

Por cada tonelada de ácido fosfórico producida durante el procesamiento de la roca fosfórica, se generan cinco toneladas de residuos. Estos desechos toman la forma de un sólido radiactivo, impuro e inútil llamado fosfoyeso . Las estimaciones oscilan entre 100.000.000 y 280.000.000 de toneladas de residuos de fosfoyeso producidas anualmente en todo el mundo. [57]

Los fertilizantes de fósforo y nitrógeno pueden afectar el suelo, las aguas superficiales y las aguas subterráneas debido a la dispersión de minerales [41] en los cursos de agua debido a las fuertes precipitaciones, [58] [59] el deshielo y pueden lixiviarse en las aguas subterráneas con el tiempo. [60] La escorrentía agrícola contribuye en gran medida a la eutrofización de las masas de agua dulce. Por ejemplo, en Estados Unidos, aproximadamente la mitad de todos los lagos son eutróficos . El principal contribuyente a la eutrofización es el fosfato, que normalmente es un nutriente limitante; altas concentraciones promueven el crecimiento de cianobacterias y algas, cuya desaparición consume oxígeno. [61] Las floraciones de cianobacterias (' floraciones de algas ') también pueden producir toxinas dañinas que pueden acumularse en la cadena alimentaria y pueden ser perjudiciales para los humanos. [62] [63] La escorrentía de fertilizantes se puede reducir mediante el uso de estrategias de fertilización optimizadas para el clima. [58]
Los compuestos ricos en nitrógeno que se encuentran en la escorrentía de fertilizantes son la causa principal del grave agotamiento del oxígeno en muchas partes de los océanos , especialmente en las zonas costeras, lagos y ríos . La resultante falta de oxígeno disuelto reduce en gran medida la capacidad de estas áreas para sustentar la fauna oceánica . [64] El número de zonas oceánicas muertas cerca de las costas habitadas está aumentando. [sesenta y cinco]
Desde 2006, la aplicación de fertilizantes nitrogenados está cada vez más controlada en el noroeste de Europa [66] y Estados Unidos. [67] [68] En los casos en que la eutrofización se puede revertir, pueden pasar décadas [69] y una gestión significativa del suelo [70] antes de que los nitratos acumulados en las aguas subterráneas puedan descomponerse mediante procesos naturales.
Sólo una fracción de los fertilizantes a base de nitrógeno se convierte en materia vegetal. El resto se acumula en el suelo o se pierde como escorrentía. [71] Las altas tasas de aplicación de fertilizantes que contienen nitrógeno combinadas con la alta solubilidad en agua del nitrato conducen a un aumento de la escorrentía hacia las aguas superficiales , así como a la lixiviación hacia las aguas subterráneas, causando así contaminación de las aguas subterráneas . [72] [73] [74] El uso excesivo de fertilizantes que contienen nitrógeno (ya sean sintéticos o naturales) es particularmente dañino, ya que gran parte del nitrógeno que no es absorbido por las plantas se transforma en nitrato, que se lixivia fácilmente. [75]
Los niveles de nitrato superiores a 10 mg/L (10 ppm) en el agua subterránea pueden causar el ' síndrome del bebé azul ' ( metahemoglobinemia adquirida ). [76] Los nutrientes, especialmente los nitratos, en los fertilizantes pueden causar problemas para los hábitats naturales y para la salud humana si son arrastrados del suelo a cursos de agua o lixiviados a través del suelo hacia aguas subterráneas. [77] La escorrentía puede provocar floraciones fertilizantes de algas que consumen todo el oxígeno y dejan enormes "zonas muertas" donde otros peces y formas de vida acuática no pueden vivir. [78]
La acidificación del suelo se refiere al proceso mediante el cual el nivel de pH del suelo se vuelve más ácido con el tiempo. El pH del suelo es una medida de la acidez o alcalinidad del suelo y se determina en una escala de 0 a 14, siendo 7 neutro. Un valor de pH inferior a 7 indica suelo ácido, mientras que un valor de pH superior a 7 indica suelo alcalino o básico.
La acidificación del suelo es una preocupación importante en la agricultura y la horticultura. Se refiere al proceso por el cual el suelo se vuelve más ácido con el tiempo.
Los fertilizantes que contienen nitrógeno pueden causar acidificación del suelo cuando se agregan. [79] [80] Esto puede conducir a una disminución en la disponibilidad de nutrientes que puede compensarse con el encalado . Estos fertilizantes liberan iones de amonio o nitrato, que pueden acidificar el suelo a medida que sufren reacciones químicas.
Cuando estos fertilizantes que contienen nitrógeno se agregan al suelo, aumentan la concentración de iones de hidrógeno (H+) en la solución del suelo, lo que reduce el pH del suelo.
La concentración de cadmio en los fertilizantes que contienen fósforo varía considerablemente y puede resultar problemática. [81] Por ejemplo, el fertilizante de fosfato monoamónico puede tener un contenido de cadmio tan bajo como 0,14 mg/kg o tan alto como 50,9 mg/kg. [82] La roca de fosfato utilizada en su fabricación puede contener hasta 188 mg/kg de cadmio [83] (ejemplos son depósitos en Nauru [84] y las islas de Navidad [85] ). El uso continuo de fertilizantes con alto contenido de cadmio puede contaminar el suelo (como se muestra en Nueva Zelanda) [86] y las plantas . [87] La Comisión Europea ha considerado límites al contenido de cadmio de los fertilizantes fosfatados . [88] [89] [90] Los productores de fertilizantes que contienen fósforo ahora seleccionan la roca de fosfato en función del contenido de cadmio. [61]
Las rocas fosfatadas contienen altos niveles de fluoruro. En consecuencia, el uso generalizado de fertilizantes fosfatados ha aumentado las concentraciones de fluoruro en el suelo. [87] Se ha descubierto que la contaminación de los alimentos por fertilizantes es motivo de poca preocupación ya que las plantas acumulan poco fluoruro del suelo; De mayor preocupación es la posibilidad de toxicidad por fluoruro para el ganado que ingiere suelos contaminados. [91] [92] También son motivo de posible preocupación los efectos del fluoruro en los microorganismos del suelo. [91] [92] [93]
El contenido radiactivo de los fertilizantes varía considerablemente y depende tanto de sus concentraciones en el mineral original como del proceso de producción del fertilizante. [87] [94] Las concentraciones de uranio-238 pueden oscilar entre 7 y 100 pCi/g (picocurios por gramo) en roca fosfórica [95] y entre 1 y 67 pCi/g en fertilizantes fosfatados. [96] [97] [98] Cuando se utilizan altas tasas anuales de fertilizantes de fósforo, esto puede resultar en concentraciones de uranio-238 en suelos y aguas de drenaje que son varias veces mayores que las normalmente presentes. [97] [99] Sin embargo, el impacto de estos aumentos en el riesgo para la salud humana por la contaminación de los alimentos por radinucleidos es muy pequeño (menos de 0,05 m Sv /año). [97] [100] [101]
Los desechos de la industria siderúrgica, reciclados en fertilizantes por sus altos niveles de zinc (esencial para el crecimiento de las plantas), pueden incluir los siguientes metales tóxicos : plomo [102] arsénico , cadmio , [102] cromo y níquel. Los elementos tóxicos más comunes en este tipo de fertilizantes son el mercurio , el plomo y el arsénico. [103] [104] [105] Estas impurezas potencialmente dañinas se pueden eliminar; sin embargo, esto aumenta significativamente el costo. Los fertilizantes de alta pureza están ampliamente disponibles y quizás sean más conocidos como los fertilizantes altamente solubles en agua que contienen tintes azules que se usan en los hogares, como Miracle-Gro . Estos fertilizantes altamente solubles en agua se utilizan en el negocio de los viveros de plantas y están disponibles en paquetes más grandes a un costo significativamente menor que las cantidades minoristas. Algunos fertilizantes granulados para jardín de venta al por menor y económicos están elaborados con ingredientes de alta pureza.
Se ha prestado atención a la disminución de las concentraciones de elementos como hierro, zinc, cobre y magnesio en muchos alimentos durante los últimos 50 a 60 años. [106] [107] Las prácticas agrícolas intensivas , incluido el uso de fertilizantes sintéticos, se sugieren con frecuencia como razones de estas disminuciones y la agricultura orgánica a menudo se sugiere como una solución. [107] Aunque se sabe que los rendimientos mejorados de los cultivos resultantes de los fertilizantes NPK diluyen las concentraciones de otros nutrientes en las plantas, [106] [108] gran parte de la disminución medida se puede atribuir al uso de variedades de cultivos de rendimiento cada vez mayor que producen alimentos. con concentraciones minerales más bajas que sus ancestros menos productivos. [106] [109] [110] Por lo tanto, es poco probable que la agricultura orgánica o el uso reducido de fertilizantes resuelvan el problema; Se supone que los alimentos con alta densidad de nutrientes se lograrán utilizando variedades más antiguas y de menor rendimiento o el desarrollo de nuevas variedades de alto rendimiento y ricas en nutrientes. [106] [111]
De hecho, es más probable que los fertilizantes resuelvan los problemas de deficiencia de minerales traza que los causen: en Australia Occidental, se identificó que las deficiencias de zinc , cobre, manganeso , hierro y molibdeno limitaban el crecimiento de cultivos y pastos de gran superficie en las décadas de 1940 y 1950. . [112] Los suelos de Australia Occidental son muy viejos, muy erosionados y deficientes en muchos de los principales nutrientes y oligoelementos. [112] Desde entonces, estos oligoelementos se añaden habitualmente a los fertilizantes utilizados en la agricultura en este estado. [112] Muchos otros suelos en todo el mundo tienen deficiencia de zinc, lo que provoca una deficiencia tanto en las plantas como en los humanos, y los fertilizantes de zinc se utilizan ampliamente para resolver este problema. [113]
Los altos niveles de fertilizantes pueden provocar la ruptura de las relaciones simbióticas entre las raíces de las plantas y los hongos micorrízicos . [114]
En Estados Unidos, en 2004, se consumieron 317 mil millones de pies cúbicos de gas natural en la producción industrial de amoníaco , menos del 1,5% del consumo total anual de gas natural en Estados Unidos . [115] Un informe de 2002 sugirió que la producción de amoníaco consume alrededor del 5% del consumo mundial de gas natural, lo que es algo menos del 2% de la producción mundial de energía. [116]
El amoníaco se produce a partir de gas natural y aire. [117] El costo del gas natural representa alrededor del 90% del costo de producir amoníaco. [118] El aumento del precio de los gases naturales durante la última década, junto con otros factores como el aumento de la demanda, han contribuido al aumento del precio de los fertilizantes. [119]
La cantidad de gases de efecto invernadero (dióxido de carbono , metano y óxido nitroso) producidos durante la fabricación y el uso de fertilizantes nitrogenados se estima en alrededor del 5% de las emisiones antropogénicas de gases de efecto invernadero . Un tercio se produce durante la producción y dos tercios durante el uso de fertilizantes. La forma más importante de reducir las emisiones es utilizar menos fertilizantes. Según el Dr. André Cabrera Serrenho: ""Somos increíblemente ineficientes en el uso de fertilizantes", "Estamos usando mucho más de lo que necesitamos". [120] Las bacterias del suelo pueden convertir el fertilizante nitrogenado en óxido nitroso , un efecto invernadero. gas [121] Las emisiones de óxido nitroso por parte de los seres humanos, la mayoría de las cuales provienen de fertilizantes, entre 2007 y 2016 se han estimado en 7 millones de toneladas por año, [122] lo que es incompatible con limitar el calentamiento global a menos de 2 °C. ]

Mediante el uso cada vez mayor de fertilizantes nitrogenados, que se utilizaron a un ritmo de aproximadamente 110 millones de toneladas (de N) por año en 2012, [124] [125] añadiendo a la cantidad ya existente de nitrógeno reactivo, óxido nitroso (N 2 O ) se ha convertido en el tercer gas de efecto invernadero más importante después del dióxido de carbono y el metano. Tiene un potencial de calentamiento global 296 veces mayor que una masa igual de dióxido de carbono y también contribuye al agotamiento del ozono estratosférico. [126] Al cambiar los procesos y procedimientos, es posible mitigar algunos, pero no todos, estos efectos sobre el cambio climático antropogénico . [127]
Las emisiones de metano de los campos de cultivo (en particular, los arrozales ) aumentan con la aplicación de fertilizantes a base de amonio. Estas emisiones contribuyen al cambio climático global, ya que el metano es un potente gas de efecto invernadero. [128] [129]
En Europa, los problemas relacionados con las altas concentraciones de nitratos en los escurrimientos están siendo abordados por la Directiva sobre Nitratos de la Unión Europea. [130] En Gran Bretaña , se anima a los agricultores a gestionar sus tierras de forma más sostenible mediante una "agricultura sensible a las cuencas hidrográficas". [131] En los EE. UU ., las altas concentraciones de nitrato y fósforo en el agua de escorrentía y drenaje se clasifican como contaminantes de fuente difusa debido a su origen difuso; esta contaminación está regulada a nivel estatal. [132] Oregón y Washington , ambos en los Estados Unidos, tienen programas de registro de fertilizantes con bases de datos en línea que enumeran los análisis químicos de los fertilizantes. [133] [134]
En China , se han implementado regulaciones para controlar el uso de fertilizantes nitrogenados en la agricultura. En 2008, los gobiernos chinos comenzaron a retirar parcialmente los subsidios a los fertilizantes, incluidos los subsidios al transporte de fertilizantes y al uso de electricidad y gas natural en la industria. En consecuencia, el precio de los fertilizantes ha subido y las granjas a gran escala han comenzado a utilizar menos fertilizantes. Si las granjas a gran escala siguen reduciendo el uso de subsidios a los fertilizantes, no tienen más remedio que optimizar los fertilizantes que tienen, lo que por lo tanto aumentaría tanto el rendimiento de los cereales como las ganancias. [135]
En marzo de 2022, el Departamento de Agricultura de los Estados Unidos anunció una nueva subvención de 250 millones de dólares para promover la producción estadounidense de fertilizantes. Como parte de Commodity Credit Corporation, el programa de subvenciones apoyará la producción de fertilizantes que sea independiente de los proveedores de fertilizantes dominantes, fabricados en Estados Unidos y que utilicen técnicas de producción innovadoras para impulsar la competencia futura. [136]
Dos tipos de prácticas de gestión agrícola incluyen la agricultura orgánica y la agricultura convencional. El primero fomenta la fertilidad del suelo utilizando recursos locales para maximizar la eficiencia. La agricultura orgánica evita los agroquímicos sintéticos. La agricultura convencional utiliza todos los componentes que la agricultura orgánica no utiliza. [137]
{{cite book}}: |website=ignorado ( ayuda ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |journal=ignorado ( ayuda ){{cite journal}}: Citar diario requiere |journal=( ayuda ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ) Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )