
La comprensión más reciente de la evolución de los insectos se basa en estudios de las siguientes ramas de la ciencia: biología molecular, morfología de insectos, paleontología, taxonomía de insectos, evolución, embriología, bioinformática y computación científica. Se estima que la clase de insectos se originó en la Tierra hace unos 480 millones de años, en el Ordovícico , aproximadamente al mismo tiempo que aparecieron las plantas terrestres . [1] Se cree que los insectos evolucionaron a partir de un grupo de crustáceos . [2] Los primeros insectos eran terrestres, pero hace unos 400 millones de años en el período Devónico un linaje de insectos desarrolló el vuelo, los primeros animales en hacerlo. [1] Se ha propuesto que el fósil de insecto más antiguo es Rhyniognatha hirsti , que se estima que tiene 400 millones de años, pero la identidad del insecto del fósil ha sido cuestionada. [3] Las condiciones climáticas globales cambiaron varias veces durante la historia de la Tierra, y junto con ellas la diversidad de insectos . Los Pterigotos (insectos alados) sufrieron una importante radiación en el Carbonífero (hace 358 a 299 millones de años) mientras que los Endopterygota (insectos que pasan por diferentes etapas de vida con metamorfosis ) sufrieron otra importante radiación en el Pérmico (hace 299 a 252 millones de años).
La mayoría de los órdenes de insectos actuales se desarrollaron durante el período Pérmico . Muchos de los primeros grupos se extinguieron durante la extinción masiva en el límite Pérmico-Triásico , el mayor evento de extinción en la historia de la Tierra, hace unos 252 millones de años. [4] Los sobrevivientes de este evento evolucionaron en el Triásico (hace entre 252 y 201 millones de años) hasta lo que son esencialmente los órdenes de insectos modernos que persisten hasta el día de hoy. La mayoría de las familias de insectos modernas aparecieron en el Jurásico (hace entre 201 y 145 millones de años).
En un ejemplo importante de coevolución , varios grupos de insectos de gran éxito —especialmente los himenópteros (avispas, abejas y hormigas) y los lepidópteros (mariposas), así como muchos tipos de dípteros (moscas) y coleópteros (escarabajos)— evolucionaron junto con plantas con flores durante el Cretácico (hace entre 145 y 66 millones de años). [5] [6]
Muchos géneros de insectos modernos se desarrollaron durante el Cenozoico , que comenzó hace unos 66 millones de años; los insectos de este período en adelante se conservaron con frecuencia en ámbar , a menudo en perfecto estado. Estos especímenes se pueden comparar fácilmente con las especies modernas y la mayoría de ellos son miembros de géneros actuales.
.jpg/440px-Fossil_insect_(Diptera,_Nematocera_in_Baltic_amber._Age_50_Mill._years_(the_Lower_Eocene).jpg)
Debido a su esqueleto externo, la historia fósil de los insectos no depende enteramente de la conservación de tipo lagerstätte como ocurre con muchos organismos de cuerpo blando . Sin embargo, con su pequeño tamaño y constitución ligera, los insectos no han dejado un registro fósil particularmente robusto. Aparte de los insectos conservados en ámbar, la mayoría de los hallazgos son de fuentes terrestres o cercanas a la tierra y solo se conservan en condiciones muy especiales, como en el borde de lagos de agua dulce. Si bien alrededor de 1/3 de las especies conocidas no relacionadas con insectos son fósiles extintos, debido a la escasez de su registro fósil, solo 1/100 de los insectos conocidos son fósiles extintos. [7]
Los fósiles de insectos son a menudo preservaciones tridimensionales del fósil original. Las alas sueltas son un tipo común de fósil, ya que las alas no se descomponen ni digieren fácilmente, y a menudo son abandonadas por los depredadores. La fosilización a menudo preservará su apariencia externa, al contrario de los fósiles de vertebrados que se conservan en su mayoría solo como restos óseos (o moldes inorgánicos de los mismos). Debido a su tamaño, los fósiles de vertebrados con el aspecto externo preservado de manera similar son raros, y la mayoría de los casos conocidos son subfósiles . [8] Los fósiles de insectos, cuando se conservan, a menudo se conservan como réplicas tridimensionales, permineralizadas y carbonizadas; y como inclusiones en ámbar e incluso dentro de algunos minerales. A veces, incluso su color y patrón aún son discernibles. [9] Sin embargo, la conservación en ámbar es limitada, ya que la abundante producción de resina por parte de los árboles solo evolucionó en el Mesozoico. [10] [11]
También hay abundante evidencia fósil del comportamiento de los insectos extintos, incluidos los daños causados por la alimentación en la vegetación fósil y en la madera, en los excrementos y en los nidos en suelos fósiles. Esta conservación es poco frecuente en los vertebrados y se limita principalmente a huellas y coprolitos . [12] : 42
El denominador común entre la mayoría de los depósitos de insectos fósiles y plantas terrestres es el ambiente del lago. Los insectos que se conservaron vivían en el lago fósil ( autóctonos ) o fueron llevados a él desde hábitats circundantes por los vientos, las corrientes de los arroyos o su propio vuelo ( alóctonos ). Los insectos que se ahogan y mueren y no son comidos por los peces y otros depredadores se depositan en el fondo, donde pueden conservarse en los sedimentos del lago, llamados lacustres, en condiciones apropiadas. Incluso el ámbar, o la resina fósil de los árboles, requiere un entorno acuático que sea lacustre o salobre para conservarse. Sin protección en sedimentos anóxicos, el ámbar se desintegraría gradualmente; nunca se encuentra enterrado en suelos fósiles. Varios factores contribuyen en gran medida a qué tipos de insectos se conservan y qué tan bien, si es que lo hacen, incluyendo la profundidad del lago, la temperatura y la alcalinidad; el tipo de sedimentos; si el lago estaba rodeado de bosque o de vastas y monótonas salinas; y si estaba ahogado en anoxia o altamente oxigenado.
Existen algunas excepciones importantes al tema lacustre de los insectos fósiles, siendo las más famosas las calizas del Jurásico Tardío de Solnhofen y Eichstätt , Alemania, que son marinas. Estos depósitos son famosos por los pterosaurios y el Archaeopteryx , un animal parecido a un pájaro . Las calizas se formaron a partir de un lodo muy fino de calcita que se asentó dentro de bahías estancadas e hipersalinas aisladas de los mares interiores. La mayoría de los organismos en estas calizas , incluidos los insectos raros, se conservaron intactos, a veces con plumas y contornos de membranas de alas blandas, lo que indica que hubo muy poca descomposición. Los insectos, sin embargo, son como moldes o yesos, que tienen relieve pero poco detalle. En algunos casos, los óxidos de hierro precipitaron alrededor de las venas de las alas, lo que reveló un mejor detalle. [12] : 42
Existen muchas formas diferentes de fosilizar y conservar los insectos, incluidas las compresiones e impresiones, las concreciones, la replicación mineral, los restos carbonizados (fusainizados) y sus restos traza. Las compresiones e impresiones son los tipos más extensos de fósiles de insectos, que se encuentran en rocas desde el Carbonífero hasta el Holoceno . Las impresiones son como un molde de un insecto fósil, que muestra su forma e incluso algo de relieve, como pliegues en las alas, pero generalmente poco o nada de color de la cutícula. Las compresiones preservan restos de la cutícula, por lo que el color distingue la estructura. En situaciones excepcionales, incluso son visibles características microscópicas como microtrichia en escleritas y membranas de las alas, pero la preservación de esta escala también requiere una matriz de grano excepcionalmente fino, como en lodos micríticos y tobas volcánicas. Debido a que las escleritas de artrópodos se mantienen juntas por membranas, que se descomponen fácilmente, muchos artrópodos fósiles solo se conocen por escleritas aisladas. Mucho más deseables son los fósiles completos. Las concreciones son piedras con un fósil en el núcleo cuya composición química difiere de la de la matriz circundante, generalmente formadas como resultado de la precipitación mineral de organismos en descomposición. El depósito más significativo consiste en varias localidades de la lutita Francis Creek del Carbonífero Tardío de la Formación Carbondale en Mazon Creek, Illinois, que están compuestas de lutitas y vetas de carbón que producen concreciones oblongas. Dentro de la mayoría de las concreciones hay un molde de un animal y, a veces, de una planta que generalmente es de origen marino. [ cita requerida ]
Cuando un insecto es reemplazado parcial o totalmente por minerales, generalmente completamente articulados y con fidelidad tridimensional, se llama replicación mineral . [12] Esto también se llama petrificación, como en la madera petrificada . Los insectos preservados de esta manera a menudo, pero no siempre, se conservan como concreciones, o dentro de nódulos de minerales que se formaron alrededor del insecto como su núcleo. Tales depósitos generalmente se forman donde los sedimentos y el agua están cargados de minerales, y donde también hay una mineralización rápida del cadáver por capas de bacterias.
El registro fósil de insectos se remonta a unos 400 millones de años, al Devónico inferior, mientras que los pterigotos (insectos alados) sufrieron una importante radiación en el Carbonífero. Los endopterigotes sufrieron otra radiación importante en el Pérmico. Los supervivientes de la extinción masiva en el límite del Pérmico evolucionaron en el Triásico hasta lo que son esencialmente los órdenes de Insecta modernos que persisten hasta los tiempos modernos.
La mayoría de las familias de insectos modernas aparecieron en el Jurásico, y probablemente se produjo una mayor diversificación de géneros en el Cretácico. En el Terciario ya existían muchos de los géneros que todavía son modernos; por lo tanto, la mayoría de los insectos del ámbar son, de hecho, miembros de géneros actuales. Los insectos se diversificaron en tan solo unos 100 millones de años hasta convertirse en formas esencialmente modernas. [7]
La evolución de los insectos se caracteriza por una rápida adaptación debida a las presiones selectivas ejercidas por el medio ambiente y fomentada por una elevada fecundidad. Parece que las rápidas radiaciones y la aparición de nuevas especies, un proceso que continúa hasta nuestros días, dan lugar a que los insectos llenen todos los nichos ambientales disponibles.
La evolución de los insectos está estrechamente relacionada con la evolución de las plantas con flores. Las adaptaciones de los insectos incluyen la alimentación de flores y estructuras relacionadas, y aproximadamente el 20% de los insectos actuales dependen de las flores, el néctar o el polen como fuente de alimento. Esta relación simbiótica es aún más importante en la evolución si se considera que más de dos tercios de las plantas con flores son polinizadas por insectos. [13]
Los insectos, en particular los mosquitos y las moscas , también son vectores de muchos patógenos que pueden incluso haber sido responsables de la aniquilación o extinción de algunas especies de mamíferos. [14]
El análisis molecular de Gaunt y Miles 2002 sugiere que los hexápodos divergieron de su grupo hermano, los Anostraca (camarones de hadas), aproximadamente al comienzo del período Silúrico hace 440 millones de años , coincidiendo con la aparición de plantas vasculares en la tierra. [15]
Misof et al. sugieren que los insectos podrían haber aparecido mucho antes, en el Ordovícico Inferior o incluso en el Cámbrico . Según esta versión, la radiación temprana de los insectos se produjo no más tarde de hace 479 millones de años en ambientes marinos o costeros. Sin embargo, los autores destacan que debido a la falta de fósiles de insectos del Cámbrico al Silúrico, esta versión sigue siendo muy controvertida. [16]
El Devónico (hace 419 a 359 millones de años) fue un período relativamente cálido y probablemente careció de glaciares.
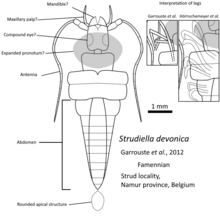
Los detalles de los primeros registros fósiles de insectos no se comprenden bien. Los fósiles que se consideraron como insectos del Devónico, como Rhyniognatha hirsti [17] o Strudiella devonica [18], fueron reconsiderados más tarde porque sus afinidades como insectos eran insuficientes. [3] [19] Pero según el estudio filogenético, los primeros insectos probablemente aparecieron antes, en el período Silúrico , [16] a partir de crustáceos del grupo troncal como Tanazios dokeron [20] que habían perdido la segunda antena. El primer insecto alado probablemente evolucionó en el Devónico dada la aparición de un gran número de insectos con alas en el Carbonífero. [9]

El Carbonífero ( hace entre 359 y 299 millones de años ) es famoso por sus climas húmedos y cálidos y sus extensos pantanos de musgos , helechos , colas de caballo y calamitas . [21] Las glaciaciones en Gondwana , desencadenadas por el movimiento hacia el sur de Gondwana, continuaron hasta el Pérmico y, debido a la falta de marcadores y rupturas claros, los depósitos de este período glaciar a menudo se denominan Pérmico-Carbonífero en edad. El enfriamiento y el secado del clima llevaron al colapso de la selva tropical del Carbonífero (CRC). Las selvas tropicales se fragmentaron y luego fueron finalmente devastadas por el cambio climático. [22]
Restos de insectos están dispersos por los depósitos de carbón, particularmente de alas de dictiópteros de tallo (Blattoptera); [23] dos depósitos en particular son de Mazon Creek, Illinois y Commentry , Francia. [24] Los primeros insectos alados son de este período de tiempo ( Pterygota ), incluyendo los mencionados Blattoptera, Caloneurodea , el grupo primitivo de tallo Ephemeropterans , Orthoptera , Palaeodictyopteroidea . [21] : 399 En 1940 (en el condado de Noble, Oklahoma), un fósil de Meganeuropsis americana representó el ala de insecto completa más grande jamás encontrada. [25] También se conocen insectos juveniles del Período Carbonífero. [26]
Los blatópteros muy primitivos tenían un pronoto grande y discoide y alas anteriores coriáceas con una vena CuP distintiva (una vena del ala no ramificada, situada cerca del pliegue claval y que llega hasta el margen posterior del ala). No eran verdaderas cucarachas, ya que tenían un ovipositor , aunque a través del Carbonífero, el ovipositor comenzó a disminuir. Se conocen los órdenes Caloneurodea y Miomoptera, siendo Orthoptera y Blattodea entre los primeros Neoptera; desarrollándose desde el Carbonífero superior hasta el Pérmico. Estos insectos tenían alas con forma y estructura similares: pequeños lóbulos anales. [21] : 399 Especies de Orthoptera, o saltamontes y parientes relacionados, es un orden antiguo que todavía existe hasta hoy y que se extiende desde este período de tiempo. De ese momento incluso se conserva la sinapomorfía distintiva de las patas traseras saltatoriales o adaptativas para saltar.
Palaeodictyopteroidea es un grupo grande y diverso que incluye el 50% de todos los insectos paleozoicos conocidos. [12] Contiene muchas de las características primitivas de la época: cercos muy largos , un ovipositor y alas con poco o ningún lóbulo anal . Protodonata , como su nombre lo indica, es un grupo parafilético primitivo similar a Odonata ; aunque carece de características distintivas como un nodus , un pterostigma y un arculus . La mayoría eran solo un poco más grandes que las libélulas modernas, pero el grupo incluye los insectos más grandes conocidos, como las moscas grifo como la Meganeura monyi del Carbonífero tardío, y la Meganeuropsis permiana del Pérmico tardío aún más grande , con envergaduras de hasta 71 cm (2 pies 4 pulgadas). Probablemente fueron los principales depredadores durante unos 100 millones de años [21] : 400 y mucho más grandes que cualquier insecto actual. Sus ninfas también deben haber alcanzado un tamaño muy impresionante. Este gigantismo puede haberse debido a mayores niveles de oxígeno atmosférico (hasta un 80% por encima de los niveles modernos durante el Carbonífero) que permitieron una mayor eficiencia respiratoria en relación con la actualidad. Esto permitió que existieran formas gigantes de pterigotas , milpiés y escorpiones , lo que hizo que los tetrápodos recién llegados permanecieran pequeños hasta el Colapso de la Selva Tropical Carbonífera . Sin embargo, se conoce una gran mosca grifo con una envergadura de aproximadamente 43-47 cm (1 pie 5 pulgadas - 1 pie 7 pulgadas) de finales del Pérmico, cuando el nivel de oxígeno era mucho más bajo. [27] Además, las moscas grifo probablemente vivían en hábitats abiertos, como lo demuestra Meganeurites gracilipes. M. gracilipes exhibió alas alargadas que no eran adecuadas para hábitats densamente boscosos, y tenía ojos compuestos agrandados dorsalmente, muy parecidos a las libélulas modernas que cazan en hábitats abiertos. [28]
El Pérmico ( hace entre 299 y 252 millones de años ) fue un período relativamente corto, durante el cual todas las principales masas terrestres de la Tierra se reunieron en un único supercontinente conocido como Pangea . Pangea se extendía a ambos lados del ecuador y hacia los polos, con un efecto correspondiente en las corrientes oceánicas en el único gran océano (" Panthalassa ", el "mar universal"), y el océano Paleo-Tetis, un gran océano que estaba entre Asia y Gondwana. El continente de Cimmeria se separó de Gondwana y se desplazó hacia el norte hasta Laurasia , lo que provocó que el Paleo-Tetis se encogiera. [21] : 400 Al final del Pérmico, se produjo la mayor extinción masiva de la historia, llamada colectivamente el evento de extinción masiva del Pérmico-Triásico : el 30% de todas las especies de insectos se extinguieron; esta es una de las tres extinciones masivas de insectos conocidas en la historia de la Tierra. [29]
Un estudio de 2007 basado en el ADN de escarabajos vivos y mapas de la probable evolución de los escarabajos indicó que los escarabajos pueden haberse originado durante el Pérmico Inferior , hasta hace 299 millones de años . [30] En 2009, se describió un escarabajo fósil del Pensilvánico de Mazon Creek , Illinois, empujando el origen de los escarabajos a una fecha anterior, hace 318 a 299 millones de años . [31] Se han encontrado fósiles de esta época en Asia y Europa, por ejemplo en los yacimientos fósiles de pizarra roja de Niedermoschel cerca de Maguncia, Alemania. [32] Se han encontrado más fósiles en Obora, República Checa y Tshekarda en los montes Urales, Rusia. [33] Se hicieron más descubrimientos de América del Norte en la Formación Wellington de Oklahoma y se publicaron en 2005 y 2008. [29] [34] Algunos de los depósitos fósiles más importantes de esta era son de Elmo, Kansas (260 millones de años); otros incluyen Nueva Gales del Sur, Australia (240 millones de años) y Eurasia central (250 millones de años). [21] : 400
Durante este tiempo, muchas de las especies del Carbonífero se diversificaron, y se desarrollaron muchos nuevos órdenes, incluyendo: Protelytroptera , parientes primitivos de Plecoptera (Paraplecoptera), Psocoptera , Mecoptera , Coleoptera , Raphidioptera y Neuroptera , siendo los últimos cuatro los primeros registros definitivos de Holometabola . [21] : 400 Para el Pensilvánico y hasta bien entrado el Pérmico, los más exitosos fueron, con mucho, los primitivos Blattoptera , o parientes de las cucarachas. Seis patas rápidas, dos alas plegables bien desarrolladas, ojos bastante buenos, antenas largas y bien desarrolladas (olfatorias), un sistema digestivo omnívoro, un receptáculo para almacenar esperma, un esqueleto de quitina que podía sostener y proteger, así como una forma de molleja y piezas bucales eficientes, le dieron formidables ventajas sobre otros animales herbívoros. Alrededor del 90% de los insectos eran insectos similares a las cucarachas ("Blattopterans"). [35] Las libélulas Odonata fueron el depredador aéreo dominante y probablemente también dominaron la depredación de insectos terrestres. Los verdaderos Odonata aparecieron en el Pérmico [36] [37] y todos son anfibios . Sus prototipos son los fósiles alados más antiguos, [38] se remontan al Devónico , y son diferentes de otras alas en todos los sentidos. [39] Sus prototipos pueden haber tenido los inicios de muchos atributos modernos incluso a finales del Carbonífero y es posible que incluso capturaran pequeños vertebrados, ya que algunas especies tenían una envergadura de 71 cm. [37]
Los insectos más antiguos conocidos que se parecen a las especies de coleópteros datan del Pérmico Inferior ( hace 270 millones de años ), aunque en cambio tienen antenas de 13 segmentos , élitros con venación más desarrollada y nervaduras longitudinales más irregulares, y un abdomen y ovipositor que se extienden más allá del ápice de los élitros. El escarabajo verdadero más antiguo tendría características que incluyen antenas de 11 segmentos, nervaduras longitudinales regulares en los élitros y genitales internos. [29] Las primeras especies parecidas a escarabajos tenían alas delanteras puntiagudas y parecidas al cuero con celdas y hoyos. Los hemípteros o chinches verdaderos habían aparecido en forma de Arctiniscytina y Paraknightia. Estos últimos tenían lóbulos parapronotales expandidos, un gran ovipositor y alas delanteras con venación inusual, posiblemente divergiendo de Blattoptera . Los órdenes Raphidioptera y Neuroptera se agrupan juntos como Neuropterida . La única familia del supuesto clado Raphidiopteran (Sojanoraphidiidae) ha sido clasificada de esta manera de manera controvertida. Aunque el grupo tenía un ovipositor largo distintivo de este orden y una serie de venas transversales cortas, sin embargo con una venación alar primitiva. Las primeras familias de Plecoptera tenían venación alar consistente con el orden y sus descendientes recientes. [21] : 186 Psocoptera apareció por primera vez en el período Pérmico , a menudo se los considera los más primitivos de los hemipteroides . [40]
El Triásico ( hace entre 252 y 201 millones de años ) fue un período en el que se desarrollaron sabanas áridas y semiáridas y aparecieron los primeros mamíferos , dinosaurios y pterosaurios . Durante el Triásico, casi toda la masa terrestre de la Tierra todavía estaba concentrada en Pangea. Desde el este, un vasto golfo ingresaba a Pangea, el mar de Tetis. Las costas restantes estaban rodeadas por el océano mundial conocido como Panthalassa . El supercontinente Pangea se estaba dividiendo durante el Triásico, especialmente a fines del período, pero aún no se había separado. [29]
El clima del Triásico era generalmente cálido y seco, formando areniscas rojas y evaporitas típicas . No hay evidencia de glaciación en ninguno de los polos o cerca de ellos; de hecho, las regiones polares eran aparentemente húmedas y templadas , un clima adecuado para criaturas similares a reptiles. El gran tamaño de Pangea limitó el efecto moderador del océano global; su clima continental era altamente estacional, con veranos muy calurosos e inviernos fríos . Probablemente tuvo fuertes monzones transecuatoriales . [ 41]
Como consecuencia de la extinción masiva P-Tr en la frontera del Pérmico y el Triásico , solo hay poco registro fósil de insectos, incluidos los escarabajos del Triásico Inferior. [42] Sin embargo, hay algunas excepciones, como en Europa del Este: en el sitio de Babiy Kamen en la cuenca de Kuznetsk se descubrieron numerosos fósiles de escarabajos, incluso especímenes completos de los infraórdenes Archostemata (es decir, Ademosynidae, Schizocoleidae), Adephaga (es decir, Triaplidae, Trachypachidae) y Polyphaga (es decir, Hydrophilidae, Byrrhidae, Elateroidea) y en una condición casi perfectamente conservada. [43] Sin embargo, las especies de las familias Cupedidae y Schizophoroidae no están presentes en este sitio, mientras que dominan en otros sitios fósiles del Triásico Inferior. Se conocen más registros de Khey-Yaga, Rusia, en la cuenca de Korotaikha. [29]
Alrededor de esta época, durante el Triásico Tardío, aparecen en el registro fósil especies de escarabajos micetófagos o que se alimentan de hongos (es decir, Cupedidae ). En las etapas del Triásico Superior comienzan a aparecer representantes de las especies algófagas o que se alimentan de algas (es decir, Triaplidae e Hydrophilidae ), así como escarabajos acuáticos depredadores. Aparecen los primeros gorgojos primitivos (es decir, Obrienidae), así como los primeros representantes de los escarabajos vagabundos (es decir, Staphylinidae ), que no muestran diferencias marcadas en el físico en comparación con las especies recientes. [29] Esta fue también la primera vez que apareció evidencia de una diversa fauna de insectos de agua dulce.
Algunas de las familias vivas más antiguas también aparecen durante el Triásico. Los hemípteros incluían a los cercópidos , los cicadélidos , los cixípidos y los membrácidos . Los coleópteros incluían a los carábidos , los estafilínidos y los traquipácidos . Los himenópteros incluían a los xiélidos . Los dípteros incluían a los anisópodos , los quironómidos y los tipúlidos . También aparecieron los primeros tisanópteros .
Las primeras especies verdaderas de dípteros se conocen del Triásico medio , y se extendieron durante el Triásico medio y superior. Se encontró una sola ala grande de una especie de dípteros del Triásico (10 mm en lugar de los 2-6 mm habituales) en Australia (Mt. Crosby). Esta familia Tilliardipteridae, a pesar de las numerosas características "tipuloideas", debería incluirse en Psychodomorpha sensu Hennig debido a la pérdida del margen distal convexo del ala 1A y la formación del asa anal. [44]
El Jurásico ( hace entre 201 y 145 millones de años ) fue importante para el desarrollo de las aves, uno de los principales depredadores de los insectos. Durante el Jurásico temprano, el supercontinente Pangea se dividió en el supercontinente norteño Laurasia y el supercontinente sur Gondwana ; el Golfo de México se abrió en la nueva grieta entre América del Norte y lo que ahora es la península de Yucatán en México . El océano Atlántico Norte del Jurásico era relativamente estrecho, mientras que el Atlántico Sur no se abrió hasta el siguiente período Cretácico, cuando el propio Gondwana se dividió. [45]
El clima global durante el Jurásico era cálido y húmedo. Al igual que en el Triásico, no había grandes masas de tierra situadas cerca de los casquetes polares y, en consecuencia, no existían capas de hielo interiores durante el Jurásico. Aunque algunas áreas de América del Norte y del Sur y África permanecieron áridas, grandes partes de las masas continentales eran exuberantes. La fauna laurasiática y gondwánica diferían considerablemente en el Jurásico Temprano. Más tarde se volvió más intercontinental y muchas especies comenzaron a extenderse globalmente. [29]
Existen muchos yacimientos importantes del Jurásico, con más de 150 yacimientos importantes con fósiles de escarabajos, la mayoría situados en Europa del Este y el norte de Asia. En América del Norte y especialmente en América del Sur y África, el número de yacimientos de ese período de tiempo es menor y los yacimientos aún no han sido investigados exhaustivamente. Los yacimientos fósiles destacados incluyen Solnhofen en la Alta Baviera, Alemania, [46] Karatau en el sur de Kazajstán , [47] la Formación Yixian en Liaoning , norte de China [48] así como la Formación Jiulongshan y otros yacimientos fósiles en Mongolia . En América del Norte solo hay unos pocos yacimientos con registros fósiles de insectos del Jurásico, a saber, los depósitos de caliza de concha en la cuenca de Hartford, la cuenca de Deerfield y la cuenca de Newark. [29] [49] Existen numerosos yacimientos de otros insectos en Europa y Asia. Incluyendo Grimmen y Solnhofen, Alemania; Solnhofen es famoso por los hallazgos de los primeros terópodos parecidos a las aves (es decir, Archaeopteryx ). Otros sitios incluyen Dorset , Inglaterra; Issyk-Kul , Kirguistán; y el sitio más productivo de todos, Karatau , Kazajstán. [ cita requerida ]
Durante el Jurásico hubo un aumento dramático en la diversidad conocida de los coleópteros a nivel de familia [ aclarar ] . [29] Esto incluye el desarrollo y crecimiento de especies carnívoras y herbívoras. Se cree que las especies de la superfamilia Chrysomeloidea se desarrollaron aproximadamente al mismo tiempo, que incluyen una amplia gama de plantas hospedantes que van desde cícadas y coníferas hasta angiospermas . [50] : 186 Cerca del Jurásico Superior, la porción de Cupedidae disminuyó, sin embargo, al mismo tiempo, la diversidad de las primeras especies que se alimentan de plantas, o fitófagas, aumentó. La mayoría de las especies fitófagas recientes de coleópteros se alimentan de plantas con flores o angiospermas.
El Cretácico ( hace entre 145 y 66 millones de años ) tuvo gran parte de la misma fauna de insectos que el Jurásico hasta mucho más tarde. Durante el Cretácico, el supercontinente Pangea , del Paleozoico tardío al Mesozoico temprano, completó su ruptura tectónica en los continentes actuales , aunque sus posiciones eran sustancialmente diferentes en ese momento. A medida que el océano Atlántico se ensanchaba, las orogenias de margen convergente que habían comenzado durante el Jurásico continuaron en la Cordillera de América del Norte , ya que la orogenia Nevadana fue seguida por las orogenias Sevier y Laramide . Aunque Gondwana todavía estaba intacta al comienzo del Cretácico, se rompió cuando Sudamérica , la Antártida y Australia se separaron de África (aunque India y Madagascar permanecieron unidas entre sí); por lo tanto, se formaron nuevamente los océanos Atlántico Sur e Índico . Tal rifting activo levantó grandes cadenas montañosas submarinas a lo largo de las crestas, elevando los niveles eustáticos del mar en todo el mundo. Al norte de África, el mar de Tetis siguió estrechándose. Mares anchos y poco profundos avanzaron a través del centro de América del Norte (la vía marítima interior occidental ) y Europa, para luego retroceder hacia el final del período, dejando gruesos depósitos marinos intercalados entre capas de carbón .
En el pico de la transgresión del Cretácico , un tercio de la superficie terrestre actual de la Tierra estaba sumergida. [51] La época berriasiana mostró una tendencia al enfriamiento que se había visto en la última época del Jurásico. Hay evidencia de que las nevadas eran comunes en las latitudes más altas y los trópicos se volvieron más húmedos que durante el Triásico y el Jurásico. [52] Sin embargo, la glaciación se limitó a los glaciares alpinos en algunas montañas de alta latitud , aunque la nieve estacional puede haber existido más al sur. El arrastre por hielo de piedras hacia entornos marinos ocurrió durante gran parte del Cretácico, pero la evidencia de deposición directamente de los glaciares se limita al Cretácico Inferior de la Cuenca de Eromanga en el sur de Australia. [53] [54]
Hay un gran número de yacimientos fósiles importantes en todo el mundo que contienen escarabajos del Cretácico. La mayoría de ellos se encuentran en Europa y Asia y pertenecen a la zona de clima templado durante el Cretácico. Algunos de los yacimientos fósiles mencionados en el capítulo Jurásico también arrojan algo de luz sobre la fauna de escarabajos del Cretácico temprano (por ejemplo, la formación Yixian en Liaoning, norte de China). [48] Otros yacimientos importantes del Cretácico Inferior incluyen los yacimientos fósiles de Crato en la cuenca de Araripe en Ceará , norte de Brasil, así como la formación Santana suprayacente, esta última situada cerca del paleoecuador, o la posición del ecuador de la Tierra en el pasado geológico según se define para un período geológico específico. En España hay yacimientos importantes cerca de Montsec y Las Hoyas . En Australia, son dignos de mención los yacimientos fósiles de Koonwarra del grupo Korumburra, South Gippsland , Victoria. Los sitios fósiles importantes del Cretácico Superior son Kzyl-Dzhar en el sur de Kazajstán y Arkagala en Rusia. [29]
Durante el Cretácico la diversidad de Cupedidae y Archostemata disminuyó considerablemente. Los escarabajos terrestres depredadores (Carabidae) y los escarabajos vagabundos (Staphylinidae) comenzaron a distribuirse en diferentes patrones: mientras que los Carabidae se encontraban predominantemente en las regiones cálidas, los Staphylinidae y los escarabajos chasqueadores (Elateridae) preferían muchas áreas con clima templado. Del mismo modo, las especies depredadoras de Cleroidea y Cucujoidea , cazaban sus presas bajo la corteza de los árboles junto con los escarabajos joya (Buprestidae). La diversidad de escarabajos joya aumentó rápidamente durante el Cretácico, ya que eran los principales consumidores de madera, [55] mientras que los escarabajos longicornios (Cerambycidae) eran bastante raros y su diversidad aumentó solo hacia el final del Cretácico Superior. [29] Los primeros escarabajos coprófagos se han registrado en el Cretácico Superior, [56] y se cree que vivían de los excrementos de los dinosaurios herbívoros, sin embargo, todavía existe una discusión sobre si los escarabajos siempre estuvieron ligados a los mamíferos durante su desarrollo. [57] Además, se encuentran las primeras especies con una adaptación tanto de las larvas como de los adultos al estilo de vida acuático. Los escarabajos remolinos (Gyrinidae) fueron moderadamente diversos, aunque otros escarabajos tempranos (es decir, Dytiscidae ) fueron menos, siendo los más extendidos las especies de Coptoclavidae , que se alimentaban de larvas de moscas acuáticas. [29]
Se conocen muchos fósiles de escarabajos de esta era, aunque la fauna de escarabajos del Paleoceno está comparativamente poco investigada. En contraste, el conocimiento sobre la fauna de escarabajos del Eoceno es muy bueno. La razón es la aparición de insectos fósiles en sedimentos de pizarra arcillosa y ámbar. El ámbar es resina de árbol fosilizada, lo que significa que consiste en compuestos orgánicos fosilizados, no minerales. Los diferentes ámbares se distinguen por la ubicación, la edad y la especie de planta productora de resina. Para la investigación sobre la fauna de escarabajos del Oligoceno, el ámbar del Báltico y de la República Dominicana es el más importante. [29] Incluso con el registro de fósiles de insectos en general deficiente, el depósito más diverso es el de la Formación Fur, Dinamarca; incluyendo hormigas gigantes y polillas primitivas ( Noctuidae ). [21] : 402
Las primeras mariposas son del Paleógeno Superior, mientras que la mayoría, como los escarabajos, ya tenían géneros recientes y las especies ya existían durante el Mioceno, sin embargo, su distribución difería considerablemente de la actual. [21] : 402
Los yacimientos más importantes de fósiles de escarabajos del Neógeno se encuentran en las zonas templadas cálidas y subtropicales. Muchos géneros y especies recientes ya existían durante el Mioceno, sin embargo, su distribución difería considerablemente de la actual. Uno de los yacimientos fósiles más importantes de insectos del Plioceno es Willershausen, cerca de Göttingen, Alemania, con fósiles de escarabajos excelentemente conservados de varias familias (escarabajos longicornios, gorgojos, mariquitas y otros), así como representantes de otros órdenes de insectos. [58] En la cantera de arcilla de Willershausen se han registrado hasta ahora 35 géneros de 18 familias de escarabajos, de los cuales seis géneros están extintos. [59] La fauna de escarabajos del Pleistoceno es relativamente bien conocida, ya que la composición de la fauna de escarabajos se ha utilizado para reconstruir las condiciones climáticas en las Montañas Rocosas y en Beringia, el antiguo puente terrestre entre Asia y América del Norte. [60] [61]

Un informe de noviembre de 2014 ubica inequívocamente a los insectos en un clado, con los remipedos como el clado hermano más cercano. [62] Este estudio resolvió la filogenia de los insectos de todos los órdenes de insectos existentes y proporciona "un árbol filogenético sólido y estimaciones temporales confiables de la evolución de los insectos". [62] Encontrar un respaldo sólido para los parientes vivos más cercanos de los hexápodos había resultado un desafío debido a las adaptaciones convergentes en varios grupos de artrópodos para vivir en la tierra. [63]
En 2008, investigadores de la Universidad de Tufts descubrieron lo que creen que es la impresión de cuerpo completo más antigua conocida del mundo de un insecto volador primitivo, un espécimen de 300 millones de años del Período Carbonífero . [65] El Rhyniognatha hirsti del Devónico , del sílex de Rhynie de 396 millones de años , se conoce solo por las mandíbulas y se considera el insecto más antiguo. Esta especie ya poseía mandíbulas dicondílicas (dos articulaciones en la mandíbula), una característica asociada con los insectos alados, lo que sugiere que las alas ya pueden haber evolucionado en este momento. Por lo tanto, si Rhyniognatha es un insecto volador real, los primeros insectos probablemente aparecieron antes, en el período Silúrico . [17] [66] Sin embargo, esta especie también se considera como miriápodo en estudios posteriores. [3] Ha habido cuatro superradiaciones de insectos: escarabajos (evolucionaron hace unos 300 millones de años ), moscas (evolucionaron hace unos 250 millones de años ), polillas y avispas (evolucionaron hace unos 150 millones de años ). [12] Estos cuatro grupos representan la mayoría de las especies descritas. Las moscas y polillas junto con las pulgas evolucionaron a partir de Mecoptera . Los orígenes del vuelo de los insectos siguen siendo oscuros, ya que los primeros insectos alados que se conocen actualmente parecen haber sido capaces de volar. Algunos insectos extintos tenían un par adicional de aletas adheridas al primer segmento del tórax, para un total de tres pares. No hay evidencia que sugiera que los insectos fueran un grupo de animales particularmente exitoso antes de que evolucionaran para tener alas. [12]
Los insectos son presas de una variedad de organismos, incluidos los vertebrados terrestres. Los primeros vertebrados en la tierra existieron hace 350 millones de años y eran grandes piscívoros anfibios ; a través de un cambio evolutivo gradual, la insectívora fue el siguiente tipo de dieta en evolucionar. [22] Los insectos estuvieron entre los primeros herbívoros terrestres y actuaron como principales agentes de selección en las plantas. [5] Las plantas desarrollaron defensas químicas contra esta herbivoría y los insectos, a su vez, desarrollaron mecanismos para lidiar con las toxinas de las plantas. [5] Estas toxinas limitan la amplitud de la dieta de los herbívoros, y la evolución de mecanismos para, no obstante, continuar con la herbivoría es una parte importante del mantenimiento de la amplitud de la dieta en los insectos, y así en su historia evolutiva en su conjunto. Tanto la pleiotropía como la epistasis tienen efectos complejos a este respecto: las simulaciones de Griswold 2006 muestran que más genes proporcionan el beneficio de más objetivos para las mutaciones adaptativas, mientras que Fisher 1930 mostró que una mutación puede mejorar un rasgo mientras que la epistasis hace que también desencadene efectos negativos, ralentizando la adaptación. [67]
Muchos insectos también hacen uso de estas toxinas para protegerse de sus depredadores. Estos insectos a menudo anuncian su toxicidad utilizando colores de advertencia. [5] Este exitoso patrón evolutivo también ha sido utilizado por los imitadores . Con el tiempo, esto ha dado lugar a grupos complejos de especies coevolucionadas. Por el contrario, algunas interacciones entre plantas e insectos, como la polinización , son beneficiosas para ambos organismos. La coevolución ha llevado al desarrollo de mutualismos muy específicos en dichos sistemas.
La sistemática tradicional basada en la morfología o la apariencia generalmente ha otorgado a Hexapoda el rango de superclase , [70] e identificado cuatro grupos dentro de ella: insectos (Ectognatha), colémbolos ( Collembola ), Protura y Diplura , los últimos tres se agrupan como Entognatha sobre la base de las partes bucales internalizadas. Las relaciones supraordinales han sufrido numerosos cambios con el advenimiento de métodos basados en la historia evolutiva y los datos genéticos. Una teoría reciente es que Hexapoda es polifilético (donde el último ancestro común no era miembro del grupo), y las clases de entognatos tienen historias evolutivas separadas de Insecta. [71] Se ha demostrado que muchos de los taxones tradicionales basados en la apariencia son parafiléticos, por lo que en lugar de usar rangos como subclase , superorden e infraorden , ha demostrado ser mejor usar agrupaciones monofiléticas (en las que el último ancestro común es miembro del grupo). A continuación se representan las agrupaciones monofiléticas mejor respaldadas para Insecta.
Los insectos se pueden dividir en dos grupos tratados históricamente como subclases: los insectos sin alas, conocidos como Apterygota , y los insectos alados, conocidos como Pterygota . Los Apterygota consisten en el orden primitivamente sin alas de los pececillos de plata (Thysanura). Archaeognatha compone los Monocondylia basándose en la forma de sus mandíbulas , mientras que Thysanura y Pterygota se agrupan juntos como Dicondylia. Es posible que los Thysanura en sí mismos no sean monofiléticos , y que la familia Lepidotrichidae sea un grupo hermano de los Dicondylia (Pterygota y el resto de Thysanura). [72] [73]
Paleoptera y Neoptera son los órdenes alados de insectos que se diferencian por la presencia de partes del cuerpo endurecidas llamadas escleritos ; también, en Neoptera, músculos que permiten que sus alas se plieguen planas sobre el abdomen. Neoptera puede dividirse además en grupos basados en metamorfosis incompleta ( Polineoptera y Paraneoptera ) y grupos basados en metamorfosis completa. Ha resultado difícil aclarar las relaciones entre los órdenes en Polyneoptera debido a nuevos hallazgos constantes que requieren la revisión de los taxones. Por ejemplo, Paraneoptera ha resultado estar más estrechamente relacionado con Endopterygota que con el resto de Exopterygota. El reciente hallazgo molecular de que los órdenes tradicionales de piojos Mallophaga y Anoplura se derivan de Psocoptera ha llevado al nuevo taxón Psocodea . [74] Se ha sugerido que Phasmatodea y Embiidina forman Eukinolabia. [75] Se cree que Mantodea, Blattodea e Isoptera forman un grupo monofilético denominado Dictyoptera . [76]
Es probable que Exopterygota sea parafilético con respecto a Endopterygota. Los asuntos que han generado mucha controversia incluyen Strepsiptera y Diptera agrupados juntos como Halteria con base en una reducción de uno de los pares de alas, una posición que no está bien respaldada en la comunidad entomológica. [77] Los Neuropterida a menudo se agrupan o dividen según los caprichos del taxónomo. Ahora se piensa que las pulgas están estrechamente relacionadas con los mecópteros boreidos . [78] Aún quedan muchas preguntas por responder cuando se trata de relaciones basales entre los órdenes de endopterigotes, particularmente los himenópteros.
El estudio de la clasificación o taxonomía de cualquier insecto se denomina entomología sistemática . Si se trabaja con un orden más específico o incluso con una familia, el término también puede hacerse específico para ese orden o familia, por ejemplo, dipterología sistemática .
Según la estimación filogenética, los primeros insectos posiblemente aparecieron en el período Silúrico y adquirieron alas en el Devónico. [16] [79]
La subclase Apterygota (insectos sin alas) se considera ahora artificial, ya que los pececillos de plata (orden Thysanura ) están más estrechamente relacionados con los Pterygota (insectos alados) que con los bichos (orden Archaeognatha ). Por ejemplo, al igual que los insectos voladores, Thysanura tiene las llamadas mandíbulas dicondílicas, mientras que Archaeognatha tiene mandíbulas monocondílicas. La razón de su parecido no se debe a una relación particularmente estrecha, sino más bien a que ambos han mantenido una anatomía primitiva y original en un grado mucho mayor que los insectos alados. El orden más primitivo de insectos voladores, las efímeras ( Ephemeroptera ), son también los que son más similares morfológica y fisiológicamente a estos insectos sin alas. Algunas ninfas de efímera se parecen a los tisanuros acuáticos.
Los modernos Archaeognatha y Thysanura aún tienen apéndices rudimentarios en su abdomen llamados estiletes, mientras que los insectos más primitivos y extintos conocidos como Monura tenían apéndices abdominales mucho más desarrollados. Los segmentos abdominales y torácicos en el ancestro terrestre más temprano de los insectos habrían sido más similares entre sí de lo que son hoy, y la cabeza tenía ojos compuestos bien desarrollados y antenas largas . Su tamaño corporal aún no se conoce. Como el grupo más primitivo hoy, Archaeognatha, es más abundante cerca de las costas, podría significar que este era el tipo de hábitat donde los ancestros de los insectos se volvieron terrestres. Pero esta especialización en nichos costeros también podría tener un origen secundario, al igual que su locomoción saltando , ya que son los Thysanura reptantes los que se consideran más originales ( plesiomórficos ). Al observar cómo las branquias de libro de los quelicerados primitivos (que aún se ven en los cangrejos herradura ) evolucionaron en pulmones de libro en arañas primitivas y finalmente en tráqueas en arañas más avanzadas (la mayoría de ellas todavía tienen un par de pulmones de libro intactos también), es posible que la tráquea de los insectos se haya formado de manera similar, modificando las branquias en la base de sus apéndices.
Hasta el momento, ninguna investigación publicada sugiere que los insectos fueran un grupo particularmente exitoso antes de la evolución de las alas . [80]
Los odonatos (libélulas) también son buenos candidatos como el miembro vivo más antiguo de los pterigotos . Las efímeras son morfológica y fisiológicamente más basales, pero las características derivadas de las libélulas podrían haber evolucionado independientemente en su propia dirección durante mucho tiempo. Parece que los órdenes con ninfas o larvas acuáticas se vuelven evolutivamente conservadores una vez que se adaptaron al agua. Si las efímeras llegaron al agua primero, esto podría explicar en parte por qué son más primitivas que las libélulas, incluso si estas tienen un origen más antiguo. De manera similar, las moscas de piedra conservan los rasgos más basales de los neópteros , pero no fueron necesariamente el primer orden en ramificarse. Esto también hace menos probable que un ancestro acuático tuviera el potencial evolutivo para dar lugar a todas las diferentes formas y especies de insectos que conocemos hoy.
Las ninfas de las libélulas tienen una "máscara" labial única que utilizan para atrapar a sus presas, y el imago tiene una forma única de copular, utilizando un órgano sexual masculino secundario en el segundo segmento abdominal. Parece que los apéndices abdominales modificados para la transferencia de esperma y la inseminación directa han aparecido al menos dos veces en la evolución de los insectos, una vez en los odonatos y otra en los demás insectos voladores. Si estos dos métodos diferentes son las formas originales de copular de cada grupo, es una fuerte indicación de que son las libélulas las más antiguas, no las efímeras. Todavía no hay acuerdo sobre esto. Otro escenario es que los apéndices abdominales adaptados para la inseminación directa hayan evolucionado tres veces en los insectos: una vez en los odonatos, una vez en las efímeras y una vez en los neópteros, y que tanto las efímeras como los neópteros hayan elegido la misma solución. Si es así, sigue siendo posible que las efímeras sean el orden más antiguo entre los insectos voladores. Se supone que el poder de volar ha evolucionado sólo una vez, lo que sugiere que el esperma todavía se transfería indirectamente en los primeros insectos voladores.
Un posible escenario de cómo evolucionó la inseminación directa en los insectos se ve en los escorpiones . El macho deposita un espermatóforo en el suelo, entrelaza sus garras con las de la hembra y luego la guía sobre su paquete de esperma, asegurándose de que entre en contacto con su abertura genital. Cuando los primeros insectos (machos) depositaron sus espermatóforos en el suelo, parece probable que algunos de ellos usaran los órganos de agarre al final de su cuerpo para arrastrar a la hembra sobre el paquete. Los antepasados de los odonatos desarrollaron el hábito de agarrar a la hembra por detrás de su cabeza, como todavía lo hacen hoy. Esta acción, en lugar de no agarrar a la hembra en absoluto, habría aumentado las posibilidades del macho de propagar sus genes. Las posibilidades aumentarían aún más si primero fijaran su espermatóforo de forma segura en su propio abdomen antes de colocar sus pinzas abdominales detrás de la cabeza de la hembra; entonces, el macho no soltaría a la hembra antes de que su abdomen hubiera hecho contacto directo con su almacenamiento de esperma, lo que permitiría la transferencia de todo el esperma.
Esto también supuso una mayor libertad a la hora de buscar una hembra, ya que los machos podían transportar el paquete de esperma a otro lugar si la primera hembra se escapaba. Esta capacidad eliminaría la necesidad de esperar a otra hembra en el lugar donde se había depositado el paquete de esperma o de producir un nuevo paquete, desperdiciando energía. Otras ventajas incluyen la posibilidad de aparearse en otros lugares más seguros que el suelo llano, como en árboles o arbustos.
Si los ancestros de los demás insectos voladores hubieran desarrollado el mismo hábito de abrazar a la hembra y arrastrarla sobre su espermatóforo, pero posterior en lugar de anterior como lo hace el Odonata, sus genitales estarían muy cerca uno del otro. Y a partir de ahí, sería un paso muy corto modificar los apéndices vestigiales cerca de la abertura genital masculina para transferir el esperma directamente a la hembra. Los mismos apéndices que usan los Odonata macho para transferir su esperma a sus órganos sexuales secundarios en la parte delantera de su abdomen. Todos los insectos con un estado ninfal o larvario acuático parecen haberse adaptado al agua de forma secundaria a partir de ancestros terrestres. De los insectos más primitivos sin alas en absoluto, Archaeognatha y Thysanura , todos los miembros viven todo su ciclo de vida en entornos terrestres. Como se mencionó anteriormente, Archaeognatha fue el primero en separarse de la rama que dio lugar a los insectos alados ( Pterygota ), y luego se ramificó Thysanura. Esto indica que estos tres grupos (Archaeognatha, Thysanura y Pterygota) tienen un ancestro terrestre común, que probablemente se parecía a un modelo primitivo de Apterygota, era un generalista oportunista y depositaba espermatóforos en el suelo en lugar de copular, como lo hacen los Thysanura todavía hoy. Si tenía hábitos alimentarios similares a la mayoría de los apterigotos de la actualidad, vivía principalmente como descomponedor .
Sería de esperar que un artrópodo que respira branquias modificara sus branquias para respirar aire si se estuviera adaptando a entornos terrestres, y no que desarrollara nuevos órganos respiratorios de abajo hacia arriba junto a los originales y aún funcionales. Además, las branquias de los insectos (larvas y ninfas) son en realidad parte de un sistema traqueal modificado y cerrado especialmente adaptado al agua, llamado branquias traqueales. Las tráqueas de los artrópodos solo pueden surgir en una atmósfera y como consecuencia de las adaptaciones de la vida en la tierra. Esto también indica que los insectos descienden de un ancestro terrestre.
Y finalmente, si nos fijamos en los tres insectos más primitivos con ninfas acuáticas (llamadas náyades: Ephemeroptera , Odonata y Plecoptera ), cada orden tiene su propio tipo de branquias traqueales que son tan diferentes entre sí que deben tener orígenes separados. Esto sería de esperar si evolucionaron a partir de especies terrestres. Esto significa que una de las partes más interesantes de la evolución de los insectos es lo que ocurrió entre la división de Thysanura-Pterygota y el primer vuelo.
El origen del vuelo de los insectos sigue siendo un misterio, ya que los primeros insectos alados que se conocen en la actualidad parecen haber sido capaces de volar. Algunos insectos extintos (por ejemplo, los paleodictiópteros ) tenían un par adicional de aletas adheridas al primer segmento del tórax , lo que suma un total de tres pares.
A veces se dice que las alas en sí son branquias (traqueales) altamente modificadas. [81] Al comparar un par de láminas branquiales bien desarrolladas en las náyades de efímeras y un par reducido de alas traseras en los adultos, no es difícil imaginar que las branquias de efímeras (tergalias) y las alas de los insectos tienen un origen común, y las investigaciones más recientes también lo respaldan. [82] [83] En concreto, la investigación genética sobre las efímeras ha revelado que las branquias y las alas de los insectos pueden haberse originado a partir de las patas de los insectos. [84] Las tergalias no se encuentran en ningún otro orden de insectos, y han evolucionado en diferentes direcciones con el tiempo. En algunas ninfas/náyades, el par más anterior se ha esclerotizado y funciona como una cubierta branquial para el resto de las branquias. Otras pueden formar una ventosa grande, usarse para nadar o modificarse en otras formas. Pero eso no tiene por qué significar necesariamente que estas estructuras fueran originalmente branquias. También podría significar que las tergalias evolucionaron a partir de las mismas estructuras que dieron origen a las alas, y que los insectos voladores evolucionaron a partir de una especie terrestre sin alas con pares de placas en sus segmentos corporales: tres en el tórax y nueve en el abdomen (existen ninfas de efímeras con nueve pares de tergalias en el abdomen, pero hasta ahora no se han encontrado insectos vivos o extintos con placas en los dos últimos segmentos). Si se tratara de branquias primarias, sería un misterio por qué habrían esperado tanto tiempo para ser modificadas cuando vemos las diferentes modificaciones en las ninfas de efímeras modernas.
Cuando surgieron los primeros bosques en la Tierra, se crearon nuevos nichos para los animales terrestres. Los animales que se alimentaban de esporas y otros que dependían de las plantas y/o de los animales que vivían a su alrededor también tendrían que adaptarse para hacer uso de ellas. En un mundo sin animales voladores, probablemente sería solo cuestión de tiempo antes de que algunos artrópodos que vivían en los árboles desarrollaran estructuras pareadas con inserciones musculares de su exoesqueleto y las usaran para planear, un par en cada segmento. Una evolución posterior en esta dirección daría lugar a estructuras de planeo más grandes en el tórax y, gradualmente, a estructuras más pequeñas en el abdomen . Sus cuerpos se habrían vuelto más rígidos, mientras que los tisanuros , que nunca desarrollaron el vuelo, mantuvieron su abdomen flexible.
Las ninfas de efímeras debieron adaptarse al agua mientras aún tenían intactos los "planeadores" de su abdomen. Hasta ahora tampoco hay evidencia concreta que respalde esta teoría, pero es una de las que ofrece una explicación a los problemas de por qué los animales supuestamente acuáticos evolucionaron en la dirección en que lo hicieron.
Los insectos saltadores y arbóreos parecen una buena explicación de este proceso evolutivo por varias razones. Como los primeros insectos alados carecían del sofisticado mecanismo de plegado de las alas de los insectos neópteros , debieron vivir al aire libre y no pudieron esconderse ni buscar comida debajo de las hojas, en las grietas, bajo las rocas y otros espacios reducidos similares. En estos bosques antiguos había pocos lugares abiertos donde los insectos con enormes estructuras en la espalda pudieran haber vivido sin experimentar enormes desventajas. Si los insectos adquirieron sus alas en la tierra y no en el agua, lo que claramente parece ser el caso, las copas de los árboles serían el lugar más obvio donde pudieron haber surgido tales estructuras planeadoras, en una época en la que el aire era un territorio nuevo.
La pregunta es si las placas utilizadas para planear evolucionaron desde cero o modificando detalles anatómicos ya existentes. Se sabe que el tórax de Thysanura y Archaeognatha tiene algunas estructuras conectadas a su tráquea que comparten similitudes con las alas de los insectos primitivos. Esto sugiere que el origen de las alas y los espiráculos están relacionados.
El planeo requiere modificaciones corporales universales, como se observa en los vertebrados actuales , como algunos roedores y marsupiales , que han desarrollado extensiones de piel anchas y planas para este propósito. Los dragones voladores (género Draco ) de Indonesia han modificado sus costillas para convertirlas en planeadores, e incluso algunas serpientes pueden planear por el aire extendiendo sus costillas. La principal diferencia es que mientras los vertebrados tienen un esqueleto interno , los insectos primitivos tenían un exoesqueleto flexible y adaptativo.
Algunos animales vivirían en los árboles, ya que los animales siempre están aprovechando todos los nichos disponibles , tanto para alimentarse como para protegerse. En esa época, los órganos reproductores eran, con diferencia, la parte más nutritiva de la planta, y estas primeras plantas muestran signos de consumo de artrópodos y adaptaciones para protegerse, por ejemplo, colocando sus órganos reproductores lo más alto posible. Pero siempre habrá algunas especies que podrán hacer frente a eso siguiendo su fuente de alimento hasta los árboles. Sabiendo que los insectos eran terrestres en esa época y que algunos artrópodos (como los insectos primitivos) vivían en las copas de los árboles, parece menos probable que hubieran desarrollado sus alas en el suelo o en el agua.
En un entorno tridimensional como los árboles, la capacidad de planear aumentaría las posibilidades de los insectos de sobrevivir a una caída, además de ahorrar energía. Este rasgo se ha repetido en especies modernas sin alas, como las hormigas planeadoras que viven una vida arbórea. Cuando se originó la capacidad de planear, el siguiente paso lógico sería el de planear y saltar, lo que finalmente se reflejaría en su diseño anatómico. La necesidad de navegar a través de la vegetación y aterrizar de forma segura implicaría un buen control muscular sobre las protoalas, y las mejoras posteriores conducirían finalmente a alas verdaderas (pero primitivas). Si bien el tórax obtuvo las alas, un abdomen largo podría haber servido como estabilizador en el vuelo.
Algunos de los primeros insectos voladores eran grandes depredadores: se trataba de un nuevo nicho ecológico. Algunas de las presas eran sin duda otros insectos, ya que los insectos con protoalas se habrían propagado a otras especies incluso antes de que las alas estuvieran completamente desarrolladas. A partir de ese momento, la carrera armamentística pudo continuar: la misma coevolución depredador/presa que ha existido desde que existen depredadores y presas en la Tierra; tanto los cazadores como las presas necesitaban mejorar y ampliar aún más sus habilidades de vuelo para mantenerse al nivel de los demás.
Los insectos que habían desarrollado sus protoalas en un mundo sin depredadores voladores podían permitirse el lujo de exponerse abiertamente sin riesgo, pero esto cambió cuando evolucionaron los insectos voladores carnívoros. Se desconoce cuándo evolucionaron por primera vez, pero una vez que estos depredadores habían surgido, ejercieron una fuerte presión selectiva sobre sus víctimas y sobre ellos mismos. Las presas que dieron con una buena solución sobre cómo plegar sus alas sobre la espalda de una manera que les permitiera vivir en espacios estrechos no solo podrían esconderse de los depredadores voladores (y de los depredadores terrestres si estaban en el suelo), sino también explotar una amplia variedad de nichos que estaban cerrados para quienes no podían plegar sus alas de esta manera. Y hoy en día los insectos neópteros (aquellos que pueden plegar sus alas hacia atrás sobre el abdomen) son, con diferencia, el grupo de insectos más dominante.
La teoría del roce con el agua sugiere que el roce con la superficie del agua es el origen del vuelo de los insectos. [85] Esta teoría se basa en el hecho de que se piensa que los que pueden ser los primeros insectos fósiles, el Rhyniognatha hirsti del Devónico (aunque puede estar más cerca de los miriápodos), poseían alas, aunque los lazos evolutivos más cercanos de los insectos son con los crustáceos, que son acuáticos.
Otro rasgo primitivo de las efímeras es el subimago ; ningún otro insecto posee esta etapa alada pero sexualmente inmadura. Unas pocas especies especializadas tienen hembras sin subimago, pero conservan la etapa subimago para los machos.
Las razones por las que el subimago todavía existe en este orden podrían ser que nunca ha habido suficiente presión selectiva para deshacerse de él; también parece especialmente adaptado para hacer la transición del agua al aire.
Los genitales masculinos no son completamente funcionales en este momento. Una razón para esto podría ser que la modificación de los apéndices abdominales en órganos de cópula masculinos surgió más tarde que la evolución del vuelo. Esto se indica por el hecho de que las libélulas tienen un órgano de cópula diferente al de otros insectos.
Como sabemos, en las efímeras las ninfas y los adultos están especializados en dos formas de vida diferentes: en el agua y en el aire. El único estadio ( instar ) intermedio entre estos dos es el subimago. En las formas fósiles más primitivas, los individuos preadultos no tenían un solo instar sino numerosos (mientras que los subimagos modernos no comen, las especies más antiguas y primitivas con subimagos probablemente también se alimentaban en esta fase de la vida, ya que las líneas entre los instares eran mucho más difusas y graduales que hoy). La forma adulta se alcanzaba varias mudas antes de la madurez. Probablemente no tuvieran más instares después de alcanzar la madurez completa. Esta forma de maduración es la que llevan a cabo los apterigotos , que mudan incluso cuando son adultos, pero no los insectos alados.
Las efímeras modernas han eliminado todos los estadios entre imago y ninfa, excepto el estadio único llamado subimago, que aún no ha alcanzado (al menos no en los machos) la madurez sexual completa. Los demás insectos voladores con metamorfosis incompleta ( Exopterygota ) han ido un poco más allá y han completado la tendencia; aquí todas las estructuras inmaduras del animal de la última etapa ninfal se completan de una sola vez en una única muda final. Los insectos más avanzados con larvas y metamorfosis completa ( Endopterygota ) han ido aún más lejos. Una teoría interesante es que la etapa de pupa es en realidad una etapa muy modificada y extendida de subimago, pero hasta ahora no es más que una teoría. Hay algunos insectos dentro de Exopterygota, trips y moscas blancas ( Aleyrodidae ), que también han desarrollado etapas similares a las pupas.
El ancestro lejano de los insectos voladores, una especie con protoalas primitivas, tenía un ciclo de vida más o menos ametábolo y estadios básicamente del mismo tipo que los tisanuros, sin estadios definidos de ninfa, subimago o adulto a medida que el individuo envejecía. Los individuos se desarrollaban gradualmente a medida que crecían y mudaban, pero probablemente sin grandes cambios entre estadios.
Las ninfas de efímeras modernas no adquieren branquias hasta después de su primera muda. Antes de esta etapa son tan pequeñas que no necesitan branquias para extraer oxígeno del agua. Esto podría ser un rasgo del ancestro común de todos los insectos voladores. Un insecto terrestre primitivo no habría necesitado excrecencias pareadas del cuerpo antes de comenzar a vivir en los árboles (o en el agua, para el caso), por lo que no tendría ninguna.
Esto también afectaría la apariencia de sus crías en los estadios iniciales, pareciéndose a las generaciones ametabolas anteriores incluso después de que hubieran comenzado a adaptarse a una nueva forma de vida, en un hábitat donde realmente podrían tener algún uso útil para las aletas a lo largo de su cuerpo. Dado que maduraron de la misma manera que los tisanuros con muchas mudas a medida que crecían y muy poca diferencia entre los adultos y los individuos mucho más jóvenes (a diferencia de los insectos modernos, que son hemimetábolos u holometábolos ), probablemente no hubo tanto espacio para la adaptación a diferentes nichos dependiendo de la edad y la etapa. Además, habría sido difícil para un animal ya adaptado a un nicho hacer un cambio a un nuevo nicho más tarde en la vida basándose solo en diferencias de edad o tamaño cuando estas diferencias no eran significativas.
Así, los protoinsectos tuvieron que especializarse y centrar toda su existencia en mejorar un estilo de vida único en un nicho particular. Cuanto más antiguas eran las especies y los individuos individuales, más se diferenciaban de su forma original, pues se adaptaban a su nuevo estilo de vida mejor que las generaciones anteriores. La estructura corporal final ya no se lograba mientras todavía estaban dentro del huevo, sino que continuaba desarrollándose durante la mayor parte de la vida, lo que causaba una diferencia mayor entre los individuos más jóvenes y los más viejos. Suponiendo que los individuos maduros probablemente dominaron su nuevo elemento mejor que las ninfas que tenían el mismo estilo de vida, parecería ser una ventaja si los miembros inmaduros de la especie alcanzaran la forma y la figura adultas lo antes posible. Esto puede explicar por qué desarrollaron menos estadios pero más intensos y un mayor enfoque en el cuerpo adulto, y con mayores diferencias entre los adultos y los primeros estadios, en lugar de simplemente crecer gradualmente como lo habían hecho las generaciones anteriores. Esta tendencia evolutiva explica cómo pasaron de insectos ametábolos a hemimetábolos.
Alcanzar la madurez y un cuerpo completamente desarrollado se convirtió en solo una parte del proceso de desarrollo; gradualmente emergieron una nueva anatomía y nuevas habilidades, solo posibles en las etapas posteriores de la vida. La anatomía con la que nacieron y crecieron los insectos tenía limitaciones que los adultos que habían aprendido a volar no padecían. Si no pudieron vivir su vida temprana como lo hicieron los adultos, los individuos inmaduros tuvieron que adaptarse a la mejor forma de vivir y sobrevivir a pesar de sus limitaciones hasta que llegó el momento en que pudieron dejarlas atrás. Este sería un punto de partida en la evolución donde las imago y las ninfas comenzaron a vivir en diferentes nichos, algunos más claramente definidos que otros. Además, una anatomía, tamaño y madurez finales alcanzados a la vez con una única etapa ninfal final significaba menos pérdida de tiempo y energía, y también [ cita requerida ] hizo que la estructura corporal adulta fuera más compleja. Obviamente, estas estrategias se volvieron muy exitosas con el tiempo.