
La química organofluorada describe la química de los compuestos organofluorados , compuestos orgánicos que contienen un enlace carbono-flúor . Los compuestos organofluorados encuentran diversas aplicaciones que van desde repelentes de aceite y agua hasta productos farmacéuticos , refrigerantes y reactivos en catálisis . Además de estas aplicaciones, algunos compuestos organofluorados son contaminantes debido a sus contribuciones al agotamiento del ozono , el calentamiento global , la bioacumulación y la toxicidad . El área de la química organofluorada a menudo requiere técnicas especiales asociadas con el manejo de agentes fluorados.
El flúor tiene varias diferencias distintivas con respecto a todos los demás sustituyentes que se encuentran en las moléculas orgánicas. Como resultado, las propiedades físicas y químicas de los organofluorados pueden ser distintivas en comparación con otros organohalógenos .
En comparación con los cloruros y bromuros de arilo, los fluoruros de arilo forman reactivos de Grignard sólo de mala gana. Por otro lado, los fluoruros de arilo, por ejemplo, fluoroanilinas y fluorofenoles , a menudo sufren sustitución nucleofílica de manera eficiente. [ cita necesaria ]
Formalmente, los fluorocarbonos sólo contienen carbono y flúor. A veces se les llama perfluorocarbonos. Pueden ser gases, líquidos, ceras o sólidos, según su peso molecular. El fluorocarbono más simple es el gas tetrafluorometano (CF 4 ). Los líquidos incluyen perfluorooctano y perfluorodecalina. Mientras que los fluorocarbonos con enlaces simples son estables, los fluorocarbonos insaturados son más reactivos, especialmente aquellos con enlaces triples. Los fluorocarbonos son más estables química y térmicamente que los hidrocarburos, lo que refleja la relativa inercia del enlace CF. También son relativamente lipofóbicos . Debido a las reducidas interacciones intermoleculares de Van der Waals , los compuestos a base de fluorocarbonos a veces se utilizan como lubricantes o son muy volátiles. Los líquidos de fluorocarbono tienen aplicaciones médicas como portadores de oxígeno. [ cita necesaria ]
La estructura de los compuestos organofluorados puede ser distintiva. Como se muestra a continuación, los compuestos alifáticos perfluorados tienden a segregarse de los hidrocarburos. Este "efecto similar se disuelve" está relacionado con la utilidad de las fases fluoradas y el uso de PFOA en el procesamiento de fluoropolímeros. A diferencia de los derivados alifáticos, los derivados perfluoroaromáticos tienden a formar fases mixtas con compuestos aromáticos no fluorados, como resultado de interacciones donador-aceptor entre los sistemas pi.


Los compuestos organofluorados poliméricos son numerosos y comercialmente importantes. Varían desde especies totalmente fluoradas, por ejemplo, PTFE, hasta especies parcialmente fluoradas, por ejemplo, fluoruro de polivinilideno ([CH 2 CF 2 ] n ) y policlorotrifluoroetileno ([CFClCF 2 ] n ). El fluoropolímero politetrafluoroetileno (PTFE/Teflón) es un sólido. [ cita necesaria ]
Los hidrofluorocarbonos (HFC), compuestos orgánicos que contienen átomos de flúor e hidrógeno, son el tipo más común de compuestos organofluorados. Se utilizan comúnmente en aire acondicionado y como refrigerantes [4] en lugar de los clorofluorocarbonos más antiguos , como el R-12 , y los hidroclorofluorocarbonos, como el R-21 . No dañan tanto la capa de ozono como los compuestos que reemplazan; sin embargo, sí contribuyen al calentamiento global . Sus concentraciones atmosféricas y su contribución a las emisiones antropogénicas de gases de efecto invernadero están aumentando rápidamente, lo que genera preocupación internacional sobre su forzamiento radiativo .
Los fluorocarbonos con pocos enlaces CF se comportan de manera similar a los hidrocarburos originales, pero su reactividad puede alterarse significativamente. Por ejemplo, tanto el uracilo como el 5-fluorouracilo son sólidos cristalinos incoloros y de alto punto de fusión, pero este último es un potente fármaco anticancerígeno. El uso del enlace CF en productos farmacéuticos se basa en esta reactividad alterada. [5] Varios medicamentos y agroquímicos contienen solo un centro de flúor o un grupo trifluorometilo .
A diferencia de otros gases de efecto invernadero del Acuerdo de París , los hidrofluorocarbonos tienen otras negociaciones internacionales. [6]
En septiembre de 2016, la llamada Declaración de Nueva York instó a una reducción global en el uso de HFC. [7] El 15 de octubre de 2016, debido a la contribución de estos químicos al cambio climático , los negociadores de 197 naciones reunidas en la cumbre del Programa de las Naciones Unidas para el Medio Ambiente en Kigali, Ruanda, alcanzaron un acuerdo legalmente vinculante para eliminar gradualmente los hidrofluorocarbonos (HFC) en un enmienda al Protocolo de Montreal . [8] [9] [10]
Como se indica a lo largo de este artículo, los sustituyentes de flúor conducen a una reactividad que difiere mucho de la química orgánica clásica. El principal ejemplo es el difluorocarbeno , CF 2 , que es un singlete mientras que el carbeno (CH 2 ) tiene un estado fundamental triplete . [11] Esta diferencia es significativa porque el difluorocarbeno es un precursor del tetrafluoroetileno .
Los compuestos perfluorados son derivados de fluorocarbonos, ya que están estrechamente relacionados estructuralmente con los fluorocarbonos. Sin embargo, también poseen nuevos átomos como el nitrógeno , el yodo o grupos iónicos, como los ácidos carboxílicos perfluorados .
Los compuestos organofluorados se preparan mediante numerosas rutas, dependiendo del grado y la regioquímica de fluoración buscada y la naturaleza de los precursores. La fluoración directa de hidrocarburos con F 2 , a menudo diluido con N 2 , es útil para compuestos altamente fluorados:
Sin embargo, estas reacciones suelen ser no selectivas y requieren cuidado porque los hidrocarburos pueden "quemarse" incontrolablemente en F.
2, análogo a la combustión de hidrocarburos en O
2. Por este motivo, se han desarrollado metodologías alternativas de fluoración. Generalmente, estos métodos se clasifican en dos clases.
La fluoración electrofílica se basa en fuentes de "F + ". A menudo estos reactivos presentan enlaces NF, por ejemplo F-TEDA-BF 4 . La fluoración asimétrica, en la que sólo uno de los dos posibles productos enantioméricos se genera a partir de un sustrato proquiral, se basa en reactivos de fluoración electrófilos. [12] Un ejemplo ilustrativo de este enfoque es la preparación de un precursor de agentes antiinflamatorios: [13]
Un método especializado pero importante de fluoración electrófila implica la electrosíntesis . El método se utiliza principalmente para perfluorar, es decir, sustituir todos los enlaces C-H por enlaces C-F. El hidrocarburo se disuelve o suspende en HF líquido y la mezcla se electroliza a 5-6 V utilizando ánodos de Ni . [14] El método se demostró por primera vez con la preparación de perfluoropiridina ( C
5F
5N ) de piridina ( C
5h
5norte ). Se han descrito varias variaciones de esta técnica, incluido el uso de bifluoruro de potasio fundido o disolventes orgánicos .
La principal alternativa a la fluoración electrófila es la fluoración nucleófila utilizando reactivos que son fuentes de "F - ", para el desplazamiento nucleofílico típicamente de cloruro y bromuro. Las reacciones de metátesis que emplean fluoruros de metales alcalinos son las más simples. [15] Para los compuestos alifáticos, esto a veces se denomina reacción de Finkelstein , mientras que para los compuestos aromáticos se conoce como proceso Halex .
Los monofluoruros de alquilo se pueden obtener a partir de alcoholes y reactivo de Olah (fluoruro de piridinio) u otros agentes fluorantes.
La descomposición de tetrafluoroboratos de arildiazonio en las reacciones de Sandmeyer [16] o Schiemann explota los fluoroboratos como fuentes de F − .
Aunque el fluoruro de hidrógeno puede parecer un nucleófilo improbable, es la fuente más común de fluoruro en la síntesis de compuestos organofluorados. Estas reacciones suelen estar catalizadas por fluoruros metálicos como el trifluoruro de cromo. El 1,1,1,2-tetrafluoroetano , un sustituto de los CFC, se prepara industrialmente utilizando este método: [17]
Observe que esta transformación implica dos tipos de reacción, metátesis (reemplazo de Cl − por F − ) e hidrofluoración de un alqueno .
La desoxofluoración convierte una variedad de grupos que contienen oxígeno en fluoruros. El reactivo habitual es el tetrafluoruro de azufre :
Una alternativa más conveniente al SF 4 es el trifluoruro de dietilaminoazufre , que es un líquido mientras que el SF 4 es un gas corrosivo: [18] [19]
Además de DAST, existe una amplia variedad de reactivos similares, que incluyen, entre otros, fluoruro de 2-piridinsulfonilo (PyFluor) y fluoruro de N -tosil-4-clorobencenosulfonimidoilo (SulfoxFluor). [20] Muchos de estos muestran propiedades mejoradas, como un mejor perfil de seguridad, mayor estabilidad termodinámica, facilidad de manejo, alta enantioselectividad y selectividad sobre las reacciones secundarias de eliminación. [21] [22]
Muchos compuestos organofluorados se generan a partir de reactivos que liberan grupos perfluoroalquilo y perfluoroarilo. Como fuente del grupo trifluorometilo se utiliza, por ejemplo, (trifluorometil)trimetilsilano, CF 3 Si (CH 3 ) 3 . [23] Entre los componentes básicos fluorados disponibles se encuentran CF 3 X (X = Br, I), C 6 F 5 Br y C 3 F 7 I. Estas especies forman reactivos de Grignard que luego pueden tratarse con una variedad de electrófilos . El desarrollo de tecnologías fluoradas (ver más abajo, en disolventes) está conduciendo al desarrollo de reactivos para la introducción de "colas fluoradas".
Una aplicación especial pero significativa del enfoque de los bloques de construcción fluorados es la síntesis de tetrafluoroetileno , que se produce industrialmente a gran escala mediante la intermediación del difluorocarbeno. El proceso comienza con la deshidrocloración térmica (600-800 °C) del clorodifluorometano : [5]
El fluorodicloroacetato de sodio (CAS# 2837-90-3) se utiliza para generar clorofluorocarbeno, para ciclopropanaciones.
La utilidad de los radiofármacos que contienen flúor en la tomografía por emisión de positrones 18 F ha motivado el desarrollo de nuevos métodos para formar enlaces C-F. Debido a la corta vida media del 18 F, estas síntesis deben ser muy eficientes, rápidas y sencillas. [24] Un ejemplo ilustrativo de los métodos es la preparación de glucosa modificada con fluoruro mediante el desplazamiento de un triflato por un nucleófilo de fluoruro marcado:
Se han encontrado organofluorados sintetizados biológicamente en microorganismos y plantas, pero no en animales. [25] El ejemplo más común es el fluoroacetato, que se presenta como defensa de las plantas contra los herbívoros en al menos 40 plantas en Australia, Brasil y África. [26] Otros organofluorados sintetizados biológicamente incluyen ácidos grasos ω-fluoro , fluoroacetona y 2-fluorocitrato , que se cree que se biosintetizan en vías bioquímicas a partir del fluoroacetaldehído intermedio. [25] La adenosil-fluoruro sintasa es una enzima capaz de sintetizar biológicamente el enlace carbono-flúor. [27] Los enlaces carbono-flúor creados por el hombre se encuentran comúnmente en productos farmacéuticos y agroquímicos porque añaden estabilidad a la estructura del carbono; Además, el tamaño relativamente pequeño del flúor es conveniente ya que el flúor actúa como un bioisóstero aproximado del hidrógeno. Introducir el enlace carbono-flúor en compuestos orgánicos es el mayor desafío para los químicos medicinales que utilizan la química organofluorada, ya que el enlace carbono-flúor aumenta la probabilidad de tener un fármaco exitoso en aproximadamente un factor de diez. [28] Se estima que el 20% de los productos farmacéuticos y el 30-40% de los agroquímicos son organofluorados, incluidos varios de los principales fármacos. [28] Los ejemplos incluyen 5-fluorouracilo , fluoxetina (Prozac), paroxetina (Paxil), ciprofloxacina (Cipro), mefloquina y fluconazol .
La química organofluorada afecta muchas áreas de la vida cotidiana y la tecnología. El enlace CF se encuentra en productos farmacéuticos , agroquímicos , fluoropolímeros , refrigerantes , tensioactivos , anestésicos , oleorrepelentes , catálisis y repelentes de agua , entre otros.
El enlace carbono-flúor se encuentra comúnmente en productos farmacéuticos y agroquímicos porque generalmente es metabólicamente estable y el flúor actúa como bioisóstero del átomo de hidrógeno . Se estima que 1/5 de los productos farmacéuticos contienen flúor, incluidos varios de los medicamentos más importantes. [29] Los ejemplos incluyen 5-fluorouracilo , flunitrazepam (Rohypnol), fluoxetina (Prozac), paroxetina (Paxil), ciprofloxacina (Cipro), mefloquina y fluconazol . Los éteres sustituidos con flúor son anestésicos volátiles , incluidos los productos comerciales metoxiflurano , enflurano , isoflurano , sevoflurano y desflurano . Los anestésicos de fluorocarbono reducen el riesgo de inflamabilidad con éter dietílico y ciclopropano . Los alcanos perfluorados se utilizan como sustitutos de la sangre .
Los fluorocarbonos también se utilizan como propulsor de los inhaladores de dosis medidas que se utilizan para administrar algunos medicamentos para el asma. La generación actual de propulsores se compone de hidrofluoroalcanos (HFA), que han sustituido a los inhaladores a base de CFC . Los inhaladores de CFC fueron prohibidos a partir de 2008 [actualizar]como parte del Protocolo de Montreal [30] debido a preocupaciones ambientales con la capa de ozono. Los inhaladores propulsores HFA como FloVent y ProAir ( Salbutamol ) no tienen versiones genéricas disponibles en octubre de 2014.
Los fluorosurfactantes, que tienen una "cola" polifluorada y una "cabeza" hidrofílica , sirven como surfactantes porque se concentran en la interfaz líquido-aire debido a su lipofobicidad . Los fluorosurfactantes tienen energías superficiales bajas y una tensión superficial dramáticamente menor. Los fluorosurfactantes ácido perfluorooctanosulfónico (PFOS) y ácido perfluorooctanoico (PFOA) son dos de los más estudiados debido a su ubicuidad, toxicidad y largos tiempos de residencia en humanos y vida silvestre.
Los compuestos fluorados suelen mostrar distintas propiedades de solubilidad. El diclorodifluorometano y el clorodifluorometano fueron en algún momento refrigerantes muy utilizados. Los CFC tienen un potente potencial de agotamiento de la capa de ozono debido a la escisión homolítica de los enlaces carbono-cloro; su uso está prohibido en gran medida por el Protocolo de Montreal . Los hidrofluorocarbonos (HFC), como el tetrafluoroetano , sirven como sustitutos de los CFC porque no catalizan el agotamiento de la capa de ozono. El oxígeno exhibe una alta solubilidad en compuestos de perfluorocarbonos, lo que refleja su lipofilicidad. Se ha demostrado que la perfluorodecalina es un sustituto de la sangre que transporta oxígeno a los pulmones.
El disolvente 1,1,1,2-tetrafluoroetano se ha utilizado para la extracción de productos naturales como el taxol , el aceite de onagra y la vainillina . El 2,2,2-trifluoroetanol es un disolvente polar resistente a la oxidación. [31]
El desarrollo de la química organofluorada ha aportado muchos reactivos de valor más allá de la química organofluorada. El ácido tríflico (CF 3 SO 3 H) y el ácido trifluoroacético (CF 3 CO 2 H) son útiles en toda la síntesis orgánica . Su fuerte acidez se atribuye a la electronegatividad del grupo trifluorometilo que estabiliza la carga negativa. El grupo triflato (la base conjugada del ácido tríflico) es un buen grupo saliente en reacciones de sustitución.
De interés actual en el área de la "Química Verde", [32] los sustituyentes altamente fluorados, por ejemplo, el perfluorohexilo (C 6 F 13 ), confieren propiedades de solubilidad distintivas a las moléculas, lo que facilita la purificación de productos en la síntesis orgánica . [33] Esta área, descrita como " química fluorada ", explota el concepto de similar-disuelve-similar en el sentido de que los compuestos ricos en flúor se disuelven preferentemente en disolventes ricos en flúor. Debido a la relativa inercia del enlace CF, estas fases fluoradas son compatibles incluso con reactivos agresivos. Este tema ha generado técnicas de "etiquetado fluorado y protección fluorada ". Un ejemplo ilustrativo de la tecnología fluorada es el uso de hidruros de estaño sustituidos con fluoroalquilo para reducciones, cuyos productos se separan fácilmente del reactivo de estaño gastado mediante extracción con disolventes fluorados. [34]
Los líquidos iónicos fluorados hidrofóbicos , como las sales orgánicas de bistriflimida o hexafluorofosfato , pueden formar fases que son insolubles tanto en agua como en disolventes orgánicos, produciendo líquidos multifásicos .
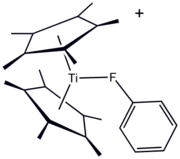
Los ligandos organofluorados han aparecido durante mucho tiempo en la química organometálica y de coordinación . Una ventaja de los ligandos que contienen F es la conveniencia de la espectroscopia de RMN de 19 F para monitorear reacciones. Los compuestos organofluorados pueden servir como "ligando donante sigma", como lo ilustra el derivado de titanio (III) [(C 5 Me 5 ) 2 Ti (FC 6 H 5 )]BPh 4 . Sin embargo, lo más frecuente es que se utilicen sustituyentes fluorocarbonados para mejorar la acidez de Lewis de los centros metálicos. Un ejemplo destacado es " Eufod ", un complejo de coordinación de europio (III) que presenta un ligando de acetilacetonato modificado con perfluoroheptilo . Esta y otras especies relacionadas son útiles en síntesis orgánica y como "reactivos de cambio" en espectroscopia de RMN .
En un área donde la química de coordinación y la ciencia de materiales se superponen, la fluoración de ligandos orgánicos se utiliza para ajustar las propiedades de las moléculas componentes. Por ejemplo, el grado y la regioquímica de la fluoración de ligandos de 2-fenilpiridina metalados en complejos de platino (II) modifican significativamente las propiedades de emisión de los complejos. [35]
La química de coordinación de ligandos organofluorados también abarca tecnologías fluoradas. Por ejemplo, la trifenilfosfina se ha modificado mediante la unión de sustituyentes perfluoroalquilo que confieren solubilidad en perfluorohexano así como en dióxido de carbono supercrítico . Como ejemplo específico, [(C 8 F 17 C 3 H 6 -4-C 6 H 4 ) 3 P. [36]
Un área activa de la química organometálica abarca la escisión de enlaces CF mediante reactivos a base de metales de transición. Se han desarrollado reacciones tanto estequiométricas como catalíticas y son de interés desde la perspectiva de la síntesis orgánica y la remediación de xenoquímicos. [37] La activación del enlace CF se ha clasificado de la siguiente manera: "(i) adición oxidativa de fluorocarbono, (ii) formación de enlace M-C con eliminación de HF, (iii) formación de enlace M-C con eliminación de fluorosilano, (iv) hidrodefluoración de fluorocarbono con formación de enlaces M-F, (v) ataque nucleofílico al fluorocarbono y (vi) desfluoración del fluorocarbono". Una reacción ilustrativa de activación de CF mediada por metales es la defluoración de fluorohexano por un dihidruro de circonio , un análogo del reactivo de Schwartz :
Los compuestos que contienen flúor suelen aparecer en aniones no coordinantes o débilmente coordinados . Tanto el tetrakis(pentafluorofenil)borato, B(C 6 F 5 ) 4 − , como el tetrakis[3,5-bis(trifluorometil)fenil]borato relacionado , son útiles en la catálisis de Ziegler-Natta y en metodologías de polimerización de alquenos relacionadas. Los sustituyentes fluorados hacen que los aniones sean débilmente básicos y mejoran la solubilidad en disolventes débilmente básicos, que son compatibles con ácidos de Lewis fuertes.
Los compuestos organofluorados disfrutan de muchas aplicaciones específicas en la ciencia de materiales . Con un bajo coeficiente de fricción , los fluoropolímeros fluidos se utilizan como lubricantes especiales. Las grasas a base de fluorocarbono se utilizan en aplicaciones exigentes. Los productos representativos incluyen Fomblin y Krytox , fabricados por Solvay Solexis y DuPont , respectivamente. Ciertos lubricantes para armas de fuego, como "Tetra Gun", contienen fluorocarbonos. Aprovechando su no inflamabilidad, los fluorocarbonos se utilizan en la espuma contra incendios. Los compuestos organofluorados son componentes de las pantallas de cristal líquido . El nafión , el análogo polimérico del ácido tríflico, es un ácido sólido que se utiliza como membrana en la mayoría de las pilas de combustible de baja temperatura . El monómero bifuncional 4,4'-difluorobenzofenona es un precursor de los polímeros de clase PEEK .
A diferencia de los muchos compuestos orgánicos naturales que contienen los haluros más pesados , cloruro, bromuro y yoduro, sólo se conocen unos pocos enlaces carbono-flúor sintetizados biológicamente. [38] La especie organofluorada natural más común es el fluoroacetato , una toxina que se encuentra en algunas especies de plantas. Otros incluyen ácido fluorooleico, fluoroacetona , nucleocidina (4'-fluoro-5'-O-sulfamoiladenosina), fluorotreonina y 2-fluorocitrato . Varias de estas especies probablemente se biosintetizan a partir de fluoroacetaldehído . La enzima fluorinasa catalizó la síntesis de 5'-desoxi-5'-fluoroadenosina (ver esquema a la derecha).
La química organofluorada comenzó en el siglo XIX con el desarrollo de la química orgánica. [17] [39] Los primeros compuestos organofluorados se prepararon utilizando trifluoruro de antimonio como fuente de F − . La no inflamabilidad y la no toxicidad de los clorofluorocarbonos CCl 3 F y CCl 2 F 2 atrajeron la atención industrial en la década de 1920. El 6 de abril de 1938, Roy J. Plunkett , un joven químico investigador que trabajaba en el Laboratorio Jackson de DuPont en Deepwater, Nueva Jersey , descubrió accidentalmente el politetrafluoroetileno (PTFE). [40] [41] [42] Los importantes acontecimientos posteriores, especialmente en los EE. UU., se beneficiaron de la experiencia adquirida en la producción de hexafluoruro de uranio. [5] A partir de finales de la década de 1940, se introdujeron una serie de metodologías de fluoración electrofílica, comenzando con CoF 3 . Se anunció la fluoración electroquímica (" electrofluoración "), que Joseph H. Simons había desarrollado en la década de 1930 para generar materiales perfluorados altamente estables compatibles con el hexafluoruro de uranio . [14] Estas nuevas metodologías permitieron la síntesis de enlaces CF sin utilizar flúor elemental y sin depender de métodos metatéticos. [ cita necesaria ]
En 1957 se describió la actividad anticancerígena del 5-fluorouracilo. Este informe proporcionó uno de los primeros ejemplos de diseño racional de medicamentos. [43] Este descubrimiento provocó un gran interés en los productos farmacéuticos y agroquímicos fluorados. El descubrimiento de los compuestos de gases nobles , por ejemplo XeF 4 , proporcionó una gran cantidad de nuevos reactivos a partir de principios de los años sesenta. En la década de 1970, la fluorodesoxiglucosa se estableció como un reactivo útil en la tomografía por emisión de positrones 18 F. En un trabajo ganador del Premio Nobel, se demostró que los CFC contribuyen al agotamiento del ozono atmosférico. Este descubrimiento alertó al mundo sobre las consecuencias negativas de los compuestos organofluorados y motivó el desarrollo de nuevas rutas para los compuestos organofluorados. En 2002, se informó sobre la primera enzima formadora de enlaces CF, la fluorinasa . [44]
Sólo unos pocos compuestos organofluorados son sumamente bioactivos y altamente tóxicos, como el fluoroacetato y el perfluoroisobuteno. [ cita necesaria ]
Algunos compuestos organofluorados plantean riesgos y peligros importantes para la salud y el medio ambiente. Los CFC y los HCFC ( hidroclorofluorocarbonos ) agotan la capa de ozono y son potentes gases de efecto invernadero . Los HFC son potentes gases de efecto invernadero y se enfrentan a llamados para una regulación internacional más estricta y calendarios de eliminación gradual como una medida de acción rápida para reducir las emisiones de efecto invernadero, al igual que los perfluorocarbonos (PFC) y el hexafluoruro de azufre (SF 6 ). [ cita necesaria ]
Debido al efecto del compuesto sobre el clima, las principales economías del G-20 acordaron en 2013 apoyar iniciativas para eliminar gradualmente el uso de HCFC. Afirmaron las funciones del Protocolo de Montreal y la Convención Marco de las Naciones Unidas sobre el Cambio Climático en la contabilidad y reducción de los HCFC a nivel mundial. Estados Unidos y China anunciaron al mismo tiempo un acuerdo bilateral con efectos similares. [45]
Debido a la fuerza del enlace carbono-flúor, muchos fluorocarbonos sintéticos y compuestos a base de fluorocarbonos son persistentes en el medio ambiente. Los fluorosurfactantes, como PFOS y PFOA , son contaminantes globales persistentes. Se han reportado CFC a base de fluorocarbonos y tetrafluorometano en rocas ígneas y metamórficas . [25] El PFOS es un contaminante orgánico persistente y puede estar dañando la salud de la vida silvestre; El Panel Científico C8 está investigando los posibles efectos del PFOA en la salud humana.
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ); Volumen Colectivo , vol. 4, pág. 525{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ); Volumen Colectivo , vol. 10, pág. 712