Calor
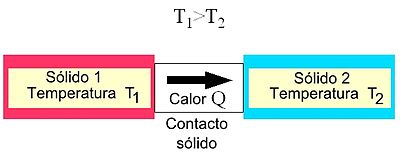
El término calor, por tanto, se debe entender como transferencia de calor y ocurre cuando hay diferencia de temperatura entre el sistema y su entorno, o entre dos zonas del sistema.
El flujo neto de calor entre dos sistemas a la misma temperatura es nulo, lo que se interpreta en que ambas regiones intercambian calor mutuamente con idéntica rapidez.
A menudo en el habla coloquial se usan expresiones como Cantidad de calor de un cuerpo o ganancia de calor y se hace porque no producen ningún malentendido y quizás porque no hay ninguna alternativa técnica que sea tan intuitiva, pero en un sentido técnico son incorrectas.
[2] Lo que tiene un cuerpo es energía térmica; mejor aún, si se considera el cuerpo como un sistema termodinámico, la energía total del sistema tiene dos formas: macroscópica y microscópica.
La microscópica es su grado de actividad molecular, que es independiente del sistema de referencia externo y es lo que se conoce como energía interna del sistema y se representa por
Resumiendo, es muy común referirse a la energía sensible y latente como calor, y está bien coloquialmente, pero en realidad es energía térmica, que es muy distinta de la transferencia de calor.
Para Anaxímenes lo caliente y lo frío son estados comunes de la materia.
La razón por la cual un cuerpo tenía cierta temperatura, venía dada por las cantidades que en él se encontraban estas dos cualidades fundamentales.
Es curioso observar, que en este período ya se apreciaba que algunos de los fenómenos físicos, como la dilatación de sólidos y líquidos, y la expansión térmica del aire y el vapor, dependían del calor, pero no se prestaba atención a las temperaturas porque no eran parte de las cualidades referidas en la física aristotélica.
En el transcurso del siglo XVII se oponen dos teorías sobre el calor, la del flogisto, y la que defendían los seguidores de los atomistas griegos, quienes admitían la corporeidad del fuego, considerando que este se constituía por partículas pequeñas, ligeras y sutiles, que tenían a su vez una enorme movilidad para penetrar en la materia en sus diferentes estados, capaces de operar simplemente con su presencia en forma de fluido imponderable, el calórico.
Entre 1775 y 1787 Lavoisier elaboró una teoría de los gases, en las que introducía el principio del calórico.
Esta idea culmina con los trabajos del médico y físico Julio R. von Mayer en 1842 y posterior y definitivamente en 1850 con James Prescott Joule, que establecen que el calor y el trabajo no son más que manifestaciones de la energía térmica, la cual puede ser convertida en un porcentaje en trabajo, mientras que el trabajo puede ser totalmente convertido en calor.
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante.
es la cantidad de calor que la sustancia recibe o cede entre las temperaturas
Se puede ver en la figura, la diferencia entre los calores específicos verdaderos, representados por las pendientes de las tangentes a la curva y los calores específicos medios entre dos temperaturas, representados por la pendiente de la cuerda que une ambos puntos.
Para la mayoría de los cuerpos, el calor específico aumenta con la temperatura y la diferencia entre valores medios y verdaderos es pequeña, siempre que la variación de temperatura sea también pequeña.
Para el agua, la curva q-t es prácticamente una recta, lo cual indica que su calor específico se mantiene, dentro de ciertos límites, prácticamente constante, normalmente se toma como 4186 kJ/kg.
De igual forma se puede definir la capacidad calorífica molar como:
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso.
A estos procesos se les conoce como cambios de fase.
Los posibles cambios de fase son: Que un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, es algo normal y frecuente.
Pero lo que no es tan normal es que dos fases o estados de agregación distintos de una misma sustancia, puedan estar en equilibrio térmico entre sí, naturalmente en circunstancias apropiadas.
A esta temperatura, todo el calor agregado se invierte en fundir el material mientras quede una partícula sólida, sin que haya un cambio significativo de su temperatura.
El calor es una magnitud con dirección, por tanto es necesario darle un signo para completar la información.
En esencia se trata de un recipiente que contendrá el líquido en el que se va a estudiar la variación de energía por transferencia de calor, cuya envolvente debe estar perfectamente aislada para garantizar que el proceso se acerque lo más posible al adiabático.
En consecuencia, el estudio de la transferencia de calor no puede basarse solo en los principios de la termodinámica, sin embargo estos y cualquier ley física que tenga que ser satisfecha por un proceso, proporcionan ecuaciones que pueden utilizarse en el análisis.
El procedimiento experimental tiene la ventaja de tratar con el sistema físico real y, gracias a ello, la cantidad deseada se determina mediante medición, dentro de los límites del error experimental.
Generalmente en la mayoría de los países, se habla ya de calor cuando la temperatura supera los 26 °C en cualquier hora del día, aunque varía mucho según la estación del año.
Esta denominación de ola de calor, no quiere decir necesariamente calor excesivo ni temperaturas inusuales para la estación, sino que pretende alertar sobre consecuencias perjudiciales en personas o colectivos vulnerables.
Pero con humedad ambiental del 90 %, se sentirá como si el ambiente fuese de 40 °C.