Los inhibidores de metaloproteasas son inhibidores celulares de las metaloproteinasas de matriz (MMP). [1] Las MMP pertenecen a una familia de endopeptidasas neutrales dependientes de zinc . [2] Estas enzimas tienen la capacidad de descomponer el tejido conectivo . La expresión de MMP aumenta en diversas condiciones patológicas como condiciones inflamatorias , enfermedad ósea metabólica, invasión de cáncer , metástasis y angiogénesis . Ejemplos de enfermedades son periodontitis , hepatitis , glomerulonefritis , aterosclerosis , enfisema , asma , trastornos autoinmunes de la piel y fotoenvejecimiento dérmico, artritis reumatoide , osteoartritis , esclerosis múltiple , enfermedad de Alzheimer , ulceraciones crónicas, involución uterina, defectos epiteliales corneales, resorción ósea y progresión tumoral y metástasis. [2] [3] Debido al papel de las MMP en condiciones patológicas, los inhibidores de MMP pueden tener potencial terapéutico. [3] Varias otras proteínas tienen efectos inhibidores similares, aunque ninguna tan eficaz (netrinas, potenciador de la proteinasa C-terminal del procolágeno (PCPE), proteína rica en cisteína inductora de reversión con motivos Kazal (RECK) e inhibidor de la vía del factor tisular (TFPI-2)). Es posible que tengan otras actividades biológicas que aún no se han caracterizado por completo. [4]
Los inhibidores de MMP se pueden subdividir en general en no sintéticos (por ejemplo, endógenos ) o sintéticos . [2] Se han identificado varios inhibidores potentes de MMP, incluidos hidroximatos, tioles , carbamoilfosfonatos , hidroxiureas , hidrazinas , β-lactamas , ácidos escuáricos y ligandos nitrogenados. [5]
Hay tres clases de inhibidores comúnmente utilizados para las metaloproteinasas .
La primera generación de inhibidores de MMP se basó en la estructura de la molécula de colágeno . Este grupo de inhibidores contiene un grupo hidroxamato (-CONHOH) que se une al átomo de zinc en el sitio activo de la enzima MMP. [6] Los primeros inhibidores de MMP que se probaron en pacientes fueron Ilomastat y Batimastat , inhibidores de MMP basados en hidroxamato. [6] [7] Sin embargo, ninguno de los compuestos mostró una buena biodisponibilidad oral . [6]
Hasta ahora, Periostat (el ingrediente activo es doxiciclina hiclato) es el único inhibidor de MMP que ha sido aprobado por la Administración de Alimentos y Medicamentos de los EE. UU. (FDA). Se utiliza para el tratamiento de la periodontitis. Otros inhibidores de MMP han mostrado efectos secundarios graves durante los ensayos preclínicos . Estos efectos secundarios son causados por una selectividad insuficiente . La mayoría de los inhibidores de MMP no pueden dirigirse a MMP específicas relacionadas con condiciones patológicas específicas . En cambio, inhiben múltiples MMP, algunas de las cuales tienen funciones protectoras o no están relacionadas con la patología. [5]
Las MMP se han considerado objetivos prometedores para la terapia del cáncer. Los estudios preclínicos que investigaron la eficacia de la supresión de MMP en modelos tumorales fueron alentadores. Después de estos resultados, se realizaron estudios clínicos, pero resultaron decepcionantes. Estudios recientes han demostrado que las MMP pueden incluso tener funciones paradójicas en la progresión tumoral. Las MMP parecen tener efectos promotores de tumores, así como efectos supresores de tumores , dependiendo de diferentes contextos. [8]

La mayoría de los inhibidores de MMP son agentes quelantes . El inhibidor se une al zinc en el centro activo de la enzima, bloqueando así su actividad. Son posibles otros mecanismos inhibidores. [1]
La α2-macroglobulina (α2M) es un inhibidor de proteasa que inhibe las MMP activadas. α2M y MMP forman un complejo que puede inactivar la MMP. [9]
Las MMP están asociadas con la superficie celular o unidas a la matriz extracelular , lo que evita que se difundan y mantiene a la MMP bajo control de la célula. Un mecanismo para inhibir la actividad de MMP es desalojar las enzimas de sus receptores . Las sales de oro se unen a un sitio de metal pesado distinto del centro activo que contiene zinc, lo que inhibe su actividad. La actividad de MMP se puede disminuir uniéndose al sitio de escisión en el sustrato, por ejemplo, la catequina . [1]
Dos características moleculares de la mayoría de los inhibidores de MMP son responsables de la afinidad . Una es una fracción quelante que interactúa con el ion zinc y la otra es una extensión hidrofóbica del sitio catalítico que se proyecta hacia el bolsillo S1' (grupo P1') de la metaloproteinasa. La diferencia estructural de las MMP está principalmente en el lado S1' y al modificar el grupo P1', se puede desarrollar selectividad inhibidora. [10]
En las siguientes secciones se explicarán varios inhibidores potenciales de MMP, incluida información sobre su desarrollo, relación estructura-actividad y farmacocinética.
La primera generación de inhibidores de MMP se basó en la estructura de la molécula de colágeno. En el diseño de estos inhibidores, se mantiene la estructura básica de la proteína del colágeno, pero el enlace amida se reemplaza por un grupo de unión al zinc. [11] Este grupo de inhibidores contiene un grupo hidroxamato (-CONHOH) que se une al átomo de zinc en el sitio activo de la enzima MMP, por lo que este grupo se denomina "inhibidores de MMP basados en hidroxamato". [6] Un ejemplo se puede ver en Marimastat , un inhibidor de primera generación, que tiene una estructura básica y un formato de cadena lateral similares al colágeno.

Ilomastat y batimastat fueron los dos primeros inhibidores de MMP que se probaron en pacientes. Ambos son inhibidores de MMP basados en hidroxamato y tienen estructuras generales similares.

Los inhibidores de MMP basados en hidroxamato muestran una excelente actividad anticancerígena en células tumorales, pero los resultados clínicos de estos compuestos fueron decepcionantes. Un factor que contribuyó a esta decepción fue que son inhibidores de amplio espectro de muchos subtipos de MMP que en muchos casos también pueden inhibir a miembros de la familia de proteasas ADAM. Cuando se probaron en pacientes, indujeron dolor muscular y esquelético limitante de dosis en varios de los pacientes. [5] [7] Solo cuando las estructuras de los inhibidores de MMP pudieran ajustarse para impartir selectividad y abolir la toxicidad , lograrían un impacto clínico en la quimioterapia contra el cáncer. [7]
Los inhibidores pioneros basados en hidroxamato fueron seguidos por un conjunto de moléculas de "nueva generación" con características que incluían un arilo sustituido , una sulfonamida y un grupo de unión a zinc hidroxamato .

En MMI-270 también hay un sustituyente de tipo cadena lateral de aminoácido en el carbono que es α con respecto al hidroxamato, junto con una cadena lateral en la sulfonamida (que más tarde se demostró que era innecesaria). El hidroxamato de N-arilsulfonil-α-aminoácido de MMI-270 imita el motivo succinato de marimastat. Cipemastat , que se desarrolló como un inhibidor de la colagenasa MMP-1 , -3 y -9 para el tratamiento de la artritis reumatoide y la osteoartritis , también tiene el motivo succinato de marimastat. Su ensayo clínico finalizó prematuramente.
MMI-166 tiene un grupo de unión de zinc N-arilsulfonil-α-aminocarboxilato, diferente del grupo de unión de zinc-hidroxamato observado en MMI-270 y Cipemastat. También tiene una sustitución triarilo que las otras estructuras no tenían. ABT-770 y Prinomastat también tienen una sustitución arilo. En ABT-770 los dos anillos de fenilo están conectados directamente pero en Prinomastat los dos anillos de fenilo están conectados por un átomo de oxígeno , formando un difeniléter . Estas tres permutaciones dirigen el SAR lejos de MMP-1 y hacia las MMP de "bolsillo profundo", como las gelatinasas . ABT-770 muestra actividad anticancerígena en modelos animales, pero se metaboliza fácilmente a un metabolito de amina que causa fosfolipidosis . MMI-166 ha mostrado actividad anticancerígena en numerosos modelos animales, pero no hay datos disponibles de su desempeño clínico. Prinomastat, por otro lado, es uno de los inhibidores de MMP mejor estudiados. Mostró una excelente eficacia anticancerígena preclínica en animales , pero una limitación recurrente de estos hidroxamatos (Prinomastat en particular) es el metabolismo del fármaco, incluida la pérdida del grupo de unión al zinc del hidroxamato.

A estos inhibidores les siguió el siguiente grupo de inhibidores basados en hidroxamato, que se centran en la supresión del metabolismo, la minimización de la actividad inhibidora de MMP-1 y el control de la selectividad del subtipo, mediante un diseño basado en la estructura. El tetrahidropirano en RS-130830 introduce un bloqueo estérico que suprime el metabolismo, lo que solucionaría el problema que mostró la generación anterior de inhibidores. El resultado de su evaluación clínica aún no se ha revelado. 239796-97-5 ha mejorado las propiedades de selectividad de ADME y MMP-1 y ha demostrado una excelente eficacia oral en un modelo animal de osteoartritis. Aunque, los objetivos terapéuticos de estos inhibidores no son el cáncer, como lo han sido para la mayoría de los inhibidores de MMP. [7]

Rebimastat es un inhibidor de MMP de amplio espectro con un grupo de unión a cinc tiol . Tiene biodisponibilidad oral y es un mimético de colágeno no peptídico. Rebimastat tiene cierta selectividad, ya que no inhibe todas las funciones de las MMP. Por ejemplo, Rebimastat no inhibe las metaloproteinasas que liberan TNF-alfa , TNF-II, L-selectina , IL-1-RII e IL-6
. En la fase I de los ensayos clínicos , no hubo signos de toxicidad articular dependiente de la dosis y se produjo una estabilización de la enfermedad. Se observó artralgia en los ensayos de cáncer de mama de fase II , que se relacionó con la toxicidad del inhibidor de MMP. Rebimastat se utilizó en un tratamiento con paclitaxel / carboplatino en la fase III. Los resultados del ensayo fueron una mayor incidencia de reacciones adversas , sin beneficio de supervivencia.

Los ensayos clínicos para Tanomastat , un alfa-((feniltio)metil)carboxilato, mostraron resultados similares. Mostró buena estabilidad de la enfermedad y tolerancia en ensayos de tumores sólidos de Fase I y buena tolerancia en cáncer avanzado en combinación con Etopósido . Sin embargo, su eficacia no demostró ser adecuada. Tanomastat mostró hepatotoxicidad significativa en una terapia contra el cáncer combinada con Cisplatino y Etopósido, aunque en un tratamiento con Doxorubicina mostró buena tolerancia y toxicidad reducida con 5-fluorouracilo y Leucovorina .
Muchos compuestos en los grupos de unión de zinc tiol tienen buena solubilidad en agua y son estables al aire en plasma y estos grupos continuarán en el diseño de inhibidores de MMP. [7]

El Ro 28-2653 es altamente selectivo para MMP-2 , MMP-9 y tipo de membrana 1 ( MT-1 )-MMP. Es un agente antitumoral y antiangiogénico con biodisponibilidad oral. La inhibición de TACE y MMP-1 está relacionada con los efectos secundarios musculoesqueléticos observados en los inhibidores de la metaloproteinasa de hidroxamato, pero este compuesto preserva las enzimas. [12] Se ha demostrado que disminuye el crecimiento tumoral en el cáncer nasal en ratas, así como en cultivos de células de cáncer de próstata . El compuesto solo tiene un efecto moderado en el tejido adiposo de los ratones y no altera las articulaciones. Con base en esto, se concluye que es menos probable que esta clase de inhibidores desencadene efectos adversos neuromusculares . En el sitio activo de la estructura hay una quelación de pirimidinetriona y la sección de fenilo y piperidinilo ocupa los bolsillos de unión S1' y S2' de MMP-8 .
El compuesto 556052-30-3 es similar a Ro 28-2653 pero incorpora una cadena lateral de 4-((2-metilquinolin-4-il)metoxi)fenilo que es selectiva para TACE.
La 5-(espiropirrolidin-5-il)pirimidinetriona es un compuesto denominado 848773-43-3 que es un potente inhibidor de MMP-2, MMP-9 y MMP-13 que preserva la MMP-1 y la TACE.
Al sustituir el heteroarilo 1,3,4-oxadiazol-2-ilo en C-4' del segmento de difeniléter para lograr la selectividad de MMP-13 sobre la MMP MT-1, se obtuvo el compuesto 420121-84-2. El compuesto tiene una CI50 (concentración inhibitoria máxima media) de 1 nM para MMP-13.
Se han diseñado pirimidinetrionas radiactivas I125 que tienen una estructura similar para su uso en la aterosclerosis con niveles elevados de MMP-9 y en cánceres con niveles elevados de MMP-2 y MMP-9.
Esta clase de inhibidores de MMP es fácil de sintetizar y es lo suficientemente potente para su valoración clínica.


El compuesto 544678-85 es el último inhibidor basado en pirimidina, el compuesto es una pirimidina-4,6-dicarboxamida que es muy potente y selectiva de MMP-13. El compuesto tiene un bucle de especificidad que dentro del bolsillo S1' y su grupo 3-metil-4-fluoro es lo suficientemente próximo al zinc para cambiar la entidad de agua. Estos compuestos tienen una buena biodisponibilidad oral y propiedades que los promueven como un buen candidato para un inhibidor de subtipo de enfermedades basadas en MMP-13 y desarrollo futuro. [7]
Las dicarboxamidas de pirimidina son inhibidores altamente selectivos de la MMP-13. En el bolsillo S1' de la MMP-13 hay un bolsillo lateral S1' que es exclusivo de la metaloproteasa de matriz. Las dicarboxamidas de pirimidina se unen a este bolsillo lateral, lo que aumenta la selectividad. La función de la MMP-13 es escindir el colágeno fibrilar a pH neutro y se detectan niveles más altos de ARNm de la MMP-13 en el carcinoma de mama y en las articulaciones con osteoartritis.
El ejemplo de inhibidor de dicarboxamida de pirimidina en la imagen no interactúa con el ion de zinc catalítico sino que se une al bolsillo lateral S1'. [10] Un brazo de piridilo está situado en la entrada del bolsillo S1' mientras que el otro brazo de piridilo pasa por el bolsillo S1' hacia el bolsillo lateral. [13]
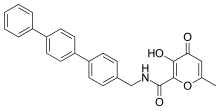
Se han desarrollado inhibidores potentes y selectivos de MMP-3 utilizando una hidroxipirona como grupo de unión de zinc. Al unir una cadena principal de arilo a la posición 2 del anillo de pirona , se obtuvo más selectividad. En el anillo de hidroxipirona, hay tres posiciones disponibles para unir cadenas principales, posición 2, 5 y 6. [14]
Los inhibidores de MMP basados en hidroxipirona corresponden estructuralmente a las pirimidinetrionas. Un inhibidor reciente es el compuesto 3-hidroxipiran-4-ona denominado 868368-30-3. Es selectivo de MMP-3 y su quelación bidentada 0,0- de zinc es la parte estructural propuesta como responsable del reconocimiento de MMP . [7]

La investigación sobre inhibidores de MMP con grupos de unión de zinc basados en fósforo se centró en fosfonatos de α-bifenilsulfonilamino. Estos inhibidores se unen a través de dos átomos de oxígeno de fosfonato. Se han desarrollado inhibidores de fosfonato que muestran selectividad por MMP-8 sobre otras MMP. Los inhibidores selectivos de MMP-8 podrían ser útiles en el tratamiento de la enfermedad hepática aguda y la esclerosis múltiple [15]. Se ha informado que los inhibidores de MMP fosfínicos se dirigen a MMP-11 y MMP-13. MMP-13 desempeña un papel en la degradación del cartílago en la osteoartritis. Estos inhibidores de MMP fosfínicos contienen segmentos de fenilo que se cree que son responsables de la selectividad a MMP-13. El grupo fosfínico de esos inhibidores (R 1 R 2 (O)OH) se une como un ligando de zinc. Los sustituyentes R 1 y R 2 afectan la potencia de inhibición. [7] Se han desarrollado inhibidores de fosfinato que mostraron una alta selectividad por la MMP-11. Los derivados basados en anillos de fenilo mostraron la mejor selectividad. La MMP-11 podría ser un objetivo útil para la tumorogénesis en el cáncer de mama.

Los inhibidores basados en fósforo con grupos de unión de zinc del carbamoil fosfonato no se unen a través de dos oxígenos del fosfonato. Los grupos de unión de zinc del carbamoil fosfonato unen Zn 2+ a través del oxígeno del fosfonato y el oxígeno del alfa carbonilo al fosfonato. Esta unión forma un anillo quelato de 5 miembros que parece similar a la unión del ácido hidroxámico.
El enlace amida del carbamoil fosfonato proporciona un donante de enlaces de hidrógeno para interacciones proteicas y el grupo amida tiene una capacidad de donación de electrones que proporciona una fuerte quelación de Zn 2+ . Los grupos de unión de zinc del carbamoil fosfonato tienen una carga negativa neta que dificulta la penetración celular de estos inhibidores y los restringe al espacio extracelular . Esta prevención de la penetración celular contribuye a la baja toxicidad de estos inhibidores. Los inhibidores con un grupo de unión de zinc del carbamoil fosfonato son selectivos para MMP-2 . MMP-2 podría ser un objetivo útil para la invasión tumoral y la angiogénesis . Se ha desarrollado un inhibidor de carbamoil fosfonato que afecta a MMP-2 y MMP-9, sin afectar a otras MMP. Este compuesto mostró actividad inhibidora sobre la invasión celular y la colonización tumoral . En estudios in vivo , este inhibidor mostró eficacia con dosificación oral y administración en la cavidad abdominal (intraperitoneal). Muestra absorción lenta, eliminación rápida y baja biodisponibilidad oral . La absorción prolongada contribuye a una eficacia sostenida. Los inhibidores con grupos de unión de zinc de carbamoil fosfonato son solubles en agua a pH fisiológico . [15]

Las tetraciclinas son antibióticos que también presentan actividad inhibidora de la MMP. Quelan el ion Zn2 + , inhibiendo así la actividad de la MMP. Se cree que las tetraciclinas también afectan la expresión de la MMP y la actividad proteolítica. [16]
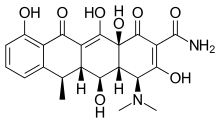
La doxiciclina es una tetraciclina semisintética que se ha estudiado para aplicaciones dentales y médicas. Se han investigado sus efectos sobre enfermedades como la periodontitis y el cáncer. [2] La doxiciclina se absorbe casi por completo con una biodisponibilidad de alrededor del 95% en promedio y una reducción del 20% con la coadministración de alimentos. Su volumen de distribución es de 50-80 L (0,7 L/kg). La unión a proteínas es del 82-93%. Se excreta en la orina y en las heces. La doxiciclina está disponible en forma oral e intravenosa . [17] La doxiciclina exhibió actividad inhibidora sobre MMP-2 y MMP-9. [2] La expresión y actividad de MMP-2 y MMP-9 a menudo están elevadas en el cáncer humano. El aumento de la expresión y actividad se correlaciona con el estadio avanzado del tumor, el aumento de la metástasis y el pronóstico . [8] Se han desarrollado tetraciclinas
modificadas químicamente (CMT) para explorar su potencial inhibidor. La mayoría de los estudios sobre tetraciclinas y CMT demostraron que pueden inhibir la actividad de MMP.

Se ha demostrado que un CMT llamado COL-3 o metastat es un potente inhibidor de MMP. COL-3 presenta un andamiaje de tetraciclina que no está sustituido en las posiciones C4-C9. [16]
Las ventajas de CMT sobre las tetraciclinas convencionales son que el uso crónico no produce toxicidad gastrointestinal y se pueden lograr niveles plasmáticos más altos durante un período de tiempo prolongado, lo que reduce la frecuencia de administración .
La farmacocinética de COL-3 se ha estudiado en ratas. COL-3 se absorbe lentamente en el tracto gastrointestinal. El 3% se excreta a través del tracto urinario , mientras que el 55-66% se excreta en las heces. El fármaco es altamente lipofílico y puede atravesar la barrera hematoencefálica en dosis más altas. COL-3 se acumula en mayor concentración en el tejido cardíaco y los testículos . En ensayos clínicos, se ha demostrado que la unión a proteínas plasmáticas es alta (~94,5%). La mayor parte de COL-3 se une a la albúmina sérica . [2]
La actividad de MMP está regulada en varios niveles, por ejemplo, por inhibidores endógenos como la α2-macroglobulina y los inhibidores tisulares de metaloproteinasas (TIMP). [18]
La α2-macroglobulina regula un amplio espectro de proteasas , mientras que los TIMP son inhibidores endógenos de MMP más específicos. La α2-macroglobulina es una proteína plasmática abundante que actúa en los fluidos tisulares. [8] La glicoproteína plasmática consta de cuatro subunidades. [19] La α2-macroglobulina no inhibe la activación de las MMP ni de las propias MMP. [8] Atrapa proteinasas como las MMP y forma un complejo con ellas. [19] El complejo es endocitado y eliminado por una proteína relacionada con el receptor de lipoproteína de baja densidad . [8]
En humanos , se han encontrado 4 TIMP diferentes. Son proteínas secretadas de bajo peso molecular . Los TIMP se unen de forma no covalente al sitio activo de las MMP. [18] Se considera que los cambios en los niveles de TIMP desempeñan un papel en las condiciones patológicas asociadas con actividades desequilibradas de MMP. [19] Los TIMP constan de 184-194 aminoácidos. Estos inhibidores se subdividen en dos dominios N-terminal y C-terminal . [19] Las regiones N-terminales de los cuatro TIMP comparten una estructura común. Todos contienen doce residuos de cisteína que forman seis enlaces disulfuro . Estos enlaces son críticos para la conformación del N-terminal y sus actividades inhibidoras de MMP. Los C-terminales de los TIMP difieren entre sí. [8] La subunidad N-terminal es capaz de inhibir MMP. La forma de la molécula de TIMP encaja en el sitio activo de una MMP. El TIMP entra en contacto con la hendidura catalítica de la MMP de manera similar a un sustrato. Los TIMP inhiben todas las MMP excepto TIMP-1 que no inhibe MT-1-MMP. [19]
Existen algunas diferencias en las preferencias inhibitorias de los TIMP. Por ejemplo, el TIMP-1 tiende a inhibir la MMP-9. Otros ejemplos son el TIMP-2 y el TIMP-4 , que son inhibidores más potentes de la MMP-2 que de la MMP-9. [8]
Los TIMP podrían ser potencialmente útiles contra enfermedades como las cardiovasculares y el cáncer. La aplicación de los TIMP como instrumento terapéutico a través de la terapia génicaLa aplicación directa de proteínas todavía se encuentra en las primeras etapas de desarrollo. Es preferible inhibir MPP específicas que desempeñan un papel en las condiciones patológicas. Dado que los TIMP inhiben múltiples MMP, es deseable desarrollar TIMP diseñados con especificidad alterada. [19]
El objetivo principal del diseño de inhibidores de MMP es la selectividad. Se espera que la selección de MMP específicas mejore la eficacia y evite efectos secundarios como el síndrome musculoesquelético (MSS). [15] Las estructuras 3D de los inhibidores de MMP brindan una fuente de información sobre las relaciones estructurales para la selectividad. El cribado de alto rendimiento también puede aumentar las posibilidades de descubrir inhibidores con alta selectividad. [13]